芥蓝TCP家族全基因组鉴定及表达分析
2022-07-25曾家晶赵怡娇曾东琳唐为玲李尊文GefuWANGPRUSKI赖钟雄郭容芳
曾家晶 赵怡娇 曾东琳 唐为玲 李尊文Gefu WANG-PRUSKI 赖钟雄 郭容芳*
(1.福建农林大学园艺植物生物工程研究所,福州 350002; 2.福建农林大学戴尔豪西大学联合试验室,福州 350002)
TCP
家族基因是植物特有的一类转录因子家族之一,不仅参与调控细胞的生长和增殖,在植物体生长发育的各个阶段也起到重要的调控作用。TCP
转录因子基因家族首先发现于1999年,此基因的命名起初来自3个不同物种的4个基因,分别是对玉米中抑制侧枝生长和雄花形成有重要作用的TB1
(Teosinte
branched
1
)基因、金鱼草中参与早期的花器官侧生区域表达并调控花对称性的CYC
(CYCLOIDEA
)基因、水稻中与细胞发育相关的PCF1
(Proliferating
cell
factors
1
)基因和PCF2
(Proliferating
cell
factors
2
)基因,TCP
即取其4个基因的首字母而得名。基于对TCP
基因家族结构域同源性分析,可将TCP
基因家族分为ClassⅠ(或者TCP
-P
)和ClassⅡ(或者TCP
-C
)2个类群。ClassⅠ类又名PCF
亚家族,ClassⅡ则进一步划分为CIN
和CYC
/TB1
这2个亚家族。随着分子生物学技术的发展,TCP
基因家族相继在拟南芥、水稻、番茄、马铃薯、高粱、牡丹和香蕉等物种中得到鉴定,并发现该家族成员广泛参与调控植物胚胎生长、种子萌发、花粉发育、叶片发育、细胞衰老、细胞周期调节、昼夜节律和激素信号传导等生长发育过程。在拟南芥属于ClassⅠ类的成员中,AtTCP15
不仅参与节间长度调控,在叶片发育方面也起调控作用;AtTCP20
与生长发育、茉莉酸(JA)生物合成及叶片衰老调控有关;AtTCP22
负调控叶片的衰老,且与AtTCP15
存在功能上的冗余。在拟南芥属于ClassⅡ类的成员中,AtTCP1
能够调控DWARF4
基因的表达,从而影响油菜素类固醇的合成,进而调控其自身的生长发育;AtTCP18
和AtTCP12
在腋芽中表达,其单突变体能够减少这2个基因的表达,增加分枝;5个CIN
-TCP
基因(AtTCP2
、AtTCP3
、AtTCP4
、AtTCP10
和AtTCP24
)均是miR319的靶基因,参与调控叶片的形态建成;CIN
-TCP
转录因子通过促进分化来影响叶片形状。在金鱼草中,CIN
类成员促进了叶片层的组织分化和生长停滞,将发育程序推向了次级形态发生。在拟南芥中,当叶片开始发育时,连续的TCP
活性促进了从初级形态发生到细胞扩张和次级形态发生阶段的转变。此外,玉米Ⅱ组基因TB1
能够影响腋分生组织的分化速率,防止低节间点芽的突起和促进高节间点雌花序的形成;番茄Ⅱ组基因SlTCP9
和SlTCP7
对腋芽的起始和突起起到相似的作用。此外,有研究表明相关ClassⅡ亚家族成员与ClassⅠ亚家族成员起相互拮抗作用。芥蓝(Brassica
oleracea
)属于十字花科芸薹属一二年生草本植物,甘蓝类蔬菜之一,原产于中国南部,是中国的特产蔬菜之一。芥蓝品种多样,叶片和主薹等形态存在差异,其菜苔柔嫩、鲜脆,味鲜美,以肥嫩的花薹和嫩叶供食用,且芥蓝富含胡萝卜素、维生素C和芥子油苷等营养物质,是一种营养价值很高的功能型蔬菜。芥蓝因其独特风味和营养保健功效而受到人们喜爱。‘香菇’芥蓝因真叶叶脉上长有小叶,貌似菇花而得名,其真叶上长出的小叶形态特异,俗称‘菇叶’,属于广东潮汕地区特色品种,后引种到福建。作为芸薹属物种的重要蔬菜之一,芥蓝在我国南方地区如福建、广东和云南等地广泛栽培。虽然栽培面积较广,但是其单位面积产出率偏低,导致其总产量和经济效益总体偏低。菜薹产量较低以及口感较差,很大一部分原因是对调控其食用器官的分子机制尚未可知,这就涉及到与叶片发育密切相关的TCP
转录因子家族。目前,对于TCP
基因家族的研究主要集中在模式植物拟南芥、水稻和玉米等物种,在蔬菜中,特别是十字花科芸薹属物种,关于TCP
基因家族的研究鲜有报道,而关于叶片发育的研究则更加不明确。相关TCP
家族成员在模式植物中,对叶片生长发育方面发挥重要的调控作用,而叶片作为植物重要的组成部位,对植物的生长发育至关重要,影响叶菜类植物产量及风味品质的形成。基于此,本研究推测叶菜类的‘香菇’芥蓝中,其叶片发育大小和叶缘形状与TCP
转录因子家族密切相关。因此,本研究拟以甘蓝基因组数据为基础,采用生物信息学方法对芥蓝中的TCP
家族成员进行鉴定,明确相关BoTCP
成员与叶片发育之间存在的关系,进而全面分析BoTCP
家族成员蛋白质理化性质、基因结构、蛋白质保守基序、基因的染色体定位、种内种间共线性关系、系统进化树、启动子顺式作用元件、蛋白互作关系、RNA-Seq数据和qRT-PCR表达,旨在为深入揭示芥蓝TCP
基因家族的生物学功能及挖掘与叶片发育相关成员奠定基础。1 材料与方法
1.1 材料
试验材料为‘香菇’芥蓝,第1批试验材料种植于福建农林大学园艺楼人工培养室内。将芥蓝种子均匀撒在装有湿润珍珠岩的培养皿中(d
=15 cm),置于28 ℃的光照培养箱中进行常规催芽,前3 d黑暗处理,后7 d光周期设定为16 h/8 h(Light/Dark)。待子叶完全展开且育苗满10 d后将芥蓝幼苗移入装有混合基质(V
(草炭土)∶V
(蛭石)∶V
(珍珠岩)=3∶1∶1)的培养钵中,放置在人工气候箱(MGC-450HP-2,上海一恒科技有限公司),25 ℃(16 h/8 h(Light/Dark))进行光照培养。生长3周后,挑选长势良好的‘香菇’芥蓝植株,对其根、叶缘、叶肉、叶脉和菇叶这5个部位进行取样,每份样品取0.1 g,3次生物学重复。第2批试验材料种植于福建农林大学设施温室大棚,前期在催芽与幼苗培养中培养参数设置与第1批试验材料相同。培养20 d后定植于精整的田间,行距为35 cm,列距为30 cm,田间四周设置保护行,定期进行日常浇水和施肥等田间管理。在2020年9月—2021年3月期间,挑选长势良好的‘香菇’植株,进行不同组织部位取样,取样分2个时期共10个部位:在抽薹未开花时期(以下简称Ⅰ时期),对根、真叶、花茎和薹叶(1次侧薹)进行取样;在全部结荚时期(以下简称Ⅱ时期),对根、真叶、花茎和薹叶进行取样;在显微镜下观察到种子处于子叶形胚时期(以下亦简称Ⅱ时期),对该时期种子和种荚进行取样。每份样品取0.1 g,3次生物学重复,取样后经液氮速冻,保存于-80 ℃冰箱,以备后续qRT-PCR表达分析。
1.2 方法
1
.2
.1
芥蓝TCP
基因家族成员鉴定本研究所使用的基因组序列信息和基因组基因结构注释信息包含甘蓝基因组、拟南芥基因组以及水稻基因组,其中甘蓝基因组和水稻基因组来源于Ensembl网站(http:∥plants.ensembl.org/),拟南芥基因组来源于TAIR网站(https:∥www.arabidopsis.org/)。
利用TBtools 1.0695软件,在Blast界面下设定参数E-value:1e-5和Number of hits:500,选取拟南芥TCP
家族氨基酸序列作为引用序列与甘蓝数据库进行同源比对,并结合NCBI网站(https:∥www.ncbi.nlm.nih.gov/)Blast分析获得芥蓝TCP
候选成员。将获得的芥蓝TCP
候选成员序列在NCBI中的CD-Seach进行蛋白保守结构域比对,手动删除不包含TCP
结构域的候选序列。进一步采用SMART(http:∥smart.embl-heidelberg.de/)网站中PFAM domain在线分析候选成员序列的蛋白结构域,从而筛选以确定芥蓝TCP
家族的成员数目。最后根据拟南芥TCP
家族成员在芥蓝中的查找同源基因注释,参考拟南芥现有的命名方法,对芥蓝TCP
家族成员进行命名。1
.2
.2
芥蓝BoTCP
家族成员表达分析参考拟南芥TCP
家族注释到芥蓝的同源基因功能和TAIR数据库基因的表达量,选定BoTCP21
和BoTCP25
用于qRT-PCR试验分析。1
.2
.3
芥蓝TCP
基因结构及蛋白基序分析采用ExPASy(https:∥web.expasy.org/protparam/)分析蛋白质的理化性质,采用singalp(http:∥www.cbs.dtu.dk/services/SignalP-3.0/)分析N端信号肽,采用Softberry ProtComp 9.0(http:∥www.softberry.com/berry.phtml)进行亚细胞定位的分析与预测。下载gDNA序列的fasta文件和gff3文件后,进一步获得CDS序列,进行Blast比对分析;采用GSDS2.0(http:∥gsds.cbi.pku. edu.cn/)对芥蓝TCP
不同成员进行基因结构的内含子和外显子特征分析并在线作图;通过MEME(https:∥meme-suite.org/)在线分析BoTCP
不同成员蛋白质保守基序motif,设置motif检索数目为20,并采用TBtools 1.0695软件对获得的motif进行可视化分析作图,再结合Smart中domain蛋白结构域进行进一步分析。1
.2
.4
芥蓝TCP
基因染色体定位分析利用甘蓝基因组中的gff3文件,通过TBtools 1.0695软件,对芥蓝TCP
家族成员在染色体上的位置分布图进行绘制。1
.2
.5
芥蓝TCP
基因家族种内和种间共线性分析使用TBtools 1.0695中Circle gene view功能构建芥蓝全基因组种内相关共线性图谱。为进一步揭示甘蓝类作物基因组存在三倍化复杂复制过程,采用MCScanX对芥蓝与拟南芥及水稻TCPs
进行种间共线性分析。1
.2
.6
芥蓝TCP
基因启动子顺式作用元件和转录起始位点预测采用TBtools 1.0695软件提取BoTCP
基因家族成员ATG上游2 000 bp作为启动子序列,使用BDGP(http:∥www.fruitfly.org/seq_tools/promoter.html)在线预测各成员启动子序列的转录起始位点;同时使用PlantCARE Database(http:∥bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线预测各成员启动子的顺式作用元件种类和数量,在Excel 2016中整理数据并绘制透视图。1
.2
.7
芥蓝TCP
基因蛋白互作预测及系统发育分析将拟南芥、芥蓝和水稻3个物种共86条TCP
家族氨基酸序列在MEGA X软件中进行多序列比对,通过建模找出构建进化树的最佳模型,进一步在MEGA X中采用邻近法(Neighbor-joining)下的JTT模型进行系统进化树的构建,自展法系数(Bootstrap)设置为1 000次。利用String 11.5(http:∥cn.string-db.org)在线软件,选用K均值聚类算法分析,最低互动评分选择High confidence(0.700),对BoTCP
成员蛋白之间、成员与其他蛋白之间存在的互作关系进行预测。1
.2
.8
家族基因在芥蓝不同光质处理下和不同时期种子种荚的转录组数据分析结合芥蓝在红蓝光质处理下RNA-seq数据以及处于鱼雷形胚时期和子叶形胚早期种子种荚的FPKM值,分析BoTCP
家族各成员的表达趋势,使用TBtools 1.0695软件绘制表达量热图。1
.2
.9
家族基因在芥蓝不同时期不同组织部位的qRT-
PCR分析采用TaKaRa试剂盒RNAiso Plus (Code No. 9109)、PrimeScript RT reagent Kit with gDNA Eraser (Code No. RR047A)和TB GreenPremix ExTaq
TM Ⅱ (Code No. RR820A)来依次提取芥蓝材料总RNA并反转录成cDNA,进行qRT-PCR反应。利用DNAMAN 9.0和Primer Premier 5软件对所选序列进行同源比对和qRT-PCR引物设计(表1)。以BoActin
作为内参基因,使用CFX96 Real-Time PCR Detection System仪器进行定量检测,反应体系为20 μL:TB Green Premix ExTaq
Ⅱ(Tli RNaseH Plus)(2x)10 μL,ddHO 7.4 μL,上、下游引物各0.8 μL,cDNA模板1 μL,每个样品4次生物学重复。qRT-PCR反应程序为:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,40个循环进行扩增。根据2方法来计算相对表达量,利用Excel 2016软件进行数据统计,采用SPSS 24软件中的Duncan法进行显著性分析(P
≤0.05),并用Origin 2017软件制作柱形图。表1 芥蓝家族相关基因引物序列
Table 1 Primer sequence of family related genes in Chinese kale
引物名称Primer name上游引物(5'→3')Forward primer (5'→3')下游引物(5'→3')Reverse primer (5'→3')引物用途Primer useBoActinCTGTGACAATGGTACCGGAATGACAGCCCTGGGAGCATCA内参 ActinBoTCP5ACGACGGAGCAATGACTAACGTGGCGGCTATGATGGAAGGqPCRBoTCP14GCTCCACCGTCGTCGTCAATCGTCAGCATCAGCGTTCGTCqPCRBoTCP16CCCTTCAGTCCAGTTACAGTCCCAGGGACCCCTCTGAGAATAAAGCqPCRBoTCP21CAACTTGGCTGATACTCAAACGCCTTGGCTTAGGTTCGGGGTGqPCRBoTCP25GTCCCCTTCAGTCCAGTTACAGTGACCATCGTGCTGCTCCTCTqPCRBoTCP40GAGGTGGTGAATTATCGGTTGGGGTGTCGGACGAAGAGTGTAGCqPCR
2 结果与分析
2.1 芥蓝TCP基因家族成员鉴定及其在叶片不同部位的qRT-PCR分析
利用生物信息学方法,最终在芥蓝中鉴定得到40个具有完整保守结构域的BoTCP
家族成员,参考拟南芥TCP
家族成员命名方法,将其依次命名为BoTCP1
~BoTCP40
。参考拟南芥同源TCP
基因注释及拟南芥数据库基因的相对表达量,初步选取BoTCP21
和BoTCP25
基因,采用qRT-PCR分析BoTCP21
和BoTCP25
在叶片不同部位(图1(a))的相对表达量(图1(b))。BoTCP21
和BoTCP25
均在叶片中大量表达,但两者在真叶不同部位的表达模式存在差异。BoTCP21
在真叶叶肉、叶脉和‘菇叶’中高表达,在叶缘中表达量较低,而BoTCP25
则在叶缘中高表达,在叶肉、叶脉和‘菇叶’中表达量较低。表明这2个BoTCP
成员与叶片发育密切相关且在叶片的近轴端和远轴端的表达趋势相反,在叶片生长发育的过程中,二者是相互协同还是拮抗作用,是否还有其他的BoTCP
家族成员参与叶片生长发育过程,有待进一步研究。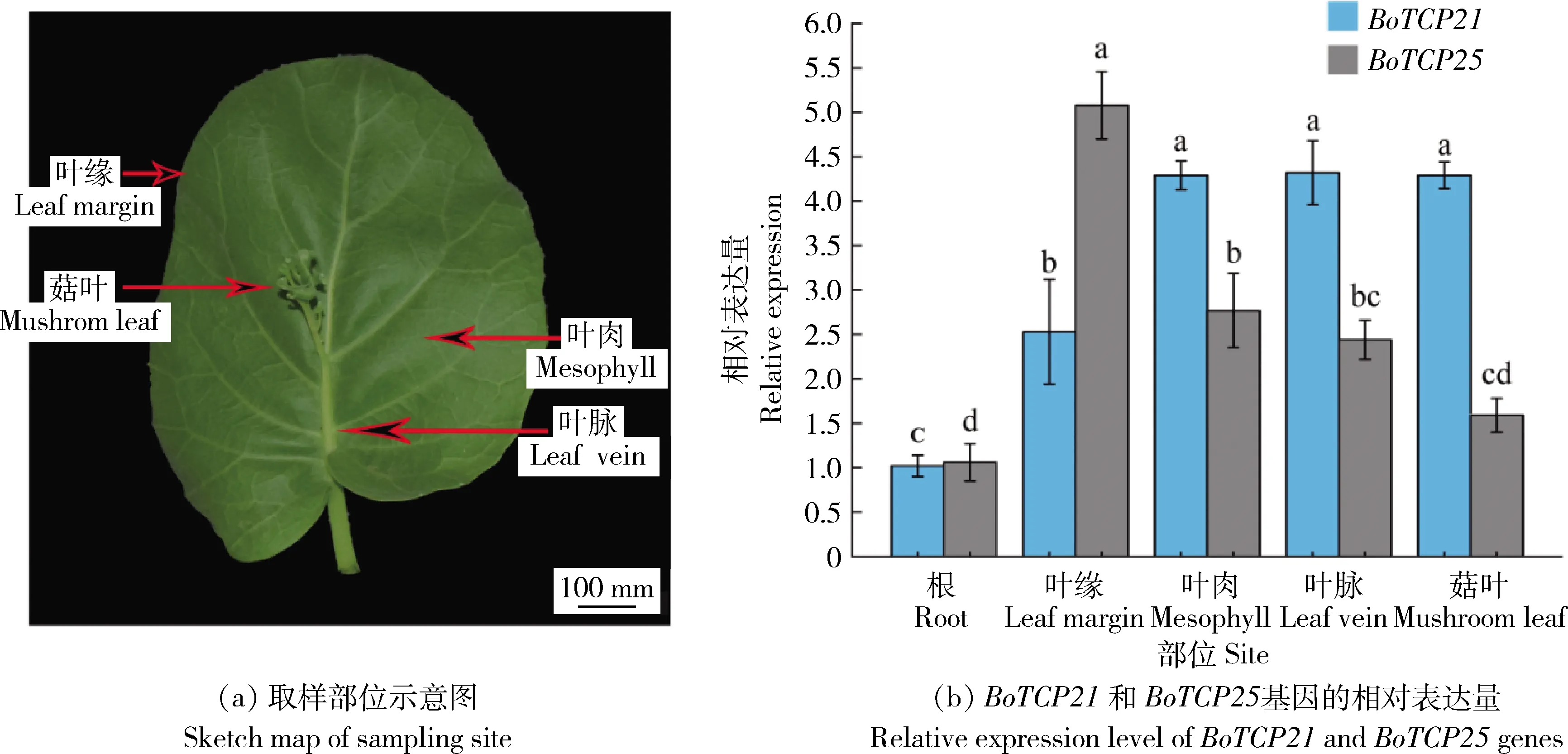
图(b)内不同小写字母代表显著差异(P<0.05)。Different lowercase letters in the graph (b) represent significant differences (P<0.05).图1 ‘香菇’芥蓝取样示意图及相关BoTCP成员在叶片不同部位的相对表达量Fig.1 ‘Xiang Gu’ Chinese kale sampling diagram and relative expression of relevant BoTCP members in different parts of leaves
2.2 芥蓝TCP基因家族成员蛋白基本理化性质分析
通过分析芥蓝TCP
家族成员蛋白质基本理化性质发现(表2),该家族的氨基酸长度在188~473 aa之间,其中氨基酸序列最短的是BoTCP22
,最长的是BoTCP18
;分子量介于3 222.52~50 857.24 ku,其中分子量最小的为BoTCP17
,最大的为BoTCP18
;等电点在5.24~10.48范围内,其中等电点最低的是BoTCP6
,最高的是BoTCP10
,有15个基因的等电点小于7.00,呈酸性,有1个等于7.00,呈中性,有24个大于7.00,呈碱性;TCP
基因编码蛋白的氨基端均无信号肽,属于非分泌蛋白;亲水性数值显示都为负值,预测40个BoTCP
基因编码蛋白均为亲水性蛋白;根据不稳定分析结果显示,BoTCP13
、BoTCP22
和BoTCP37
这3个基因编码蛋白的不稳定系数低于40,可能为稳定蛋白,其余可能是不稳定蛋白;亚细胞定位预测结果显示,绝大部分的BoTCP
家族成员定位在细胞核,各有1个成员定位在内质网、细胞质和液泡;参考拟南芥同源基因注释,有19个BoTCP
成员属于PCF
亚家族,13个成员属于CIN
类亚家族,其他8个成员属于CYC
类亚家族。表2 芥蓝基因家族成员蛋白质基本理化性质
Table 2 Basic physical and chemical properties of gene family proteins in Chinese kale
基因名称Genename基因IDGeneID氨基酸数Numberof aminoacids分子量Molecularweight理论等电点Theoreticalpl平均亲水性Gravy不稳定指数Instabilityindex亚细胞定位Subcellularlocalization拟南芥同源基因Arabidopsishomologousgene类别ClassBoTCP1Bo00998s02028830 999.505.89-0.63451.05NCAtTCP19PCFBoTCP2Bo1g01952035839 146.657.91-0.84941.26NCAtTCP2CINBoTCP3Bo1g11749042648 744.226.88-0.89051.09NCAtTCP18CYCBoTCP4Bo1g12983035838 633.827.00-0.65468.00NCAtTCP3CINBoTCP5Bo2g00904022523 567.399.29-0.38849.71NCAtTCP21PCFBoTCP6Bo2g05564034639 407.665.24-0.86651.59NCAtTCP1CYC/TB1BoTCP7Bo2g06125034539 044.637.71-0.84251.92NCAtTCP12CYC/TB1BoTCP8Bo2g06439031433 286.407.43-0.67759.42NCAtTCP15PCFBoTCP9Bo2g07521037138 832.988.97-0.65444.42NCAtTCP22PCFBoTCP10Bo2g16097023024 924.2110.48-0.50353.01NCAtTCP7PCFBoTCP11Bo2g16124030133 765.066.35-0.80847.50NCAtTCP5CINBoTCP12Bo3g00467024427 292.216.40-0.62055.63NCAtTCP17CINBoTCP13Bo3g00485023524 258.1910.18-0.35838.63NCAtTCP21PCFBoTCP14Bo3g03890029330 942.339.71-0.24855.77NCAtTCP9PCFBoTCP15Bo3g05546032035 752.396.56-0.81854.77NCAtTCP13CINBoTCP16Bo3g06654040444 097.587.49-0.79168.45NCAtTCP4CINBoTCP17Bo3g0715602873 222.527.27-0.70457.12NCAtTCP18CYC/TB1BoTCP18Bo3g13472047350 857.246.66-0.87665.35NCAtTCP14PCFBoTCP19Bo3g14776030734 402.567.80-0.96964.52NCAtTCP24CINBoTCP20Bo4g02486033235 273.949.44-0.27758.57ERAtTCP9PCFBoTCP21Bo4g05368034938 687.396.44-0.87151.32CPAtTCP10CINBoTCP22Bo4g14076018820 205.639.20-0.64528.70NCAtTCP6PCFBoTCP23Bo5g06258031735 046.127.81-0.91550.83NCAtTCP24CINBoTCP24Bo5g11741041147 348.208.90-0.87854.55NCAtTCP18CYC/TB1BoTCP25Bo5g12750040444 277.888.02-0.80764.90NCAtTCP3CINBoTCP26Bo5g15284039043 898.389.12-0.46352.29VCAtTCP13CINBoTCP27Bo6g09527031133 366.407.43-0.73953.95NCAtTCP15PCFBoTCP28Bo6g09904035440 233.905.67-0.79844.91NCAtTCP1CYC/TB1BoTCP29Bo6g10367035940 875.565.41-0.86761.65NCAtTCP1CYC/TB1BoTCP30Bo6g10724032336 445.128.82-0.76360.43NCAtTCP12CYC/TB1BoTCP31Bo6g11029031934 037.097.08-0.77161.49NCAtTCP15PCFBoTCP32Bo6g11453035637 338.296.64-0.62846.90NCAtTCP23PCFBoTCP33Bo7g08412031833 475.996.95-0.66153.31NCAtTCP20PCFBoTCP34Bo7g09779024125 956.989.69-0.58155.64NCAtTCP7PCFBoTCP35Bo7g09826036440 441.986.35-0.89252.72NCAtTCP5CINBoTCP36Bo7g10596038241 987.657.05-0.93142.80NCAtTCP2CINBoTCP37Bo9g00811027429 032.245.64-0.49138.77NCAtTCP20PCFBoTCP38Bo9g01426021623 119.849.38-0.47545.17NCAtTCP7PCFBoTCP39Bo9g05209039241 170.066.05-0.67152.48NCAtTCP8PCFBoTCP40Bo9g17449023624 818.567.99-0.45446.81NCAtTCP21PCF
注:NC,细胞核;ER,内质网;CP,细胞质;VC,液泡。
Note: NC, nucleus; ER, endoplasmic reticulum; CP, cytoplasm; VC, vacuole.
2.3 芥蓝TCP基因家族基因结构及其编码蛋白基序组成分析
利用基因组信息和蛋白质编码序列从基因结构角度分析芥蓝TCP
家族的进化过程(图2(a))。结果表明40个家族成员中大部分成员基本不存在内含子,仅以1个外显子为主,占总数的82.5%;其中有4个家族成员(BoTCP7
、BoTCP11
、BoTCP26
和BoTCP28
)具有2个外显子,占总数的10.0%,仅有1个家族成员(BoTCP17
)包含有3个外显子,占总数的2.5%,有2个TCP
家族成员(BoTCP3
和BoTCP24
)具有4个外显子,占总数的5.0%。有趣的是,在拟南芥中,其TCP
基因家族只含有1个外显子的成员约占总数的82.0%,占比上趋近于芥蓝,不同BoTCP
成员外显子-内含子结构数量分布不同,可能是物种进化过程中由于内含子的插入或丢失造成的,进而很大程度上会导致其基因功能的分化和表达调控方式的多样性。通过上述结果,预测拟南芥和芥蓝的TCP
家族成员在基因功能的表达上具有一定的相似性。为了解芥蓝TCP
家族成员蛋白保守结构域特点,利用MEME在线软件预测分析,设定搜索出20个motif,结果显示40个芥蓝TCP
家族成员氨基酸序列中均包含motif1,大部分序列(25条以上)包含motif2~4和motif15这4个motif,表明这5个基序在芥蓝TCP蛋白中较为保守。由编码蛋白保守基序标识和motif基本信息所示(图2(b)),其中最保守的基序motif1的氨基酸长度为50,数量为40,再结合domain结构域(图2(c))进一步分析可知,motif1即为TCP
结构域。各成员含有motif的数量差异较大,最少含有2个motif,且总是以motif1与motif2、motif1与motif3组合的形式出现在9个芥蓝TCP
家族成员蛋白序列中;最多含有7个motif,其中BoTCP4
、BoTCP16
、BoTCP25
编码蛋白与BoTCP28
、BoTCP29
编码蛋白具有的motif基序种类和排列顺序一致;某些motif保守基序只在特定的成员氨基酸序列中出现,motif10只在BoTCP8
、BoTCP27
和BoTCP31
这3个成员中出现,motif14也只在BoTCP4
、BoTCP16
和BoTCP25
中出现;另外同一个家族成员编码的蛋白序列中,只有motif2存在2次重复出现的情况,体现在BoTCP14
和BoTCP39
编码的蛋白质序列中,预测二者可能编码相似的蛋白质产物。本研究还发现,某些motif的出现呈现出一定的规律性,如motif2总是与motif1相邻并在其后出现,motif3也总是与motif1相邻并在其前出现,推测可能包含该序列特征的成员属于同一个亚家族。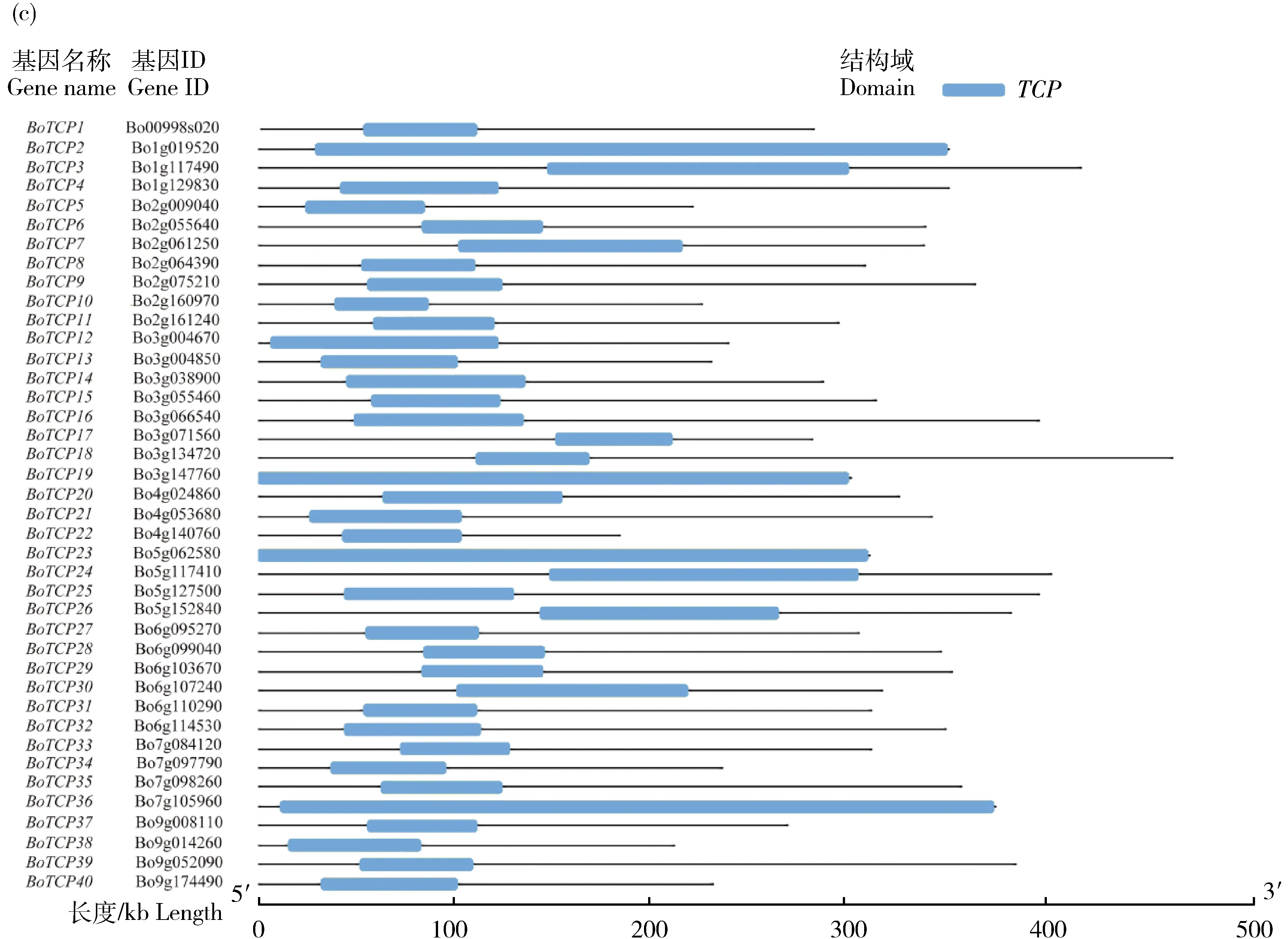
图2 芥蓝TCP家族基因结构(a)、保守基序(b)和蛋白保守结构域(c)分布图Fig.2 The distribution map of the gene structure (a), conserved motif (b) and protein conserved domain (c) of the TCP family of Chinese kale
2.4 芥蓝TCP基因家族染色体定位
利用甘蓝基因组gff3文件,通过TBtools软件进行染色体定位结果可视化,获得芥蓝TCP
家族成员染色体定位信息(图3)。40个芥蓝TCP
家族成员中除了TCP1
,其他39个成员均能精准定位在组装好的9条染色体上的第1、2、3、4、5、6、7及第9条上且不均匀分布。其中第3条染色体上分布最多,含有8个成员,占比20.0%;第1条和第4条分布最少,各有3个成员,各占比7.5%;第5、7和9条染色体各包含4个成员,各占比10.0%;第6条染色体分布有6个成员,占比15.0%;第2条染色体含有7个成员,占比17.5%。除此之外,从图中可以明显看出存在小型的基因簇,第2条染色体上的BoTCP10
和BoTCP11
、第3条染色体上的BoTCP12
和BoTCP13
以及第7条染色体上的BoTCP34
和BoTCP35
都相聚在同一位点上,预测这3条染色体的2个成员在功能上具有相似性。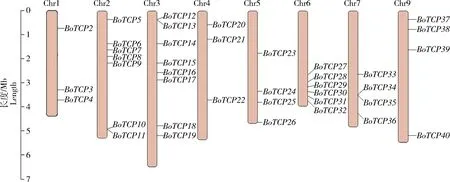
图3 芥蓝TCP家族成员染色体定位图Fig.3 Chromosome mapping of TCP family members of Chinese kale
2.5 芥蓝TCP基因家族种内和种间共线性分析
在进化过程中,染色体通过节段复制、串联复制和全基因组复制在不同基因组中发生扩增有助于扩大基因家族。采用MCScanX软件对BoTCPs
进行共线性关系分析(图4(a)),发现该家族存在24对重复基因,其中在第2、3和7条染色体上各含有1对串联重复基因,分别为BoTCP10-BoTCP11
、BoTCP12-BoTCP13
和BoTCP34-BoTCP35
,其余21对基因为染色体片段重复基因。由于甘蓝类作物基因组存在三倍化复杂复制过程,利用拟南芥基因组和水稻基因组与甘蓝基因组进一步分析芥蓝与拟南芥同源基因、水稻TCP
家族的共线关系。如图4(b)所示,共有8条染色体上的32个BoTCP
基因与5条染色体上的19个AtTCP
基因构成37对共线性关系。对拟南芥TCP
基因与芥蓝的共线基因统计发现,68%的AtTCP
基因在芥蓝中有2个以上共线基因,其中AtTCP4
在芥蓝中有9个共线基因,表明BoTCP
基因家族在芸薹属多倍化事件中得到显著的扩张。仅有4条染色体上的5个BoTCP
基因与4条染色体上的5个OsTCP
基因存在6对共线性关系,表明芥蓝与双子叶植物拟南芥的亲缘关系更近,与单子叶植物水稻的亲缘关系更远。此外,5个成员(BoTCP19
、BoTCP23
、BoTCP31
、BoTCP33
和BoTCP34
)在芥蓝与拟南芥基因组共线性及芥蓝与水稻基因组共线性中均有发现,推测这些成员在单子叶与双子叶植物祖先分化前已经完成进化。
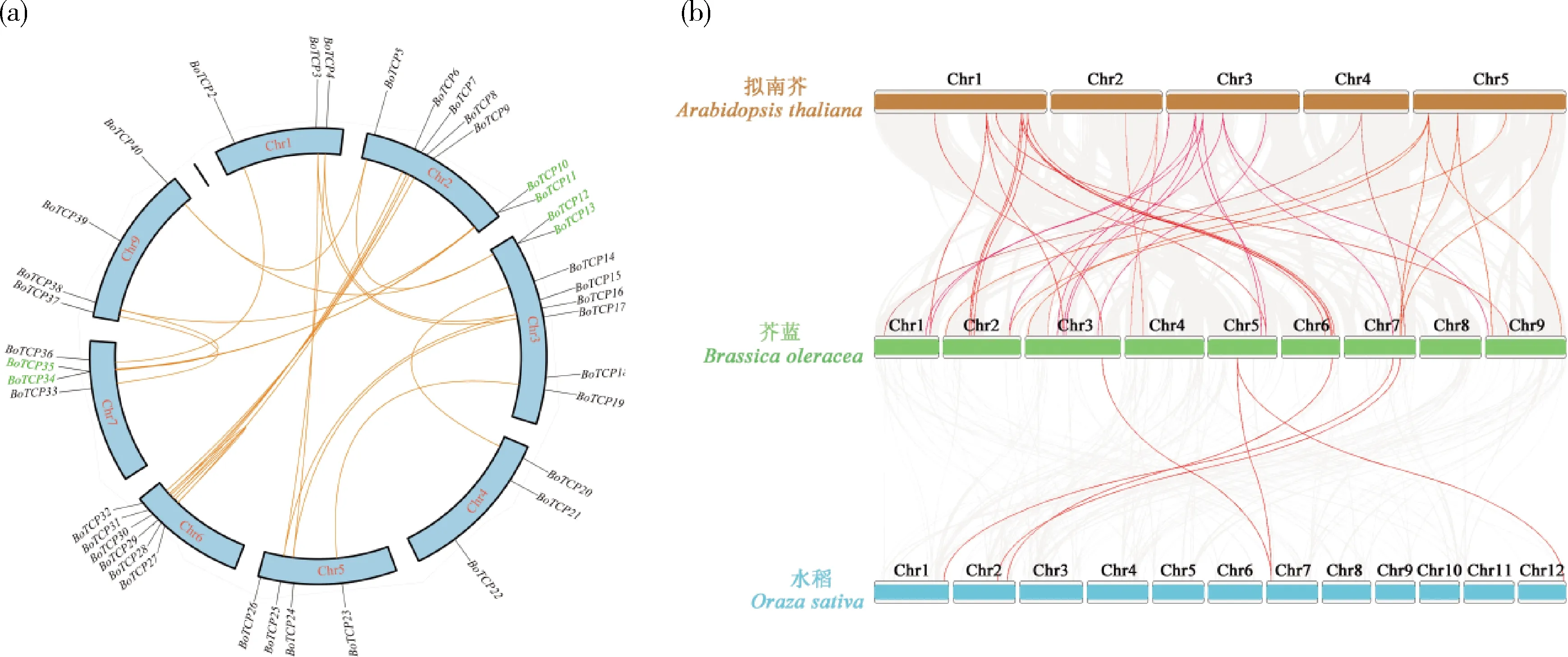
图4 芥蓝TCP家族成员种内(a)及与拟南芥和水稻的种间(b)共线性关系图Fig.4 Intraspecific (a) and interspecific (b) collinear relationships amongTCP family members in Chinese kale and Arabidopsis and rice
2.6 芥蓝TCP基因家族系统发育进化树构建分析
为研究芥蓝与拟南芥和水稻TCP
之间的进化关系,采用这3个物种的TCP氨基酸序列构建系统进化树(图5)。参考拟南芥中TCP
基因分类,再结合进化树中成员聚类情况,可初步将TCP
基因家族分为3类,即PCF
亚家族、CYC
亚家族和CIN
亚家族。在PCF
亚家族中,芥蓝、拟南芥和水稻各有成员19、12和14个;在CYC
亚家族中,芥蓝、拟南芥和水稻各有成员8、4和2个;在CIN
亚家族中,芥蓝、拟南芥和水稻各有成员13、8和6个。从聚类情况来看,芥蓝TCP
家族成员将近50%属于PCF
亚家族,同一类的TCP
基因家族成员可能行使相似的功能。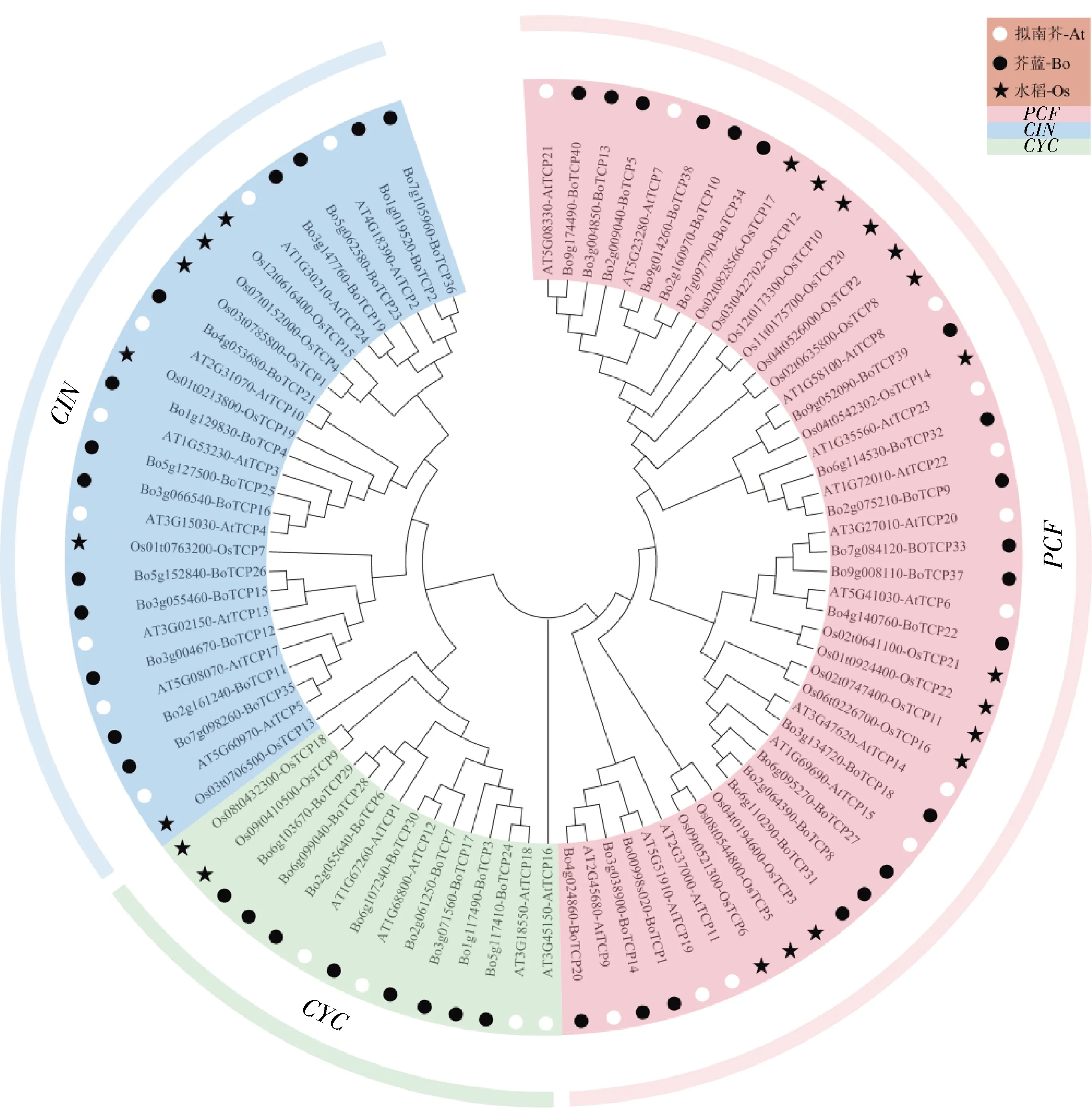
图5 芥蓝、水稻和拟南芥中TCP家族成员的系统进化树Fig.5 Phylogenetic tree of TCP family members in Chinese kale, rice and Arabidopsis
2.7 芥蓝TCP基因家族启动子顺式作用元件和转录起始位点分析
分析芥蓝BoTCP
基因启动子序列(ATG上游2 000 bp),预测存在的核心启动子区域和转录起始位点。将芥蓝TCP
家族成员启动子分别命名为:BoTCP1p
~BoTCP40p
。转录起始位点预测结果表明:40个芥蓝TCP
家族成员中除了BoTCP22p
、BoTCP24p
和BoTCP25p
这3个成员出现转录起始起点缺失外,其余37个成员均包含转录起始起点;其中BoTCP9p
、BoTCP14p
和BoTCP30p
仅有1个转录起始位点,BoTCP21p
转录起始位点最多,达到6个,且得分都≥0.88,其余33个成员均具有多个转录起始位点。总体而言,转录起始位点数量和得分存在较大差异。为深入了解BoTCP
家族成员之间对环境胁迫的响应和激素的应答调控功能,对其基因上游2 000 bp的启动子序列进行顺式作用元件预测(图6)。结果表明:在预测到的15种响应元件中,所有家族成员均具有光响应元件,且各成员含有的光响应元件在种类和数量上存在较大差异;55%以上的基因成员含有厌氧诱导响应元件、脱落酸和茉莉酸甲酯激素应答元件;40%的基因成员响应生长素和乙烯的调控;20%的基因成员含有赤霉素、水杨酸、玉米胶蛋白代谢、低温、昼夜节律、防御胁迫和干旱胁迫下MYB
结合位点响应元件,表明这些基因可能具有响应以上元件的作用;只有4个(BoTCP1p
、BoTCP6p
、BoTCP13p
和BoTCP27p
)成员包含响应分生组织表达元件,推测这些成员在芥蓝分生组织表达方面发挥重要作用;此外,也只有4个(BoTCP1p
、BoTCP5p
、BoTCP12p
和BoTCP40p
)成员包含光胁迫下MYB
转录因子结合位点,暗示了在特定条件下,芥蓝TCP
家族基因可能受MYB
结合因子调控作用;值的注意的是,只有BoTCP1p
基因同时含有分生组织表达和光胁迫下MYB
转录因子结合位点,猜测BoTCP1p
基因在芥蓝中协同调控分生组织表达和MYB
转录因子结合位点。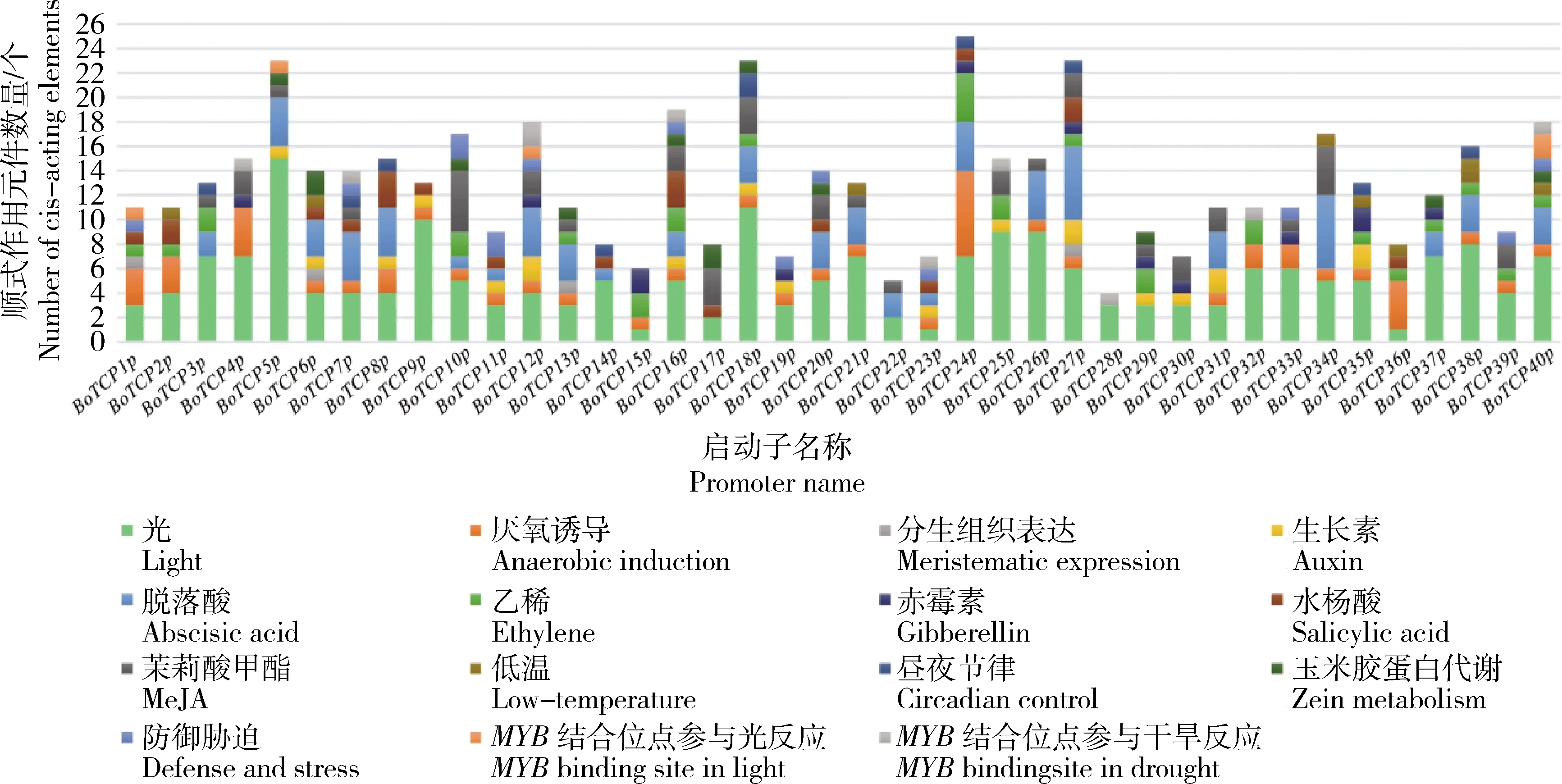
图6 芥蓝TCP基因家族启动子顺式作用元件分布Fig.6 Distribution of cis-acting elements in the promoters of the TCP gene family of Chinese kale
2.8 芥蓝TCP基因家族编码蛋白网络互作预测分析
利用String 11.5在线软件对芥蓝TCP
基因编码蛋白之间以及与其他蛋白之间进行蛋白互作预测(图7)。聚类结果显示,除BoTCP25和BoTCP26蛋白外,剩余38个芥蓝TCP蛋白之间均可以发生不同程度的相互作用。BoTCP蛋白既可以与自身成员之间发生互作,也可以和其他蛋白之间发生互作。BoTCP蛋白与其他蛋白存在互作关系并形成3个分支,第1支(红色区域)与ARF4和Rab发生互作,主要与生长素合成运输和细胞增殖功能相关;第2支(绿色区域)与Cpn60、P450、Methyltyansf和Prenyltrans等存在互作,这些蛋白依次与叶绿体分子伴侣蛋白、植物细胞色素、甲基化作用和异戊烯酶合成等功能相关;第3支(青色区域)与CCT、PDB、PPR-4和DUF1313发生互作,这些蛋白依次与光周期响应、过氧化物酶、胚胎发育和未知结构域蛋白功能相关。进一步研究发现尤其在青色区域和绿色区域中,TCP蛋白之间和其他多种蛋白之间发生互作的关系最强,预测与TCP蛋白互作关系较强的蛋白可能与TCP具有功能相关性。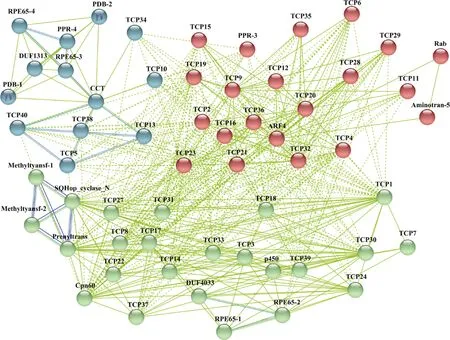
K均值聚类下分为3支:第1支(红色区域)、第2支(绿色区域)和第3支(青色区域)。K-means clustering is divided into three branches: the first branch (red area), the second branch (green area) and the third branch (cyan area).图7 芥蓝TCP基因家族编码蛋白网络互作预测Fig.7 Interacting protein prediction of TCP gene family in Chinese kale
2.9 TCP家族基因在芥蓝不同光质处理下和不同时期种子种荚的转录组数据分析
结合芥蓝在红蓝光质处理下以及处于鱼雷形胚时期和子叶形胚早期种子种荚的FPKM值,生成聚类热图(图8(a)和(b))分析BoTCP
家族基因的表达模式。结果显示其表达模式可分为六类:第一类在红蓝光处理下和子叶形胚的种子表达量较高(BoTCP4
和BoTCP16
);第二类在红蓝光处理下和子叶形胚的种荚表达量较高(BoTCP5
和BoTCP13
);第三类在红光处理下表达量较高(BoTCP14
);第四类在红蓝光处理下表达量较高(BoTCP18
和BoTCP21
);第五类除了在鱼雷形胚的种子中表达量较低,其他阶段都有较高表达量(BoTCP25
和BoTCP36
);第六类中BoTCP40
在每个阶段都有较高的表达量。总体而言,TCP
家族成员在芥蓝不同表达模式中存在协同作用,推测其可能存在功能冗余和分化。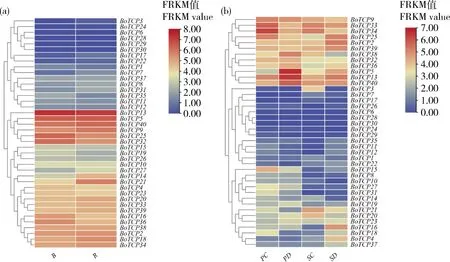
(a)中B为蓝光处理,R为红光处理;(b)中PC和SC为鱼雷形胚种子种荚,PD和SD为子叶形胚种子种荚。In figure (a), B is blue light processing and R is red light processing; In Figure (b), PC and SC are torpedo-shaped embryo seed pods, PD and SD are cotyledon embryo seed pods.图8 BoTCP家族成员在芥蓝不同光质处理(a)和不同时期种子种荚(b)下表达量热图Fig.8 BoTCP family members expressed caloric maps under different light quality treatments (a) and seed pods (b) at different times in Chinese kale
2.10 TCP家族基因在芥蓝不同时期不同组织部位的qRT-PCR分析
为了进一步了解TCP
家族基因在芥蓝不同时期不同组织部位的表达模式,根据转录组数据下的热图分析,BoTCP
家族差异基因有6种表达模式。每种模式下各选择1个成员,结合PCR表达量验证,最终选取BoTCP5
、BoTCP14
、BoTCP16
、BoTCP21
、BoTCP25
和BoTCP40
基因,以‘香菇’芥蓝在不同时期不同组织部位(Ⅰ时期的根、真叶、花茎和薹叶及Ⅱ时期的根、真叶、花茎、薹叶、种子和种荚)为试验对象,利用qRT-PCR检测以上6个成员的相对表达量(图9)。结果显示,BoTCP5
、BoTCP21
、BoTCP25
和BoTCP40
在种子中高表达,尤其是BoTCP21
,其在种子中的表达量远高于其他成员,这和转录组数据表达量趋势一致,进一步验证了转录组数据的准确性。其中BoTCP5
在种荚和花茎也具有较高的表达量,BoTCP21
和BoTCP25
还在真叶和薹叶中具有较高的表达量,而BoTCP40
还在薹叶中高表达,BoTCP14
在开花结荚的植株根部表达量较高,而BoTCP16
则在抽薹植株的根部表达量最高。以上结果表明,芥蓝中的TCP
广泛参与了植株的形态建成和器官发育且不同BoTCP
家族成员在表达模式上存在时空特异性。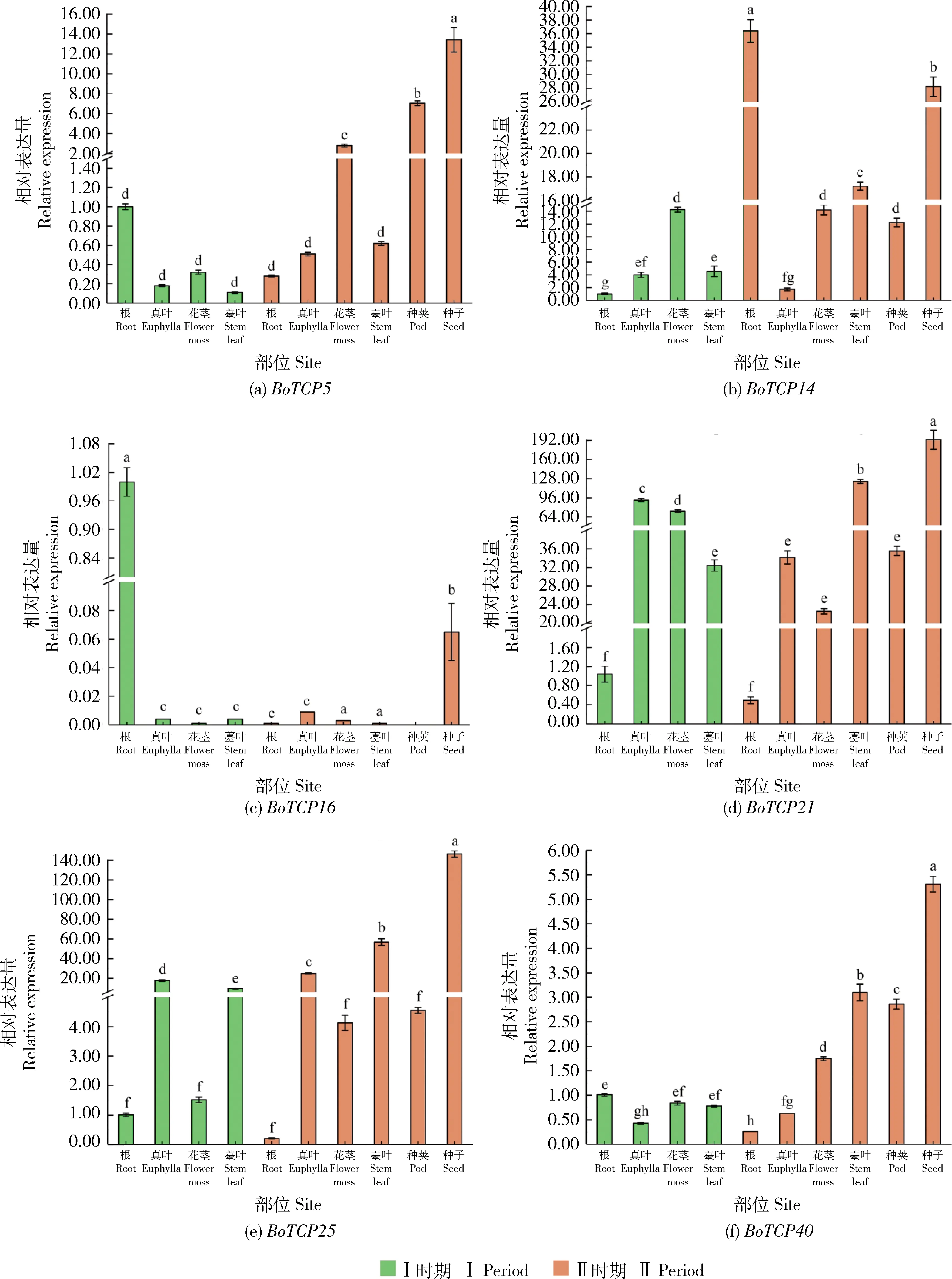
图内不同小写字母代表显著差异(P≤0.05)。Different lowercase letters in the graph represent significant differences (P≤0.05).图9 TCP家族成员在‘香菇’芥蓝不同时期不同组织部位的相对表达量Fig.9 Relative expression of TCP family members in different tissues of ‘Xiang Gu’ Chinese kale in different periods
3 讨论与结论
TCP
基因家族有重要且广泛的调控作用,其蛋白是植物特有的一类转录因子。目前,TCP
基因家族已经陆续在马铃薯、高粱、菠萝和玉米中分别被鉴定出43、27、9和43个成员。本研究通过序列比对和保守结构域分析,从甘蓝基因组数据库中鉴定出40个BoTCP
基因。相比模式作物拟南芥,甘蓝类芸薹属作物经历了全基因组三倍化复制事件,通过种内和种间共线性发现,芥蓝与拟南芥的同源共线性基因对数不太吻合三倍体复制化进程,表明甘蓝芸薹属作物在漫长的进化过程中发生过基因丢失。然而由于芥蓝TCP
成员存在串联重复和片段复制现象,总体上BoTCP
基因家族发生了基因扩张现象,这也表明BoTCP
基因家族有着更加精细的功能。前人研究发现,在模式植物拟南芥中TCP
家族成员广泛调节叶片发育和种子的形态建成。金鱼草CIN
基因突变导致叶边缘形态发生改变,同时对叶子大小也有重要的调控作用。AtTCP24
、AtABAP1
和AtORC1
通过形成复合物抑制叶片发育过程中DNA的复制;AtTCP4
直接激活HD
-ZIP
转录因子HAT2
的表达,以调控生长素响应,使叶片细胞分裂结束从而导致叶片减小。除了CIN
类成员,ClassⅠ基因也参与调控叶的发育,AtTCP9
和AtTCP20
突变导致叶片发育早期表面细胞增大,AtTCP14
不仅影响叶边缘细胞增殖,还参与调控种子的胚胎发育。芥蓝与拟南芥同属十字花科,二者在叶片和种子等部位生长发育上存在一定的相似及差异性。生物信息学分析显示BoTCP5
与AtTCP14
基因同源聚类,本研究通过qRT-PCR试验发现BoTCP
5在种子中高表达,这与前人的研究一致。AtTCP23
参与植物开花节律和植物发育,但在此次的芥蓝研究中未能充分体现相关成员具有与之相似的功能,可能是只在其同源基因BoTCP32
上及芥蓝不同品种间特异性表达。关于不同物种间TCP
成员参与根部位调控研究的文献未见报道,在本研究中,BoTCP14
在‘香菇’Ⅱ时期的根中高表达,BoTCP16
在‘香菇’Ⅰ时期的根中特异性表达且表达量相对较高,是否这2个成员与根部形态建成密切相关,有待后期进一步研究。除了TCP
家族外,NGA
、SPL
、GRF
和ARF
等家族也在不同时期以直接或者间接的方式调控叶片的发育,这可能很大程度上导致其功能的冗余,进而导致基因表达存在时空特异性。据文献报道,拟南芥AtTCP3
能够结合AtNGA3
启动子中的1个保守区域,通过激活NGA3
启动子来调控其合成表达,进而影响叶片的形态发育。本研究生物信息学分析表明BoTCP25
与AtTCP3
基因同源聚类,是否BoTCP25
与BoNGA3
存在转录后调控关系,有待进一步研究。叶片发育来源于茎顶端分生组织(Shoot apical meristem,SAM),茎尖分生组织外周特定区域形成细胞突起,随后发育形成叶原基,叶原基经生长和分化发育最终形成成熟叶片。生长素(Auxin)促进叶原基分化形成小叶,高浓度生长素在SAM中的积累部位是叶原基起始的位置,与此相似,生长素高浓度点也是叶缘缺刻和小叶发生的部位。ARF
家族是1类与生长素合成密切相关的转录因子家族,AtARF4
通过与AtARF5
和IAA12
的协同作用调节不定芽再生,同时与AtTCP10蛋白也存在一定的协同作用。本研究进化树聚类分析表明BoTCP21
与AtTCP10
基因同源聚类且蛋白网络互作预测BoTCP21
与BoARF4
存在潜在的互作关系,是否二者间存在互作后期有待试验佐证。综上,本研究基于生物信息学、RNA-seq下的FPKM值和qRT-PCR试验发现BoTCP
家族成员在‘香菇’芥蓝不同时期不同组织部位表达存在一定的时空特异性,推测其在植物生长的不同阶段行使不同的生物学功能。本研究表明CIN
类BoTCP
与叶片发育密切相关,而叶片作为十字花科芸薹属植物重要的组成部位和食用器官,对植物的生长发育及现代化的生产至关重要,这为后期深入挖掘BoTCP
相关基因在芥蓝叶片发育中的分子功能研究和调控利用提供理论依据。