石见穿多糖对肝腹水H22荷瘤小鼠的作用及可能机制*
2022-07-23蔡兴锐黄芬刘韵许丹妮曾江正
蔡兴锐 黄芬 刘韵 许丹妮 曾江正
(海南医学院第一附属医院肿瘤内科,海南 海口 570102)
恶性腹水是由各种恶性肿瘤引起的腹水,50%左右的晚期或复发恶性肿瘤患者在其病程中可能出现恶性腹水[1]。目前,化疗、腹腔穿刺术、利尿剂和腹腔分流术等是临床上治疗腹水症状常用方法,但这些疗法会产生许多副作用[2]。因此,寻找更有效的治疗方法已成为当前研究的主要任务。越来越多的证据表明,中医药为治疗恶性腹水提供可能途径[3]。研究表明,中药能减轻部分肿瘤患者抗肿瘤治疗的毒副作用[4]。石见穿系唇形科鼠尾草属华鼠尾草Salvia chinensis benth的干燥地上部分,具有清热解毒、活血镇痛之功能,主治肝炎、肾炎、痛经、噎隔、痛肿、癌症等[5]。天然植物多糖具有较好的免疫调节活性,还能促进机体抗肿瘤免疫反应。因此本研究通过石见穿多糖(Polysaccharides from salvia chinensis benth, PSSC)成分的有效提取,建立H22荷瘤小鼠腹水模型,探究其对肝癌腹水的抑制作用及可能机制。
1 材料与方法
1.1 主要药物与试剂 石见穿药材购自湖北省中药材有限公司,按文献[6]方法提取PSSC,溶于生理盐水备用;小鼠肝癌 H22 细胞株由中南大学湘雅医学院细胞典藏中心提供;刀豆蛋白A(ConA)和脂多糖(LPS) 购自美国Sigma公司产品;环磷酰胺(CTX)、CCK8购自长春百金生物工程有限公司;白介素2(IL-2)、γ-干扰素(IFN-γ)、肿瘤坏死因子-α(TNF-α)、血管内皮生长因子(VEGF)酶联免疫检测试剂盒购自联科生物技术有限公司;Tunel检测试剂盒、Caspase3/8试剂盒购自南京凯基生物公司;GAPDH、Janus激酶1(Jak1)、信号传导和转录激活因子-3(Stat3)、Bcl2-相关X蛋白(Bax),B淋巴细胞瘤-2(Bcl-2)一抗抗体购自美国Abbkines公司。
1.2 实验动物 BALB/c小鼠80只,体质量(18±2)g,购自南华大学实验动物中心,许可证号:SYXK(湘)2018-0021。实验前于(25±1)℃和(55±5)%相对湿度适应性饲养一周,以12 h光照/12 h避光交替循环饲养,所有小鼠均自由摄食、饮用蒸馏水。该实验小鼠的处理符合动物伦理要求,并获得本院伦理委员会批准。
1.3 方法
1.3.1 动物分组及模型建立 取对数生长期的H22细胞,以1×106个/mL的浓度重新悬浮在盐水中,在左腹腔中注射0.2 mL细胞悬浮液。H22荷瘤小鼠80只随机分为5组:对照组、CTX组及PSSC组(20、40和120 mg/kg PSSC),每组16只。对照组给予等量生理盐水;CTX组给予20 mg/kg CTX;PSSC组给予20、40和120 mg/kg PSSC。荷瘤次日给药,给药方法为隔天腹腔注射PSSC,共7次。每天测量小鼠腹部周长和体重,在第18天时处死一半小鼠,取脾脏、血清和腹水,其余小鼠正常喂养,记录存活时间。
1.3.2 脾淋巴细胞转化实验 采用无菌技术,粉碎小鼠脾脏,离心800×g 30 min,分离脾细胞,将细胞洗涤并重新悬浮于RPMI-1640培养基中。将脾细胞悬液培养 24 h后,分成实验组和对照组,以1×106个/mL浓度接种于96孔板中,分别加入ConA 2 mg/L和LPS 5 mg/L,细胞于37℃、5% CO2培养箱中孵育48 h,将CCK8试剂添加到每孔(20 μL/孔)中,再孵育2 h,450 nm处测量每孔中脾淋巴细胞的吸光度。模拟指标计算如下:刺激指数(SI)=实验组吸光度值/对照组吸光度值×100%。
1.3.3 E-花环实验 依据1.3.2操作,提取各组小鼠的脾淋巴细胞,用Hanks液配成1×106个/mL细胞悬液,每只小试管加入 0.1 mL脾淋巴细胞悬液,再加0.1 mL 1% 绵羊红细胞(SRBC)和0.05 mL灭活FBS,然后低速离心混合物,4℃过夜。次日用0.8%戊二醛在冰上固定细胞30 min,在高倍显微镜下观察。能够结合三个或更多的T细胞SRBCs被认为是阳性对照。随机抽取5个视野中不少于200个淋巴细胞计算花环形成率(EtRFC)。
1.3.4 血清和腹水细胞因子分析 取小鼠眼眶血,分离血清进行细胞因子分析;提取腹水离心,收集上清液,按ELISA试剂盒说明书操作,检测IL-2、IFN-γ、TNF-α、VEGF水平。
1.3.5 TUNEL法检测H22细胞凋亡 PSSC处理(1、2、4 mg/mL)H22细胞24 h后,4%多聚甲醛固定30 min,用PBS洗涤后,加入10%蛋白酶K孵育20 min,然后加入50 μL TDT溶液37℃孵育1 h,PBS洗涤后,加入50 μL Tritc染色剂37℃下孵育30 min,用DAPI(4,6-二氨基-2-苯基吲哚)染色细胞核,荧光显微镜观察细胞。
1.3.6 比色法测定Caspase-3和Caspase-8活性 按试剂盒说明书步骤收集细胞、处理检测样品,在酶标仪激发波长405 nm处测定吸光度(A)值,相对活性(%)=(实验组吸光度值/对照组吸光度值)×100%。
1.3.7 Western blot检测Jak1、Stat3、Bax和Bcl-2蛋白 将H22细胞(1×105个/mL)接种于6孔平板中,用不同浓度的PSSC(1、2、4 mg/mL)孵育48 h,然后预冷的PBS中洗涤2次,通过BCA法检测蛋白浓度,然后用8%或12%十二烷基硫酸钠/聚丙烯酰胺凝胶电泳(SDS/PAGE)分离蛋白,转膜,用含5%脱脂牛奶的TBST封闭,加入Jakl、Stat3、Bcl-2、Bax和GAPDH的多克隆抗体4℃下孵育过夜,TBST洗膜,加入HRP 标记的二抗稀释液孵育,采用ECL化学发光法进行显色反应,并使用GEDOC 2000系统进行分析。

2 结果
2.1 PSSC在体内抗肿瘤作用 将H22细胞移植到小鼠左腹腔,用不同剂量PSSC(20、40、120 mg/kg)和CTX 20 mg/kg处理。5 d后,接种肿瘤细胞的对照组小鼠出现明显的腹胀,而注射PSSC的小鼠则没有腹胀。7 d后,对照组小鼠腹水增多,腹部隆起明显,开始出现饮水和进食困难,变得懒惰,毛发没有光亮,体重和腹部周长迅速增加。第13天,对照组小鼠腹部隆起呈球形,小鼠无动于衷,几乎不活动,开始死亡(图1A)。接种后测量小鼠腹部周长和体重结果,与对照组相比,PSSC组的腹部周长和体重显著下降,且PSSC 40、120 mg/kg组腹部周长和体重均低于CTX组(P<0.05)(图1B、1C);与对照组相比,PSSC组的存活率和存活时间(在第50天结束时)呈剂量依赖性增加,且PSSC组小鼠存活率和存活时间均高于CTX组(P<0.05),见图1D、1E。
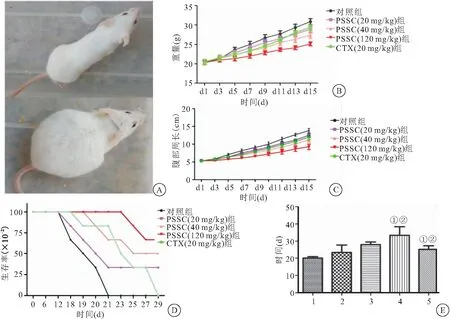
图1 PSSC对H22恶性腹水小鼠模型的影响
2.2 PSSC对脾淋巴T细胞增殖影响 采用ConA和LPS诱导H22肿瘤小鼠淋巴细胞增殖,与对照组相比,PSSC组小鼠脾脏淋巴细胞增殖量(SI)随PSSC治疗剂量的增加而增加,而与CTX组相比,PSSC 120mg/kg组SI升高(均P<0.05),见图2。
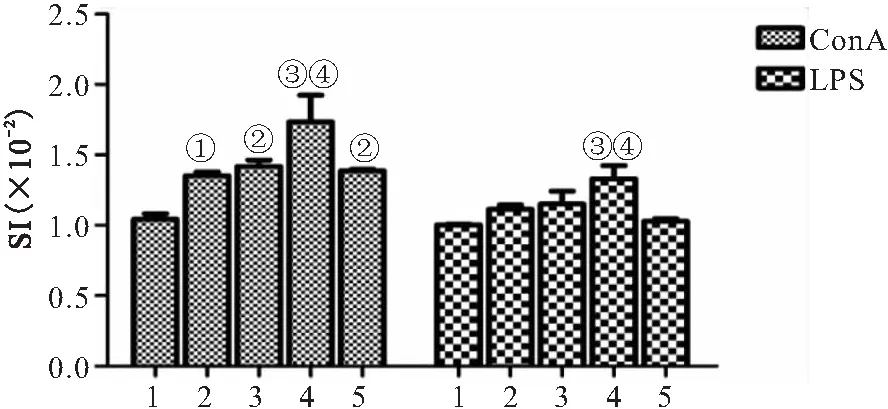
图2 PSSC对淋巴细胞增殖影响
2.3 PSSC对淋巴细胞玫瑰花结形成影响 T细胞CD2受体能特异性结合SRBC并形成特征性的花环(图3A)。各组玫瑰花结形成率结果显示,与对照组相比,PSSC组EtRFC(E-玫瑰花结形成细胞的比率)百分比呈剂量依赖性增加,而与CTX组相比,PSSC 120 mg/kg组EtRFC百分比升高(P<0.05),见图3B。
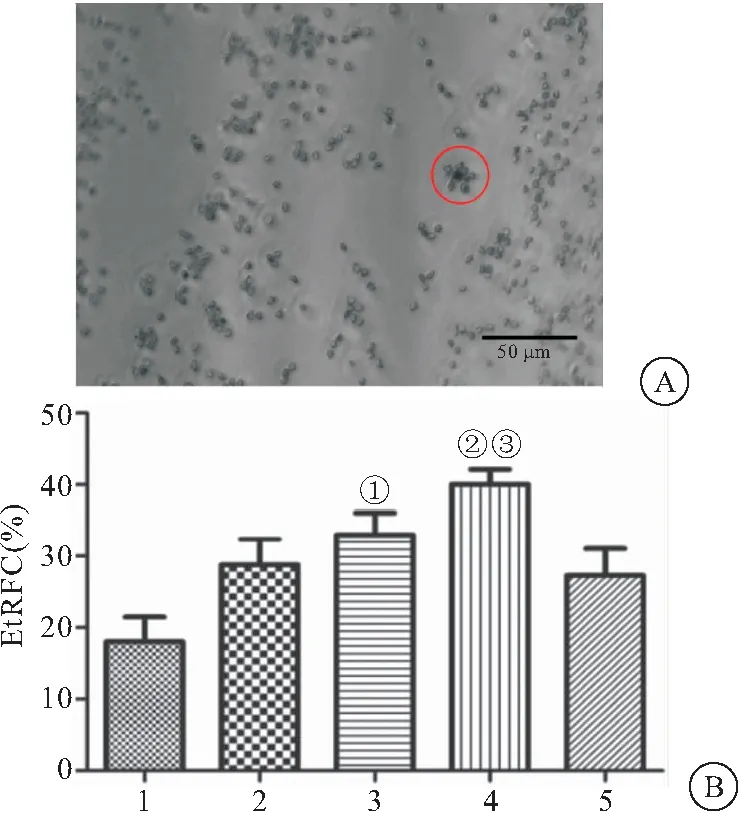
图3 PSSC对淋巴细胞玫瑰花结形成率影响
2.4 PSSC对血清和腹水细胞因子水平的影响 PSSC组H22肿瘤小鼠血清和腹水中的IL-2、IFN-γ和TNF-α水平较对照组增加,而VEGF表达降低,均呈剂量依赖性;PSSC 120mg/kg组小鼠血清和腹水中的IL-2、IFN-γ和TNF-α水平均高于CTX组,而VEGF表达水平低于CTX组(均P<0.05),见图4。
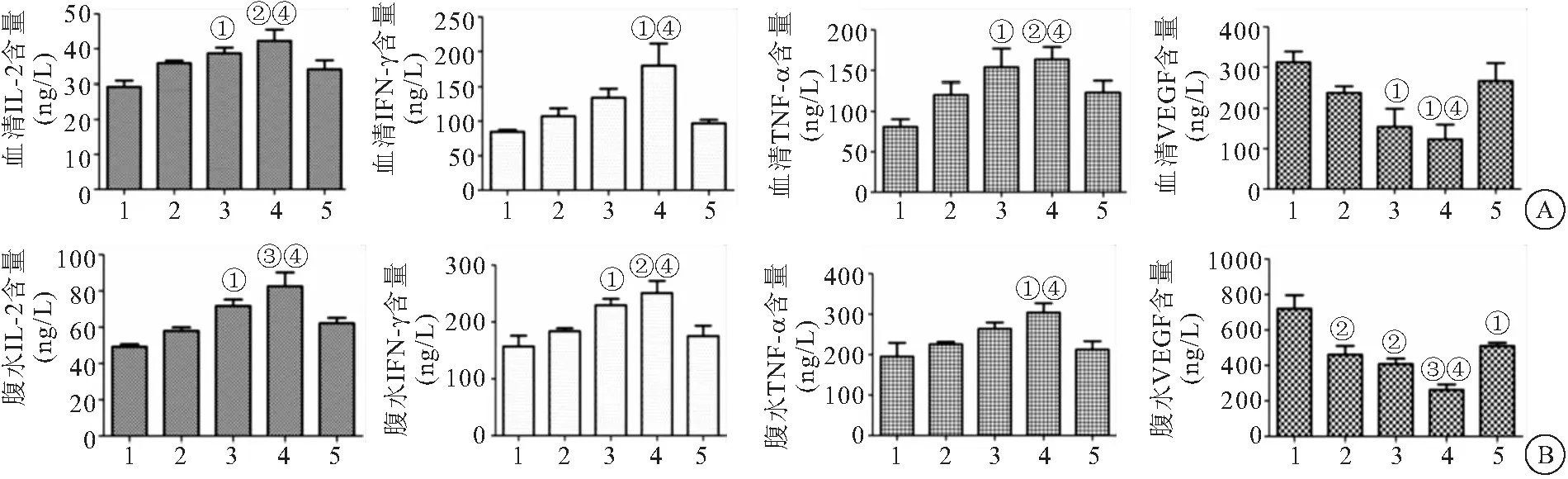
图4 PSSC对各组小鼠血清和腹水细胞因子影响
2.5 PSSC诱导H22细胞凋亡 TUNEL实验中,非凋亡细胞经DAPL染色呈蓝色核荧光,凋亡细胞经TRITC染色呈强红色荧光。与对照组相比,PSSC组H22细胞凋亡数量增加,呈剂量依赖性,见图5。

图5 TUNEL法检测H22细胞凋亡(400×)
2.6 PSSC体外抗肿瘤活性分析 用Caspase比色法测定PSSC处理的H22细胞Caspase-3和Caspase-8酶活性,与对照组相比,PSSC诱导H22细胞Caspase-3和Caspase-8活化,且随着PSSC浓度的增加而表达上升,见图6。

图6 Caspase-3和Caspase-8在H22细胞中的相对活性
2.7 Wester blot检测Jak1、Stat3、Bax和Bcl-2蛋白表达 随着PSSC浓度的增加,PSSC组Jak1、Stat3和Bcl-2蛋白表达较对照组降低,而Bax/Bcl-2比值上升,见图7。

图7 PSSC对Caspase-3和Caspase-8活化及其它相关蛋白表达的影响
3 讨论
恶性腹水是恶性肿瘤病情恶化或预后不良的标志,也是引起肿瘤患者死亡的常见原因之一[7-9]。目前肿瘤治疗方法主要为手术、化疗、放疗,但是这些方法具有副作用较强,治疗费用高昂等缺点[10]。目前反复穿刺仍是治疗恶性腹水的常用方法,但效果有限,且这些方法只是缓解症状,并不能解决根本问题。
研究表明,从中草药中分离出来的多糖具有多种生物功能[11]。石见穿作为中草药中的一种,各部位提取物对多种癌细胞具有一定的抗肿瘤作用[12-13]。由于多糖的毒副作用小,目前已成为研究热门领域。本实验通过观察石见穿多糖对H22荷瘤小鼠治疗效果,以及对各种细胞因子表达影响,探讨其抗肝腹水的可能机制,为临床治疗肝腹水提供一定的参考。
本研究发现CTX组小鼠的生存时间较中、高浓度PSSC组明显降低。PSSC组的腹部周长和体重较对照组显著下降,存活率和存活时间较对照组呈剂量依赖性增加。这些结果均表明PSSC在H22肿瘤模型中具有一定的抗肿瘤作用。
脾脏和胸腺是动物主要的中枢免疫器官,是T细胞发育、成熟的场所,在细胞免疫系统的建立中具有重要作用[14-15]。ConA对T淋巴细胞具有丝裂原作用,可诱导淋巴细胞体外增殖。PSSC对脾淋巴T细胞增殖影响发现,脾脏淋巴细胞增殖量(SI)随PSSC治疗剂量的增加而增加,这说明PSSC能促进脾淋巴细胞增殖,而在CTX的作用下,小鼠脾脏SI均显著降低,说明CTX抑制ConA和LPS 刺激的脾脏淋巴细胞增殖作用;E-花环实验检测发现,与对照组相比,PSSC组EtRFC呈剂量依赖性增加,这说明PSSC具有促进T细胞增殖作用,通过T细胞分泌的细胞因子(IL-2、IFN-γ等)发挥抗癌作用。
肿瘤的发生、发展与机体的免疫功能失调有密切相关[16-17]。IL-2主要是由激活的T淋巴细胞产生的一类细胞因子,其主要生理功能是促进T淋巴细胞的增殖[18];经证实,TNF-α是一多功能的细胞因子,调节包括细胞凋亡在内的许多细胞生物学进程,在抗肿瘤活动中发挥重要作用[19];在防御和免疫系统中IFN-γ具有多种生物功能,如抗病毒、抗菌、抗增殖和抗肿瘤活性[20];VEGF表达与浸润深度、淋巴结转移、病理分期、肿瘤分化程度密切相关,可激活 Jak-Stat 通路里的 Stat-3[21]。ELISA法检测结果发现,PSSC组小鼠血清和腹水中的IL-2、IFN-γ和TNF-α水平增加,VEGF水平降低,均呈剂量依赖性。说明PSSC具有强抗肿瘤免疫反应,其机制可能除了对肿瘤细胞的直接杀伤作用外,还通过促进宿主的免疫反应而间接发挥作用。
Jak/Stat 蛋白被认为是关键的细胞生长、增殖、分化和免疫调节功能。文献报道[22],STAT3经JAK磷酸化,成为其活性形式-pSTAT3(Tyr705),并形成二聚体从细胞质转移至细胞核,与Bcl-2 启动子结合,能减少 Bax 促凋亡基因的表达,而诱导 Bcl-2 抗凋亡的基因的表达[23]。TUNEL法检测发现,与对照组相比,PSSC呈剂量依赖性增加H22细胞凋亡数量,提示PSSC抗肿瘤作用可能与促H22细胞凋亡有关;Caspase-3和Caspase-8是细胞凋亡的重要介质[24],Caspase比色法发现,PSSC诱导H22细胞Caspase-3和Caspase-8活化,且随着PSSC浓度的增加而表达上升。Western blot结果显示,与对照组相比,PSSC组Jak1、Stat3和Bcl-2蛋白随着PSSC浓度的增加而表达降低,Bax/Bcl-2比值上升。推测PSSC的抗癌机制可能通过刺激T细胞和B细胞生长,促进分泌TNF-α、IFN-γ和 IL-2,减少 VEGF 表达,起到抗肿瘤作用。除此之外,还可能与通过激活 Caspase 家族和下调Jak1-Stat3表达,从而提高 Bax/Bcl-2 的比例,促进H22细胞凋亡有关。
4 结论
PSSC对体外和H22荷瘤小鼠腹水模型具有一定的抗肿瘤作用,其机制可能与免疫调节与抗凋亡作用有关。可将PSSC作为一种新的免疫调节剂,为肿瘤药物的开发提供一个新的依据和治疗靶点。
