温度对真眼点藻生长、总脂及二十碳五烯酸(EPA) 合成的影响
2022-07-22许瑾李涛李楚琳朱顺妮王忠铭向文洲
许瑾 李涛,,3 李楚琳 朱顺妮 王忠铭 向文洲,3
(1. 中国科学院广州能源研究所 广东省新能源和可再生能源研究开发与应用重点实验室 中国科学院可再生能源重点实验室,广州 510640;2. 中国科学院南海海洋研究所 中国科学院热带海洋生物资源与生态重点实验室 广东省海洋药物重点实验室,广州 510301;3. 南方海洋科学与工程广东省实验室(广州),广州 511458)
二十碳五烯酸(C20:5,EPA)是一种人体不能合成但又不可缺少的ω-3长链多不饱和脂肪酸,它具有降低胆固醇、预防心脑血管疾病的功能[1],此外,它也是许多水生甲壳类动物生长发育不可缺少的营养物质[2]。自然界中许多微藻可以合成EPA,藻细胞合成的EPA主要存在于膜脂中[3-5],EPA对藻细胞具有储存能量和碳源、清除胞内自由基和调节膜流动性等作用,对维持藻细胞生命活动具有重要意义[6]。
微藻细胞EPA的合成主要有ω-3和ω-6两种途径[6],乙酰辅酶a经脂肪酸从头合成途径生成C16:0,随后在链延长酶、Δ9和Δ12去饱和酶的作用下,生成C18:2(ω-6)。ω-3途 径 具 体 为C18:2(ω-6)→C18:3(ω-3)→C18:4(ω-3)→C20:4(ω-3)→EPA,其中涉及的酶依次为Δ15去饱和酶、Δ6去饱和酶、链延长酶和Δ5去饱和酶[6]。ω-6途径具体为C18:2(ω-6)→C18:3(ω-6)→C20:3(ω-6)→C20:4(ω-6)→EPA,涉及的酶依次为Δ6去饱和酶、链延长酶、Δ5去饱和酶和Δ17去饱和酶[6]。许多脂肪酸去饱和酶并非以脂酰CoA或脂酰ACP为底物,而是以甘油脂为底物(如磷脂酰胆碱PC、单半乳糖甘油二脂MGDG、双半乳糖甘油二脂DGDG和磷脂酰乙醇胺PE等),并且甘油酯的合成存在叶绿体与其他膜系统之间复杂且高度调控的相互作用[7],例如,EPA存在于类囊体膜的MGDG和DGDG中,而C16:0合成EPA需经链延长酶、Δ5和Δ6去饱和酶的催化,链延长酶存在胞质中,Δ5和Δ6去饱和酶存在于内质网中,因此叶绿体外合成的EPA必须穿梭回叶绿体,才能参与MGDG和DGDG合成[8],对高等植物的研究表明这一穿梭载体可能是PC或者二酰甘油[7],但对于产EPA微藻,这一过程仍然未被解析。
影响微藻EPA合成的因素主要包括光强、营养盐、温度和盐度等,研究表明低温有利于微藻多不饱和脂肪酸的合成,而高温不利于多不饱和脂肪酸的合成[8]。真眼点藻(Eustigmatos sp.)可以积累高含量的EPA受到广泛关注,目前该藻已完成了全基因组测序,有望成为EPA研究的新模式物种[9]。温度作为影响真眼点藻EPA合成的重要因素,目前鲜有报道。本研究以一株自行分离的真眼点藻JHsu-01为材料,设置高温(30℃)和低温(15℃)两种培养条件,通过测定藻细胞生长、脂类组成、脂肪酸组成和分布,研究温度对真眼点藻EPA合成规律的影响,随后利用转录组技术,探究脂肪酸和脂类合成相关酶基因转录水平的变化,研究结果为后续通过基因改造提高真眼点藻EPA产量提供理论依据。
1 材料与方法
1.1 材料
以真眼点藻(Eustigmatos sp. JHsu-01)为实验材料,该藻株分离自广东省韶关市丹霞山国家公园[10],现保藏于中国科学院广州能源研究所。
1.2 方法
1.2.1 培养方法 该藻利用BG-11培养基培养[11],培养至对数生长期的藻细胞离心后重新悬浮于新鲜BG-11培养基中,初始接种OD750为0.50 ± 0.02,培养容器为500 mL三角烧瓶,置于三温区光照培养箱中进行培养,培养时间为12 d。
设置2个处理组,分别为高温处理组(30℃)和低温处理组(15℃),每个处理组设置3个生物学重复。光强为300 μmol photons/(m2·s),连续照明,在培养周期中,每2 d测定生长参数(生物量和细胞密度)和光合效率,并收集藻泥利用FD-1-50冷冻干燥机(北京博医康实验仪器有限公司,中国)进行干燥,并保存在-20℃冰箱中备用。收集第6天藻泥,利用液氮速冻后,置于-80℃冰箱保存用于转录组测定。
1.2.2 细胞形态和细胞密度 使用BX41光学显微镜(Olympus,日本)观察藻细胞形态,并用XB-K-25血球计数板(上海求精生化试剂仪器有限公司,中国)测定细胞密度。
1.2.3 生物量 取藻液10 mL过滤到预先烘好的混合纤维滤膜(重量为m1,g)上,将带有藻细胞的滤膜置于80℃烘箱24 h,放置干燥器中冷却至室温后称重(重量为m2,g)。

1.2.4 总脂含量和脂类层析分级 80 mg藻粉加入3 mL 10%二甲亚砜-甲醇溶液,分别于50℃抽提30 min、冰浴抽提30 min后,离心收集上清液于预先烘干的玻璃小瓶中,藻渣加入乙醚/正己烷6 mL(1∶1,V∶V),冰浴抽提1 h,离心收集上清液至同一玻璃小瓶中,重复上述过程直到藻渣变白。在合并的抽提液中加入3 mL纯水,震荡分相,移取有机相,并氮气吹干至恒重,即得总脂含量[12]。
以一定体积的氯仿/甲醇(1∶1,V∶V)溶解总脂,利用500 mg Cleanert Silica硅胶柱(博纳艾杰尔科技有限公司,天津)进行总脂层析分级,首先用10 mL的氯仿洗脱得到中性脂(主要为三酰甘油),然后用10 mL丙酮洗脱得到粗糖脂,最后用10 mL甲醇洗脱得到磷脂,收集每一组份于小玻璃瓶中,在通风橱中用氮气吹至较小体积,将浓缩液转移至预先称重的1.5 mL 塑料离心管中,用氮气吹干至恒重,得到不同脂类组分的重量[13]。
1.2.5 脂肪酸组成和含量 称25 mg藻粉,加入2 mL 2% H2SO4无水甲醇∶甲苯(90∶10,V∶V),充氩气后,置于80℃的水浴加热搅拌1.5 h,加入1 mL纯水和1 mL正己烷震荡分层,将上层有机相转移到1.5 mL样品瓶中,用氮气吹干,同时加入1 mL碳十七烷酸甲酯,利用气相色谱进行测定,获得的脂肪酸峰与标准品图谱比较,分析获得其组成和含量。气相色谱测定条件为DB-5毛细管柱(30 m × 0.25 mm),以高纯氮气为载气,检测器为FID检测器,进样口温度260℃,程序升温(60℃保留2 min→30℃/min升温至120℃→1.5℃/min升温至250℃保留2 min)[13]。
1.2.6 光合效率测定 利用脉冲调制式叶绿素荧光仪PAM-100(Walz,德国)测定光系统II的实际光量子产量Y(PSII)和调节性能量耗散的量子产量Y(NPQ)。取藻液5 mL,于黑暗处适应60 min,测定时,首先打开测量光(8 μmol photons·m-2·s-1)照射30 s, 测得初始荧光F0,随后开启饱和脉冲光(4 000 μmol photons·m-2·s-1)照射0.8 s,测得最大荧光Fm,打开光化光(300 μmol photons·m-2·s-1)照射10 min,测得最小荧光强度Fs,再次打开饱和脉冲光 (4 000 μmol photons·m-2·s-1)照 射0.8 s,测 得Fm′,根据以下公式计算得到Y(II)和Y(NPQ)。
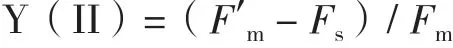
Y(II)为光系统II的实际光量子产量,F′m为光化光条件下的最大荧光强度,Fs为光化光条件下的最小荧光强度,Fm为暗适应后的最大荧光强度。

Y(NPQ)为光系统II调节性能量耗散的量子产量,F′m为光化光条件下的最大荧光强度,Fm为暗适应后的最大荧光强度。
1.2.7 转录组分析 (1)RNA提取、cDNA文库构建及测序:利用RNA提取试剂盒提取总RNA,RNA纯度和完整性分别利用NanDrop 1000 spectrophotometer(Termo Scientific,USA)和Agilent 2100 Bioanalyzer(Agilent,USA)进行检测。去除rRNA后,利用mRNA Capture Beads富集真核生物mRNA,采用高温和金属离子作用实现mRNA的片段化。以mRNA为模板,用六碱基随机引物合成单链cDNA,随后进行双链cDNA的合成反应,再用DNA Clean Beads纯化双链cDNA,纯化的双链cDNA先进行末端修复、加A尾并连接测序接头,再用DNA Clean Beads进行片段大小分选。最后进行PCR扩增,并用DNA Clean Beads纯化PCR产物,得到最终的文库。构建好的文库用Agilent 2100 Bioanalyzer进行质检。最后,利用Illumina HiSeq2000进行测序。(2)De novo组装及基因注释:对原始数据进行去除接头序列及低质量Reads的处理,获得Clean Data;用短reads组装软件Trinity组装,对组装获得的unigene进行BLAST,分别将unigene注释到NR、Nt、Swiss-Prot、GO、KEGG和COG。(3)差异基因分析:利用FPKM(Fragments Per Kilobase of transcript per Million fragments mapped)计算基因表达量。FPKM代表的是每一百万个能对比上Reads中每kb外显子的片段数。错误发现率(false discovery rate,FDR)<0.001且log2(fold change)>±1作为筛选条件评价基因的差异性。
1.2.8 统计分析 本文中所有图表所示的平均值和标准偏差均由3个生物学重复和3个测定重复计算获得,利用SPSS 18.0进行数据分析(ANOVA),样品均值之间的差异用最小显著性差异(LSD)进行分析,置信度为0.05。
2 结果
2.1 温度对真眼点藻生长的影响
真眼点藻JHsu-01在30℃和15℃培养条件下的生长情况如图1-A和1-B所示,15℃处理组获得了更高的生物量(0.57 g/L),较30℃(0.48 g/L)提高了18.8%。细胞密度的变化趋势与生物量一致,15℃比30℃提高了17.8%。图1-C和1-D是真眼点藻在30℃和15℃培养条件下的细胞形态,结果表明,温度对真眼点藻JHsu-01的细胞形态影响较大,30℃时叶绿体分界不明显,叶绿体出现片段化,细胞黄绿色,可见多个大且分散的眼点,眼点呈鲜红色,15℃处理组,叶绿体结构完整,周生裂叶状,细胞深绿色,存在1-2个眼点,眼点呈暗红色。

图1 不同温度培养下真眼点藻JHsu-01的细胞形态及生长特性Fig.1 Cell morphology and growth characteristics of Eustigmatos sp. JHsu-01 cultured at different temperatures
2.2 温度对真眼点藻光合效率的影响
Y(PSII)表示藻细胞光系统II的实际光量子产量,如图2-A所示,随着培养时间的延长,30℃条件下,藻细胞的Y(PS II)均呈现降低趋势,至培养结束,Y(PS II)降低幅度达到98.5%,说明30℃培养条件显著抑制了藻细胞光系统II的活性。15℃条件下,藻细胞的Y(PS II)相对稳定。Y(NPQ)是光系统II的调节性能量耗散的量子产量,如图2-B所示,30℃条件下,藻细胞的Y(NPQ)显著高于15℃,说明藻细胞在30℃条件下将更多能量用于热耗散。
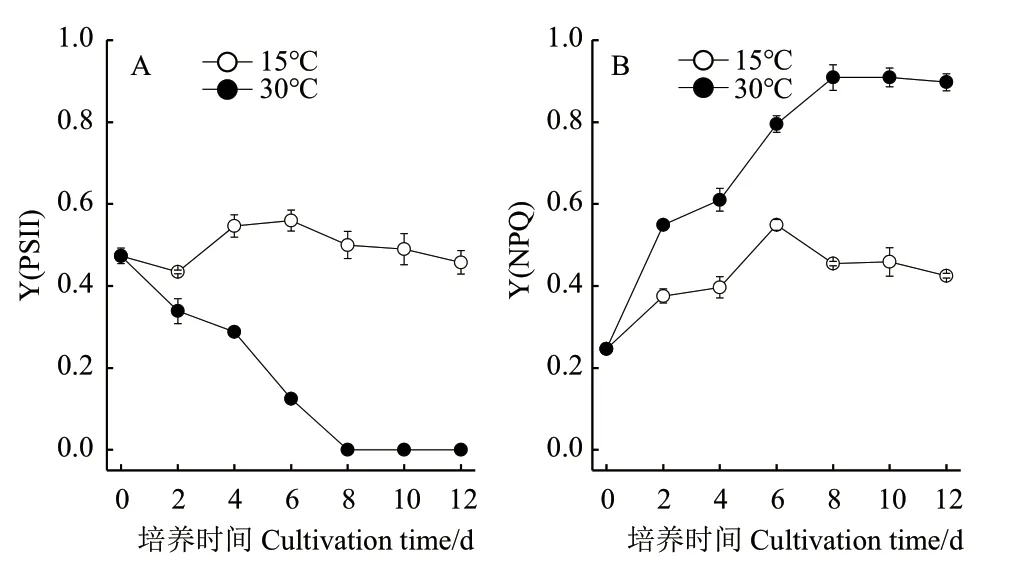
图2 温度对真眼点藻JHsu-01的PSII的实际光量子产量(A)和PSII的调节性能量耗散的量子产量(B)的影响Fig.2 Effects of temperature on the effective photochemical quantum yield of PSII(A)and quantum yield of the light-induced non-photochemical fluorescence quenching of PSII(B)of Eustigmatos sp. JHsu-01
2.3 温度对真眼点藻脂类积累的影响
温度对真眼点藻JHsu-01油脂含量的影响如图3-A所示,30℃组从第2天开始总脂含量呈降低趋势,而15℃组总脂含量逐渐增加,培养结束时,15℃组的总脂含量为20.3% DW,30℃处理组的总脂含量为16.0% DW。30℃培养条件下,中性脂比例逐渐增加,从初始的40.7% TL(total lipid)增加至62.3% TL,膜脂(糖脂+磷脂)的比例由59.3% TL降低至37.8% TL(图3-B);15℃培养条件下,中性脂由40.7% TL增加至46.8% TL,膜脂(糖脂+磷脂)的比例由59.3% TL降低至53.3% TL(图3-B),上述结果表明,30℃加速了中性脂的积累,但不利于膜脂的积累,而15℃有利于膜脂的积累,而不利于中性脂的积累。

图3 温度对真眼点藻JHsu-01总脂含量(A)和脂类分级(B)的影响Fig.3 Effects of temperature on the total lipid content(A)and lipid classification(B)of Eustigmatos sp. JHsu-01
2.4 温度对真眼点藻脂肪酸组成的影响
真眼点藻JHsu-01脂肪酸组成的时相变化如图4所示,C16:0、C16:1、C18:1和C20:5是该藻的主要脂肪酸,30℃培养显著提高了C16:1的比例,由培养初始的37.6% TFA(total fatty acid)增加至50.4% TFA,15℃培养时,C16:1的比例变化较小(在35.7%-37.6% TFA范围变化)。30℃条件下,EPA由培养初始的23.8% TFA逐渐降至14.1% TFA,而15℃条件下,EPA的含量稳定在27.7%-28.7% TFA,上述结果表明,15℃有利于EPA的合成,而30℃不利于EPA的合成。

图4 30℃(A)和15℃(B)培养温度对真眼点藻JHsu-01脂肪酸组成的影响Fig.4 Effects of 30℃(A)and 15℃(B)on the fatty acid composition of Eustigmatos sp. JHsu-01
2.5 温度对真眼点藻EPA分布的影响
由图5-A和5-B可知,30℃培养显著降低了真眼点藻的EPA含量,藻细胞EPA含量由2.30% DW(0 d)降低至1.37% DW(12 d),降低幅度达到40.6%(P<0.01),而15℃条件下,藻细胞中EPA含量由2.30% DW(0 d)增加至2.78% DW(12 d),增加幅度达到20.86%(P<0.05),说明15℃比30℃更有利于EPA的合成。进一步测定了不同脂组分的EPA含量(图5-A和5-B),30℃培养条件下,中性脂的EPA含量变化较小,糖脂和磷脂的EPA含量明显降低,至培养结束,糖脂和磷脂的EPA含量分别降低65.44%和69.95%(P<0.05),上述结果表明,膜脂中EPA含量的降低是导致EPA总量减低的原因。
为了分析藻细胞合成EPA后的去向问题,本研究分析了总EPA在中性脂、糖脂和磷脂的比例,由图5-C和5-D可知,温度可以影响藻细胞EPA在不同脂组分间的分布,15℃培养条件下,总EPA在中性脂、糖脂和磷脂中的比例分别为22.0%、62.0%和16.0%(第12天),而30℃培养条件下,总EPA在中性脂、糖脂和磷脂中的比例分别为40.9%、51.4%和8.3%(第12天),30℃培养条件下,EPA在中性脂的比例较15℃增加了85.9%(P<0.05),而在糖脂的比例较15℃降低了17.1%(P<0.05),上述结果表明,15℃条件下,微藻更多的EPA分布在糖脂和磷脂中,而30℃条件下,微藻将更多的EPA分布在中性脂中。
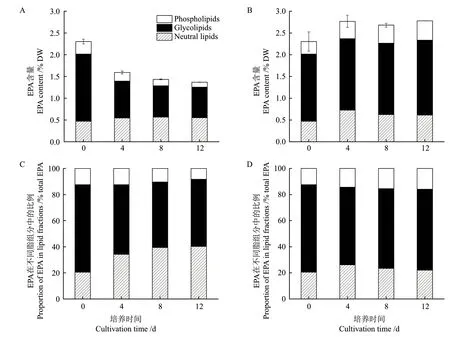
图5 EPA在中性脂、糖脂和磷脂中的分布Fig.5 Distribution of EPA in neutral lipids,glycolipids and phospholipids
2.6 温度对真眼点藻脂肪酸代谢相关通路的影响
测序及注释:高通量测序获得Raw Reads经过低质量数据过滤后,得到高质量Clean Reads分别为55.1 M(30℃)和49.8 M(15℃),GC含量均超过55%,Q20均大于98%,N碱基比例低于0.01%,表明转录组测序质量较高,可用于进一步的生物信息学分析;将Clean Reads数据de novo组装获得参考序列,获得unigene数目为106 864个,将unigene与数据库进行比对,共有67 363个成功得到了注释,注释率为63.0%。同源物种分布结果显示物种相似度最高的5个物种分别为水云(22.4%)、伽得拟微绿球藻(13.1%)、玉米(6.1%)、大豆疫霉菌(6.0%)和抑食金球藻(5.2%)(图6-A);E-value分布结果显示31.8%的mapped sequences展示出较强的可信度(小于10-45),仍然有68.2%的mapped sequences展示出在10-5-10-45的可信度(图6-B);序列覆盖度结果显示相似度大于80%的mapped sequences只有2.7%,其余mapped sequences展示出17-80%的相似度(图6-C)。

图6 注释基因的统计分析Fig.6 Statistical analysis of annotated genes
脂肪酸合成:乙酰辅酶a经乙酰CoA羧化酶(ACCase)催化生成丙二酸单酰-ACP,随后经过缩合、还原、脱水和还原4步反应进行链延长,每循环一次增加2个碳,4步反应分别在3-酮酰基-ACP合成酶(fabF)、3-酮酰基-ACP还原酶(fabZ)、3-酮酰基-ACP脱水酶(fabG)和烯酯酰ACP还原酶I(fabI)进行,最终合成C16:0和C18:0。结果显示accA、fabF、fabG、fabZ、fabI四个基因在15℃条件下均显著上调,说明15℃条件下较30℃条件更有利于脂肪酸的合成(图7和表1)。
脂肪酸去饱和:EPA合成中的3个关键去饱和酶(Δ5、Δ6和Δ15脂肪酸去饱和酶),在15℃条件下,均显著上调(图7和表1),说明15℃条件下较30℃条件更有利于EPA的合成,未注释到Δ17脂肪酸去饱和酶,因此无法确定ω-6合成途径是否存在。
硫脂和糖脂合成:SQDG合成中的两个关键酶硫代异鼠基转移酶(SQD2)和UDP-硫代异鼠糖合酶(SQD1)在15℃条件下均显著上调;MGDG和DGDG合成中的两个关键酶二酰基甘油3-β-半乳糖基转移酶(MGD)和二半乳糖二酰基甘油合酶(DGD)在15℃条件下均显著上调(图7和表1),说明15℃条件下较30℃条件更有利于硫脂和糖脂的合成。
磷脂合成:PC、PE和磷脂酰丝氨酸(PS)合成中的3个关键酶CPT1、EPT1和PTDSS2下调,磷脂酰甘油(PG)的关键酶pgsA和GEP4无显著性变化,磷脂酰肌醇(PI)合成中的关键酶CDIPT上调(图7和表1)。
三酰甘油合成:磷酸二羟丙酮分别经3-磷酸甘油酰基转移酶(GPDH)、甘油磷酸脱氢酶(GPAT)、1-酰基甘油-3-磷酸酰基转移酶(plsC)、磷脂酸磷酸酶(PLPP)、二酰基甘油酰基转移酶(DGAT)合成三酰甘油,其中,GPAT、plsC、PLPP和DGAT在15℃条件下均上调(图7和表1),说明15℃条件下较30℃条件更有利于甘油酯的合成。
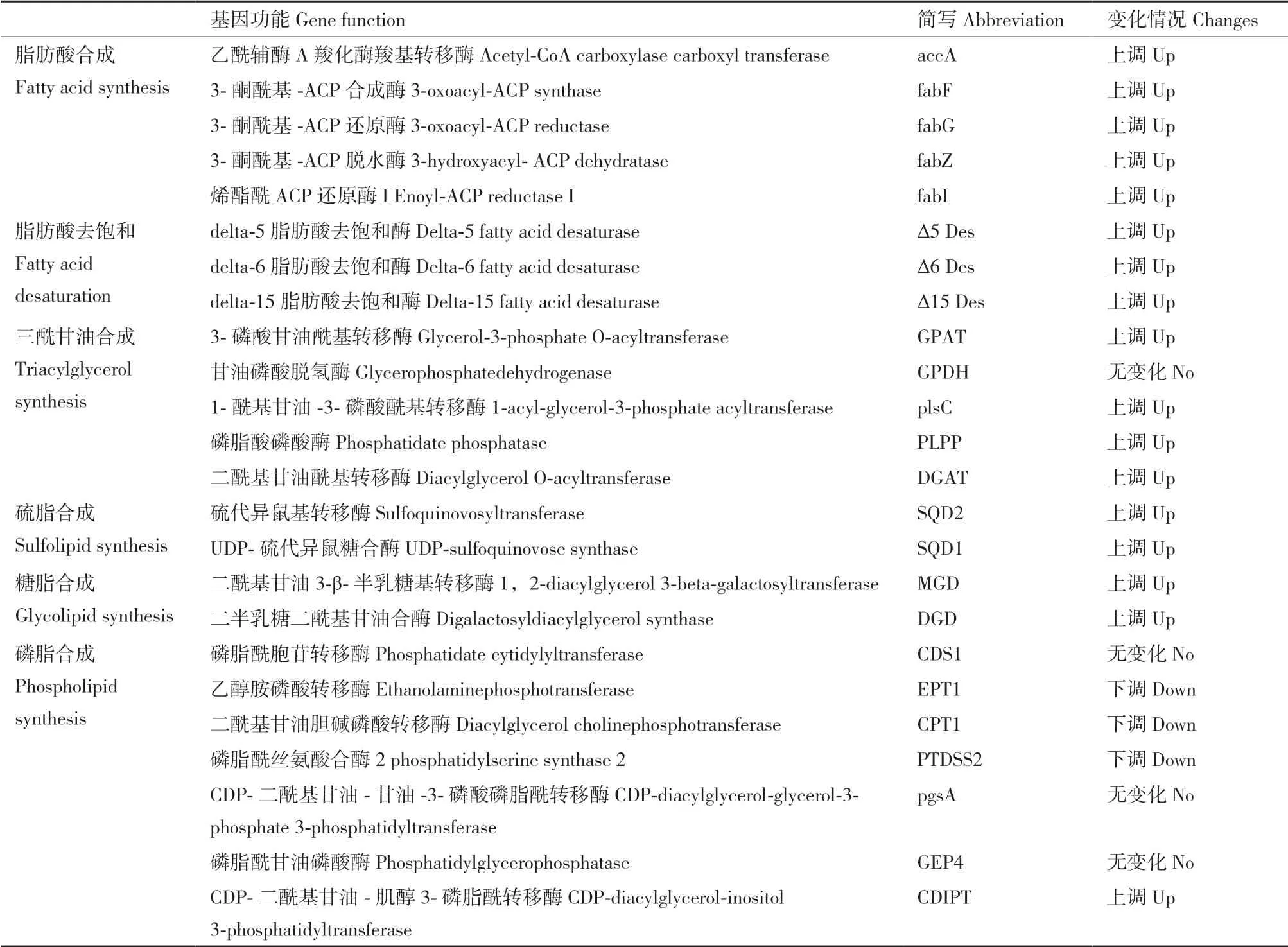
表1 脂肪酸合成相关酶基因的变化情况Table 1 Expression changes of genes in lipid and fatty acid biosynthesis pathways

图7 温度对真眼点藻JHsu-01脂肪酸代谢通路的变化Fig.7 Changes of temperature on the fatty acid metabolic pathways of Eustigmatos sp. JHsu-01
3 讨论
3.1 温度影响真眼点藻的生长和脂类积累
温度是影响微藻生长的重要环境因素之一,针对一些具有生物饵料潜力的微藻,研究温度的影响尤为重要。本研究表明,真眼点藻JHsu-01在15℃条件下的细胞密度、生物量和光合效率均高于30℃培养条件,由于该藻株采集自广东地区,生境温度可达30℃以上,但实际上降低培养温度更有利于其生长。大部分微藻在15-30℃均可以生长,但适宜生长的温度却各有不同,三角褐指藻(Phaeodactylum tricornutum CCMM2012)、微拟球藻(Nannochloropsis sp. CCMM6004)和 栅 藻(Scenedesmus quadricauda CCMM4002)的适宜生长温度均为25℃[14],瑞典四爿藻(Tetraselmis suecica FIKU032)可以在40℃条件下生长[15]。真眼点藻纲共有1目6科13属28种,它们在淡水、海水和土壤表面等环境中都有分布[16],大部分已报道的真眼点藻研究中,培养温度通常为25℃[17],具体到真眼点藻纲的某一种类,适宜生长的温度可能存在较大差异,适宜眼点拟微球藻(Nannochloropsis oculata)生长的温度为21℃[18],大洋拟微球藻(Nannochloropsis oceanica)在18-28℃条件下都可以正常生长[19]。本研究重点探究低温和高温对真眼点藻JHsu-01多不饱和脂肪酸代谢的影响,对于适宜其生长的具体温度,则需要更为细化的温度梯度实验进行验证。
温度可以影响微藻的脂类合成[20]。真眼点藻JHsu-01在15℃培养条件下获得了更高的总脂含量,分析脂类组成发现,15℃条件下总脂含量提高的原因是由于膜脂比例增加引起,膜脂提高通常是微藻增强环境适应性的一种策略。不同种类微藻对温度的响应存在差异,改变小球藻(Chlorella sp. MACC-728)的培养温度,其油脂含量并没有显著变化[21],四尾栅藻(Scenedesmus quadricauda)在30℃时,脂类积累效率最高[22],由于脂类合成涉及的酶种类多,因此温度影响脂类合成的潜在调控位点可能存在多个,目前对于这一调控机制仍不清楚。
3.2 温度影响真眼点藻JHsu-01脂肪酸的组成和EPA的分布
温度可以影响微藻的脂肪酸组成[20]。研究表明,微藻脂肪酸的不饱和度随温度降低而增加,而饱和脂肪酸比例随温度升高而增加[20,23]。本研究也发现了类似规律,真眼点藻JHsu-01在30℃时的EPA含量为1.37% DW,而15℃时EPA含量达到2.78% DW,提高幅度达到102.9%,说明15℃比30℃更有利于EPA的合成。利用10、15、20、25和30℃培养三角褐指藻(P. tricornutum MP-2),结果表明15℃处理组的EPA含量最高[24];当培养温度由10℃提高到25℃时,菱形藻(Nitzschia paleacea)的EPA相对含量由28.4% TFA降低至18.1% TFA,韦氏海链藻(Thalassiosira weissflogii)的培养温度由16℃提高到20℃,其EPA含量明显降低[25]。低温有利于EPA合成的原因可能与藻细胞调节膜的流动性有关,膜脂中不饱和脂肪酸增加,可以保证膜在低温条件仍具有较好的流动性,从而执行正常的生理功能[26]。
温度可以改变真眼点藻EPA在中性脂、糖脂和磷脂中的分布,低温使更多的EPA分配在糖脂中,糖脂是类囊体膜的主要成分,分布在糖脂中的EPA增加,预示着类囊体膜的流动性增加,类囊体膜上的色素蛋白复合物可以更好的横向运动,提高光能吸收和传递效率。30℃培养使藻细胞合成的EPA更多的分布在中性脂中,结合“EPA总量减少”、“膜脂比例降低而中性脂比例增加”这一结果,我们推测30℃条件下,中性脂的EPA可能有一部分来源于磷脂,藻细胞中存在磷脂转化为三酰甘油的途径,这步反应在磷脂酰胆碱-二酰基甘油酰基转移酶(PDAT)催化作用下进行,衣藻的PDAT拥有酰基转移酶及脂肪酶两种活性,在膜脂分解的过程中,伴随TAG的产生,使藻细胞在各种胁迫条件下更好地生存[27]。
3.3 温度对脂类相关代谢通路的影响
转录组测序可以全面快速地获得藻细胞在某一状态下几乎所有转录本的序列信息,是一种探究微藻代谢规律的理想技术。真眼点藻JHsu-01在15℃培养条件下合成脂肪酸的能力增强,并且合成EPA的3个关键酶基因(Δ15、Δ5和Δ6去饱和酶)上调,这结果可以解释15℃比30℃更有利于EPA的合成。球等鞭金藻(Isochrysis galbana)IgFAD5基因仅在低温15℃处理6-12 h期间表达水平较高[28],球等鞭金藻3011的Δ4、Δ5、Δ6、Δ8、Δ9和Δ12在18℃的相对表达量最高[29],上述结果与本研究结果相似,均表明低温可以诱导一些脂肪酸去饱和酶的表达。
微藻细胞中存在原核和真核两种膜脂合成途径,原核途径发生在质体内,而真核途径发生在内质网,原核途径合成的膜脂主要有磷脂酰甘油PG、MGDG、DGDG和SQDG,而真核途径合成的脂类主要有PE、PS、PC和PI等[7]。15℃培养条件下,合成糖脂(MGD和DGD)和硫脂(SQD1和SQD2)关键酶基因的表达上调,说明低温条件下,叶绿体膜脂合成旺盛,藻细胞可能具有更强的光需求。三酰甘油合成中的几个关键酶基因(GPAT、plsC、PLPP和DGAT)在15℃条件下的表达均上调,说明TAG合成加强,但15℃条件下的中性脂比例比30℃有所降低,推测上述结果可能与糖脂与中性脂的合成速率有关,15℃条件下糖脂合成增强,当糖脂合成速率快于TAG合成速率时,就会出现中性脂比例降低的现象,后续可以通过荧光定量PCR对糖脂和TAG合成通路的关键酶基因更加更准确的量化分析。
真眼点藻JHsu-01的EPA主要分布在糖脂中,根据转录组数据并不能得出EPA分布在糖脂中原因。大量研究表明,许多微藻合成的EPA同样分布在糖脂中,如紫球藻[5]、三角褐指藻[4]、微拟球藻[4]等,三角褐指藻84%的EPA存在于糖脂中,而仅有11%的EPA存在于TAG中[4],紫球藻可以积累占总脂肪酸约47%的EPA,但分布在TAG中的EPA仅有2%[5],这一分配机制可能与某些酶对特定脂肪酸选择性有关,大洋微拟球藻(Nannochloropsis oceanica)中存在的2种类型的DGAT(NoDGAT2J和NoDGAT2K),它们对某一种多不饱和脂肪酸具有偏好性,因此可以调节EPA在TAG中的比例[30]。真眼点藻JHsu-01的EPA倾向于分配在糖脂中,推测可能与MGD和DGD对脂肪酸选择的特异性有关系,对这一机制更深入的分析,需要借助脂组学技术,尽可能多的鉴定脂类分子,并通过生物信息学分析,获得它们之间的关联性,进而阐释EPA分布的内在调控机制。
4 结论
15℃较30℃更有利于真眼点藻JHsu-01的生长、膜脂和EPA的合成,EPA含量最高达到2.78% DW。温度可以改变EPA在糖脂和中性脂之间的分布比例,15℃条件下,微藻更多的EPA分布在糖脂和磷脂中,而30℃条件下,微藻将更多的EPA分布在中性脂中。低温条件下,脂肪酸从头合成、三酰甘油、糖脂、硫脂和ω-3合成途径加强。综上所述,低温是促进微藻EPA合成的重要条件,同时也是一种获得高含量糖脂型EPA的理想培养方式。
