端梗霉Z45产漆酶培养基的优化及其对染料的脱色
2022-07-22贾晨波苏一黄马秀梅王春利徐春燕
贾晨波 苏一黄 马秀梅 王春利 徐春燕
(宁夏大学生命科学学院 西部特色生物资源保护与利用教育部重点实验室,银川 750021)
生物法是目前处理染料废水的主要方法之一,它主要依赖特殊微生物的作用改变染料分子的结构使废水脱色,运行成本低且绿色环保[1],具有较大的应用空间,已成为印染废水处理的研究热点。采用真菌处理染料废水已经得到了广泛研究,所使用的菌株既有担子菌也有子囊菌[2-3],漆酶在真菌降解染料的过程中发挥着重要作用。漆酶是含有铜离子的多酚氧化酶,能够催化多种酚类物质和非酚类物质的氧化,同时将分子氧还原为水。漆酶的底物范围广,反应效率高且稳定性好[4-5],反应过程不需要辅酶因子和H2O2参与,因此在多个领域中都有应用,例如污水处理[6]、制浆造纸[7]、染料脱色[8]等。担子菌产生的漆酶在木质纤维素脱木质化中具有良好的潜力和特性,相关研究很多;相比之下,对子囊菌漆酶的了解较少[9],目前的报道仅仅提到了少数的几种产漆酶子囊菌,例如Nectriella pironii[10]和Cladosporium cladosporioides[11]。与担子菌相比,子囊菌大多生长更快且能够产生大量子囊孢子,产漆酶的子囊菌能够在培养的早期阶段产生漆酶[12-13],因此在应用上拥有独特的优势,但相关研究还较为欠缺。
本实验室前期分离到一株端梗霉属子囊菌Z45(Acrophialophora sp.)[14],它能够产生漆酶,推测其也具有降解染料的能力。端梗霉属于耐热土壤真菌,大部分都耐高温且具有分解木质纤维素的能力,能够产生大量的对热稳定的纤维素酶和木聚糖酶,对木质素和植物残体中的碳循环起着重要作用。菌株Z45耐热、喜酸,培养周期短,对营养物质的要求低,优良的生长特性使其在农业、环保等方面的应用前景值得关注。本文利用漆酶氧化愈创木酚产生棕红色物质这一原理,依据棕红色氧化圈的大小研究影响端梗霉Z45产漆酶的关键因素,进一步通过正交试验设计对其产酶的基础培养基进行优化,并测定其在优化后的产酶培养基中的漆酶活力,最后研究了菌株Z45及其粗酶液对合成染料的脱色能力。本研究将对耐热真菌端梗霉Z45的产酶能力和应用潜力提供参考数据,为针对该菌株进一步展开深入研究打下基础。
1 材料与方法
1.1 材料
1.1.1 供试菌种 菌株Z45为一株产漆酶的子囊菌端梗霉,其ITS序列的GenBank登录号为MN784715,该菌株由本实验室分离鉴定并保存。
1.1.2 培养基 PDA培养基;PDB培养基;G-PDA培养基:在PDA中加入愈创木酚(0.1%)即为G-PDA培养基。
液体产酶基础培养基:葡萄糖20 g,硫酸镁0.5 g,磷酸二氢钾 0.5 g,氯化钙0.5 g,蛋白胨2 g,维生素B110 mg,愈创木酚1 mL(0.1%),蒸馏水1 000 mL。
固体产酶基础培养基:在液体产酶基础培养基的基础上加18 g琼脂。
PDA染料培养基:分别向PDA培养基加入0.1%的中性红、刚果红、苏丹红、孔雀绿、结晶紫、甲基蓝、亚甲基蓝、溴酚蓝染料。
甲基蓝培养基:在正交试验优化后的最优培养基中加入适量甲基蓝,即蔗糖20 g,硫酸镁0.5 g,磷酸二氢钾0.5 g,氯化钙0.5 g,硝酸钠0.5 g,琼脂18 g,蒸馏水1 000 mL,甲基蓝按所需浓度添加,调节pH值至5.0。
1.2 方法
1.2.1 产漆酶能力验证 在G-PDA培养基中接种直径6.0 mm的新鲜菌饼一块,于40℃恒温培养24 h后进行倒置培养,每天观察并测量菌落与变色圈直径,每个实验设置3个生物学重复。
1.2.2 菌株Z45的产漆酶培养基优化 分别用不同碳源替代基础产酶培养基中的葡萄糖,接种直径6.0 mm的菌饼于不同碳源的基础产酶培养基上,测定菌株Z45的产漆酶情况,供试碳源分别为葡萄糖、蔗糖、麦芽糖、乳糖、淀粉、羧甲基纤维素钠。用不同氮源替代基础产酶培养基中的蛋白胨,接种直径6.0 mm的菌饼于不同氮源的基础产酶培养基上,测定菌株Z45的产漆酶情况,供试氮源分别为蛋白胨、酵母粉、硝酸铵、硝酸钠、硫酸铵、尿素。以淀粉和硝酸钠分别配制碳氮比为10∶1、20∶1、30∶1、40∶1、50∶1和60∶1的基础产酶培养基,接种直径6.0 mm的菌饼于不同碳氮比的基础产酶培养基,探究不同碳氮比对菌株Z45氧化愈创木酚的影响。以淀粉和硝酸钠为碳氮源,按40∶1的碳氮比,其他成分与基础产酶培养基相同,配制培养基并调节pH分别为4.0、5.0、6.0、7.0、8.0、9.0和10.0,接种直径6.0 mm的菌饼,测定菌株Z45的产漆酶 情况。
在单因素试验基础上,选择产漆酶效果较好的碳源、氮源、碳氮比、pH值,设计四因素三水平L9(43)的正交试验,测定不同条件下菌株Z45的变色圈直径,用SPSS17.0进行分析,优化产漆酶培养基。
1.2.3 菌株Z45的漆酶活力测定 将菌株Z45分别在PDB培养基和优化后的液体产酶基础培养基中于40℃培养,每3 d取样按照文献方法[15]测定漆酶 活性。
1.2.4 染料脱色实验 在PDA染料培养基上接种菌株Z45(直径6.0 mm),于40℃培养并观察不同染料的脱色情况。调整PDA甲基蓝培养基的甲基蓝浓度为0.05 g/L,0.08 g/L,0.1 g/L,0.15 g/L,0.2 g/L,0.25 g/L和0.3 g/L,按上述方法接种、培养,观察菌株生长及脱色情况。在优化后的产漆酶培养基中加入甲基蓝使其浓度为0.1 g/L,0.15 g/L,0.2 g/L,0.25 g/L和0.3 g/L,同上述方法接种、培养,观察菌株生长及对不同浓度甲基蓝的脱色情况。
离心收集优化后的产漆酶培养基中菌株Z45的粗酶液,测定其漆酶活力,将粗酶液按1∶1的比例分别与0.2 g/L和0.5 g/L的甲基蓝溶液混合,于40℃水浴锅中温浴,在不同的时间取样,于588 nm处测定其OD值并计算粗酶液在不同时间对不同浓度甲基蓝溶液的脱色情况。改变酶液与甲基蓝染料的比例用于探究漆酶与染料脱色的相关性。
2 结果
2.1 菌株Z45的产漆酶能力
与PDA上的生长情况相比,菌株Z45在G-PDA上的菌丝较细且比PDA培养基上生长缓慢(图1),这可能是愈创木酚的毒性所致,但菌株Z45使愈创木酚氧化极为明显,变色圈为深褐色,且变色圈远大于菌丝覆盖范围,提示该菌株具有较好的产漆酶能力。随着培养时间延长,变色圈逐渐增大,圈径比先增大再减小,培养至第2天时,圈径比最大,为1.98,培养2 d后,菌株Z45对培养基中的愈创木酚持续氧化,但圈径比开始减小。圈径比和变色圈直径都是评价不同菌株产漆酶能力的重要指标,鉴于本研究中所关注的菌种只有端梗霉Z45一种,再结合菌株Z45培养6 d内圈径比与变色圈的变化规律,后续研究仅采用变色圈直径进行表征。

图1 G-PDA与PDA平板上菌株Z45不同培养时期的基本情况Fig. 1 Basic performance of strain Z45 on the G-PDA and PDA medium
2.2 不同因素对菌株Z45产漆酶的影响
在各单因素试验中,不同培养基上的菌落生长形状与变色圈都较为规则,基本呈圆环形,菌丝生长颜色均为白色至灰白色,所有培养基上均出现了氧化变色圈,变色圈呈现暗红色且其直径大于菌落直径。图2-A为菌株Z45在不同碳源培养基下的氧化变色圈直径,可以看到在以淀粉为碳源时,菌株产漆酶效果最好,其次是蔗糖和乳糖,在以葡萄糖、麦芽糖和羧甲基纤维素钠为碳源时也能产漆酶,但是效果较差。在氮源的比较试验中(图2-B),以硫酸铵、蛋白胨、酵母粉、尿素、硝酸钠和硝酸铵为氮源时,菌株Z45均能产生漆酶,其中以尿素为氮源时产漆酶效果最差,以硝酸钠和硝酸铵为氮源时菌株Z45产漆酶效果均较好,二者没有显著性差异;但在硝酸铵的培养基上有较多孢子产生的新菌落,各菌落容易连成一片,不易观测分析,因此选择硝酸钠为氮源做后续分析。在不同碳氮比的单因素试验中(图2-C),菌株Z45的氧化变色圈在40∶1时最大,在40∶1和50∶1时无显著性差异。图2-D为不同pH的单因素试验,当pH为5.0时变色圈最大,其次是pH为4.0时,pH值大于8.0时菌株生长缓慢,菌丝较弱且没有出现典型的超出接种块范围的变色现象。
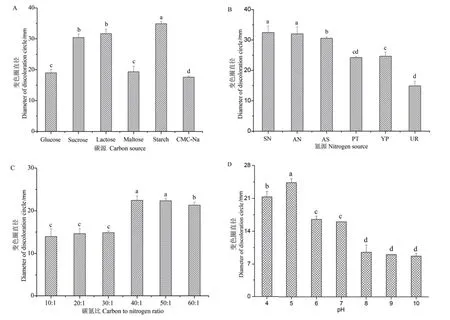
图2 不同条件下的变色圈直径Fig.2 Diameter of discoloration circle under different condition
2.3 正交实验优化结果
正交实验和方差分析(表1、表2)显示,碳源、氮源和C/N比对漆酶的影响极显著,极差RB>RA>RC>RD,说明各单因素对菌株Z45产漆酶的影响程度依次为氮源>碳源>碳氮比>pH。菌株Z45产漆酶的最优培养基组合为A3B1C3D2,即以蔗糖为碳源、硝酸钠为氮源、碳氮比为45∶1、 pH为5。
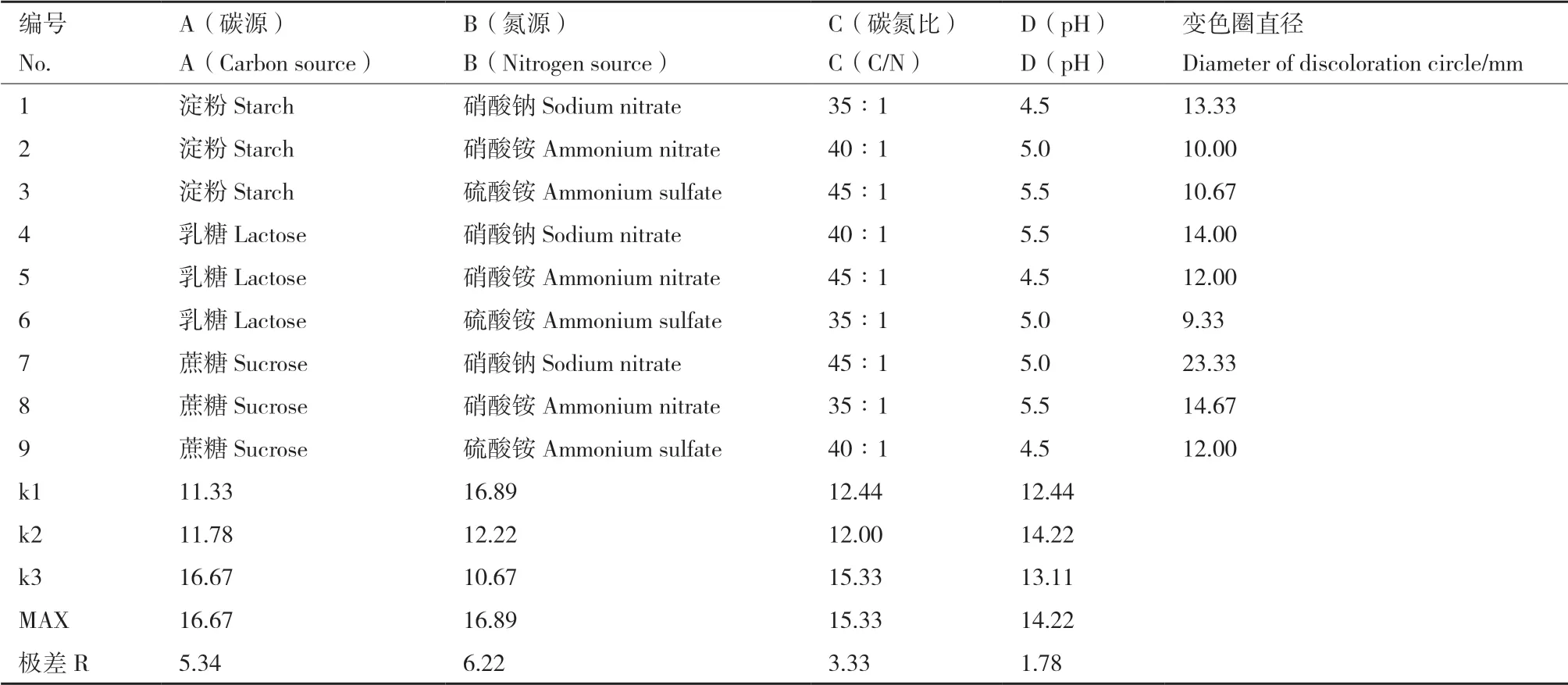
表1 正交试验的结果与直观分析Table 1 Results of orthogonal test and the visual analysis

表2 正交试验的方差分析Table 2 ANOVA of the orthogonal test
2.4 漆酶活性及漆酶与染料脱色的相关性
菌株Z45在PDB培养基和优化后的产漆酶培养基中培养不同时间的漆酶活性(图3)显示,优化后的产漆酶培养基中的漆酶活性显著大于PDB中的活性。在培养的前5 d,两种培养基中均难以检出漆酶活性;第6天开始,两种培养基中均能够检测到漆酶活性;两种培养基中的漆酶活性均在第9天达到最高,而后逐渐降低,其中优化后的产漆酶培养基中漆酶活性最高可达7.6 U/mL。
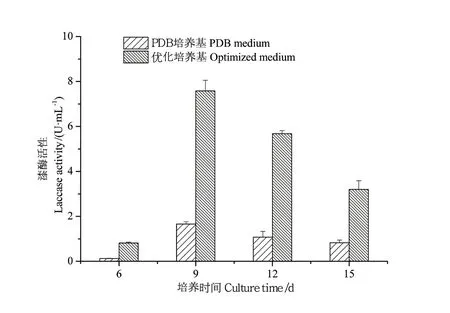
图3 不同培养基中的漆酶活性Fig. 3 Laccase activities in different media
为明确漆酶与染料脱色的相关性,改变染料脱色体系中加入漆酶的比例,并测定了反应1 h的脱色率,即脱色速率。结果(图4)表明,随着脱色体系中粗漆酶液加入比例的增加,反应1 h时,甲基蓝染料的脱色率逐渐升高,提示在一定范围内甲基蓝染料的脱色率与脱色体系中粗漆酶液的用量呈正相关,推测漆酶在甲基蓝染料的脱色中发挥了关键作用。

图4 不同粗酶液加入量下甲基蓝的脱色速率Fig.4 Decolorization rate of methyl blue with different amount of crude laccase
2.5 染料脱色能力
2.5.1 菌株Z45对不同染料的脱色比较 将菌株Z45在PDA染料培养基上培养2.5 d后观察发现,在所有染料培养基上,菌株Z45均能够较好地生长,但无脱色现象发生;培养5 d后,孔雀石绿、刚果红和苏丹Ⅲ依然无脱色现象,而溴酚蓝、中性红、甲基蓝、亚甲基蓝和结晶紫脱色明显。其中,菌株Z45对甲基蓝染料的脱色效果最好,平板上蓝色基本完全脱除;对照为不接菌株Z45的PDA染料培养基,可以看到平板依然呈现蓝色(图5)。

图5 菌株Z45对甲基蓝染料的脱色Fig.5 Decolorization of methyl blue by strain Z45
2.5.2 菌株Z45对甲基蓝染料的脱色 菌株Z45在不同甲基蓝浓度的PDA培养基上培养3 d时,除甲基蓝浓度为0.3 g/L的培养基外,其它较低甲基蓝浓度的培养基均开始脱色。培养7 d时,不同浓度甲基蓝染料培养基上染料脱色较为明显(图6),此时,浓度在0.1 g/L以下时甲基蓝完全无色,甲基蓝浓度在0.1 g/L以上时,甲基蓝完全脱色的时间随染料浓度升高逐渐延长。

图6 PDA培养基上不同浓度甲基蓝染料的脱色情况Fig.6 Decolorization of methyl blue under different concentrations on PDA medium
在优化后的产漆酶培养基上添加不同浓度的甲基蓝染料,菌株都能正常生长,且在接菌后的第1天就开始脱色。甲基蓝浓度为0.1 g/L和0.15 g/L的培养基在第7天时完全脱色,其余浓度的培养基接近完全脱色(图7),在第8天时其余浓度的培养基也全部脱色。这与在PDA甲基蓝培养基上的脱色情况基本一致,仅0.15 g/L甲基蓝浓度下优化后的产漆酶培养基上的脱色比PDA培养上的更彻底、更快一些。但两种培养基上的菌丝颜色有较大差别,PDA甲基蓝培养基上的菌丝为纯白色,而优化后的产漆酶培养基上的菌丝为灰白色或黑色。

图7 优化后的产漆酶培养基中不同浓度甲基蓝的脱色情况Fig. 7 Decolorization of methyl blue under different concentrations on the optimized medium for laccase production
菌株Z45的粗酶液在24 h内对两种浓度甲基蓝染液的脱色结果(图8)表明,粗漆酶与甲基蓝的反应迅速,在前1 h内粗漆酶对甲基蓝的脱色速度最快;而后随着反应时间的延长,反应速度减慢,进入缓慢脱色期。此时,漆酶与两种浓度甲基蓝染液的反应呈现不同现象,在0.2 g/L的甲基蓝溶液中,反应迅速进入平台期;而在0.5 g/L的甲基蓝溶液中,反应经过较长一段时间的中速反应期后逐渐进入平台期。24 h后,粗漆酶对0.2 g/L和0.5 g/L甲基蓝溶液的脱色率分别达到34.5%和42.3%。
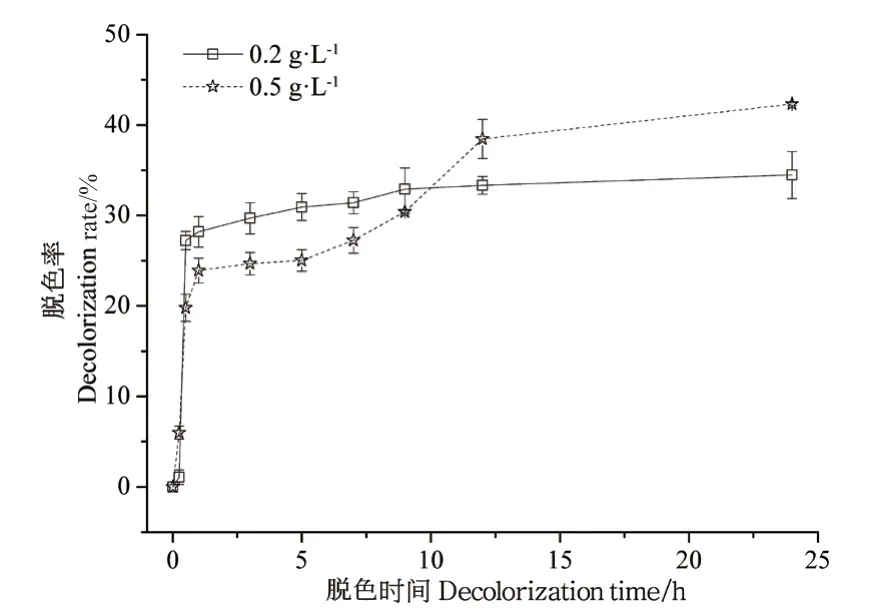
图8 粗酶液对不同浓度甲基蓝溶液的脱色情况Fig. 8 Decolorization of methyl blue under different concentrations by crude enzyme solution
3 讨论
漆酶广泛地存在于微生物中,许多真菌和细菌都具有产漆酶的能力,目前对于白腐真菌(主要是担子菌类)产漆酶的研究较多,一些子囊菌也能够产漆酶,如曲霉[16],但相关报道较少。子囊菌和担子菌是真菌的主要类群,占真菌总量的98%。子囊菌的种类繁多,无论是已知种类还是未知种类都比担子菌表现出了更大的多样性及更快的进化速率[17],巨大的数量蕴涵了更强的适应性和更多的功能。许多子囊菌生长迅速,菌丝体发达且能产生大量无性孢子,在开放的自然环境中能够迅速占领生态位,因此,产漆酶的子囊菌比产漆酶的担子菌在应用上更具优势。本实验室前期从干旱区土壤中获得了一株产漆酶的子囊菌端梗霉Z45[14],其耐高温且生长迅速,这些特点可能赋予它在应用上具有一定的独特性。
优化产漆酶的培养基与培养条件以提高菌株的产漆酶能力一直是漆酶研究的重要方向之一,本文首先通过愈创木酚氧化实验研究了其产漆酶的规律,基于正交实验优化了产漆酶的培养基并测定了其在优化后的产漆酶培养基中的漆酶活性。对比适合生长的基础培养基和优化后的产漆酶培养基中的C/N比发现,在最适生长培养基中,C/N比为10∶1[14],而最优产酶基础培养基的C/N比则为45∶1,说明菌株Z45产漆酶受低氮诱导。最后,分析了菌株Z45对不同染料的脱色能力及优化后的产漆酶培养基对三苯甲烷类染料甲基蓝脱色的促进作用,并测试了粗酶液对甲基蓝染料的脱色能力。甲基蓝染料是目前常用的三大类染料之一,该染料废水常见于制革业、纺织业、造纸业等,具有致癌、致畸、致突变等较大危害[18]。该类染料具有特殊的化学结构,在自然界中很难被降解。染料废水排放到地表水中时,会造成水污染以及严重的环境问题。优化后的产漆酶培养基中漆酶活性显著增加,且对甲基蓝脱色也有一定的促进作用,结合菌株Z45产纤维素酶(液体培养基中培养6 d纤维素酶活性可达19.84 U/mL)及耐高温、易培养的特性,后续研究可采用生物质/染料的共降解体系在该菌株降解染料及木质纤维素方面进行探索。此外,菌株Z45具有在较低pH值下对多种结构的染料进行脱色的能力,这是处理酸性工业染色废水的优势。
漆酶基因上游往往有多种顺式作用元件,使得其表达可以受到多种因素的调控,通过改变营养条件提高漆酶产量是真菌产漆酶条件优化中的有效方法,在相关研究中常常用到[19]。添加硫酸铜、硫酸亚铁等合适的诱导剂也能够提高漆酶活性[20-21],不同调控因子之间还可能具有协同诱导作用。例如,在培养基中同时添加酵母粉和硫酸铜,可促进杏鲍菇产漆酶[22]。向基础产酶培养基中同时添加甘草渣和硫酸铜,也能够协同诱导漆酶产生,有效提高漆酶活性[15]。向G-PDA培养基中添加0.05 mmol/L硫酸铜后接种Z45,培养基上的棕红色变色圈显著增大,说明适量的硫酸铜也能够促进菌株Z45产漆酶。向优化后的产漆酶培养基中添加不同浓度甲基蓝,其脱色情况与PDA甲基蓝培养基上基本一致,但菌丝颜色产生较大差异,这可能是因为不同的培养基会影响菌株的生长及色素的产生[23],两种培养和营养不同导致了菌丝颜色发生变化。
在甲基蓝脱色实验中添加的粗酶液活力较低,因此脱色时间较长,脱色率较低。实际生产中产生的染料废水,往往成分复杂,常含有多种重金属离子,它们对于漆酶的活性或促进,或抑制,因此欲将端梗霉的漆酶用于实际废水处理还需要更多研究。此外,有不少研究人员对漆酶的固定化应用[24]进行了探索,以提高漆酶的性能和可重复使用性,这也为该菌株的进一步研究指明了方向。
4 结论
端梗霉Z45具有较好的产漆酶能力,通过单因素实验和正交试验设计得到了其产漆酶的优化培养基:产酶基础培养基以蔗糖为碳源、硝酸钠为氮源、碳氮比为45∶1、pH为5。菌株Z45在优化培养基中的漆酶活性显著大于PDB中的活性,且染料脱色速率与漆酶活性呈现正相关性。菌株Z45对溴酚蓝、中性红、亚甲基蓝、甲基蓝和结晶紫等多种染料具有脱色能力,其中对甲基蓝的脱色效果最好,培养5 d时蓝色基本完全消除,在较低的甲基蓝浓度下,脱色不受染料浓度的影响,优化培养基更利于菌株Z45使甲基蓝脱色。
