超广谱β-内酰胺酶CTX-M-14中药抑制剂的筛选及芸香苷抑酶作用研究
2022-07-22赵子玉王春光吕建存李继开张铁
赵子玉 王春光 吕建存 李继开 张铁
(河北农业大学动物医学院 中兽医学院,保定 071001)
抗菌药物是当今兽医临床用于预防和治疗动物细菌感染性疾病的主要手段,保障了现代化养殖业的持续发展。但是由于人类对抗生素的滥用,使得细菌耐药现象日益严重,对人类和动物健康造成了严重危害,因此受到了广泛关注[1-3]。细菌耐药性的产生机制主要包括细菌细胞膜通透性的改变、细菌生物膜的形成、抗生素作用靶位的改变、主动外排机制和灭活酶或钝化酶的产生等[4]。在这些耐药机制中,灭活酶β-内酰胺酶的产生最为常见,占比高达80%[5]。
β-内酰胺酶最早发现于1940年,至今已超过500多种[6]。β-内酰胺酶是耐药细菌针对β-内酰胺类抗生素分泌的一类酶,可以与内酰胺类抗生素的β-内酰胺环相结合,破坏甚至裂解β-内酰胺环,从而使其失去抗菌活性[7]。其主要有两种分类方法,一种是Bush分类法[8],另一种是Ambler分类法[9]。最具有代表性的为超广谱β-内酰胺酶(ESBLs)[10],其主要存在于革兰氏阴性杆菌中的肠杆菌科细菌中,代表菌种为大肠杆菌和肺炎克雷伯菌[11],铜绿假单胞菌也有产ESBLs的报道[12]。目前世界各地已发现超过200余种的ESBLs,且具有明显的区域性特征[13]。根据编码基因的同源性,ESBLs可分为CTX-M型、SHV型、TEM型、OXA型和其他型。据报道显示,CTX-M型是我国产ESBLs菌株的主要基因型[14-15],可能与我国临床治疗细菌感染时应用头孢噻肟多且量大有关[16]。CTX-M型ESBLs根据氨基酸序列的同源性可分为6组,主要代表为CTX-M-14型[17],其属于CTX-M-9亚群,在全世界也呈现流行趋势[18-19]。
目前已经研发出多种β-内酰胺酶抑制剂,常见的抑酶剂有克拉维酸、舒巴坦、他唑巴坦等[20-21],其本身具有较弱的抗菌活性,可以抑制β-内酰胺酶,因此常与β-内酰胺类抗生素联合应用增强抗生素的耐药性。但随着这些抑酶剂与抗生素复合制剂的应用,新的耐药菌株也逐渐出现[22-23]。因此需要寻找一种新型的β-内酰胺酶抑制剂,使细菌恢复对β-内酰胺类抗生素的敏感性。众所周知,中药历史悠久,具有种类多、安全、不易产生耐药性等特点,在细菌耐药性研究中具有一定的优势。且中药内不含酰胺键,不容易被ESBLs破坏,可以很好的抑制β-内酰胺酶的活性[24],因此从中药中寻找一种β-内酰胺酶抑制剂不失为一种解决β-内酰胺酶耐药性的好办法。
本试验构建了超广谱β-内酰胺酶CTX-M-14的原核表达载体,通过计算机虚拟筛选从中药单体数据库中得到了一个较好的CTX-M-14中药抑制剂—芸香苷,联合抑菌试验证明芸香苷与头孢噻肟钠具有联合抑菌作用,并通过酶动力学试验测定抑酶剂芸香苷与克拉维酸的抑酶作用与抑酶方式。
1 材料与方法
1.1 材料
大肠杆菌E320(本实验室测序并保存的多重耐药大肠杆菌菌株,NCBI登录号:CP020933)、大肠杆菌ATCC25922购自美国组织细胞收藏中心(ATCC)、pET-28a(+)空质粒载体购自武汉淼灵生物科技有限公司、His-Tagged Protein Purification Kit 试剂盒购自康为世纪生物科技有限公司、DH5α、BL-21购自上海昂羽生物技术有限公司、EcoR I、Xho I限制性核酸内切酶、Q5超保真DNA聚合酶购自NEB、IPTG购自索莱宝生物科技有限公司、芸香苷购自上海源叶生物科技有限公司、头孢硝噻吩(Nitrocefin)购自上海阿拉丁生化科技股份有限公司、苯唑西林钠、氨苄西林钠、头孢唑啉钠、头孢他啶、头孢呋辛、头孢曲松钠、头孢噻肟钠购自北京酷来搏科技有限公司。
1.2 方法
1.2.1 重组质粒的构建与表达
1.2.1.1 CTX-M-14的基因克隆与鉴定 根据CTX-M-14的基因设计引物,以E320、ATCC25922的DNA为模版,98℃ 30 s,98℃ 10 s,50℃ 30 s,72℃ 30 s,72℃ 2 min,4℃保存,共35个循环,进行PCR,将PCR产物进行琼脂糖凝胶电泳,观察结果是否存在876 bp的条带。
1.2.1.2 重组质粒的构建与鉴定 以大肠杆菌E320为模板,设计的引物引入酶切位点。CTX-M-14 F:5′- CGGAATTCATGGTGACAAAGAGAG-3′(划 线 为EcoR I酶切位点),CTX-M-14 R:5′- CCCTCGAGTTACAGCCCTTCG -3′(划线为Xho I酶切位点)。根据上述PCR条件,将得到的PCR产物与pET-28a(+)分别用EcoR I和Xho I双酶切以及胶回收,用T4连接酶过夜连接并转化到感受态DH5α,获取的质粒通过双酶切进行鉴定,确定质粒构建成功后,将质粒进行测序,并与目的序列比对。
1.2.1.3 诱导表达及可溶性检测 测序成功后将目的质粒转化到感受态细胞BL-21中,于37℃振荡培养至OD600达到0.6左右,取适量菌液做未诱导对照,其余的菌液加IPTG至终浓度为1 mmol/L诱导表达4 h后收集菌体,处理后通过SDS-PAGE电泳和考马斯亮蓝染色进行检测。
取诱导表达后的菌液,冰浴中超声裂解,分别收集上清和沉淀,处理后通过SDS-PAGE电泳和考马斯亮蓝染色进行检测,确定表达产物是在上清中以可溶性形式存在还是在沉淀中以包涵体形式存在。
1.2.1.4 重组蛋白诱导表达条件的优化 将蛋白阳性重组菌分别进行诱导时间、诱导温度和IPTG浓度的优化。第一组优化诱导时间,终浓度1 mmol/L,37℃分别诱导3、4、5、6 h;第二组优化诱导温度,终浓度1 mmol/L,26℃、31℃、34℃、37℃、42℃分别诱导4 h;第三组优化IPTG浓度,终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mmol/L,31℃诱导4 h。处理后通过SDS-PAGE电泳和考马斯亮蓝染色进行检测。
1.2.1.5 蛋白纯化与活性的鉴定 冰浴条件下超声破碎蛋白阳性重组菌直至菌体清亮,取出上清液,使用His-Tagged Protein Purification Kit试剂盒进行纯化,使用头孢硝噻吩(Nitrocefin)检测酶的活性。
1.2.2 超广谱β-内酰胺酶CTX-M-14中药抑制剂的虚拟筛选
1.2.2.1 超广谱β-内酰胺酶CTX-M-14和中药单体化合物的结构处理 从PDB(Protein Data Bank,www.rcsb.org)上下载大肠杆菌超广谱β-内酰胺酶CTX-M-14晶体结构(PDBID:6vnu)。在AutoDock-Tools(The Scripps Institute)中删除水分子,加电荷、加氢原子,经处理后转换成pdbqt格式。从ZINC数据库(www.zinc.org)下载中药单体化合物结构,并转换成pdbqt格式。
1.2.2.2 超广谱β-内酰胺酶CTX-M-14虚拟筛选及作用力分析 在AutoDoockTools上通过Grid Box工具找到2drd蛋白的活性口袋,用PyRx(The Scripps Institute)运行Autodock Vina完成虚拟筛选,并应用DSVisualizer(BIOVIA)进行作用力分析。
1.2.3 联合抑菌试验
1.2.3.1 MIC的测定 芸香苷经DMSO溶解后加水配成50 mg/mL的准备液,采用微量肉汤二倍稀释法,用MHB营养肉汤分别测定芸香苷、苯唑西林钠、氨苄西林钠、头孢唑啉钠、头孢他啶、头孢呋辛、头孢曲松钠、头孢噻肟钠对大肠杆菌E320与蛋白阳性重组菌BL-21的最小抑菌浓度(MIC),并以ATCC25922作为质控菌株。
1.2.3.2 芸香苷与头孢噻肟钠的联合抑菌试验 采用微量棋盘稀释法对大肠杆菌E320、蛋白阳性重组菌BL-21进行药物体外联合抑菌试验,以导入空质粒的BL-21作为空白对照,在纵横两个方向上以芸香苷、头孢噻肟钠的MIC为初始浓度,对芸香苷和头孢噻肟钠分别进行倍比稀释,每孔加入大肠杆菌菌液使终浓度为5×105CFU/mL,37℃培养20 h,以无细菌生长的最低药物浓度为联合用药MIC,计算分级抑菌浓度指数(FICI),判定联合用药效果。
FICI=MIC(芸香苷联合用药)/MIC(芸香苷单用)+MIC(头孢噻肟钠联合用药)/MIC(头孢噻肟钠单用)
判定标准:FICI≤0.5判定为协同作用,0.5<FICI≤1判定为相加作用,1<FICI≤2判定为无关作用,FICI>2判定为拮抗作用。
1.2.4 酶动力学测定
1.2.4.1 米氏常数(Km)与最大反应速率(Vmax)的测定 选取头孢噻肟钠作为底物进行测定,将芸香苷溶解在含0.1 mmol/L的Na2CO3中配成10 mg/mL的溶液备用,将β-内酰胺酶CTX-M-14加入到PBS中,含抑制剂组将加入抑制剂终浓度为1 mmol/L,调节pH 7.0,溶剂对照组加入等量的0.1 mmol/L的Na2CO3,空白对照组加入等量的PBS,置于37℃中温浴5 min,头孢噻肟钠溶液pH调整为7.0,并置于37℃中温浴5 min,然后根据头孢噻肟钠浓度(10、20、30、40、50 μm/L)将头孢噻肟钠加入到上述溶液中并迅速转移到比色皿中,通过紫外分光光度计监测5 min内236 nm处吸光度值的变化。选取初始反应吸光度值变化与时间呈线性关系的区段,计算水解的初速度V0,并根据方程V=Vmax/(Km+S)进行非线性拟合,分别得出Km与Vmax。
1.2.4.2 抑制常数Ki的测定 选取头孢噻肟钠作为底物进行测定,分别将0、0.1、0.2、0.3、0.4、0.5、1、5 μm的克拉维酸或芸香苷与含有β-内酰胺酶CTX-M-14的PBS混合,调节pH 7.0,置于37℃中温浴5 min,然后转移至比色皿中,分别加入50、100 μm的头孢噻肟钠进行混合,迅速加入到紫外分光光度计中,检测5 min内236 nm处吸光度值的变化,选取初始反应吸光度值变化与时间呈线性关系的区段,计算水解的初速度V0,以Dixon做图, 求出Ki。
1.2.4.3 抑酶保护率的测定 选取头孢噻肟钠作为底物进行测定,在含有β-内酰胺酶CTX-M-14的PBS中加入芸香苷或克拉维酸至终浓度为2 mmol/L,调节pH 7.0,溶剂对照组加入等量的0.1 mmol/L的Na2CO3,空白对照组加入等量的PBS,置于37℃中温浴5 min,然后加入与抑制剂质量比为1∶1的头孢噻肟钠,空白对照组加入头孢噻肟钠至终浓度为4 mmol/L,测定其236 nm处的OD值后继续置于37℃温浴30 min,再次测定其OD值,每组重复3次,根据OD值的变化,计算抑酶保护率。
抑酶保护率(%)=(对照组OD值的变化量-试 验组OD值变化量)/对照组OD值的变化量×100%
2 结果
2.1 PCR扩增凝胶电泳
使用CTX-M-14这对引物对E320和ATCC25922进行PCR扩增,结果(图1)显示,E320携带CTX-M-14基因,出现约876 bp的条带,ATCC25922未扩增到CTX-M-14基因。
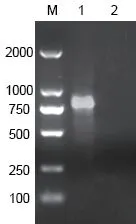
图1 PCR扩增产物凝胶电泳图Fig. 1 Gel electrophoresis of PCR amplified product
2.2 重组质粒酶切鉴定结果
将提取的重组质粒用EcoR I和Xho I进行双酶切,1%琼脂糖凝胶电泳,在750 bp与1 000 bp之间有与CTX-M-14相同大小条带,证明构建成功(图2)。

图2 转化后质粒经双酶切Fig. 2 Double enzyme digestion of transformed plasmid
2.3 DNA测序结果
重组质粒经序列分析,与GenBank中CTX-M-14基因相同。测得核苷酸序列与GenBank中CTX-M-14对照,如图3所示。

图3 CTX-M-14测序结果比对图Fig. 3 Alignment of CTX-M-14 sequencing results
2.4 CTX-M-14型ESBLs重组蛋白的诱导表达及可溶性检测
重组菌诱导后样品约在28 kD左右有明显的融合蛋白条带,而重组菌未诱导样品无明显特异性条带,如图4-A所示。裂解后的上清和沉淀中均出现一条28 kD左右的明显的融合蛋白条带,如图4-B所示。

图4 重组蛋白的表达检测Fig. 4 Expression detection of recombinant protein
2.5 诱导条件的优化
结果显示重组蛋白在31℃、IPTG浓度在0.6 mmol/L时诱导4 h为最佳条件,如图5所示。
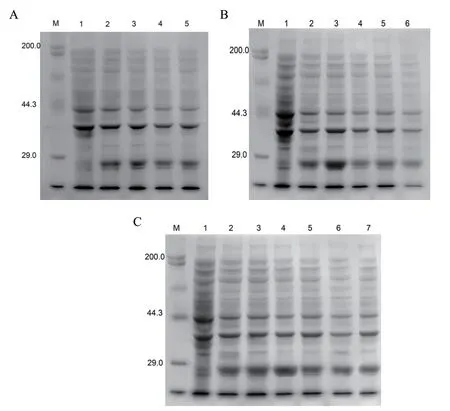
图5 蛋白表达条件的优化Fig. 5 Optimization of protein expression conditions
2.6 重组蛋白纯化及活性鉴定
重组蛋白经蛋白纯化试剂盒纯化的SDS-PAGE结果见图6-A;对CTX-M-14重组蛋白活性鉴定中,加入β-内酰胺酶CTX-M-14的头孢硝噻吩纸片从黄色变为红色,而对照仍呈黄色,说明重组蛋白存在活性,如图6-B所示。
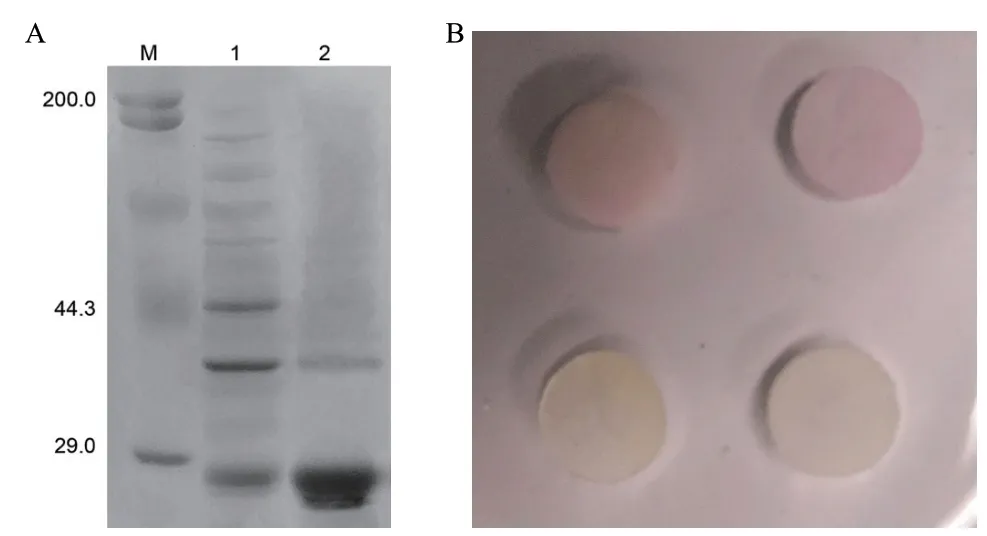
图6 重组蛋白纯化及活性鉴定Fig. 6 Purification and activity identification of recombinant protein
2.7 超广谱β-内酰胺酶CTX-M-14抑制剂的虚拟筛选
经过筛选共得到12个结合能低于-9.8 kcal/mol的中药单体,其中结合能最高的是rhein diglucoside(大黄酸二葡萄糖苷),为-11.5 kcal/mol,其次是agastachin(藿香素)、glycyrrhizin(甘草酸)、timosaponin A3(知母皂苷A3)、biepiasterolide(双表白术内酯)、sennidin A(森尼丁A)、rutin(芸香苷)、ciwujianoside(刺五加皂苷)、galloylpaeoniflorin(没食子酰芍药苷)、acaciin(刺槐甙)(表1)。考虑到毒性、溶解性和价格等因素,我们选取了rutin(芸香苷)来做后续的研究。

表1 Autodock Vina虚拟筛选的部分中药成分评分结果Table 1 Scoring results of some Chinese herbal medicinal ingredients screened virtually by AutoDock Vina
2.8 芸香苷配体与超广谱β-内酰胺酶CTX-M-14作用力分析
通过Autodock Vina软件对中药单体与超广谱β-内酰胺酶CTX-M-14进行分子对接模拟,结果显示多种中药单体能很好的与超广谱β-内酰胺酶CTX-M-14结合。本试验选取芸香苷进行了分子间作用力分析,芸香苷与超广谱β-内酰胺酶CTX-M-14对接部位形成多个氢键和范德华力(图7)。其结 合 作 用 力 为-9.9 kcal/mol,与Ser274、Ser237、Ser70、Ser130、Asn170、Asn132、Asn104、Arg276、Thr216、Thr235形成氢键,与Gly238形成范德华力。

图7 芸香苷与超广谱β-内酰胺酶CTX-M-14作用力分析Fig. 7 Interaction analysis of rutin with extended-spectrum β-lactamases CTX-M-14
2.9 MIC的测定
E320对苯唑西林钠、氨苄西林钠、头孢唑啉钠、头孢他啶、头孢曲松钠、头孢噻肟钠为耐药,对头孢呋辛为敏感;重组蛋白阳性菌BL-21对苯唑西林钠、氨苄西林钠、头孢唑啉钠、头孢曲松钠、头孢噻肟钠为耐药,对头孢他啶、头孢呋辛为中度敏感,且对头孢噻肟钠耐药极其显著(表2)。

表2 大肠杆菌E320、重组蛋白阳性菌BL-21的MICTable 2 MIC of E. coli E320 and recombinant protein positive BL-21
2.10 芸香苷和头孢噻肟钠的联合抑菌试验
通过微量肉汤二倍稀释法测得芸香苷、头孢噻肟钠对菌株E320的MIC分别为2.5 mg/mL、1 024 μg/mL,芸香苷与头孢噻肟钠联合抑菌时,两者具有协同作用(FICI=0.236);通过微量肉汤二倍稀释法测得芸香苷、头孢噻肟钠对CTX-M-14蛋白阳性重组菌的MIC分别为2.5 mg/mL和>1 024 μg/mL,芸香苷与头孢噻肟钠联合抑菌时,两者具有协同作用(FICI≤0.3125);通过微量肉汤二倍稀释法测得芸香苷、头孢噻肟钠对导入空白质粒pET-28a(+)的BL-21的MIC分别为2.5 mg/mL、8 μg/mL,芸香苷与头孢噻肟钠联合抑菌时,两者具有无关作用(FICI=1.5)(表3)。

表3 芸香苷和头孢噻肟钠联合抑菌试验Table 3 Combined antibacterial test of rutin and cefotaxime sodium
2.11 酶动力学参数
根据拟合线性方程得出,β-内酰胺酶CTX-M-14的Km为7.13,Vmax为21.33;溶剂对照组的Km为7.11,Vmax为20.97;加入芸香苷后的Km为8.76,Vmax为17.63;加入克拉维酸的Km为8.45,Vmax为17.79,加入抑制剂后相比空白对照Km均变大,Vmax均变小。根据Dixon作图得出芸香苷的Ki为11.38,克拉维酸的Ki小于芸香苷为3.78(表4)。
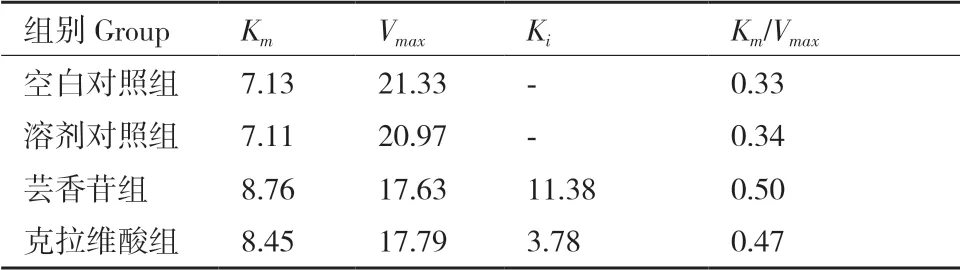
表4 酶动力学参数Table 4 Enzyme kinetic parameters
2.12 抑酶保护率
芸香苷组的OD值平均变化量为0.35,克拉维酸组的OD值平均变化量为0.32,空白对照组的OD值平均变化量为0.82,溶剂对照组变化量为0.81,根据计算得出克拉维酸的抑酶保护率为60.98%,芸香苷的抑酶保护率为57.31%(表5)。

表5 抑酶保护率Table 5 Inhibition rate of enzyme
3 讨论
分子对接是通过计算模拟的方式解决了实验过程中效率低下的问题。Autodock Vina作为AutoDock的第二代分子对接软件,对接的精度较第一代AutoDock更高,且操作简易,可进行并行计算,对接速度较AutoDock具有很大优势。芸香苷,又名芦丁,是一种天然的黄酮类化合物,广泛存在于各种药用植物中,其化学成分独特、生物活性广泛,引起了国内外学者的关注[25],其具有抗炎、抗病毒、抗肿瘤等作用[26-27]。研究显示黄酮类化合物具有一定的抗菌活性[28],Danciu等[29]还发现芸香苷可以显著降低金黄色葡萄球菌、大肠杆菌等的致病力。本研究通过Autodock Vina软件对中药单体与超广谱β-内酰胺酶CTX-M-14进行分子对接模拟,结果显示多种中药单体与超广谱β-内酰胺酶CTX-M-14受体有好的结合作用。本研究选取芸香苷为研究对象,结果显示芸香苷与CTX-M-14受体多个氨基酸残基形成了疏水作用力,并且还与对接部位形成多个氢键,说明芸香苷与CTX-M-14蛋白的结合很稳定。
序列比对分析结果与CTX-M-14相同,且蛋白大小相同,证明重组蛋白菌可以正确表达出CTX-M-14。头孢硝噻吩是具有显色特征的一种头孢菌素,可以用来检测β-内酰胺酶活性。β-内酰胺酶可以水解头孢硝噻吩β-内酰胺环上羰基碳和氮基间的酰胺键,该过程可以使头孢硝噻吩显现红色[30],结果显示头孢硝噻吩变为红色,说明重组蛋白菌表达出的β-内酰胺酶CTX-M-14具有活性。
阳性蛋白重组菌BL-21对苯唑西林钠、氨苄西林钠、头孢唑啉钠、头孢曲松钠、头孢噻肟钠显示为耐药,并且对头孢噻肟钠的耐药性最为显著,可知CTX-M-14对头孢噻肟钠的水解能力最好,与文献中报道相似[31]。因此对酶动力参数试验选用头孢噻肟钠作为底物。芸香苷使用DMSO溶剂不会对试验结果产生影响[32],其本身对大肠杆菌的抗菌活性较弱,但与抗生素头孢噻肟钠联合应用时出现了协同作用,可增强头孢噻肟钠对大肠杆菌的敏感性,提高了抗菌活性,且E320和CTX-M-14蛋白阳性重组菌呈协同作用,而芸香苷与头孢噻肟钠联合应用对导入空白质粒pET-28a(+)的大肠杆菌呈无关作用,且芸香苷与CTX-M-14蛋白有很好的结合作用,一定程度上可以说明芸香苷是通过抑制β-内酰胺酶CTX-M-14的活性从而降低对头孢噻肟钠的耐药性,表明中药单体芸香苷可作为β-内酰胺酶抑制剂的前体,可能通过结构改造而变成抑制作用良好、毒副作用低的β-内酰胺酶抑制剂。
米氏常数(Km)是酶动力学的经典且重要的参数,代表酶与底物的亲和力,Km越小亲和力越大,在加入抑制剂后,Km值明显增大,说明抑制剂会抑制酶与底物的结合,从而起到抑制作用,且克拉维酸的增大量比芸香苷大,说明克拉维酸的抑制作用比芸香苷好。Vmax代表酶对底物的最大水解速度,可以反映β-内酰胺酶对酶的稳定性,在加入抑制剂后Vmax变化不大,说明这两种抑制剂均为竞争性抑制剂[33]。Km/Vmax这一比值称之为水解效率,可以综合反应底物与酶的亲和力[34],抑制剂组Km/Vmax均大于空白对照组,说明这两种抑制剂与酶的亲和力大于底物头孢噻肟钠。抑制常数Ki是反应酶与抑制剂复合物的解离常数,越小说明抑制作用越强,芸香苷的Ki大于克拉维酸的Ki值,说明克拉维酸的抑制作用优于芸香苷,与Km的结果一致。抑酶保护率结果中克拉维酸的抑酶保护率也大于芸香苷的抑酶保护率,说明克拉维酸的抑制作用优于芸香苷。
4 结论
芸香苷具有成为新型中药β-内酰胺酶抑制剂的潜质,它与β-内酰胺类抗生素联合应用时可以增强β-内酰胺类抗生素对大肠杆菌的敏感性,通过竞争性抑制β-内酰胺酶的活性,从而提高β-内酰胺类抗生素的抗菌活性。
