土壤类型对花生根际土壤细菌群落多样性和产量的影响
2022-07-22徐扬张冠初丁红秦斐斐张智猛戴良香
徐扬 张冠初 丁红 秦斐斐 张智猛 戴良香
(山东省花生研究所,青岛 266100)
花生(Arachis hypogaea L.)是世界重要的油料作物之一,不仅可提供优质食用植物油,还具有丰富的蛋白质、维生素和矿物质等营养[1-2]。中国是世界上主要的花生生产国,总产、单产和产值均居世界第一。中国花生种植分布很广,各地都有种植,主产区为河南、山东、河北、广东、辽宁、四川、湖北、广西、安徽、吉林、江西、湖南、福建、江苏等省份[3-4]。因地域间社会、自然资源禀赋和土壤类型差异,花生长势和产量不同。土壤是植物生长发育的基础,不同类型的土壤理化特性和营养元素不同,供应作物生长的养分存在差异,必然影响作物品质和产量[5]。先前研究报道,不同土壤类型对花生根系生长、分布和产量均有影响,其中壤土较砂土和黏土具有更高的产量和有效果数[6]。不同土壤类型花生品质也存在差异和区域性,朱振林等[7]研究表明不同土壤类型间各花生品质指标均有差异,脂肪和蛋白质含量在地理空间分布上均呈明显的变化趋势,从北至南脂肪含量呈降低趋势,而蛋白质含量呈增高趋势[8-9]。砂土土壤花生籽仁总糖、蔗糖含量和油酸/亚油酸比例明显高于黏土[10]。另外不同土壤类型理化特性和营养元素也会影响植物根系外源分泌物,从而对根际微生物群落结构有很大的调控作用[11-13]。但不同土壤类型理化特性及营养组成差异引起的花生根际微生物菌群结构的空间分异与花生产量的关系尚不明确。研究花生与不同土壤类型根际微生物菌群结构间的复杂关系,揭示花生生产的区域土壤优势差异,以更有针对性地调控花生生产,对继续保持花生产业稳步发展至关重要。
植物根系向周围土壤分泌化学物质和养分,吸引大量的微生物(包括细菌和真菌),形成一个以植物根为主体核心,以植物-土壤-微生物相互作用形成的微生态环境系统[14-16]。土壤类型对土壤细菌群落结构和种群代谢功能产生重大影响,是影响根际细菌菌群结构的重要因素之一[17-19]。相同土壤类型通过不同栽培措施和肥料配施调控土壤微生物和花生产量的研究结果已有报道。如轮作栽培模式能提高花生根表有益微生物假单胞菌(Pseudomonas sp.)和白地霉(Geotrichum candidum)的丰度,降低病原菌比例,较连作栽培模式下产量提高45.8%、根瘤数提高57.5%、植株生物量提高24.1%[20]。持续施用生物有机肥可以改良红壤理化环境,进而优化连作花生根际细菌群落结构并提高根际抗病性能,提高产量[21]。盐碱土施加钙肥和Arbuscular Mycorrhizal Fungi(AMF)菌肥也会改变花生根际微生物菌群结构,提高氮固定相关细菌鞘氨醇单胞菌属(Sphingomonas)的相对丰度,增强花生耐盐性,百果重提高17.04%[22]。但是不同土壤类型理化因子和营养组成差异引起的花生根际微生物菌群结构的空间分异及其与花生产量的关系目前研究较少。本研究旨在探讨不同花生主产区主要土壤类型对其根际土壤细菌群落结构和产量的影响。以不同花生主产区土壤(主要来源于河南、山东、河北、吉林、新疆和湖南等6个省份)为材料,设置盆栽实验,以成熟期花生根际土壤为研究对象,利用高通量测序技术对土壤中细菌种类及多样性进行系统分析,结合荚果产量,探讨不同土壤类型花生根际细菌群落结构和产量的关系,明确土壤类型优势,旨在为研究花生根际土壤类型和菌群结构平衡、优质花生生产提供参考,为花生主产区高产优质栽培提供依据和技术指导。
1 材料与方法
1.1 材料
选择花生品种花育25号(Huayu25)为试验材料。供试土壤为河南焦作潮褐土(简写为焦作潮褐土)、山东沂南褐土(简写为沂南褐土)、河北滦县褐土(简写为滦县褐土)、吉林公主岭黑土(简写为黑土)、新疆石河子棕钙土(简写为棕钙土)和湖南邵阳红壤(简写为红壤)6种。各土壤类型采集地区经纬度、年平均气温和年平均降水量见表1,土壤类型营养成分和理化因子见表2。

表1 不同土壤经纬度、年平均气温和年平均降水量Table 1 Different soils latitude and longitude,annual average temperature,and annual mean precipitation
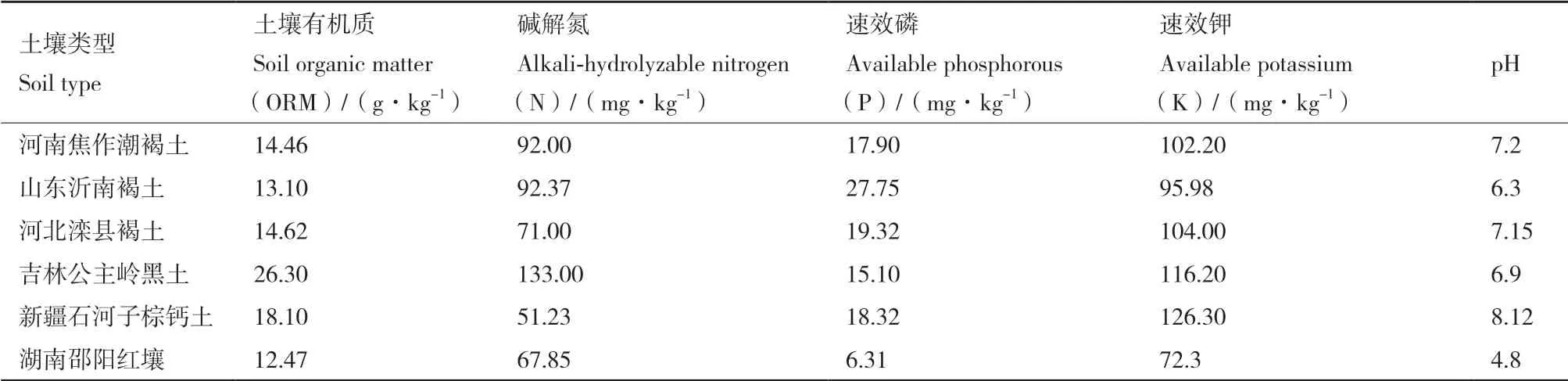
表2 不同土壤类型营养成分和理化因子分析Table 2 Analysis of nutrient components and physicochemical factors in different soil types
1.2 方法
1.2.1 试验设计 试验于山东省花生研究所试验站防雨棚中进行,设置盆栽种植花生和盆栽不种植花生2个处理。采取的各地各类型土壤风干、过筛(1 cm)后装入同规格塑料盆中(底部直径为36 cm,高为26 cm),每盆装土18 kg。选取子粒饱满均匀的花生种子,每盆播6粒,播深3 cm,出苗后留取长势一致的幼苗4株,重复10次。5月10日播种,9月20日收获,隔2日重量法补水,保持土壤湿度为田间持水量的75%-80%至收获期。收获时以多点混合采样法分别采集各处理根际土壤样本和非根际土壤样品[23]。每3株花生根际土壤样品和每3点采集的非根际土壤样品分别混合为1个重复,每种土壤类型3次重复。6种土壤类型均设有对照非根际土和根际土。焦作潮褐土的非根际土和根际土样品分别表示为HNCS、HNRS,沂南褐土非根际土和根际土样品分别表示为SDCS、SDRS,滦县褐土分别表示为HBCS、HBRS,黑土分别表示为JLCS、JLRS,棕钙土分别表示为XJCS、XJRS,红壤分别表示为HUCS、HURS。相关测试由上海美吉生物医药科技有限公司进行。
1.2.2 土壤DNA提取及高通量测序 利用OMEGA土壤试剂盒(OMEGA soil DNA kit)对所采集的土壤样本进行DNA提取,Nanodrop 2000分光光度计测定DNA浓度,并根据260 nm/280 nm和260 nm/230 nm的比值评估DNA质量,进一步利用1.0%琼脂糖凝胶电泳检测DNA的完整性[24]。利用引物340F:5′-CCTACGGGNBGCASCAG-3′以 及805R:5′-GACTACNVGGGTATCTAATCC-3′,对土壤细菌16S rRNA基因V3-V4区进行PCR扩增。应用HiSeq2500平台进行PE250测序。使用Trimmomatic[25](version 0.33)对原始数据进行质量过滤,去除adapter和尾部质量值20以下的碱基,然后使用Cutadapt[26](version 1.9.1)按照允许最大错配率20%,最小覆盖度80%的参数进行引物序列的识别与去除,其后使用USEARCH[27](version 10)对双端reads进行拼接并去除嵌合体(UCHIME[28]version 8.1),最终得到高质量的序列用于后续分析。相似度高于97%的定义为一个聚类操作分类单元(operational taxonomic units,OTUs),根据测序及计算结果进行OTUs聚类和物种分类分析,然后在SILVA细菌16S rRNA数据库(Release 119,http://www.arb-silva.de)中比对分析,得到每个样本的OTUs分类学注释结果[29]。
1.2.3 生物信息学分析 所有的测序数据在美吉I-Sanger云数据分析平台上进行在线数据分析(www.majorbio.com)。对根际土壤细菌群落多样性和丰富度进行α多样性分析,包括绘制稀释性曲线(rarefaction curve)、等级丰度曲线(rank abundance),以及Chao(度量丰富度)和Shannon指数(度量多样性)分析[30]。稀释性曲线趋于平缓或者达到平台期时可认为测序深度基本覆盖到样品中所有的物种[31]。等级丰度曲线可同时解释样品所含物种的丰富度和均匀度[32]。样本间的β多样性分析包括主坐标分析(principal co-ordinates analysis,PCoA)、样本层次聚类统计分析、相似性分析(ANOSIM),更深入挖掘样本间的组成差异[33-36]。多组样本菌群差异分析采用克氏秩和检验(Kruskal-Wallis H test),土壤细菌菌群结构与土壤理化因子之间的相关性通过redundancy analysis(RDA)预测[37-38]。
1.2.4 荚果产量测定 于成熟期各处理分别收获并选取代表性植株15株,摘取所有具有经济产量的荚果,自然晒干后考种、计产。
1.2.5 数据处理 采用SPSS 18.0软件中Student’s t-test(P=0.05)和单因素方差分析(One-Way ANOVA)进行方差分析。利用Excel 2003和GraphPad Prism 7软件作图,图表中数据为平均值±标准差。
2 结果
2.1 不同土壤类型营养成分和花生荚果产量
6种土壤类型具有不同的土壤营养成分和理化因子,表2显示黑土具有较高的土壤有机质和碱解氮含量;棕钙土较其他类型土壤具有更高的速效钾含量,但碱解氮含量较低;沂南褐土的速效磷含量高于其他土壤类型;而红壤各指标均较低。除红壤pH较低(4.8)为酸性土外,其余各土类pH均在6.3(沂南褐土)以上,棕钙土pH最高,为8.12。表3可以看出,不同地区荚果产量存在显著性差异,黑土荚果产量最高,其次为棕钙土和沂南褐土,红壤花生百果重、百仁重以及荚果产量显著低于其他几种土壤类型。

表3 不同土壤类型对花生荚果产量的影响Table 3 Effects of soil types on pod yield of peanut
2.2 α多样性分析
2.2.1 稀释性曲线和等级丰度曲线 α多样性分析可以检测土壤细菌群落的丰富度和多样性,其中稀释性曲线可以用来评价测序量是否足以覆盖所有类群,并间接反映样本中物种的丰富程度。图1-A所示,各样本在测序量达到8 000时,所有土壤样本曲线均趋于平缓,说明测序深度足够,基本覆盖所测样本内的所有物种。等级丰度曲线能直观地显现各样本物种的均匀度和丰富度,如图1-B所示,当OTU数量大于1 000时曲线较为平缓,物种分布较均匀。
2.2.2 Chao和Shannon指数分析 对6种土壤样本的细菌α多样性指数分析结果表明,黑土和红壤细菌的丰富度(Chao指数)低于其他地区土壤样本,并以红壤的丰富度最低,且该土壤细菌多样性(Shannon指数)也较低,而滦县褐土细菌丰富度和多样性均较高。另外,焦作潮褐土和棕钙土的土壤样本细菌多样性也较高(图1-C、D)。综合分析,红壤细菌丰富度和多样性均低于其他土壤类型,推测红壤环境较不利于土壤细菌生长繁殖。
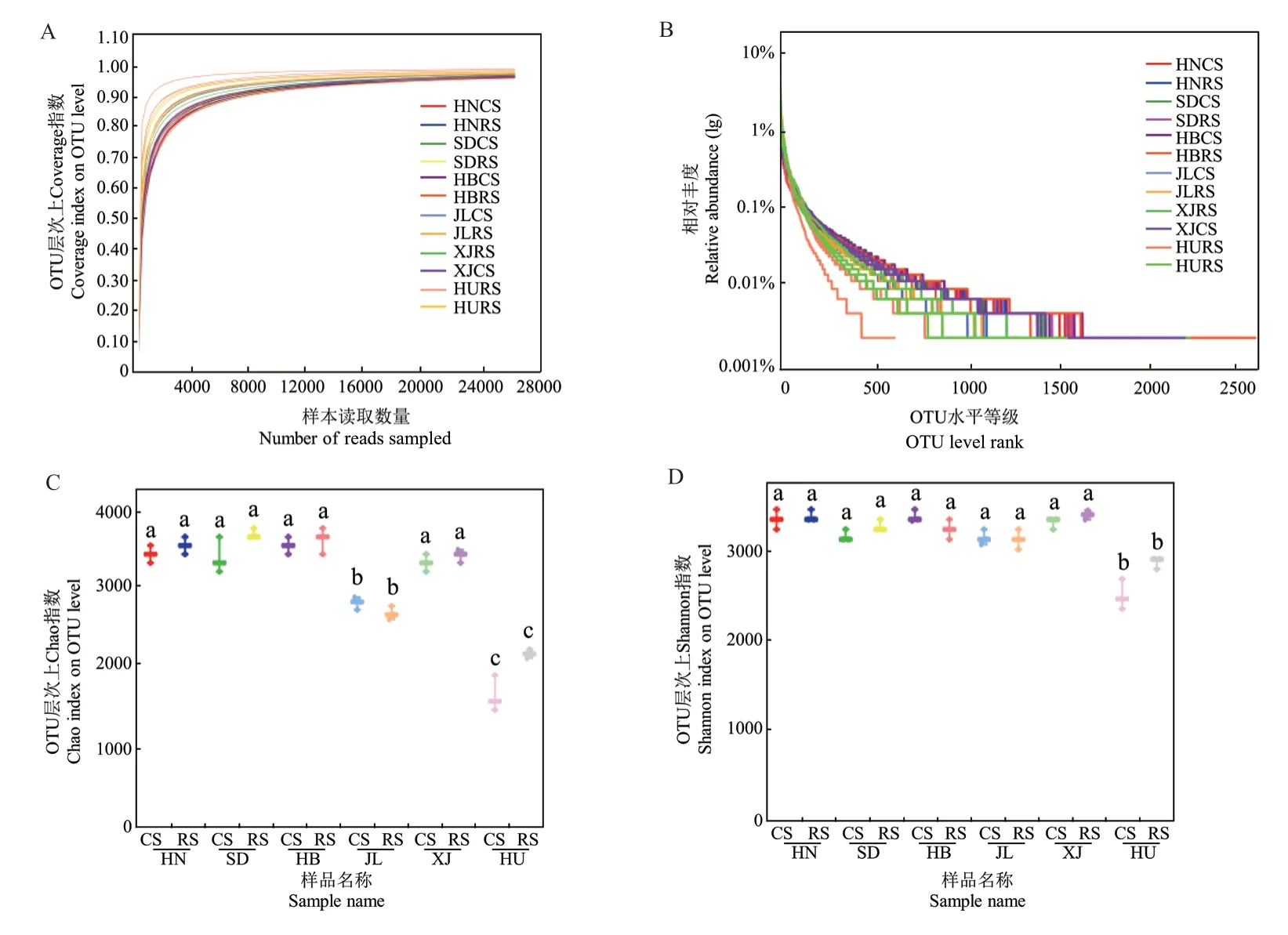
图1 α多样性分析Fig.1 α diversity analysis
2.3 物种组成及样本间差异比较
2.3.1 全样本门水平菌群结构分析 由图2可见,各土壤样本均以放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)及芽单胞菌门(Gemmatimonadetes)等为共有优势菌门,其相对丰度之和占总菌量的80%以上,但在不同类型土壤样本中存在明显的菌群丰度差异。焦作潮褐土、沂南褐土、滦县褐土、黑土以及棕钙土中放线菌门和变形菌门均较丰富,但是红壤中这些菌门的相对丰度显著低于其他地区土壤样本,绿弯菌门是其最丰富的细菌门类,占总菌量的33.7%-52.3%。另外,根际土与非根际土细菌门丰度间有差异,红壤根际土与非根际土各细菌菌门(包括放线菌门、变形菌门、绿弯菌门、酸杆菌门、芽单胞菌门以及厚壁菌门)丰度变化比其他地区大。滦县褐土、黑土和棕钙土3地区根际土酸杆菌门相对丰度低于非根际土,而变形菌门相对丰度高于非根际土。红壤根际土中放线菌门、变形菌门、酸杆菌门和芽单胞菌门相对丰度高于非根际土,但是酸杆菌门相对丰度低于非根际土。

图2 门水平各样本细菌群落结构Fig.2 Bacterial community structure of each sample at the phylum level
2.3.2 全样本纲、目、科水平菌群结构分析 纲水平的分析结果(图3-A)显示,除红壤外,其他地区土壤优势菌纲主要为放线菌纲(Actinobacteria)、α-变 形 菌 纲(Alphaproteobacteria)、γ-变 形 菌 纲(Gammaproteobacteria)、Subgroup_6和 芽 单 胞 菌纲(Gemmatimonadetes)。红壤优势菌纲为放线菌纲(Actinobacteria)、α-变形菌纲(Alphaproteobacteria)、纤线杆菌纲(Ktedonobacteria)、TK10和AD3(图3-A)。目水平的分析结果(图3-B)显示,除红壤外,其他地区土壤优势菌目主要为Gaiellales、根瘤菌目(Rhizobiales)、β-变形菌目(Betaproteobacteriales)、norank_c__Subgroup_6和鞘脂单胞菌目(Sphingomonadales),红壤优势菌目为芽孢杆菌目(Bacillales)、norank_c__TK10、norank_c__AD3和纤线杆菌目(Ktedonobacterales)。科水平分析结果(图3-C)显示,焦作潮褐土、沂南褐土、滦县褐土和黑土优势菌科主要为norank_o__Gaiellales、norank_o__norank_c__Subgroup_6、鞘脂单胞菌科(Sphingomonadaceae)和芽单胞菌科(Gemmatimonadaceae),棕钙土优势菌科为Nocardioidaceae、Geminicoccaceae和norank_o__norank_c__Gemmatimonadetes,红壤以norank_o__norank_c__TK10、norank_o__norank_c__AD3和纤线杆菌科(Ktedonobacteraceae)为优势菌科。
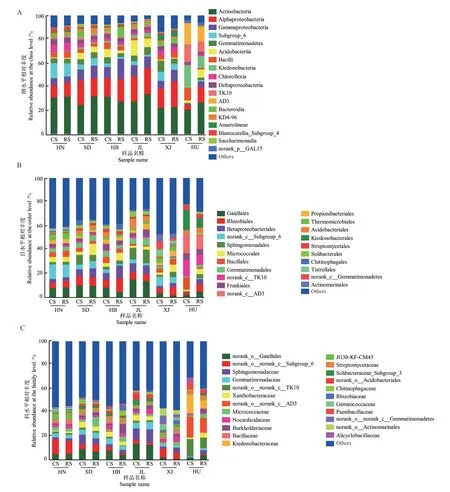
图3 纲、目、科水平各样本菌群结构Fig.3 Structure of bacterial community at the class,order and family level
2.3.3 全样本属水平菌群结构分析 在属层次上调查分析发现,所有菌属的相对丰度均小于17%,菌属数量较多,未命名菌属比例较高,表明花生根际土壤细菌菌群多样性高,菌群构成较复杂(图4-A)。6个地区的花生根际土壤和非根际土壤的菌群结构在属水平上差异较大,各样品菌群分类中相对丰度占比最高的前15个属的丰度在不同地区存在显著性差异(图4-B)。不同土壤类型优势菌属显著不同,焦作潮褐土优势菌属为norank_f__norank_o__norank_c__Subgroup_6和norank_f__norank_o__Gaiellales,沂南褐土和黑土优势菌属为norank_f__norank_o__Gaiellales、norank_f__norank_o__norank_c__Subgroup_6和鞘氨醇单胞菌属,滦县褐土优势菌属为norank_f__norank_o__Gaiellales,棕钙土优势菌属为norank_f__norank_o__norank_c__Subgroup_6、norank_f__norank_o__norank_c__Gemmatimonadetes和norank_f__norank_o__Actinomarinales;而未分类 菌 属norank_f__norank_o__norank_c__TK10和norank_f__norank_o__norank_c__AD3以及链霉菌属(Streptomyces)仅在红壤中表现出较高丰度,为该土壤优势菌属。在属水平上,样品间菌种丰度整体差异较大,并在个别菌种丰度上呈现出特有性。

图4 属水平各样本细菌群落结构Fig.4 Bacterial community structure of each sample at the genus level
2.4 β多样性分析
主坐标分析是研究数据相似性或差异性的可视化方法,可以通过样本点间的相互位置关系分析个体或群体间的差异。如图5-A所示,红壤细菌菌群结构差异较大,单独分布在一个象限,焦作潮褐土和棕钙土分布于一个象限,其余地区土壤菌群相似度大,差异较小,分布于同一象限。同一样本的3次重复间差异较小,分布较集中,说明3次平行重复性较好。样本层次聚类分析显示,同一土类的根际和非根际土壤样本重复聚集到同一分支,不同地区土壤样本聚集于不同分支,距离较远,差异较大(图5-B)。相似性分析显示,不同地区土壤样本组间差异较大,远远高于样本组内差异(R=0.931 2,P=0.01,图5-C)。由此可知,不同土壤类型细菌群落多样性组间差异较大。
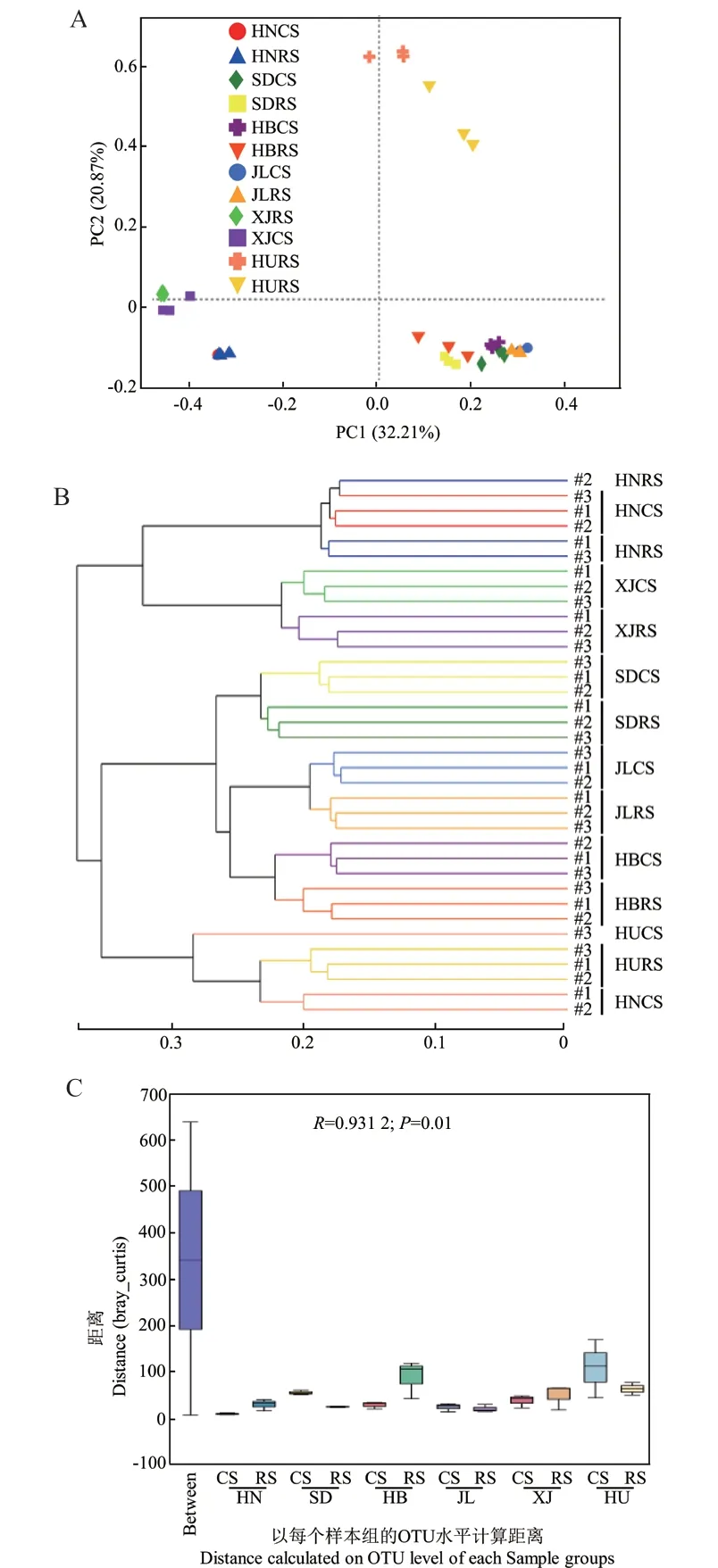
图5 花生根际细菌群落β多样性分析Fig.5 β diversity analysis of bacterial communities on the rhizosphere of A. hypogaea
2.5 土壤细菌菌群与土壤理化因子的相关性分析
本研究将6个不同地区不同类型土壤的酸碱度(pH)、有机质(ORM)、碱解氮(N),速效磷(P)和速效钾(K)等因子作为土壤理化因子,与土壤门水平细菌菌群结构进行相关性分析发现,大多数细菌在门水平上的相对丰度与pH、ORM、N、P和K等理化因子间有显著或极显著相关性,其中,表现显著或极显著正相关的有拟杆菌门与pH、ORM、P和K间,芽单胞菌门与ORM、P和K间,变形菌门与ORM、N、P间,放线菌门、酸杆菌门和疣微菌门与N间,Patescibacteria、蓝细菌门和硝化螺旋菌门与P间;而Rokubacteria仅与pH间呈极显著正相关,与N间呈显著负相关。绿弯菌门与GAL4与ORM、P和K间均呈显著或极显著负相关(图6-A)。
样品门分类水平与土壤理化因子聚类结果进行RDA分析(图6-B)。从图中各理化因子箭头与样品中心连线的夹角大小可以看出,焦作潮褐土根际土与非根际土与pH、ORM、N、P和K间的夹角均为锐角,呈正相关;而红壤根际土与非根际土与所有因子间均为钝角,呈负相关。沂南褐土非根际土与ORM、N、P和K间为锐角,呈正相关,与pH间无相关性;而其根际土与所有土壤理化因子间的夹角均为钝角,即均呈负相关。滦县褐土非根际土与ORM、N和P间为锐角,呈正相关,与pH和K间为钝角,呈负相关。黑土根际土与非根际土与ORM、N、P和K间的夹角为锐角,呈正相关,与pH间为钝角,呈负相关。棕钙土根际土与非根际土与pH和K间为锐角,呈正相关,与ORM、N和P间为钝角,呈负相关。通过从样品点向数量型环境因子的箭头做投影,其投影点与原点的距离用于评价该环境因子对样本群落分布相对影响的大小。各环境因子对焦作潮褐土、沂南褐土、滦县褐土以及黑土影响力小于对棕钙土和红壤的影响力。各环境因子对棕钙土影响程度的大小顺序为pH>N>K,而ORM和P两理化因子未表现出对该样品细菌菌群的影响力。各环境因子对湖南红壤的影响程度较大,负相关性影响力大小顺序为P>ORM>K>pH>N。

图6 各土壤样品细菌群落与土壤理化因子的相关性分析Fig.6 Correlation analysis between soil bacterial community and soil physical and chemical factors
3 讨论
根际土壤细菌作为根际-土壤-微生物微生态系统中关键参与者,在维持根际微生物生态平衡,协调植物生长发育与营养物质的摄取等方面具有重要作用[39]。本研究采用盆栽试验对分别从花生主产区河南、山东、河北、吉林、新疆、湖南等地采集的6种不同类型的土壤的花生根际与非根际土壤细菌菌群多样性进行了研究,并对土壤细菌菌群与环境因子间的相关性进行了分析。土壤样本细菌菌群丰富度和多样性分析显示,红壤细菌菌群丰富度和多样性低于其他5个地区,而滦县褐土、焦作潮褐土和棕钙土土壤样本细菌的多样性均较高。在细菌菌群结构分析上,不同地区土壤样本中细菌组成具有一定的相似性,但是差异性明显,个别菌群丰度上呈现出特有性。其中,红壤中绿弯菌门的丰度特异性提高,其他土壤类型放线菌门和变形菌门优势较明显。RDA分析显示土壤理化因子土壤pH、有机质(ORM)、碱解氮(N)、速效磷(P)和速效钾(K)等对样品细菌菌群组成和物种丰度均有不同程度的影响。相同盆栽管理措施下以红壤花生荚果产量最低。综合本研究结果显示,红壤与其他土壤类型相比其花生生产的土壤禀赋优势较低。
目前,分析土壤微生物α多样性常用指数为Chao指数和Shannon指数。本研究通过对不同花生主产区根际与非根际土壤细菌的α多样性研究表明,不同类型土壤细菌的α多样性指数不同,说明不同地区土壤花生根际土壤细菌的丰富度和多样性发生了改变,其中湖南邵阳红壤Chao指数和Shannon指数均最低。不同地区的土壤类型、气候以及品种特性和栽培方式都会影响土壤微生物的α多样性[40-41]。在本研究中,供试土壤样品均同时采自花生播种前,于相同处理和管理措施下进行盆栽,因此不同地区各类型土壤花生根际细菌的变化主要是来自于土壤类型的差异。对不同地区土壤理化性质研究表明,不同地区土壤pH、有机碳、碱解氮、速效磷和速效钾均出现差异,土壤细菌菌群结构与多种土壤理化因子具有显著相关性,但理化因子之间的相互作用机制和对微生物群落的影响方式还需进一步深入研究。红壤有机碳、速效磷和速效钾均低于其他地区,pH较低,细菌菌群结构与各土壤理化因子呈显著负相关性,故与多种土壤理化因子显著负相关的细菌门如绿弯菌门与GAL4在该土壤中特异性提高,但与土壤理化因子正相关的细菌门如变形菌门、芽单胞菌门和拟杆菌门在该土壤中丰度很低。相关性分析结果与土壤细菌菌群结构分析两结果互相佐证。
植物和微生物共存于土壤,土壤微生物的生长繁殖直接或间接受植被覆盖的影响,并且其种类和多样性易受土壤类型、肥料种类及栽培方式的影响[42]。本研究发现,不同地区土壤理化性质互有差异,导致各地区土壤细菌结构也不相同,说明适应于某类微生物生长的土壤类型未必适应其他微生物类群的生存,这也是土壤微生物对于土壤生境具有选择适应性的体现,与之前研究报道一致[43]。南方酸性红壤呈现酸、粘、瘠、毒的特点,土壤环境恶劣,与其他地区菌群结构差异尤其大。绿弯菌门在红壤中丰度最高,占总菌量的33.7%-52.3%。绿弯菌门是一个深度分支的门级别细菌类群,形态多样,代谢途径十分丰富,参与了碳、氮、硫等一系列重要营养元素的循环过程[44]。张静等[45]对红壤水稻土中的微生物多样性和群落结构研究表明,酸化土壤中绿弯菌门的相对丰度最高,与本文的研究结果一致。Epelde等[46]对长期遭受重金属污染的土壤微生物进行了研究,结果显示绿弯菌门的相对丰度随污染物浓度的增高而不断增加,说明绿弯菌门对外界恶劣环境的抵抗力较强。因而,绿弯菌门能够耐受酸性红壤环境,通过改善土壤中的碳、氮循环来促进自身生长繁殖,成为该类土壤中最丰富的细菌门类。
土壤微生物对于植物的生长发育至关重要,研究不同产地花生根际土壤微生物与土壤理化性质之间的关系,对揭示不同地域花生生长发育、因地制宜增产增效具有重要意义。根据不同土壤细菌菌群结构分析发现,沂南褐土、黑土以及棕钙土中变形菌门丰富度高于红壤,属水平鞘氨醇单胞菌属在沂南褐土和黑土也较高。荚果产量统计学分析结果显示,黑土、棕钙土和沂南褐土荚果产量显著高于红壤。推测根际土壤变形菌门和鞘氨醇单胞菌属可能与花生产量有一定关系,其相对丰度的增高可能对花生生长和荚果产量提高有帮助。变形菌门能够利用有机物分解产生的氨气、甲烷等营养物质进行生长代谢活动[47],其丰度随土壤全氮含量和有机碳含量的增加而提高[48],本研究中变形菌门与土壤有机物含量呈显著正相关,有机物含量较高的土壤(黑土以及棕钙土)中其丰度均较丰富,与之前研究结果一致。变形菌门利用有机碳为土壤提供固氮能力并促进土壤养分碳、硫循环[49-50],鞘脂单胞菌属主要参与土壤中芳香族化合物的降解及碳循环过程[51],可以改善土壤环境、降解有毒物质,二者可能为花生根系生长提供良好微环境,在一定程度上促进花生形态建成,进一步提高花生荚果产量。未来将分离纯化变形菌门中优势菌群和鞘脂单胞菌属,按需接种到根际周围,结合花生植株形态和荚果产量统计学分析,深入验证根际土壤变形菌门和鞘脂单胞菌属在花生生长发育和荚果产量中的生物学作用。分离纯化并培养利于植物存活和生长的微生物,结合不同花生主产区土壤微生物菌群结构差异,因地制宜地改良土壤微生物环境对不同花生主产区土壤的高效利用和花生高产优质生产具有指导意义。
4 结论
本研究利用高通量测序技术和荚果产量分析,明确了6种不同土类花生根际土壤细菌菌群结构特征及其与花生产量的关系。湖南邵阳红壤中绿弯菌门优势最明显,其他土壤类型放线菌门和变形菌门优势较明显。变形菌门和鞘氨醇单胞菌属可能分别是与花生荚果产量提高相关的有益菌门和菌属。相同盆栽管理措施下以红壤花生荚果产量最低,红壤与其他土壤类型相比其花生生产的土壤禀赋优势较低。
