向日葵HaLACS1的克隆、表达及酵母功能互补鉴定
2022-07-22杨佳宝周至铭张展冯丽孙黎
杨佳宝 周至铭 张展 冯丽 孙黎
(1. 石河子大学生命科学学院,石河子 832003;2. 兵团兴新职业技术学院,巴州 841007)
向日葵(Helianthus annuus L.)是我国四大油料作物之一,主要种植在内蒙古、新疆、甘肃等北方地区,种植面积约100万hm2,总产约200万t[1]。传统葵花籽油中含有大量的不饱和脂肪酸,主要为油酸(14%-43%)和亚油酸(44%-75%),约占总脂肪酸含量的85%[2],是最健康的食用植物油之一,而且向日葵耐盐碱、抗旱、耐瘠薄,被誉为“盐碱地的先锋作物”[3],在生态环境保护和地方经济可持续发展中具有不可替代的重要作用。
植物油主要以三酰甘油(triacylglycerol,TAG)形式储存在成熟种子中,为种子萌发和幼苗生长提供能量[4]。在TAG合成与分解代谢过程中,长链脂酰CoA合成酶(long chain acyl-CoA synthetase,LACS)是极为重要的一类酶,它可催化游离脂肪酸生成脂酰CoA,这是其他脂代谢酶利用脂肪酸所必需的关键步骤[5-6]。LACS的催化作用主要分为两步:首先游离脂肪酸和ATP反应形成中间体,然后中间反应产物与CoA的硫酯键反应形成脂酰CoA[6-8]。形成的脂酰CoA可进入β-氧化途径,参与脂肪酸的降解过程[7],也可作为TAG合成的前体物质发挥 作用[5]。
LACS广泛存在于哺乳动物、植物、酵母以及大肠杆菌等生物体中,在生物油脂合成及分解代谢中发挥着重要作用。LACS属于酰基CoA合成酶(acyl-CoA synthetase,ACS)超家族,具有ACS家族的共同特征:其一是含有一个高度保守的AMP结合结构域(AMP-binding domain,PROSITE PS00455), 是ATP的结合位点[9];其二是含有ACS信号序列,可能是ACS的激活位点和脂肪酸结合部位[10]。与其他ACS不同的是,LACS蛋白具有一个由大约45个氨基酸残基组成的连接域(linker)[11]。
高等植物LACS基因家族包含多个成员,对拟南芥LACS各成员的功能研究工作开展得较为深入。拟南芥基因组中共有9个LACS基因(AtLACS1-AtLACS9),除了AtLACS6和AtLACS7以外,均能互补LACS缺陷型酵母的表型,使其恢复生长[12]。其中AtLACS1编码的蛋白定位于内质网,在发育的种子中优势表达,与AtLACS9存在部分功能冗余,在种子油脂合成中发挥重要作用[13]。此外,AtLACS1还与表皮蜡质及花粉脂质的形成有关[13-14]。由于角质层是植物抵御生物和非生物胁迫的天然屏障,因此,LACS在植物抗逆响应中也具有重要作用[15],拟南芥单或双突变体如atlacs2和atlacs1atlacs2提高了表皮的渗透性、水分散失率和对干旱的敏感 性[16-17]。在酿酒酵母(Saccharomyces cerevisiae)中发现LACS有4种形式,分别为Faa1p、Faa2p、Faa3p和Faa4p,其中Faa1p和Faa4p的催化活性较高,主要参与长链脂肪酸的活化[18]。
虽然LACS基因在拟南芥中已经有较为详尽的研究,然而向日葵LACS基因在TAG合成和逆境胁迫中的作用至今仍不甚清楚。本研究通过分析向日葵基因组发现LACS为多基因家族,进一步从实验室前期获得的向日葵种子发育转录组发现,LACS家族成员在种子发育过程中呈现差异表达模式,筛选获得一个包含完整编码区的LACS基因序列,命名为HaLACS1,使用反转录PCR克隆获得该基因并对其进行了生物信息学分析,研究其亚细胞定位、组织表达及在干旱、盐和ABA处理下的表达模式,并通过酵母突变体功能互补试验进一步明确HaLACS1编码酶的活性和底物偏好性,以期为揭示该基因的功能及其在向日葵油脂合成和抗逆中的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 材料及处理 供试向日葵品种为油葵T303(含油量约49%),于2020年春季种植于石河子大学农试场试验田。将开花后第0天的植株进行人工自花授粉,并做标记,取开花当天及油脂积累3个不同时期(初期、中期和后期,即开花后10、24和31 DAF(day after flowering))的种子,液氮速冻后于-80℃保存。
将向日葵种子播种于花盆中,置于温室中培养[(25±2)℃,16 h光照/8 h黑暗],当幼苗生长至2片真叶时,分别取根、茎、叶和子叶,液氮速冻后-80℃保存,同时以盆栽幼苗为材料,以无菌水处理为对照,进行不同浓度的盐胁迫(0、150、200和300 mmol/L NaCl)处理24 h;干旱胁迫(15% PEG 6000)和外源ABA(100 μmol/L)处理0、1、3、6、12和24 h。每个样品进行3个生物学重复。
1.1.2 菌株与主要试剂 pMD18-T载体购自TaKaRa公司。大肠杆菌(E. coli)DH5α、亚细胞定位载体pAN580-eGFP和酵母穿梭表达载体pYES2由石河子大学生命科学学院植物功能基因实验室保存。pAN580带有增强型绿色荧光蛋白(enhanced green fluorescent protein,eGFP)报 告 基 因。LACS缺陷型酵母(Saccharomyces cerevisiae)YB525菌株(faa1△faa4△)由朱骏教授(上海师范大学)惠赠。
1.2 方法
1.2.1 HaLACS1的克隆及序列分析 使用FastPure Plant Total RNA Isolation Kit(Vazyme,南京,中国) 提取向日葵总RNA,使用PrimeScriptTMReverse Transcriptase(TaKaRa,大连)反转录cDNA。根据向日葵基因组,用Primer Premier 5.0设计HaLACS1编码区引物(L1F/L1R),并添加Hind Ⅲ和XhoⅠ酶切位点,用于构建PYES2-HaLACS1载体(表1)。使用在线网站ExPASy(https://web.expasy.org/protparam/)预测HaLACS1蛋白分子量和等电点。使用MEGA 7.0软件的邻接法(neighbor-joining)构建系统发育树,采用Clustal W结合GeneDoc软件对蛋白序列进行比较和可视化分析。利用在线软件PlantCARE与TBtools分析HaLACS1启动子顺式作用元件。

表1 引物信息Table 1 Information of primers used in this study
1.2.2 亚细胞定位分析 使用引物PF和PR扩增HaLACS1,经琼脂糖凝聚检测、纯化后,与亚细胞定位载体pAN580-eGFP连接,构建融合表达载体pAN580-HaLACS1-eGFP。将构建好的融合表达载体、pAN580-eGFP空载体及mCherry-HDEL-eRFP(内质网定位marker)质粒分别转化拟南芥原生质体,弱光下培养8-10 h,利用激光共聚焦显微镜观察GFP在细胞内的分布,判断HaLACS1的亚细胞定位。
1.2.3 HaLACS1的表达分析 以向日葵18S rRNA(AF107577)基因为内参,使用ChamQTM Universal SYBR qPCR Master Mix(Vazyme,南京)进行qRTPCR反应,分析HaLACS1的表达水平。反应程序为95℃ 30 s;95℃ 10 s,60℃ 30 s,72℃ 20 s,40个循环。采用2-ΔΔCT法计算基因相对表达量[19]。
1.2.4 HaLACS1 在酵母中的功能验证 使用引物L1F和L1R(表1)扩增HaLACS1的编码区序列,构建酵母表达载体pYES2-HaLACS1。采用LiAc转化法[20],分别将重组质粒和对照质粒pYES2转化至LACS缺陷型酵母YB525中。转基因酵母在含2%(W/V)半乳糖的尿嘧啶缺陷培养基(yeast synthetic drop-out agar medium without uracil,SCU)上进行诱导培养[21-22]。
1.2.5 底物偏好性分析 将转基因酵母接种于SCU培养基中,培养至对数期中后期,收集酵母细胞。加入2 mol/L山梨醇清洗2次。将酵母细胞转入3-5 mL SCU液体培养基(含2%半乳糖),30℃培养4 h,诱导外源基因表达。测OD600,然后吸取30 μL菌液加入到3 mL含2%半乳糖、98 μmol/L脂肪酸(C12: 0、C14:0、C16:0、C18:0、C18:1)的SCU液体培养基中,并添加0.1% Triton X-100溶解脂肪酸。30℃震荡培养48 h,使用分光光度计测量菌体密度,推测HaLACS1催化反应的底物偏好性[23]。
1.2.6 酵母细胞油脂的检测 利用苏丹黑B染色法[24]分析转基因酵母细胞中的油脂含量(脂肪粒散布在细胞质中,可被苏丹黑B氧化成黑蓝色,在580 nm波长下酵母细胞油脂含量与吸光值呈线性关系)。首先用无菌水悬浮收集半乳糖诱导后的酵母菌体,将OD600处菌液浓度调为0.5,5 000 r/min离心10 min收集菌体。用0.3%的苏丹黑(苏丹黑0.3 g,70%乙醇100 mL)染色15 min后,弃去染料,用70%酒精悬浮菌体漂洗3次后悬浮于无菌水, 测OD580。
1.2.7 统计和分析 采用SPSS 26.0(one-way ANOVA)和Duncan法对qRT-PCR和底物偏好性进行单因素方差和多重比较分析(P<0.05)。使用SPSS 26.0和Turkey’s法对中性油脂含量进行单因素方差和多重比较分析。所有数据均用3个生物学重复的平均值±标准差(±s)表示,并使用GraphPad Prism 8.0.2进行绘图。
2 结果
2.1 HaLACS1的克隆及序列分析
以向日葵cDNA为模板,扩增得到了1 980 bp的HaLACS1完整开放阅读框(图1-A)。该基因编码659个氨基酸,分子量为74.672 kD,等电点为5.82,与拟南芥AtLACS1蛋白的同源性为64%,与莴苣(Lactuca sativa)LsLACS1的同源性为79%。通过染色体定位发现其位于第4染色体63 100 598-63 107 432基因座,具有19个外显子和18个内含子(图1-B)。将HaLACS1编码的氨基酸序列与其他5个植物LACS氨基酸序列进行同源性比对,结果(图2)显示,向日葵HaLACS1蛋白序列中含有高度保守的AMP结合结构域(AMP-binding domain)和ACS信号结构域(ACS signature domain),同时HaLACS1还含有LACS酶特异的LACS特异的连接域(LACS-specific linker domain)。不同植物中LACS连接域的氨基酸序列相似性差异较大。保守结构域分析表明,HaLACS1具备LACS家族蛋白的共同特征,可以确定所克隆的基因为向日葵LACS基因。
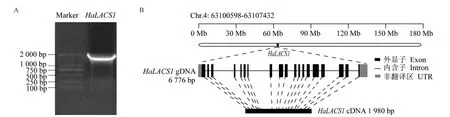
图1 向日葵HaLACS1的克隆(A)及染色体定位分析(B)Fig. 1 Cloning(A)and chromosome location(B)of the HaLACS1 gene in H. annuus

图2 不同植物LACS1蛋白序列多重比对结果Fig. 2 Multiple alignment results of LACS1 proteins from different plants
2.2 HaLACS1启动子序列分析
从向日葵基因组数据中获得了HaLACS1开放阅读框(ORF)上游2 000 bp的启动子序列,利用在线软件PlantCARE与TBtools对HaLACS1启动子顺式作用元件进行分析(图3)。发现含有TATAbox(RNA聚合酶Ⅱ结合位点,可以保证转录精确起始)、参与厌氧诱导的ARE元件(AAACCA)、参与水杨酸反应的TCA元件(CCATCTTTTT);另外还发现了GARE-motif(TCTGTTG)赤霉素、TGAelement(AACGAC)生长素及CGTCA-motif茉莉酸甲酯响应元件;除此之外,还发现低温响应元件LTR(CCGAAA)和一个参与干旱诱导的MYB结合位点元件MBS(CAACTG)。结果表明,HaLACS1可能通过激素调控来发挥调节植物生长和响应外界环境胁迫的作用。
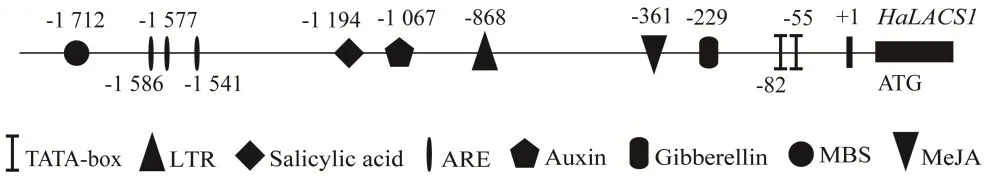
图3 向日葵HaLACS1启动子的顺式作用元件Fig. 3 Cis-acting elements of the H. annuus HaLACS1 gene promoter
2.3 HaLACS1蛋白序列的系统发育分析
系统发育分析结果(图4)表明,向日葵HaLACS1与拟南芥AtLACS1的同源性为64%,与莴苣LsLACS1同源性最高(79%)。HaLACS1与芝麻SiLACS1、蓖麻RcLACS1、花生AhLACS1、大豆GmLACS1等双子叶植物LACS1在同一进化支上,与单子叶植物水稻、玉米、小麦的LACS蛋白同源关系较远。而酿酒酵母与三角褐指藻的LACS蛋白序列聚为另一分支上,亲缘关系较近。

图4 向日葵HaLACS1蛋白与其他植物LACS1的系统进化树分析Fig. 4 Phylogenetic relationships of the HaLACS1 protein in H. annuus with other plant LACS1
2.4 HaLACS1的亚细胞定位分析
PCR扩增HaLACS1的编码区,经SpeⅠ和NcoⅠ 双酶切、测序、连接、转化,获得HaLACS1与绿色荧光蛋白(GFP)融合的表达载体pAN580-HaLACS1-eGFP。通过与携带红色荧光蛋白(RFP)的mCherry-HDEL-RFP质粒共转化拟南芥原生质体瞬时表达后,在激光共聚焦显微镜下观察定位情况。结果(图5)表明,携带有GFP的HaLACS1与携带RFP的mCherry-HDEL-eRFP在共聚焦显微镜下可以共定位,表明HaLACS1定位于内质网。
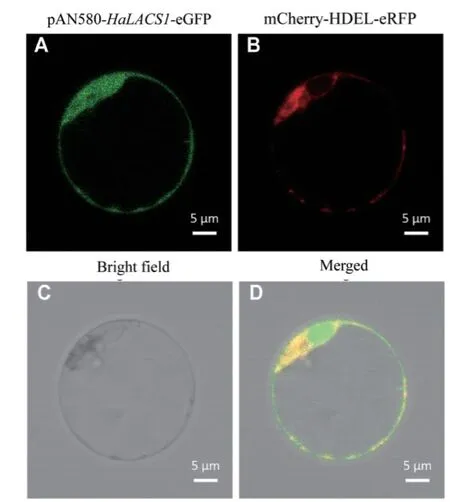
图5 HaLACS1在拟南芥原生质体中的亚细胞定位Fig. 5 Subcellular localization of the HaLACS1 protein in the protoplasts of Arabidopsis
2.5 HaLACS1组织特异性表达分析
使用qRT-PCR技术检测HaLACS1在向日葵各组织中的表达情况,结果(图6)表明,HaLACS1在向日葵根、茎、叶、子叶、花和种子中均有表达,在花和种子发育初期(10 DAF)表达量较高,其中,在种子发育早期表达量最高,是根中表达量的17倍,随后表达量下降,推测HaLACS1参与向日葵种子的油脂积累,且发挥作用的时段主要为早期,同时该基因可能还与向日葵花器官中的油脂积累有关。
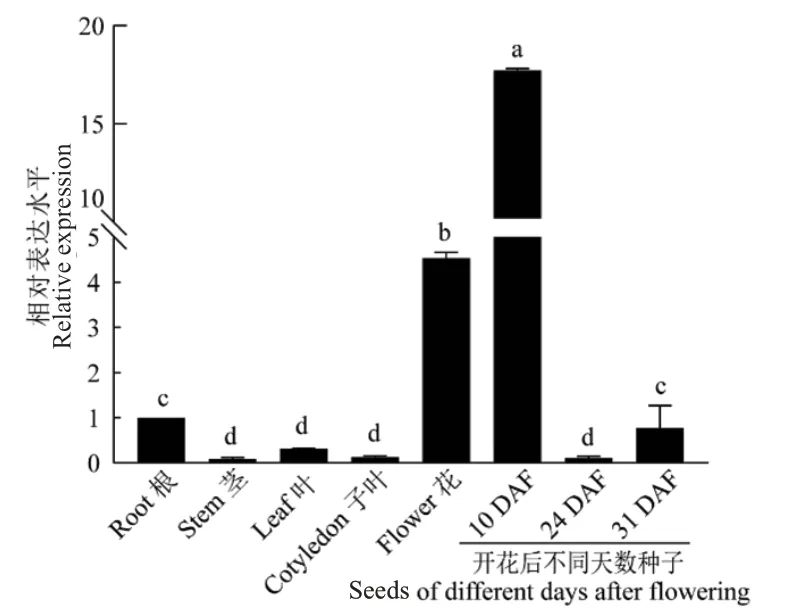
图6 HaLACS1在不同组织中的表达Fig. 6 Tissue expression analysis of the HaLACS1 gene
2.6 HaLACS1对非生物胁迫和外源ABA的响应
向日葵是一种抗旱、耐盐碱的作物,为了明确向日葵HaLACS1对干旱和盐胁迫的响应,采用qRTPCR方法分析HaLACS1在2种胁迫下的表达情况。结果(图7)表明,HaLACS1响应干旱和盐胁迫,且不同组织(根、茎、叶)具有不同的响应模式。在干旱胁迫下(图7-A),HaLACS1在茎和叶中的表达量呈“升-降-升”的趋势,茎中的表达量在干旱处理1 h时达到最高,为对照的2倍左右,叶中表达量在处理12 h时达到最高,为对照的3倍左右。根中的表达量在处理后先降低,在3 h处其表达量开始升高,于12 h处达到最高,为对照的3倍左右。
用不同浓度NaCl(0、150、200和300 mmol/L)处理向日葵幼苗,处理24 h后检测HaLACS1的相对表达量,结果(图7-B)表明,供试组织(根、茎、叶)在150 mmol/L NaCl处理下,HaLACS1的表达较对照显著上调,在根、茎和叶中的相对表达量约为对照的8-10倍。随着NaCl浓度的升高,HaLACS1在茎、叶中的表达量呈下降趋势,而在200 mmol/L NaCl胁迫后,在根中的表达下调,300 mmol/L NaCl胁迫后又显著升高,表明HaLACS1受干旱和盐胁迫诱导。
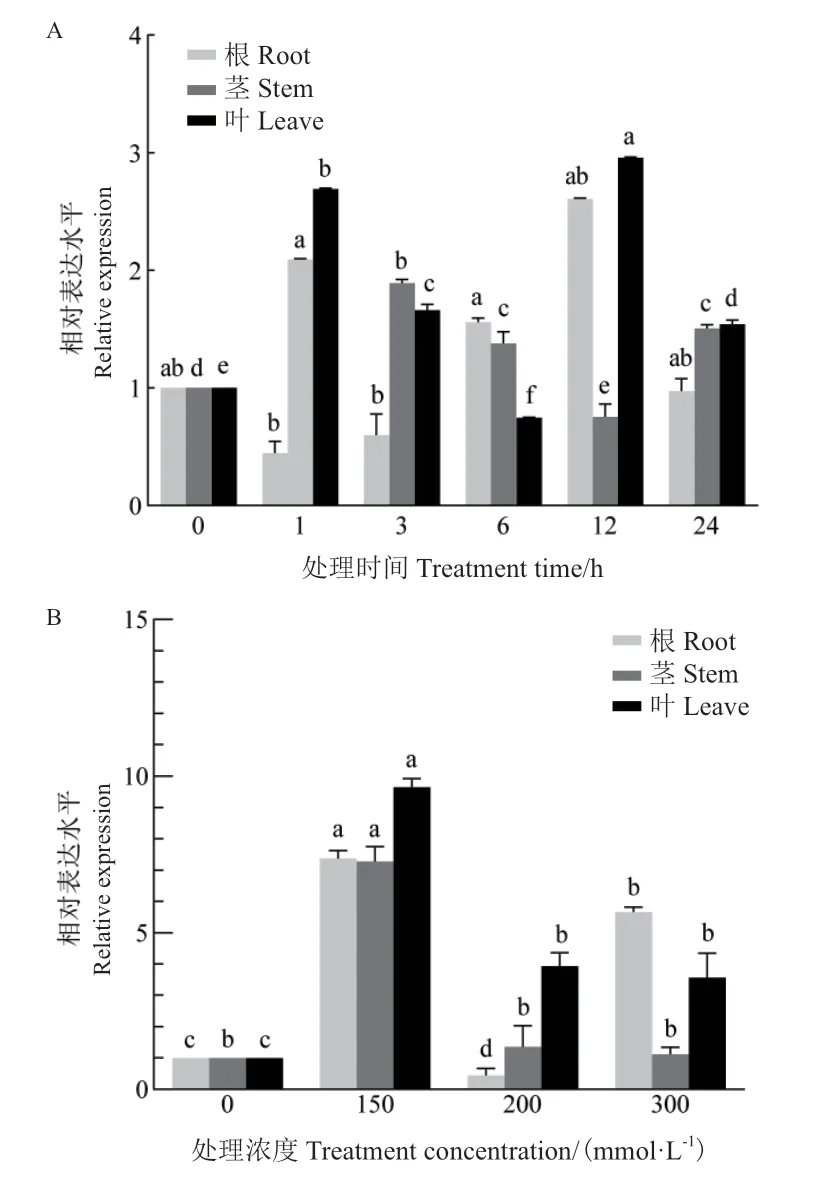
图7 向日葵在干旱(A)和盐(B)胁迫下不同组织中HaLACS1的表达分析Fig. 7 Relative expressions of the HaLACS1 gene in H. annuus tissues under drought(A)and salt stresses(B)
ABA处理后(图8),HaLACS1在根中的表达在处理1 h时下调,然后持续上调,在12 h表达量最高,约为对照的2倍;HaLACS1在茎中的表达较对照显著上调,在茎中12 h时表达量最高,为对照的5倍左右,在24 h时略有下调。在叶的表达量在ABA处理后出现“升-降-升”趋势,在12 h时表达量最高,约为对照的3倍,表明HaLACS1受ABA 诱导。

图8 向日葵在ABA处理下不同组织中HaLACS1的表达分析Fig. 8 Expression pattern of HaLACS1 in H. annuus tissues under ABA treatment
2.7 酵母功能互补试验及底物偏好性分析
为明确HaLACS1是否具有LACS酶活性,构建pYES2-HaLACS1酵母表达载体,并转化至LACS缺陷型酿酒酵母菌株YB525中,置于以脂肪酸为唯一碳源的液体培养基中培养。YB525为酵母LACS缺陷型菌株,不能在含有脂肪酸为唯一碳源的培养基中生长[25]。在培养基里添加不同链长的外源脂肪酸作为底物,根据酵母生长情况确定HaLACS1是否具有LACS酶活性,并探究HaLACS1的底物偏好性,以转pYES2空载体的菌株为对照。结果(图9)表 明,30℃震荡培养48 h后,转化pYES2-HaLACS1的酵母弥补了该突变菌株不能在以脂肪酸为唯一碳源的SCU培养基中正常生长的缺陷,恢复了其正常生长速率,说明HaLACS1具有LACS酶活性。并且转基因酵母在棕榈酸(C16:0)和油酸(C18:1)的培养基中生长速率更快,说明HaLACS1对底物 C16:0和C18:1脂肪酸具有偏好性。

图9 重组酵母的生长状况Fig. 9 Growth status of recombinant yeast cells
2.8 转基因酵母油脂含量分析
半乳糖诱导48 h后的阳性酵母菌用于转基因酵母的油脂检测,通过苏丹黑B染色法检测酵母细胞油脂含量,结果(图10)显示,pYES2-HaLACS1的酵母转化子中苏丹黑B染色程度较对照显著升高(P<0.01),表明pYES2-HaLACS1的酵母转化子相较于对照含有更高的油脂,说明HaLACS1可以提高酵母油脂含量。
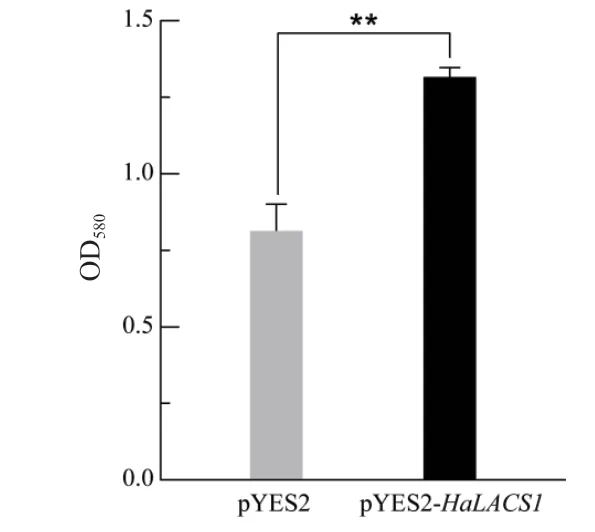
图10 重组酵母细胞的苏丹黑B染色Fig. 10 Sudan black B staining of recombinant yeast cells
3 讨论
LACS基因家族在高等植物中广泛分布,在植物甘油酯的合成与分解、角质和蜡质合成、逆境响应等多个过程中具有重要作用。已有研究表明,高等植物LACS家族蛋白定位于不同的细胞器,如内质网[26]、叶绿体[27]、过氧化物酶体[26-28]和质膜[15,25]。前期研究发现,向日葵基因组中具有13个LACS基因家族成员,本研究从向日葵基因组中克隆了一个HaLACS1基因,与拟南芥AtLACS1具有较高的相似性。构建GFP融合表达载体在拟南芥原生质体中表达发现,HaLACS1定位于内质网,这与拟南芥同源蛋白AtLACS1的亚细胞定位结果一致[11]。前人也报道了向日葵中的2个LACS基 因[29],本研究对其序列进行比对,发现已报道的这两个向日葵LACS基因与拟南芥AtLACS8和AtLACS9的相似性较高,其中向日葵HaLACS8蛋白定位于内质网,HaLACS9蛋白定位于叶绿体。并且研究表明,位于不同细胞器中的LACS蛋白具有不同的生物学功能。位于质体中的LACS蛋白与质体中从头合成的长链脂肪酸的激活有关,并参与质体和内质网之间的脂质运输[26]。定位于过氧化物酶体的AtLACS6、AtLACS7和一种大豆蛋白GmLACS2参与脂肪酸的降解[26-27]。位于内质网的AtLACS1、AtLACS2、AtLACS4和AtLACS8参与脂质的合成[12]。本研究发现HaLACS1定位于内质网,推测该蛋白可能与拟南芥中定位于内质网中的LACS蛋白具有相似的脂质合成功能。
研究表明,拟南芥AtLACS基因家族成员可在根、茎、叶、花和种子等多个器官中高表达[12-13],其表达模式上的多样化也印证了AtLACS基因功能的多样化。其中,AtLACS1在拟南芥茎、叶表皮细胞、花和发育的种子中高表达,参与拟南芥表皮蜡和角质、花粉外壁脂质和种子TAG的合成等多个生物过程[12]。AtLACS1突变体导致茎和叶的C16角质单体分别减少了37%和22%,同时,AtLACS1具有超长链脂肪酸(C20-C30)合成酶活性,尤其对C30脂肪酸具有高活性,在拟南芥表皮蜡质代谢中发挥重要作用[14]。AtLACS1和AtLACS4双突变体导致花粉败育,花粉外壁脂质显著降低[30]。AtLACS1和AtLACS9双突变体的研究表明,二者在籽粒TAG的合成功能上存在部分冗余[13],此外,AtLACS2、AtLACS4和AtLACS8也在拟南芥种子中高表达,在TAG的合成中发挥重要作用[15]。研究表明,HaLACS9在向日葵种子发育前期有较高的表达,HaLACS8主要在种子发育后期表达[29]。本研究克隆的HaLACS1在向日葵花和种子发育的前期(花后10 d)表达量较高。HaLACS1和HaLACS9虽然定位于不同的细胞器,但都在种子发育前期表现出最强的活性,说明其在向日葵种子TAG的合成功能上存在部分冗余,这与报道的拟南芥AtLACS1和AtLACS9相似[13]。而HaLACS8虽然定位于内质网,但在向日葵种子发育后期表现出高活性,推测这些基因的表达在种子发育过程中受到不同机制的调控。本研究结果推测HaLACS1参与向日葵花和种子中脂质的积累过程,尤其参与向日葵种子TAG合成早期的调控。
植物角质层的主要成分是超长链脂肪酸及其衍生物[31],是隔离外界的天然屏障,具有防止植物非气孔性失水、抵御病虫害和非生物逆境等多种功能[32]。从苹果中鉴定了11个MdLACS,其中多个MdLACS在ABA处理后表达上调,并且MdLACS1的过表达增强了苹果愈伤组织对PEG、ABA和NaCl的耐受性,表明MdLACS1是响应非生物胁迫的重要调节因子[33]。异源表达2个苹果LACS基因(MdLACS2和MdLACS4)导致拟南芥表皮细胞的渗透性降低,减少了水分散失,增强了转基因拟南芥对干旱和盐胁迫的耐受性[34]。这些结果表明LACS在植物角质合成中的作用增强了植物的抗旱性。向日葵作为一种耐盐碱、抗旱性较强的油料作物,在我国西北地区广泛种植,探究向日葵的抗逆机制具有重要意义。在拟南芥中的研究表明,干旱、盐和ABA均可诱导MYB转录因子家族中的MYB41高表达,而且可通过MYB41的下游调控基因AtLACS2来调控角质的合成,从而提高拟南芥对干旱和盐胁迫的耐受性[35]。本研究证实,ABA、PEG和NaCl胁迫均能诱导HaLACS1在向日葵茎、叶中的表达上调,并且该基因上游启动子序列中包含MYB转录因子结合位点,因此,猜测HaLACS1受MYB转录因子调控参与向日葵角质的合成,与向日葵的耐逆代谢有关,具体功能有待进一步深入研究。
尽管拟南芥LACS酶是个小的多基因家族,但对不同碳链长度的脂肪酸具有明显的底物偏好性差异,这与其功能差异和亚细胞定位是相一致 的[12,15]。棉花(Gossypium hirsutum)GhACS1偏好长链脂肪酸作为底物,尤其是油酸(C18:1)[28]。油菜(Brassica napus)BnLACS2参与种子油脂的合成,偏好肉蔻酸(C14:0)、软脂酸(C16:0)、硬脂酸 (C18:0)、油酸(C18:1)和芥酸(C22:1)为底 物[5]。这些研究表明,LACS酶在高等植物中的功能较为保守。但由于种子油脂组分和脂质代谢过程在不同植物中具有多样性的特点,LACS酶的底物偏好性在不同的植物中是不同的。为了明确向日葵HaLACS1的活性和底物偏好性,将HaLACS1转入LACS缺陷型酵母细胞YB525中进行功能互补试验,结果证明HaLACS1能够补偿酵母突变体YB525的生长缺陷,证实了HaLACS1具有长酰基辅酶A合成酶活性。通过在不同脂肪酸培养基中测定酵母的生长速率来间接分析其底物偏好性,结果表明,HaLACS1偏好软脂酸和油酸等长链脂肪酸作为底物。在对酵母油脂含量的检测中发现转基因酵母的油脂含量显著升高,结合HaLACS1定位在内质网的分析结果,说明HaLACS1参与了向日葵的油脂合成过程中软脂酸和油酸的活化。
4 结论
成功克隆了一个向日葵长链酰基辅酶A合成酶基因HaLACS1,该基因全长1 980 bp,编码659个氨基酸,分子量为74.672 kD,等电点为5.82。HaLACS1定位于内质网。该蛋白序列具有典型的酰基辅酶A合成酶特征。HaLACS1主要在向日葵种子发育早期高表达,可能参与向日葵种子油脂积累,并响应干旱、高盐和ABA的调控。HaLACS1可能参与了向日葵油脂的合成代谢,并对软脂酸和油酸具有偏好性。
