枯草芽孢杆菌K-268的分离鉴定及对水稻稻瘟病的防病效果
2022-07-22祖雪周瑚朱华珺任佐华刘二明
祖雪 周瑚 朱华珺 任佐华 刘二明
(1. 湖南农业大学植物保护学院,长沙 410128;2. 植物病虫害生物学与防控湖南省重点实验室,长沙 410128; 3. 南方粮油作物协同创新中心,长沙 410128)
稻瘟病是由稻瘟病菌(Magnaporthe oryzae)引起的灾难性病害,每年造成全球水稻产量损失可养活6 000万人[1]。目前,防治稻瘟病的主要策略是利用抗病品种和化学农药。尽管利用抗瘟品种是防治稻瘟病最安全有效的措施,但选育抗病品种的周期长,加之抗病品种与稻瘟病菌存在特异性互作,一般抗瘟品种大面积种植3-5年会抗性“丧失”[2]。化学防治主要是通过化学杀菌剂来防治稻瘟病,在稻瘟病流行年份需要多次施用才能达到一定的防治效果,由此会带来潜在的稻米食用安全问题。而生防微生物分布广泛,对环境和人类影响较小,因此,稻瘟病生防微生物的研发成为了研究热点[3]。
生物防治是微生物农药的发展趋势,用于稻瘟病菌生物防治的芽孢杆菌主要包括短小芽孢杆菌(Bacillus pumilus)、地衣芽孢杆菌(B. licheniformis)、解淀粉芽孢杆菌(B.amyloliquefaciens)、蜡样芽孢杆菌(B. cereus)和枯草芽孢杆菌(B. subtilis)等[4]。Ghasemi等[5]从伊朗高盐度生态中分离的短小芽孢杆菌SG2 产生的两种几丁质酶(ChiS 和 ChiL),对稻瘟病菌、禾谷镰刀菌和立枯丝核菌等多种植物病原菌显示出抗菌活性,首次报道了短小芽孢杆菌的双功能几丁质酶/溶菌酶的作用。Tendulkar等[6]从土壤中分离的地衣芽孢杆菌BC98除了对稻瘟病菌(M. oryzae)表现较高的抗菌活性,还对水稻纹枯病、玉米大斑病等有抑制效果。表面活性素是芽孢杆菌产生的一类重要脂肽,在农业制药领域占有重要地位,Wu等[7]从海洋微生物中分离出了一株对稻瘟病菌有抑制作用的海洋芽孢杆菌CS30,并进行了抗真菌活性研究,其代谢物表面活性素明显降低了稻瘟病菌(M. oryzae)对植物的致病性;Zhang等[8]分离的海洋芽孢杆菌对稻瘟病菌(M. oryzae)的抑菌效果显著,从中分离出的活性代谢物鉴定为芬霉素家族的环脂肽(CLPs),命名为芬霉素 BS155,其通过诱导膜损伤和细胞器功能障碍、破坏 MMP、氧化应激和染色质凝聚而起作用,从而抑制稻瘟病菌(M. oryzae)菌丝生长。冯蓉等[9]从草莓根际土壤中分离筛选的解淀粉芽孢杆菌 F11,对水稻稻瘟病病菌、猕猴桃软腐病菌、烟草黑胫病菌和烟草炭疽病菌等多种常见病原菌的抑制效果达70%以上;由云南省星耀生物制品厂、云南农业大学和中国农业大学共同研发的微生物农药产品“百抗”,是我国第一个在水稻上获得登记的芽孢杆菌制剂,其有效成分为枯草芽孢杆菌B908,具有防治防范广效果好等优点,对水稻纹枯病和烟草青枯病防治效果最佳均达70%[10-11]。中国农药信息网(http://www.chinapesticide.org.cn/)的行业数据显示:目前我国利用芽孢杆菌研发并登记投入使用的微生物杀菌剂有152种,其中用于防治稻瘟病的杀菌剂有26种。
为筛选出对稻瘟病菌有高效拮抗效果的生防菌,本实验指示菌为水稻稻瘟病菌,从感病品种K020268感病稻丛的健康稻株的叶片中分离获得内生菌株263株,经平板对峙法从叶片中筛选出1 株对稻瘟病菌具有较好拮抗作用的菌株K-268。结合形态学观察、生理生化鉴定及 16S rRNA和 gyrA序列分析对其进行了菌株鉴定,初步测定了其对不同植物病原菌的抑菌谱;并研究了该菌在不同温度、pH和NaCl浓度培养下的生物学特性;通过室内离体水稻叶片和盆栽活体实验,评价了该菌株的发酵液对稻瘟病的防治效果,以期为植物病害生物防治药剂研发提供理论基础。
1 材料与方法
1.1 材料
1.1.1 供试病原菌 水稻稻瘟病菌(Magnaporthe oryzae)、玉米大斑病菌(Exserohilum turcicum)、水稻纹枯病菌(Rhizoctonia solani)、油菜菌核病菌(Sclerotinia sclerotiorum)、辣椒枯萎病菌(Fusarium oxysporum)、黄瓜疫霉病菌(Phytophthora melonis)、茭白镰刀菌(Fusarium graminearum)、香樟炭疽病菌(Colletotrichum gloeosporioides)、油菜菌核病菌(Sclerotinia sclerotiorum)、禾谷镰刀菌(Fusarium graminearum)、茄 子 根 腐 病 菌(Fusarium solani)、草莓灰霉病菌(Botrytis cinerea)、柑橘沙皮病菌(Diaporthe citri)、棉 花 黄 萎 病 菌(Verticillium dahlia)、烟草赤星病菌(Alternaria alternate)、水稻恶苗病菌(Fusarium moniliforme)均保藏于湖南农业大学植物病原微生物及水稻病害实验室。
1.1.2 水稻品种 感稻瘟病品种湘晚籼12号来自湖南金色农丰种业有限公司,种植于湖南农业大学植物保护学院教学基地温室。
1.2 方法
1.2.1 样品采集 样本采集于湖南桃江病圃(湖南省益阳市桃江县高桥乡罗溪村28°22′29.2584″E,112°2′27.4848″N),从感病水稻品种K020268的病丛中采集健康植株。
1.2.2 拮抗细菌的分离与纯化 将水稻样品的根部、茎秆和叶片剪成3-5 cm的小段,表面消毒后置于灭菌的研钵中,加入适量的液氮捣碎研磨,再加入10-20 mL无菌水,静置30-35 min,10-1-10-7的梯度进行稀释,每个浓度取0.2 mL液体均匀涂布于牛肉膏蛋白胨固体培养基(beef extract peptone AGAR medium)平板上,重复3次,倒置于28℃恒温培养箱中培养24-48 h。待平板内长出单菌落后,挑取不同形态的细菌单菌落于新的NA平板上划线纯化。
1.2.3 拮抗稻瘟病菌细菌的筛选 参照平板对峙法[12]对纯化的菌株进行筛选,即在9 mm的PDA平板中央接种7 mm稻瘟菌菌饼,再将纯化的菌株划线接种于菌饼两侧3-5 cm处,以不接菌株的平板为对照组,每个处理3次重复。置于28℃恒温培养箱中倒置培养2-7 d,观察并测量有明显抑菌带的菌落直径。根据以下公式计算菌株抑菌率,筛选出对稻瘟病菌菌丝的生长抑制效果较好的菌株。

式中:DCK为对照组菌落生长直径(cm);Dd为处理组菌落生长直径(cm)。
1.2.4 拮抗菌株的抑菌谱测定 采用平板对峙法测定菌株K-268对玉米大斑病菌、水稻纹枯病菌和油菜菌核病菌等14株供试植物病原菌的抑菌效果。
1.2.5 拮抗细菌的分类鉴定 (1)拮抗细菌K-268的生物学鉴定。参照《伯杰细菌鉴定手册》[13]和《常见细菌系统鉴定手册》[12]的方法观察单个菌落的形态、大小、颜色、干湿、光滑或粗糙等。对拮抗细菌K-268进行革兰氏染色、接触酶、硝酸还原、明胶的液化、硫化氢、酶的水解、吲哚实验、VP实验、甲基红实验、石蕊牛奶实验、苯丙氨酸脱氢酶等多项生理生化特征分析试验。每处理重复3次。
(2)16S rRNA序列分析。用细菌基因组提取试剂盒提取菌株K-268的 DNA,用 1% 的琼脂糖凝胶电泳检测菌株DNA完整性,16S rRNA测序进行菌种鉴定的通用引物为 27F:5′-AGAGTTTGATCCTGGCTCAG -3′ 和 1492R:5′-CTACGGCTACCTTGTTA- CGA -3′,gyrA测序进行菌种鉴定的通用引物为42F: 5′-CAGTCAGGAAATGCGTACGTCCTT-3′和1066R:5′-CAAGGTAATGCTTCCAGGATTGCT-3′,25 μL PCR扩增反应体系12.5 μL Super Mix,上下游引物各1 μL,1 μL DNA,9.5 μL ddH2O。PCR反应条件预变性98℃ 2 min(变性98℃ 10 s,退火53℃ 10 s,延伸72℃ 20 s)35个循环,延伸72℃ 2 min,4℃保存。将扩增产物送至湖南擎科生物有限公司进行测序,将所得序列在 NCBI的Genbank数据库中进行同源性搜索比对,并利用 MEGA5.0 软件构建系统发育树。
1.2.6 菌株K-268的生物学特性 (1)生长曲线测定。将菌株K-268进行两次活化,在第二次活化 24 h 时将菌悬液取 1 mL 转接入200 mL NB 培养液的三角瓶(300 mL)中,180 r/min 28℃培养 24 h,测定其OD600的值;用无菌水将菌株的OD600稀释相等,取1 mL接入200 mL NB 培养液的三角瓶(300 mL),180 r/min 28℃培养,从接种第2小时开始,每隔 2 h 取一次样,一直测到58 h,每次取样均用分光光度计测量OD600值,并采用稀释涂布法测定样品中的有效活菌数,测定均重复3次,计算菌液浓度并绘制生长曲线。
(2)生长温度范围测定。取 1 mL 接种于NB 培养液中,设置平行实验,分别置于4℃、10℃、15℃、20℃、25℃、28℃、30℃、35℃、37℃、40℃、45℃、50℃和60℃环境下黑暗培养7 d,每组3次重复。在培养第24小时时取样,测定其 OD600值和有效活菌数。
(3)生长pH范围测定。配制pH分别为 2、3、4、5、6、7、8、9、10、11、12、13 的NB培养基,将1 mL 种子液接种于不同 pH 的培养液中,180 r/min、28℃ 培养24 h后取样,测定样本的OD600值,每组3次重复。
(4)氯化钠溶液质量分数对细菌生长的影响。配置NaCl 浓度分别为 0.5%、1%、2%、5%、7%、10%和15%(W/V)的NB培养基,再将1 mL 种子液接于其中,180 r/min、28℃ 培养 24 h 后取样,测定样本的OD600值,每组3次重复。
1.2.7 菌株K-268对水稻叶瘟的防治效果评价 离体接种:以易感稻瘟病的湘晚籼12号为实验材料,待水稻长至5叶1心时,采用针刺离体接种法[12]。即剪下约6-7 cm的新鲜水稻叶片,用接种针对离体叶片正面轻刺造成 3个微刺伤口,在伤口上接种稻瘟病菌5 μL孢子悬浮液,叶片保存在含有0.1% 6-苄基氨基嘌呤的无菌水培养皿中。采用浓度为6×109CFU/mL、6×108CFU/mL和6×107CFU/mL的K-268发酵液,设置两个处理组,预防组(-24 h):分别用NB培养液、清水、75%三环唑(WP)750倍稀释液及不同浓度发酵液浸泡叶片5 min分钟左右并晾干,24 h后接种稻瘟病菌分生孢子悬浮液。治疗组(+24 h):先接种稻瘟病菌分生孢子悬浮液,24 h后分别用NB培养液、清水、75%三环唑(WP)750倍稀释液及不同浓度发酵液浸泡叶片5 min分钟左右并晾干。接种后的培养皿置于 28℃、相对湿度 100%环境下,黑暗处理 24 h后,再按光照和黑暗交替培养,直至水稻叶片发稻瘟病,根据整体发病情况计算发病率[14]。
活体盆栽接种:以易感稻瘟病的湘晚籼12号为试材,待水稻长至3叶1心时采用喷雾接种法进行实验。设计3个处理:(1)对照组,仅喷施稻瘟病菌孢子悬浮液;(2)预防组(-24 h),将15 mL浓度为6×109CFU/mL、6×108CFU/mL和6×107CFU/mL的K-268菌株发酵液均匀地喷施在植株叶片上,24 h后再喷施稻瘟病菌孢子悬浮液。(3)治疗组(+24 h),先将稻瘟病菌孢子悬浮液喷洒在水稻叶片表面,保湿24 h再均匀喷洒10 mL浓度为6×109CFU/mL、6×108CFU/mL和6×107CFU/mL的K-268菌株发酵液。以清水、NB培养液、75%三环唑可湿性粉剂(WP)750倍稀释液和40%稻瘟灵(EC)可湿性粉剂500倍稀释液为对照,每处理重复3次,置于25-32℃温室条件下生长,光周期为12 h,温相对湿度范围为85%-100%。叶瘟的分级标准参照 GB/T 15790-2009《稻瘟病测报调查规范》[15]。

1.2.8 数据统计与分析 试验数据采用 Excel 2010、SPSS 17、Origin2018和MEGA5.0统计软件进行处理分析和构建系统发育树。
2 结果
2.1 拮抗细菌的分离与筛选
采用稀释涂布平板法从感稻瘟病品种K020268健康植株的叶片、茎杆和根部共分离纯化出菌株263株,其中从叶片中分离获得的菌株K-268对稻瘟病菌的抑制效果最好,对稻瘟病菌菌丝生长的抑制率达86.3%±0.70%(图1)。
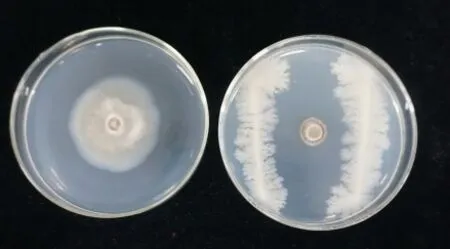
图1 菌株 K-268对稻瘟病产生的拮抗作用Fig. 1 Antagonistic effect of strain K-268 on M. oryzae
2.2 拮抗菌株K-268对不同植物病原菌的抑菌作用
菌株 K-268对14株供试的病原真菌及卵菌均有抑制效果(表1),其中对水稻纹枯病菌的抑制效果最为显著,抑制率达79.5% ± 0.67%;对辣椒枯萎病菌和水稻恶苗病菌的抑制率达到 60% 以上;对禾谷镰刀菌、油菜菌核病菌、黄瓜疫霉病菌3 种病原菌的抑制率均达50%以上;对柑橘沙皮病菌、玉米大斑菌、香樟炭疽病菌、烟草赤星病菌等病原菌也有不同程度的抑制作用。

表1 菌株 K-268对不同植物病原菌的抑菌作用Table 1 Bacteriostatic effects of strain K-268 on different plant pathogens
2.3 拮抗菌株的形态及生理生化特征
在28℃、黑暗的条件下培养48 h,发现K-268菌落乳白色,形态不规则,边缘隆起,粗糙不透明,表面干燥,有皱襞(图2-A);通过扫描电镜观察菌体形态,菌体呈杆状,革兰氏呈阳性(图2-B)无荚膜,有鞭毛,大小为(0.6-0.8)μm ×(2.0-3.0)μm,芽孢(0.6-0.9)μm ×(1.0-1.5)μm,位于菌体中央或稍偏,芽孢形成后菌体不膨大芽孢成椭圆形(图2-C)。菌株K-268的生理生化特征表明(表2),接触酶、吲哚试验阳性,可还原硝酸盐,使明胶液化和石蕊牛奶胨化;硫化氢试验、V. P和甲基红试验呈阴性,以上特征符合《常见细菌系统鉴定手册》中关于枯草芽孢杆菌的描述。

表2 菌株K-268的生理生化特性Table 2 Physiological and biochemical characteristics of strain K-268
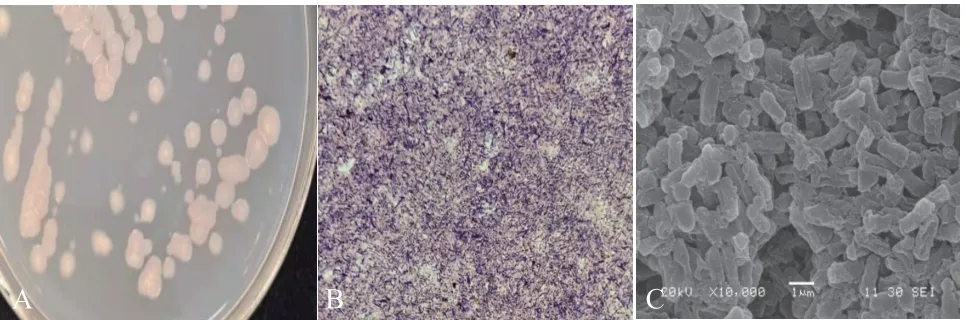
图2 K-268菌株菌落形态Fig. 2 Colony morphology of K-268 strain
2.4 拮抗菌株的16S rRNA和gyrA序列分析
对菌株K-268的 16S rRNA和gyrA序列进行测序,经PCR扩增获得部分有效序列长度分别为1 422 bp和947 bp。将序列分别提交上传至 GenBank 中,进行 BLAST 同源序列检索比对,使用 MEGA5.0软件中的的 Neighbor-Joining Tree 法构建系统发育树分析。结果显示菌株K-268的16S rRNA序列与枯草芽孢杆菌 B.subtilis IAM12118的序列相似性达89%(图3),菌株K-268的gyrA序列同样与枯草芽孢杆菌 B.subtilis SRCM102754的同源性为100%(图4),结合形态学观察、生理生化特征及16S rRNA和gyrA基因系统发育树分析,将K-268菌株鉴定为枯草芽杆菌。

图3 K-268菌株16SrRNA系统发育树Fig. 3 16SrRNA phylogenetic tree of K-268 strain

图4 K-268菌株gyrA系统发育树Fig.4 gyrA phylogenetic tree of K-268 strain
2.5 K-268菌株的生物学特性
由菌株K-268生长曲线(图5-A)可知,菌株 K-268在14 h内微生物数量变化最小,在12 h-18 h时OD值逐渐升高;12-32 h为对数期生长阶段细菌数呈几何级数比数增长是选育菌种的最佳时期;时长为32 h时活菌数量最多达到K值,说明菌液中的次生代谢物持续积累,并产生次级代谢产物;32 h之后随着时间的延长繁殖率小于死亡率,活菌数急剧下降,释放代谢产物;而18-48 h OD值与浓度呈正比关系。48 h时OD达到最大浓度最高,48 h后处于动态平衡。
根据《常见细菌系统鉴定手册》可知枯草芽孢杆菌的最适温度为30℃、pH5.7-7.8、最适盐浓度质量分数在2%-7%之间,由图5-B可见,菌株K-268的最适温度在10℃-37℃之间无显著差异性,随着温度的上升OD值呈下降趋势,但在≥50℃高温条件下仍能生长且保持代谢活跃;随着pH增加菌液的OD值逐步升高pH6时到达峰值,当pH>6 时OD值呈下降趋势(图5-C),即菌株K-268的最适生长pH 6,适合生长pH为6.0-7.0;最适NaCl浓度为0-3%(图5-D)

图5 菌株K-268的生物学特性Fig. 5 Biological characteristics of strain K-268
2.6 菌株K-268对稻瘟病的防治效果
室内离体实验表明,不同浓度的K-268发酵液对离体接种水稻叶片都有抑制作用(图6,表3),经清水或NB培养液对照处理的叶片,发病率达95%-98.77%;经100倍稀释液(6×107CFU/mL)、10倍稀释液(6×108CFU/mL)、原液(6×109CFU/mL)K-268发酵液处理的水稻叶片,预防组和治疗组的发病率明显低于与对照组;从表3可以看出:经稀释750倍75%三环唑(WP)处理的水稻叶片发病率为12.34%-17.28%,菌株 K-268浓度为6×107CFU/mL时,拮抗效果相对最好,发病率为14.81%-23.46%,与750倍稀释液75%三环唑(WP)的效果基本相当。此外,在预防组中750倍稀释液75%三环唑(WP)与浓度6×107CFU/mL相比,后者因浓度过低接近于清水导致发病率与处理组相比无显著差异;但在治疗组中浓度6×109CFU/mL、6×108CFU/mL和750倍稀释液75%三环唑(WP)无显著差异。

表3 不同浓度的K-268发酵液对水稻稻瘟病的离体拮抗效果Table 3 In vitro antagonistic effects of different concentrations of K-268 fermentation broth on rice blast
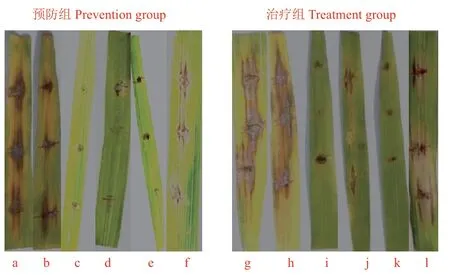
图6 菌株K-268对叶瘟的防治效果(离体接种)Fig. 6 Control effect of strain K-268 on leaf blast(indoor detached-leaf inoculation)
活体喷雾接种实验(图7,表4)表明,在预防组中菌株K-268 对水稻瘟病有较好的防治效果,原液(6×109CFU/mL)因渗透压的影响会导致植株生长萎蔫,而稀释100倍(6×107CFU/mL)浓度过低防治效果不佳,因此稀释10倍(6×108CFU/mL)时对抑制稻瘟病菌的生长效果最佳,其相对防效为59.00%,与750倍稀释液75%三环唑(WP)和500倍稀释液的40%稻瘟灵(EC)的防治效果基本一致;治疗组中750倍稀释液75%三环唑(WP)和500倍稀释液40%稻瘟灵(EC)的相对防效分别为67.20%和51.00%,经不同浓度对稻瘟病的相对防效分别为45.50%、60.23%、38.9%与750倍稀释液75%三环唑(WP)和500倍稀释液的40%稻瘟灵(EC)相比存在差异性。结合两组的结果相比较,先喷施菌株K-268发酵液24 h后再接种稻瘟病菌孢子悬浮液的防治效果好。

表4 菌株K-268对水稻稻叶瘟的盆栽防治效果Table 4 Control effect of strain K-268 on rice leaf blast in pot

图7 菌株K-268对叶瘟的防效局部图(活体接种)Fig.7 Partial view of the control effect of strain K-268 against leaf blast(indoor live inoculation)
3 讨论
目前,用于防治植物病害的细菌微生物主要是假单孢菌属(Pseudomonas spp.)和芽孢杆菌属(Bacillus spp.),其中芽孢杆菌因其具有高度抗逆能力,能产生多种抗菌肽和脂类,在保护生态环境方面有良好的环境兼容性、不易产生抗药性、具有抑菌广谱性和极强的抗逆性等优点,成为了当下植物病害生物防治领域的主要研究热点[16]。日本学者分离得到的枯草芽孢杆菌RB14和NB22对茄子根腐病和辣椒枯萎病有很强的抑制作用[17]。Cavaglieri等[18]分离出的贝莱斯芽孢杆菌 RC8、RC9 和 RC11对玉米轮枝镰孢菌有较好的拮抗效果。周瑚等[10]等分离鉴定的特基拉芽孢杆菌JN-369对其进行室内离体接种实验,结果表明,预防组和治疗组的发病率仅为11.04%-21.85%;李瑾等[19]进行了解淀粉芽胞杆菌HR-2对水稻盆栽实验,结果显示,该菌发酵液稀释10倍和 100倍对水稻稻瘟病的防治效果分别为 63.81% 和 40.77%。Sha等[1]从水稻非根际土壤中分离的解淀粉芽孢杆菌S170和短小芽孢杆菌S9对稻瘟病菌的抑制效果显著,并对11种植物病原菌真菌引起的植物病害有抑制作用,其对水稻离体和室内活体叶片的防效分别为75.5%和74.6%;Chen等[3]研究发现的贝莱斯芽孢杆菌菌株ZW-10培养液对水稻离体叶片的抑制效果预防组和治疗组与清水对照组相比分别减少了58.2%和53.3%;因此可看出,拮抗菌株的筛选和生防制剂的研发成为防治植物病害的一种安全、有效的途径。
菌株K-268采集于湖南省益阳市桃江县高桥乡罗溪村,试验土壤pH值为6.3,该菌株可在 pH 13.0 和盐浓度质量分数为 15%的 NB培养基中亦能生长。由《伯杰细菌鉴定手册》可知,枯草芽孢杆菌的最适生长温度为30℃,最适pH为7,最适盐浓度质量分数范围在2%-7%之间,张国庆等[20]分离出的拮抗芽孢杆菌 P-25 菌株在盐度范围为 2%-10%、pH为 5.0-8.0;赵庆新等[21]研究报道的枯草芽孢杆菌ZQX8 的盐浓度范围为5%-10%、pH 7.0-9.0,常见作物的最适生长温度为20℃-30℃、pH为5-8[22]。本研究中的K-268菌株在60℃高温条件下仍能存活,pH为2-13亦能生长,且耐盐范围广,即该菌株具有耐高温和耐盐性,表现出较强的环境适应能力,因此该拮抗菌株能够广泛用于一般作物的自然生长环境条件,同时也有利于生物制剂的制备、改良土壤、降低盐碱度以及在轻度盐渍化环境中的施用。此外,K-268菌株除了对水稻稻瘟病、纹枯病、恶苗病3个重要病害有较强的抑制作用之外,还对辣椒枯萎病、黄瓜疫霉病、油菜菌核病等12种植物病原菌有不同程度的抑制作用,与杨杰等[23]、Zhang 等[24]、余闲美等[25]、Wijtzes等[26]报道的枯草芽孢杆菌相比抑菌谱更广,对稻瘟病的防治效果更佳;与孔建等[27]分离获得的枯草芽孢杆菌B-903对棉苗病害、菠菜枯萎病、苹果病害的盆栽实验的抑菌广谱性相似,可能是菌株K-268分泌某些抗菌物质对植物病原菌起到抑菌作用,具体分泌那些抗拒物质尚未明确,还需进一步研究。刘连盟[28]的枯草芽孢杆菌H158对水稻稻瘟病的防治效果在38.4%-50.1%之间,与化学杀菌剂混用性能良好。朱华珺等[29]室内活体实验表明枯草芽孢杆菌JN005的胞外抗菌物质100倍稀释液对稻瘟病的防治效果与40%的稻瘟灵(EC)相似但是不如75%(WP)的三环唑。而经K-268菌株发酵液 10倍稀释液处理的水稻叶片不管是离体还是活体发病率明显降低,且活体接种预防组中的防治效果与500倍稀释液40%稻瘟灵(EC)和750倍稀释液75%三环唑(WP)的防治效果基本相近,且对水稻叶片有一定的保护作用。因此,鉴于菌株K-268的实用性可进行大量生产和田间应用,但推广还需明确该菌的拮抗物质、作用机理和田间稳定性实验等研究。
4 结论
从患病稻丛的健康水稻植株叶片中分离获得的内生菌株K-268,对水稻稻瘟病菌有较强的抑制作用,同时对15株供试植物病原菌均有明显抑制作用,对水稻纹枯病菌(R. solani)、水稻恶苗病菌(F. moniliforme)、辣椒枯萎病菌(F. oxysporum)和茄子根腐病菌(F. solani)的抑菌效果均达到60%以上,表现出广谱的抗菌活性。结合菌株形态特征、生理生化特征及16S rRNA和gyrA基因系统发育树分析,将菌株K-268鉴定为枯草芽孢杆菌(Bacillus subtili)。其对稻瘟病的盆栽防治效果为59.00%-60.23%,与40%稻瘟灵和75%三环唑的防效基本相当。
