GRAS转录因子AtSCL4负调控拟南芥应答渗透胁迫
2022-07-22徐红云张明意
徐红云 张明意
(贵州民族大学生态环境工程学院,贵阳 550025)
非生物胁迫严重影响植物的生长发育,造成农林生产的重大损失[1]。渗透胁迫是限制植物生长、分布,影响作物产量的重要因素之一,会导致细胞水分缺失而引起损伤[2]。干旱、盐害、低温和冰冻灾害等都会引起渗透胁迫。为了适应渗透胁迫,植物在生理生化方面会发生改变,如关闭气孔、增加过氧化物酶活、积累渗透物质等,以适应逆境胁迫[3-4]。同时,渗透胁迫会诱导大量抗逆基因的表达,来调控植物的生理变化。
GRAS家族为植物体内一类非常重要的转录因子,GRAS蛋白有1个可变的N末端区域和1个高度保守的C末端区域。GRAS蛋白含有5个关键结构域:LHR-I、VHIID、LHR-II、PFYRE和SAW[5]。拟南芥GRAS蛋白可分为10个亚家族,即LISCL、AtPAT1、AtSCL3、DELLA、AtSCR、AtSHR、AtLAS、HAM、AtSCL4/7、DLT[6]。截至目前,已从多种植物中鉴定出多个GRAS家族成员,如在杨树、拟南芥和水稻中分别鉴定出有106、34和60个GRAS家族基因[7],此外,在烟草[8]、青梅[9]、大白菜[10]、番茄[11]、莲藕[12]等植物中也分别鉴定出GRAS基因。
GRAS转录因子参与调控植物应答各种非生物胁迫。例如,水稻OsGRAS23可被干旱、NaCl和茉莉酸诱导表达,并且OsGRAS23过表达转基因植株可通过减少H2O2含量和促进抗氧化相关基因的表达,进而提高植物抗旱性和抗氧化性[13]。山葡萄VaPAT1转入拟南芥,转基因植株可通过增加脯氨酸和可溶性糖含量,提升植株的耐寒性、耐旱性和耐盐性;此外,VaPAT1可诱导抗逆相关基因的表达,如AtSIZ1、AtCBF1、ATATTR1、MYB34、AtMYC2、AtCOR15A、AtRD29A和AtRD29B等[14]。杨树GRAS蛋白PeSCL7通过增强α-淀粉酶和超氧化物歧化酶活性,提高了植物应对干旱和高盐的耐受性[15]。盐穗木HcSCL13基因的过表达提高植株的耐盐性[16]。尽管从不同的植物中克隆出许多GRAS基因,但GRAS家族基因调控植物响应渗透胁迫的生理和分子机制还有待进一步深入研究。
AtSCL4为GRAS转录因子家族中非常重要的一个成员,但目前对其功能研究较少。本研究通过比较野生型和AtSCL4突变体拟南芥应对渗透胁迫的抗逆能力差异,并分析不同植株间生理及相关抗逆基因的表达情况,为GRAS蛋白在非生物胁迫中的功能研究奠定基础。
1 材料与方法
1.1 材料
野生型拟南芥(Arabidopsis thaliana,WT)为Columbia(Col)生态型,由东北林业大学林木遗传育种实验室提供。AtSCL4(AT5G66770)T-DNA插入突变体植株(SALK_031569)购买自拟南芥生物资源中心(Arabidopsis Biological Resource Center,ABRC)。
1.2 方法
1.2.1 AtSCL4受渗透胁迫诱导表达分析 3周龄的野生型拟南芥用200 mmol/L甘露醇处理3、6、12、24和48 h后分别取样,以0 h清水处理为对照。根和叶分开取样后,用液氮速冻后放-80℃保存。提取植株RNA,利用qRT-PCR方法测定AtSCL4在不同处理条件下及不同组织中的表达量。
1.2.2 非生物胁迫耐受实验 用10%次氯酸钠消毒WT和AtSCL4纯合突变体的种子,放置在添加200 mmol/L甘露醇的1/2 Murashige Skoog(MS)培养基上培养,7 d后计算幼苗发芽率。将WT和AtSCL4突变体的种子放置在1/2 MS培养基上生长4 d后,将幼苗转移至含200 mmol/L甘露醇的1/2 MS培养基上培养10 d,测定苗根长和鲜重。
1.2.3 逆境相关生理指标测定 气孔孔径测定:将3周龄拟南芥叶片下表皮剥离,浸泡在30 mmol/L KCl和10 mmol/L MES-KOH(pH6.15)的 溶 液 中, 22℃培养2.5 h,诱导气孔开放,然后添加200 mmol/L甘露醇,再孵育2 h。在光学显微镜下(Olympus BX43,Japan)观察气孔孔径,并使用IMAGEJ 1.36b软件测量气孔开放度。
叶片失水率测定:将3周龄拟南芥的叶片剥离植株后立即称量鲜重(fresh weight,FW),然后每30 min称一次分离叶片失水后重量(leaf desiccated weight,LDW)。4 h后,将叶片置于80℃烘箱中过夜后称量干重(dry weight,DW)。失水率(water loss rates,WLR)计算公式为:WLR(%)=[(FWLDW)/(FW-DW)]×100%。
叶片组织染色:用水和200 mmol/L甘露醇处理3周龄的野生型和突变体植株24 h后取叶片,浸泡在3,30-二氨基联苯胺(diaminobenzidine,DAB,1.0 mg/mL)和硝基四氮唑蓝(nitroblue tetrazolium,NBT,1 mg/mL)溶液中染色,保持真空15 min后于黑暗处反应6 h,然后用95%乙醇于沸水浴脱色。
脯氨酸、甜菜碱和抗氧化酶活测定:用200 mmol/L甘露醇处理3周龄野生型和突变体植株3 d后,采用ELISA试剂盒测定脯氨酸、甜菜碱、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化物酶(peroxidase,POD)等指标。
1.2.4 抗逆基因的qRT-PCR检测 用TRIzol试剂(Invitrogen)提取植物总RNA,用TransScript One-Step gDNA Removal and cDNA Synthesis SuperMix kit(TRANSGEN BIOTECH)试剂盒合成cDNA,并稀释10倍用于下一步试验。qRT-PCR反应体系包括10 μL TransStart-Top-Green-qPCR-SuperMix(TRANSGEN BIOTECH)、10 μmol/L正 向 和 反 向 引 物 和2 μL cDNA稀释产物。采用荧光定量PCR仪进行产物扩增(qTOWER3,Analytikjena,德国)。qRT-PCR反应条件为94℃ 30 s;94℃ 10 s,58℃ 30 s,72℃ 40 s,79℃ 1 s,read plate,44个反应循环;55-99℃, 每0.5℃维持1 s。选择Act7(AT5G09810)和Tub2(AT5G62690)为内参,对目标基因表达进行标准化。并用2-ΔΔCT方法计算抗逆基因的相对表达量,用-ΔΔCT方法计算AtSCL4在突变体中的表达情况,qRT-PCR的引物见表1。

表1 qRT-PCR所用引物序列Table 1 Primer sequences used in qRT-PCR
1.2.5 基因序列号 本文的序列数据可以在拟南芥信息资源(http://www.arabidopsis.org/)中找到下列基因序列号:AtSCL4(AT5G66770)、ATMYB61(AT1G09540)、P5CS1(AT2G39880)、BADH(AT3G48170)、SOD1(AT1G08830)、PER4(AT1G14540)。
2 结果
2.1 AtSCL4受渗透胁迫诱导表达分析
利用qRT-PCR方法分析AtSCL4是否受渗透胁迫所诱导(图1),与未处理对照相比,甘露醇胁迫下,AtSCL4在根和叶中的表达量明显升高,在叶片中的表达水平随处理时间变化逐渐升高并在12 h时达到高峰,在根系当中在24 h时达到高峰。结果表明,AtSCL4受渗透胁迫诱导表达明显。
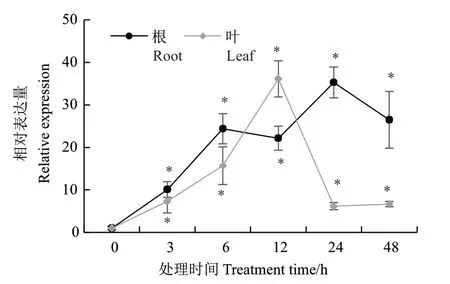
图1 甘露醇处理下AtSCL4基因在不同时间段的表达分析Fig. 1 Expression profiles of AtSCL4 at different times in response to mannitol stress
2.2 AtSCL4负向调控植物应对渗透胁迫的耐受性分析
运用qRT-PCR的方法验证筛选出的AtSCL4拟南芥纯和突变体(图2),KO1-KO8株系的表达量均低于野生型对照,说明T-DNA的插入阻碍了AtSCL4的表达,并且KO1、KO6和KO8株系中AtSCL4的表达量显著降低(P<0.05),被用作后续试验。
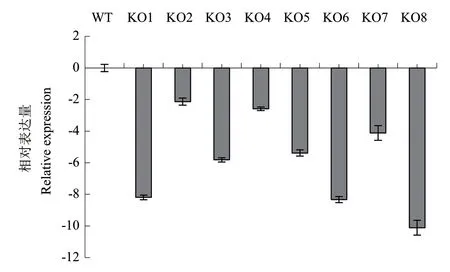
图2 AtSCL4在突变体中的表达量分析Fig. 2 Expression analysis of AtSCL4 in mutants
比较野生型拟南芥(WT)和AtSCL4突变体株系(KO1、KO6、KO8)在渗透胁迫下种子的萌发和生长情况(图3)。在正常条件下,WT和AtSCL4突变体株系的幼苗萌发、生长表型、根长和鲜重没有差异,但在甘露醇胁迫下,KO植株幼苗发芽率、根长和鲜重显著高于WT(图3)。结果显示,敲除AtSCL4提高拟南芥应对渗透胁迫的耐受性。
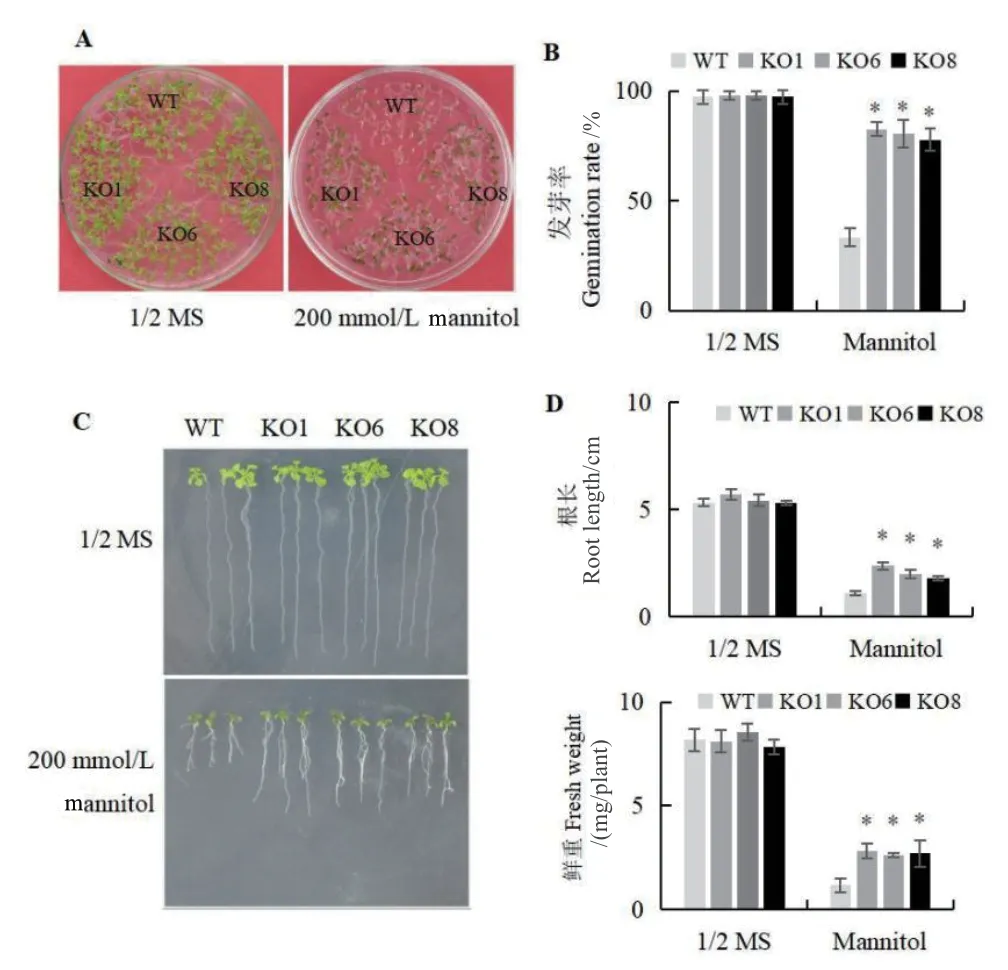
图3 渗透胁迫下AtSCL4调控苗的萌发和生长分析Fig. 3 Analysis of seedling germination and growth regulated by AtSCL4 under osmotic stress
2.3 渗透胁迫下AtSCL4负向调控气孔开度
为了研究AtSCL4是否影响拟南芥的蒸腾作用,测定不同株系叶片的失水率。渗透条件下WT的失水率显著高于KO植株(图4-A),KO植株表现出更强的保水能力。由于水分损失与气孔开度关系密切,因此对叶片气孔开度进行了测定。在正常条件下,WT和KO植株的气孔开度没有明显差异。但在甘露醇胁迫下,与野生型相比,KO不同植株的气孔孔径显著减小(图4-B、C)。结果表明,AtSCL4可能通过负向调控气孔开度和叶片水分蒸腾来提高植物的抗渗透胁迫能力。进一步测定与调节气孔孔径有关的AtMYB61的表达情况。正常情况下,不同株系间AtMYB612的表达无显著差异(图4-D)。当植物暴露于甘露醇胁迫时,与WT相比,KO株系中AtMYB61的转录水平显著上调(图4-D),表明在渗透胁迫下AtSCL4可能负向调控AtMYB61的表达,进而调节气孔开放度。

图4 渗透胁迫下AtSCL4调控苗的气孔开放度分析Fig. 4 Stomatal aperture assay of seedlings regulated by AtSCL4 under osmotic stress
2.4 渗透胁迫下AtSCL4负向调控渗透物质的积累
为了确定AtSCL4是否能调节植物渗透物质的合成而应对逆境胁迫,测定脯氨酸和甜菜碱的含量。与野生型相比,KO株系在甘露醇胁迫下显著提高了脯氨酸和甜菜碱的含量(图5-A、B)。随后,测定了一个脯氨酸生物合成基因(P5SC1)和一个甜菜碱生物合成基因(BADH)在不同株系的表达量,甘露醇胁迫下,P5SC1和BADH在KO植株中显著上调。以上结果表明,AtSCL4可能负向调节脯氨酸和甜菜碱代谢基因,促进渗透物质积累,从而提高AtSCL4突变体对渗透胁迫的耐受性。

图5 渗透胁迫下AtSCL4调控苗渗透物质合成分析Fig. 5 Synthesis analysis of osmolyte in seedlings mediated by AtSCL4 under osmotic stress
2.5 渗透胁迫下AtSCL4负向调控ROS清除能力
通过NBT和DAB染色法测定叶片中O2-·和H2O2的含量。发现在正常生长条件下,野生型和突变体植株叶片经NBT和DAB染色后没有差异(图6-A、B)。然而,甘露醇胁迫下,野生型叶片的颜色明显比突变体深,表明AtSCL4突变体株系的O2-·和H2O2含量显著降低。此外,为测定不同植株对活性氧(reactive oxygen species,ROS)的清除能力,分别测定植株POD和SOD活性。在甘露醇胁迫下,KO植株的SOD和POD活性显著高于WT植株(图6-C、D)。同时,进一步测定SOD基因(AtSOD1)和POD基因(PER4)在不同植株中表达情况。在甘露醇胁迫下,AtSOD1和PER4在KO植株中显著上调(图6-E、F)。以上结果表明,渗透胁迫下AtSCL4对SOD和POD基因的表达具有负调控作用。
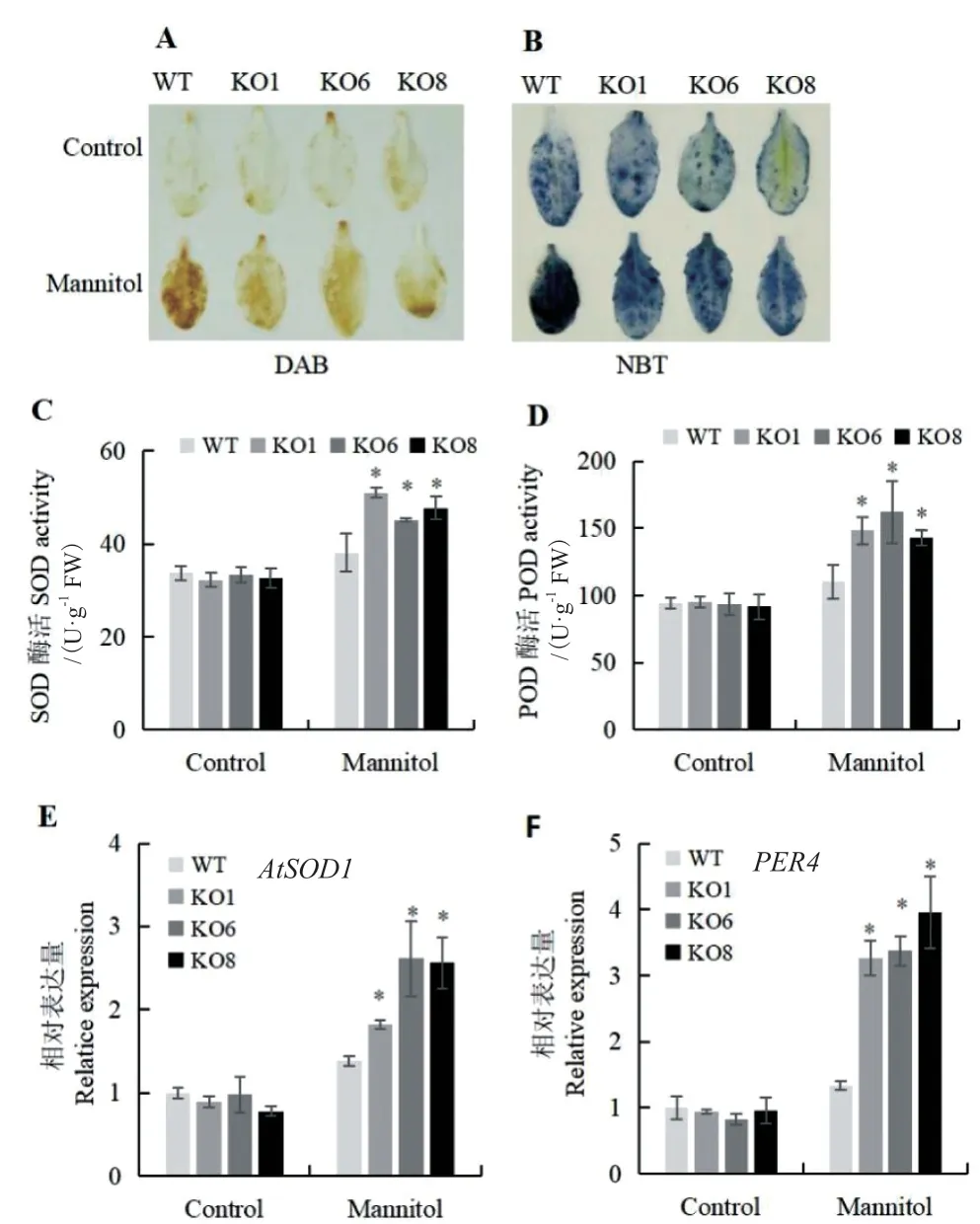
图6 渗透胁迫下AtSCL4调控苗活性氧清除能力分析Fig. 6 ROS scavenging capacity assay of seedlings regulated by AtSCL4 under osmotic stress
3 讨论
植物遭受逆境胁迫的时候,易引起气孔的关闭而减少因蒸腾作用造成叶片水分缺失的情况。Zhang等[17]研究发现毛果杨PtrWRKY75过表达可减小气孔开放度而提高植株抗旱能力。本研究发现类似现象,应对渗透胁迫,AtSCL4突变植株减小气孔孔径以防止叶片水分损失。前期报道发现拟南芥R2R3-MYB转录因子AtMYB61能够调控气孔开度[18],本研究发现渗透胁迫下,AtMYB61在AtSCL4突变植株中显著上调表达,所以推测AtSCL4可能负调控AtMYB61的表达,控制气孔关闭,减少水分流失,但后期还需要结合更多的方法验证这一结论。
植物受到渗透胁迫,一些调节渗透压的物质(如脯氨酸、可溶性糖和甜菜碱)就会被诱导合成以适应脱水胁迫[19]。脯氨酸、可溶性糖和甜菜碱可以保护植物细胞膜系统免受非生物胁迫的伤害[20]。Yuan等[14]发现山葡萄转录因子VaPAT1正调控脯氨酸和可溶性糖积累,增强转基因拟南芥的耐寒性、耐旱性和耐盐性。P5CS和BADH分别编码脯氨酸和甜菜碱生物合成的关键酶[21-22],本研究发现,脯氨酸和甜菜碱在AtSCL4突变植株中显著富集,且P5SC1和BADH在KO植株中上调表达明显。结果表明,AtSCL4可能通过负调控脯氨酸和甜菜碱代谢基因的表达,进而影响脯氨酸和甜菜碱生物合成,而调控植物的抗渗透胁迫能力。
ROS清除对植物耐受非生物胁迫具有重要意义。非生物胁迫下,植物易积累大量的活性氧而引起植物损伤和突变、阻碍代谢功能和造成细胞死亡[23]。本研究发现AtSCL4可能负调控AtSOD1和PER4的表达,提高SOD和POD活性,增强植物对活性氧的清除能力,从而提高其抗渗透胁迫能力,该研究结果与Wang等[24]研究类似。
4 结论
渗透胁迫下,AtSCL4可能负向调控AtMYB61、P5SC1、BADH、AtSOD1和PER4等基因的表达,而减小气孔开度、增加渗透物质(脯氨酸、甜菜碱)合成和提高抗氧化酶(SOD和POD)活性,提高植物抗渗透能力。
