黄瓜AHP基因家族的鉴定及其非生物胁迫表达分析
2022-07-22周国彦银珊珊高佳鑫武春成闫立英谢洋
周国彦 银珊珊 高佳鑫 武春成 闫立英 谢洋
(河北科技师范学院园艺科技学院 河北省园艺种质资源挖掘与创新利用重点实验室,秦皇岛 066004)
细胞分裂素是重要的植物激素之一,通过调控植物组织或细胞的分化与生长,影响植物的生长与发育[1]。细胞分裂素还通过抑制植物中叶绿素、核酸、蛋白质等物质的分解,将必需的氨基酸、激素、无机盐等化合物重新分配到植物的其他部位,从而阻碍植物衰老[2]。越来越多研究表明,细胞分裂素在调控植物生长发育和逆境响应等方面发挥重要的作用[3-4]。
组氨酸磷酸转运蛋白(histidine phosphotransfer proteins,AHP)是细胞分裂素信号转导途径的正向调控蛋白[5]。在细胞质中,受体组氨酸蛋白激酶(histidine kinases,HK)与细胞分裂素结合后自磷酸化,AHP上保守的组氨酸位点自动识别来自HK的磷酸基团,并将磷酸基团从细胞质转移至细胞核上的系列反应调节因子(response regulators,RR),激活下游相关基因完成细胞分裂素信号转导过程,从而调控植物的生长发育[6]。据报道,拟南芥中有6个AHP基因家族成员,其中AHP2、AHP3和AHP5响应盐、干旱胁迫,其三重突变体ahp2,3,5对盐和干旱的耐受性显著增强[7];水稻中有5个AHP基因家族成员,其中OsAHP1和OsAHP2的RNAi转基因株表现出对盐敏感且对干旱耐性增强的特性[8];小麦中有4个AHP基因家族成员,其中TaAHP4响应盐、干旱和脱落酸胁迫且为抑制表达[9]。
黄瓜是重要的世界性蔬菜之一[10-11]。联合国粮食及农业组织(FAO)2020年统计,我国黄瓜栽培面积与产量跃居全球第一,占比分别为全球56.4%和81.2%。黄瓜是喜温不耐高温、抗旱能力弱、不耐弱光的蔬菜作物。当光照强度低于外界自然光照的1/2时,其同化量基本不增加,影响最终产量和效益[12]。因此,低温弱光、高温、干旱等非生物胁迫是限制黄瓜高效生产和品质育种的重要因子[13-15]。AHP作为细胞分裂素信号转导通路的重要调控者,在逆境胁迫响应方面发挥着重要作用[16]。然而,关于黄瓜AHP基因家族鉴定及其在系列非生物胁迫下基因表达情况鲜见报道。
本研究对黄瓜AHP基因家族进行鉴定,系统分析其进化关系、基因结构、顺式作用元件及其在非生物胁迫下表达模式,为进一步探究黄瓜AHP基因的功能和提高植物的非生物胁迫耐受性提供理论依据。
1 材料与方法
1.1 材料
试验于2021年4-7月在河北科技师范学院园艺实验楼人工气候室内进行。将黄瓜‘津研四号’(购于山东鲁蔬种业有限责任公司)播种于草炭∶蛭石∶珍珠岩=3∶1∶1混合基质的营养钵中,置于温室中培养(昼/夜温度为25℃/16℃,光照14 h/黑暗8 h)。将25 d苗龄的幼苗进行不同胁迫处理:干旱(3 d,50%田间持水量)、高温(42℃,48 h)、低温弱光(3 d,光照强度2 klx,昼/夜温度为12℃/8℃,7 d)。采用完全随机设计,每种处理3次重复,混合取样,-80℃保存备用。
1.2 方法
1.2.1 黄瓜AHP基因家族成员鉴定 利用Pfam在线软件(http://pfam.xfam.org/)检索拟南芥AHP蛋白,获取AHP结构特征序列的种子文件PF01627,随后通过HMMER 3.0软件以该种子文件为索引在黄瓜数据库(http://cucurbitgenomics.org/,V3版本)中检索,获得与该蛋白结构特征相匹配的序列,即为黄瓜AHP家族候选成员[17]。利用NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线网站Blastp验证已获得的黄瓜AHP家族候选成员,具有AHP结构域的候选蛋白即为黄瓜AHP家族成员,将编码这些蛋白质的基因定为CsAHP基因。
1.2.2 黄瓜AHP基因家族的染色体定位与共线性分析 利用Map Inspect软件分析AHP家族基因在染色体上的分布情况。在黄瓜基因组内进行BLASTP搜索(E<1×10-5),利用MCScanX软件进行共线性区块预测(阈值≤1×10-5)[18]。
1.2.3 黄瓜AHP基因家族系统进化树的构建 分别在黄瓜、拟南芥tair和葫芦科数据库(CuGenDB,http://cucurbitgenomics.org/)下载黄瓜、拟南芥、南瓜、西瓜、甜瓜、冬瓜、西葫芦、葫芦等蛋白数据库,提取其AHP基因家族的蛋白序列,利用MEGA 6.0软件,采用Neighbor-Joining方法,构建系统进化树[19]。
1.2.4 黄瓜AHP基因顺式作用元件预测 从黄瓜基因组数据库中提取CsAHP基因5′UTR上游1 000 bp序列,提交至PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)数据库,用于基因启动子区顺式作用元件分析[20]。
1.2.5 黄瓜AHP家族成员基因结构和保守结构域分析 从黄瓜基因组数据库中提取黄瓜AHP家族基因的DNA、CDS和氨基酸序列;利用MEME(http://meme-suite.org/tools/meme)网站在线分析该家族共有的保守结构;利用TBtools展示基因结构和保守基序图[21]。
1.2.6 黄瓜AHP基因的表达模式分析 样品总RNA提取和cDNA合成分别采用RNAprep Pure Plant Kit和FastKing RT Kit(With gDNase)试剂盒(天根,中国)。利用Beacon Designer 7.0软件进行基因引物设计,并委托中美泰和生物技术(北京)有限公司合成引物(表1)。利用实时荧光定量PCR仪(伯乐CFX96 Touch)进行实时定量聚合酶链反应与数据分析[22]。利用前人报道的黄瓜RNA-Seq数据信息,获取黄瓜在盐胁迫[23]、硅[24]、高温/低温/长日照/短日照[25]、开花前后[26]、正常子房与超级子房不同发育时期[27]等中AHP家族基因的表达量(每百万reads中来自某基因每千碱基长度的reads数,RPKM)信息,再利用Cluster 3.0和Tree View软件进行基因表达量分析。

表1 qRT-PCR引物设计Table 1 qRT-PCR primer design
2 结果
2.1 黄瓜AHP基因家族成员鉴定、染色体定位与共线性分析
在黄瓜基因组数据库Cucumber(Chinese Long)v3 Genome中,共检索到8条与AHP结构序列特征相匹配的蛋白序列(E-value<0.01)。利用NCBI在线网站blastp验证候选基因蛋白序列的保守性,鉴定结果显示,有7条序列含有AHP结构序列特征,说明黄瓜AHP基因家族有7个成员。依据蛋白序列检索的score值由高到低,依次将其命名为CsAHP1-CsAHP7。
染色体定位结果(图1)显示,这7个AHP成员不均匀分布于黄瓜6条染色体上,而第5染色体上不存在AHP基因。CsAHP1(CsaV3_6G005590.1)、CsAHP2(CsaV3_7G035290.1)、CsAHP3(CsaV3_1G039330.1)、CsAHP5(CsaV3_2G030700.1)和CsAHP6(CsaV3_4G001620.1)分别成功定位到黄 瓜Chr.6、Chr.7、Chr.1、Chr.2和Chr.4染 色 体上,基因CsAHP4(CsaV3_3G014010.1)和CsAHP7(CsaV3_3G023600.1)成功定位到黄瓜Chr.3染色体上。利用MCScanX软件进行共线性预测(阈值≤1×10-5),发现这7个基因不存在片段重复或串联重复等基因复制现象。

图1 黄瓜AHP基因家族成员染色体定位分布图Fig. 1 Chromosome location distribution map of AHP gene family members in C. sativus
2.2 黄瓜AHP基因家族系统进化分析
为揭示黄瓜AHP蛋白与模式作物拟南芥及葫芦科其他物种的AHP蛋白亲缘关系,利用MEGA7.0软件对黄瓜(Cs)、拟南芥(At)、南瓜(Cmo)、西瓜(Cla)、甜瓜(MEL)、冬瓜(Bhi)、西葫芦(Cp)、葫芦(Lsi)的AHP蛋白序列构建系统进化树。结果 (图2)显示,黄瓜、拟南芥和葫芦科AHP家族蛋白可以分为4个大的亚群(Ⅰ、Ⅱ、Ⅲ和Ⅳ),其中Ⅱ类亚群(16个成员)中,黄瓜CsAHP2和CsAHP7分别与冬瓜Bhi09M000375和甜瓜MELO3C030799.2.1 亲缘关系最近,Ⅲ类亚群(7个成员)中,黄瓜CsAHP5与甜瓜MELO3C030319.2.1亲缘关系最近;Ⅳ类亚群(31个成员)中,黄瓜CsAHP1、CsAHP3、CsAHP4、CsAHP6分别与冬瓜Bhi12M001571、甜瓜MELO3C015359.2.1、拟南芥AT3G21510.1(AtAHP1)、冬瓜Bhi01M002749亲缘关系最近;而Ⅰ类亚群(2个成员)中没有黄瓜AHP家族成员。
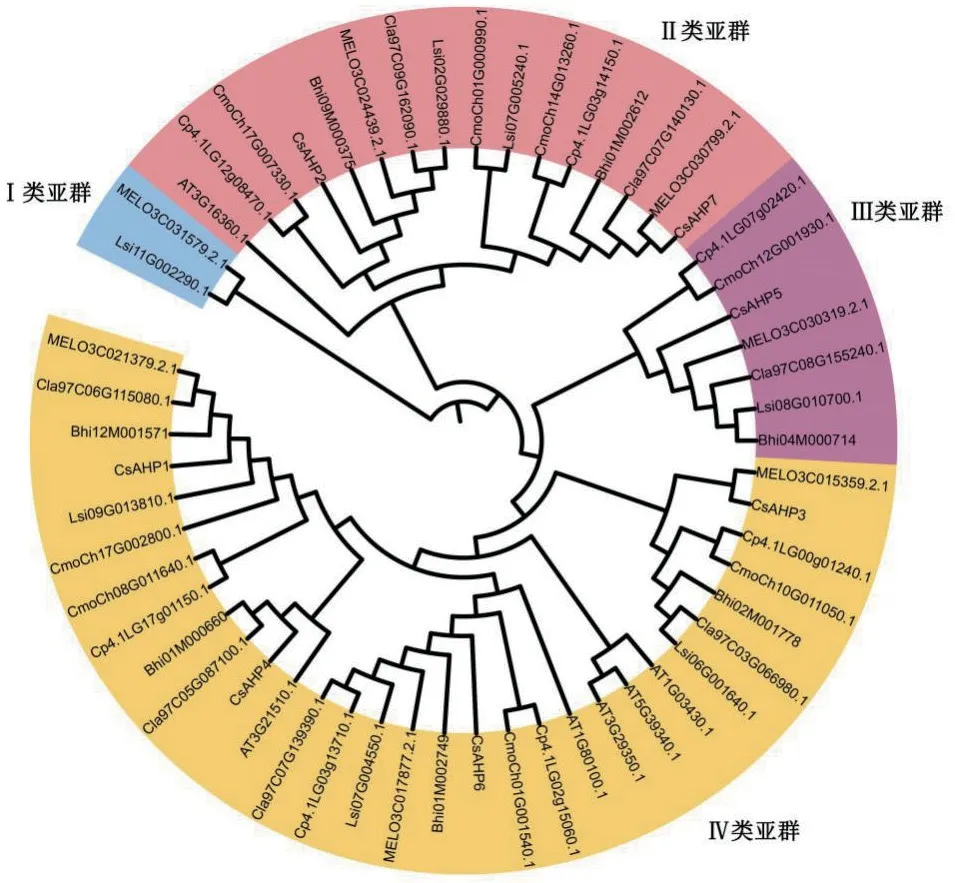
图2 黄瓜、拟南芥和葫芦科AHP家族成员进化树分析Fig. 2 Phylogenetic tree analysis of AHP family members in C. sativus,Arabidopsis thaliana and Cucurbitaceae
2.3 黄瓜AHP基因顺式作用元件分析
为预测黄瓜AHP基因的调控方式,利用PlantCARE软件对该基因家族启动子区的序列进行顺式作用元件分析。结果(图3)显示,黄瓜AHP基因家族成员含有CAAT-box、TATA-box、光响应(13种,I-box、LAMP-element、TCT-motif、GATA-motif、TCCC-motif、MRE、GT1-motif、AAAC-motif、G-box、ACE、ATCT-motif、Box 4、AE-box)、低温响应(1种,LTR)、干旱响应(1种,MBS)、激素响应(8种,TGA-element、TATC-box、TCA-element、ABRE、CGTCA-motif、TGACG-motif、P-box、TGA-box)、厌氧响应(2种,ARE、GC-motif)、玉米蛋白代谢响应(1种,O2-site)和防御与应激(1种,TC-rich repeats)等29种作用元件。

图3 黄瓜AHP家族基因启动子序列顺式作用元件分析Fig. 3 Analysis of cis-acting element in promoter sequence of AHP family gene in C. sativus
黄瓜AHP基因家族7个成员均含有光响应作用元件,CsAHP1、CsAHP2和CsAHP3含有赤霉素响应作用元件,CsAHP2、CsAHP3和CsAHP6含有脱落酸响应作用元件,CsAHP2、CsAHP4和CsAHP5含有生长素响应作用元件,CsAHP2和CsAHP5含有茉莉酸甲酯响应作用元件,CsAHP5和CsAHP7含有干旱胁迫响应作用元件,CsAHP1和CsAHP7含有低温胁迫响应作用元件。
2.4 黄瓜AHP家族成员基因结构和保守结构域 分析
基因结构分析(图4)显示,黄瓜CsAHP1、CsAHP2、CsAHP3、CsAHP4、CsAHP5和CsAHP7均含有6个外显子,而CsAHP6仅含有5个外显子。黄瓜AHP家族蛋白含8个保守motif,其中CsAHP1、CsAHP2、CsAHP7均 含Motif1-Motif6,CsAHP3含Motif1-Motif3和Motif5-Motif7,CsAHP4含Motif1-Motif5,CsAHP6含Motif1-Motif3、Motif5、Motif7-Motif8。
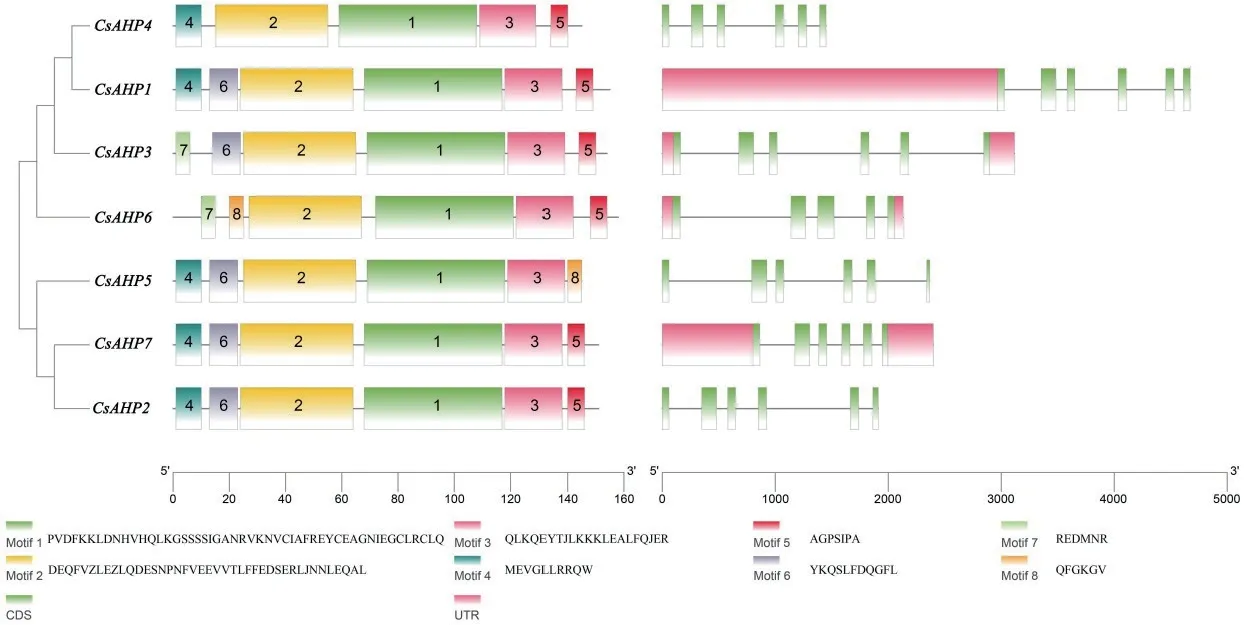
图4 黄瓜AHP家族基因结构与保守结构域分析Fig. 4 Gene structure and conservative domain analysis of AHP family in C. sativus
2.5 黄瓜AHP基因在发育和非生物胁迫下的表达模式分析
利用前人发表的黄瓜表达谱数据库,提取盐胁迫、硅胁迫、高/低温且长/短日照胁迫、不同开花时期、超级子房与正常子房等非生物胁迫和发育时期的AHP家族基因表达谱信息(RPKM值)。结果 (图5)表明,盐胁迫下CsAHP1、CsAHP3和CsAHP4显著下调表达,尤其CsAHP4在对照和处理组中基因表达量的差异倍数达15倍;高温长日照/短日照和低温长日照/短日照条件下,基因表达模式相近,均为CsAHP1和CsAHP4高,其余表达量都低;硅胁迫下CsAHP3显著上调表达,其余都下调表达且差异不显著;CsAHP1在开花期较其他CsAHPs基因表达量最高,开花前6 d,CsAHP3表达量最高;CsAHP7在正常子房和超级子房开花前1 d表达量均为最高,CsAHP1在正常子房和超级子房开花期表达量最高。
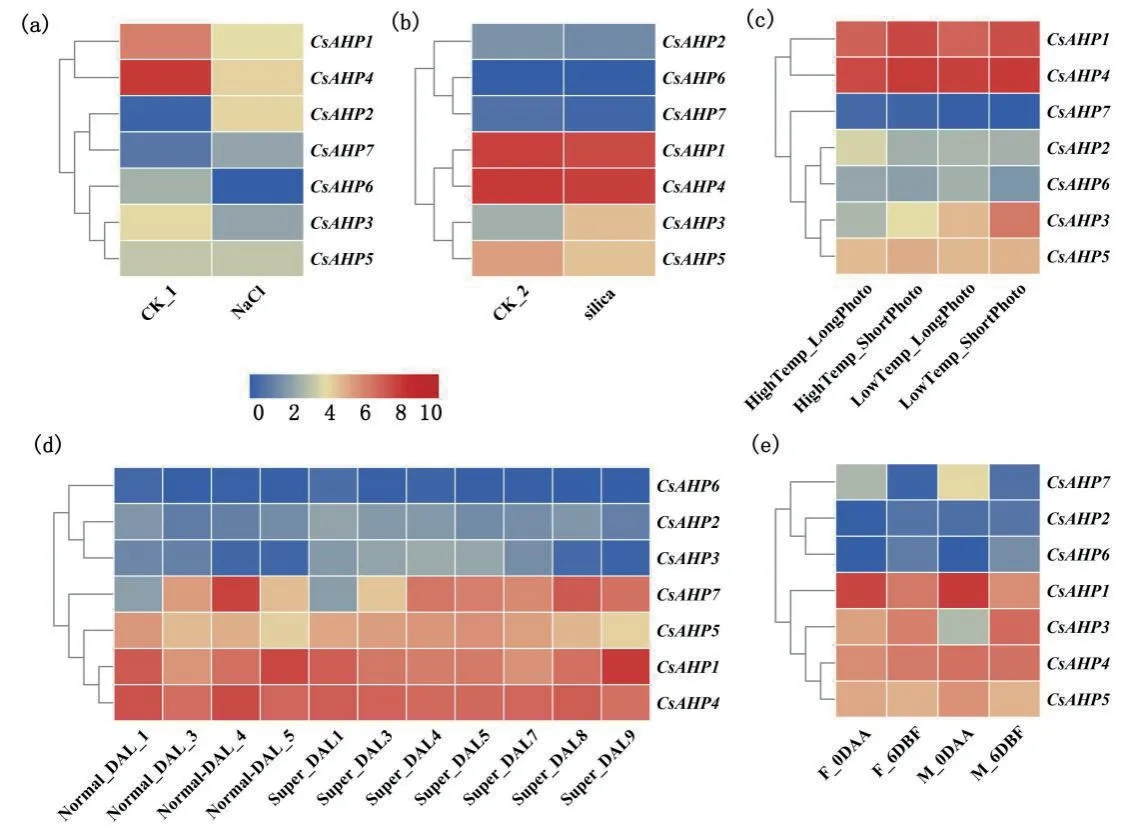
图5 黄瓜非生物胁迫与不同发育时期AHP家族基因表达模式分析Fig. 5 Expression pattern analysis of AHP family in abiotic stress and different developmental stages of C. sativus
进一步利用qRT-PCR技术分析黄瓜AHP家族基因在干旱、高温和低温弱光胁迫下相对表达量情况。结果(图6)发现,CsAHP1和CsAHP3均在干 旱、高温胁迫下较对照显著上调表达,CsAHP1、CsAHP2和CsAHP5在低温弱光胁迫下较对照显著上调表达。以上数据说明黄瓜AHP家族基因响应干旱、高温和低温弱光等非生物胁迫且推测该家族基因成员间可能存在功能冗余现象。

图6 在干旱、高温和低温弱光胁迫下黄瓜AHP家族基因qRT-PCR分析Fig. 6 qRT-PCR analysis of AHP family gene under drought,high temperature,and low temperature and low light stress in C. sativus
3 讨论
近些年,随着高通量测序技术迅猛发展,重要性状的基因大数据的公开,利用生物信息学技术将相关数据信息进行有效整合,将为挖掘重要性状相关基因及其功能研究提供理论基础[28]。本研究运用生物信息学手段,分别从黄瓜、南瓜、西瓜、甜瓜、冬瓜、西葫芦、葫芦和拟南芥基因组数据库鉴定到7(Cs)、8(Cmo)、7(Cla)、7(MEL)、7(Bhi)、7(Cp)和6(Lsi)个基因家族成员,且黄瓜AHP家 族成员与葫芦科中冬瓜、甜瓜的亲缘关系较近。葫芦科作物与十字花科的拟南芥(6个)和萝卜(6个)成员个数相当,说明AHP家族具有保守性[29]。
为了探究黄瓜AHP基因的调控网络机制,本研究对黄瓜AHP家族基因启动子序列进行顺式作用元件分析。结果显示,黄瓜AHP基因家族7个成员均含有光响应作用元件,且CsAHP1和CsAHP7含有低温胁迫响应作用元件。qRT-PCR分析发现CsAHP1在低温弱光胁迫下较对照显著上调表达,说明CsAHP1响应低温弱光胁迫。侯凌燕[30]研究发现拟南芥AHP1-5缺失可以提高植物的抗冻能力,与本研究结果相近,可能是因为低温弱光下CsAHP1表达量增多造成植株出现胁迫症状。本研究中,在干旱、高温胁迫下CsAHP1和CsAHP3较对照显著上调表达,盐胁迫下CsAHP1、CsAHP3和CsAHP4显著下调表达,与拟南芥AHP2、AHP3、AHP5响应盐、干旱胁迫相一致[7],但与水稻OsAHP1、OsAHP2响应盐和干旱胁迫的表达模式相反[9],说明其参与响应黄瓜逆境胁迫的生物学过程。
进一步利用基因表达谱与qRT-PCR分析黄瓜AHP家族基因的表达情况,结果显示CsAHP1和CsAHP4均响应盐胁迫、高/低温/长/短日照,CsAHP3响应盐胁迫、硅胁迫,暗示着CsAHP1、CsAHP3和CsAHP4参与调控逆境胁迫响应机制。在萝卜中研究发现RsAHP1、RsAHP2和RsAHP5响应盐胁迫且均为上调表达[31],与本研究结果相反,其可能原因是不同物种对盐胁迫的响应不同。本研究还鉴定到CsAHP7在正常子房和超级子房开花前1 d表达量均为最高,而CsAHP1在正常子房和超级子房开花期表达量最高,说明CsAHP1和CsAHP7可能参与黄瓜开花调控过程。综上推测,CsAHP1可能通过参与细胞分裂素信号转导途径调控黄瓜提前开花响应植物逆境胁迫,使植物提前进入生殖生长阶段。
4 结论
鉴定到的7个黄瓜AHP基因家族成员与葫芦科物种及十字花科萝卜、拟南芥的AHP家族具有很强的保守性;基因启动子序列中含有光响应、低温响应、干旱响应、激素响应和防御应激与胁迫响应等多种顺式作用元件;黄瓜AHP基因家族与植物发育和非生物胁迫响应有着密切的关系。
