柱切换液相色谱法快速定量检测参附注射液中乌头碱类生物碱和人参皂苷
2022-07-22张艳海张大伟
张艳海,李 玲,张大伟,鲁 锐
(1.安捷伦科技(中国)有限公司,上海 200080;2.黑龙江农垦总局总医院,黑龙江 哈尔滨 150088)
参附注射液(Shenfu injection,SFI)由红参、附子(黑顺片)经现代工艺加工制备而成,具有益气温阳、蠲化寒饮、振奋心阳、益气固脱等多重功效,主要用于阳气暴脱引起的厥脱症,以及阳虚(气虚)所致的惊悸、喘咳、胃疼、泄泻、痹症等[1-2]。近年来,SFI被广泛用于治疗心力衰竭、休克、心律失常、脓毒症等[3-7]复杂疾病,疗效显著。SFI 也被推荐用于新型冠状病毒肺炎(COVID-19)危重症患者的救治,在国家、各省市出台的23种中医药防治COVID-19的治疗方案中有重要地位[8-9]。研究表明,人参皂苷和乌头类生物碱作为SFI 的两类有效活性成分,其抗炎作用在治疗心脑血管疾病方面有重要意义[1,10]。附子中的乌头类生物碱(包括双酯型生物碱及其水解产物单酯型生物碱)既是有效成分又是毒性成分,其中双酯型生物碱的毒性约是单酯型生物碱的100 ~200倍。附子经炮制后,双酯型和单酯型生物碱的含量显著降低[11-12],而参附注射液在制备过程中单酯型生物碱的含量进一步降低[13]。因此准确测定两类生物碱的含量,不仅能保证药物安全性和有效性,也是保证炮制工艺和生产工艺的重要方面。
参附注射液中人参皂苷和乌头碱类生物碱的分析方法主要包括液相色谱法[13-16]和液相色谱-质谱联用法(LC-MS)[17]。其中乌头碱类生物碱成分由于含量较低,且样品基质复杂,测定时常采用C18离线固相萃取[13]或在线固相萃取(online SPE)进行富集和净化[16-17]。但基于C18的SPE柱仅能去除样品基质中极性较大的水溶性成分干扰,无法去除其他极性相近的中性干扰成分,净化效果有限。此外,采用液相色谱的人参皂苷定量方法仅涵盖人参皂苷Rg1、Re、Rf、Rb1、Rc 和Rd 等原人参二醇型(Protopanaxadiol)和原人参三醇型(Protopanaxatriol)[14-15]物质。而齐墩果烷型人参皂苷如人参皂苷Ro 具有抗炎、抗氧化等作用,含量仅次于Rb1,且Ro/Re含量比值可作为红参年限的重要参考指标[18]。LCMS法能同时对13种人参皂苷和10种乌头碱类生物碱进行定量[17],但其检测成本较高,不适合在实际质控等实验室应用。本文采用柱切换液相色谱技术,选择强阳离子交换(SCX)柱作为online SPE柱,建立了6 个乌头碱类生物碱的在线固相萃取/液相色谱-紫外检测(online SPE/LC-UV)快速分析方法;并优化了人参皂苷含量的测定方法,同时完成了包括人参皂苷Ro在内的9种人参皂苷的定量。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260 Infinity Ⅱ液相色谱系统(美国安捷伦科技公司),包括:四元泵(G711B)、二元泵(G7112B)、自动进样器(G7129A)、柱温箱(G7116A)(内置一个2位6通阀)、阀切换单元(G1170A,含一个2 位6 通阀)、二极管阵列检测器(G7117A)× 2,软件采用Agilent OpenLab CDS 2.5。Zorbax SB-C18(4.6 mm × 150 mm × 3.5 µm)、Poroshell EC-C18(4.6 mm × 100 mm × 2.7 µm)及其保护柱(4.6 mm×5 mm×2.7µm)、Zorbax SCX(4.6 mm×12.5 mm×5µm)(美国安捷伦科技公司)。
乙腈、甲醇(色谱级,Avantor J.T.Baker 公司);去离子水(18.2 MΩ·cm-1,Millipore 纯水机);磷酸(HPLC 级,浓度85%,Dikma 公司);醋酸铵(LC-MS级,5 mol/L,Sigma-Aldrich 公司);甲酸、乙酸(LC-MS级),异丙醇、二氯甲烷(HPLC级)(上海安谱实验科技股份有限公司)。
人参皂苷Rg1(供含量测定用,纯度按96.3%计),Re(供含量测定用,纯度按92.7%计),Rf(供含量测定用,纯度≥98%)、Rb1(供含量测定用,纯度按92.9%计)、Rb2(供含量测定用,纯度按93.8%计)、Rd(供含量测定用,纯度按94.4%计)、Rb3(供含量测定用,纯度按92.7%计)(中国药品生物制品检定所);Rc(纯度>98%,化学对照品)、人参皂苷Ro(纯度>98%)(成都普瑞法科技开发有限公司);苯甲酰新乌头原碱(BMA)、苯甲酰乌头原碱(BAC)、苯甲酰次乌头原碱(BHA)、新乌头碱(MA)、次乌头碱(HA)和乌头碱(AC)(纯度≥98%,上海源叶生物科技有限公司);红参粉(吉林抚松,5 年);参附注射液(华润三九(雅安)药业有限公司,批号:200704AK07、201203AK03、210303AK05)。
1.2 对照品溶液配制
取苯甲酰新乌头原碱、苯甲酰乌头原碱、苯甲酰次乌头原碱、新乌头碱、次乌头碱和乌头碱对照品适量,精密称定,加异丙醇-二氯甲烷(体积比1∶1)混合溶液制成每1 mL 各含0.1 mg对照品的储备溶液。再分别取各对照品储备液适量,加入体积分数50%的异丙醇-水(含0.1%(体积分数)甲酸)溶剂稀释,配制成质量浓度10µg/mL的混合对照品溶液。
取人参皂苷Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd、Ro 对照品适量,精密称定,置于10 mL 量瓶中,加甲醇溶解并定容至刻度,制成Rg1、Re、Rf、Rb1、Rc、Rb2、Rb3、Rd、Ro质量浓度分别为2.60、2.58、2.20、2.74、2.60、2.40、2.60、2.66、2.35 mg/mL 的储备溶液。再精密称取上述各对照品储备溶液适量,分别加甲醇稀释,制成1.0 mg/mL的标准工作溶液。
1.3 样品溶液制备方法
取参附注射液样品适量,加水按照体积比4∶6(样品∶水)稀释,摇匀后,上机分析。
1.4 色谱条件
乌头碱类生物碱的分析条件:SPE 泵的流动相A 为0.1%(体积分数)乙酸,B 为乙腈,C 为100 mmol/L醋酸铵;SPE柱为Zorbax SCX(4.6 mm×12.5 mm×5µm),流速为1.0 mL/min;分析泵的流动相A 为100 mmol/L 醋酸铵,流动相B 为乙腈,分析柱为Zorbax SB-C18(4.6 mm×150 mm×3.5µm)。梯度洗脱程序见表1。流速为1.0 mL/min,进样体积为200µL,柱温为35 ℃,紫外检测波长为235 nm。Online SPE 的系统连接见图1,阀1(V1)的切换过程:0 ~16 min,1-6;16 ~17.8 min,1-2;17.8 ~56.5 min,1-6。阀2(V2)保持在1-6。

表1 SPE泵和分析泵的梯度洗脱程序(乌头碱类生物碱检测)Table 1 Gradient program of SPE and analytical pumps(aconitine-type alkaloids assay)

图1 在线固相萃取和柱切换系统连接示意图Fig.1 Flow scheme of online SPE and column switching system A. aconitine-type of alkaloids(乌头碱类生物碱);B. ginsenosides(人参皂苷)
进行人参皂苷分析时,流动相A为0.1%(体积分数)磷酸,流动相B为乙腈,采用Poroshell EC-C18(4.6 mm × 100 mm × 2.7 µm)作为分析柱。流速为1.0 mL/min,梯度洗脱过程为:0 ~5 min,10% B;5 ~6 min,10% ~19% B;6 ~10 min,19% B;10 ~24 min,19% ~24% B;24 ~45 min,24% ~36% B;45 ~48 min,36% ~95% B;48 ~50 min,95% B。柱温25 ℃,检测波长203 nm,进样量5 µL。以Poroshell EC-C18(4.6 mm × 5 mm × 2.7 µm)作为保护柱;阀2(V2)切换过程:进样后,0 ~5 min,1-2;5 ~50 min,1-6。阀1(V1)位置保持在1-2。
2 结果与讨论
2.1 Online SPE方法的建立
样品制备是复杂样品分析过程的重要组成部分,也是最为耗时、费力的过程,已成为制约快速分析的主要瓶颈,而在线联用样品制备策略是发展快速分析方法的重要方向,其中基于柱切换液相色谱的在线online SPE技术是被广泛应用的一种在线样品制备技术[19-20]。SPE柱是方法构建的关键,主要基于目标待测物性质及其与SPE 的吸附相互作用进行选择,同时也要考虑样品基质的组成情况[21]。实验根据附子中乌头碱类生物碱的理化性质,选择强阳离子交换(SCX)小柱作为online SPE柱,以选择性富集生物碱。除附子生物碱外,基质中还含有人参皂苷、有机酸、核苷、多糖等其他内源基质成分[10],以及吐温80等辅料。为降低上述物质的干扰,实验优化了SPE 洗脱除杂过程,分别采用高水相(乙腈∶0.1%磷酸= 5∶95,体积比)的“弱洗脱”和高有机相(乙腈∶0.1%磷酸= 95∶5,体积比)的“强洗脱”两步净化除杂过程,最大程度地去除非生物碱类成分的干扰。由图2 可知,基于硅胶载体的Zorbax SCX小柱能够有效保留目标待测物,同时达到了较好的净化效果。
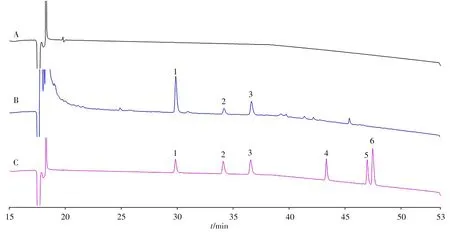
图2 红参阴性对照溶液(A)、参附注射液(B)和乌头碱类生物碱混合对照品(C)的色谱图Fig.2 The chromatograms of red ginseng negative control solution(A),Shenfu injection(B)and mixed standards of aconitine-type alkaloids(C)1.benzoylmesaconine(苯甲酰新乌头原碱),2.benzoylaconine(苯甲酰乌头原碱),3.benzoylhypaconine(苯甲酰次乌头原碱),4.mesaconine(新乌头碱),5.aconine(乌头碱),6.hypaconine(次乌头碱)
目标物洗脱时,采用分析泵的流动相反向冲洗SPE 柱,并结合100 mmol/L 醋酸铵-乙腈(体积比80∶20)混合溶剂,可实现目标分析物的快速转移。考察了乌头碱类生物碱6 个对照品混合溶液的洗脱效果和洗脱时间,结果显示,在16 ~17.5 min,SPE 上吸附的目标物可被完全洗脱,因此确定转移时间即阀1(V1)的切换时间为1.5 min。在优化梯度条件下,6 个目标待测生物碱分离良好(图2C),且乌头碱和次乌头碱的分离度大于1.5。
2.2 系统适用性实验
2.2.1 专属性实验 按照确定的色谱条件,分别进样混合对照品、参附注射液样品和红参阴性对照溶液,其中混合对照品中苯甲酰新乌头原碱等6种乌头碱类生物碱的分离色谱图如图2C 所示。结果显示,各目标待测物分离良好。参附注射液样品中未检测到新乌头碱、乌头碱和次乌头碱3 种双酯型生物碱,苯甲酰新乌头原碱、苯甲酰乌头原碱和苯甲酰次乌头原碱3 种单酯型生物碱无其他基质成分干扰,其UV 吸收光谱与对照品一致,色谱峰的纯度因子[22]分别为999、998 和998,表明目标峰纯度较好,基质干扰少。以上结果说明本方法专属性较好,可对化合物进行准确定量。
按照“1.4”中人参皂苷的分析条件,分别进样混合对照品和参附注射液样品溶液,由图3 可知,9种目标人参皂苷分离良好,各目标峰的峰纯度因子均大于980,表明各峰纯度较好,其他基质成分干扰较少,方法专属性良好。

图3 人参皂苷混合对照品(A)和参附注射液样品(B)的分离色谱图Fig.3 The chromatograms of mixed standards of nine ginsenosides(A)and Shenfu injection(B)1-9:ginsenoside Rg1,Re,Rf,Rb1,Rc,Ro,Rb2,Rb3,Rd
2.2.2 精密度实验 取1.0µg/mL 的生物碱混合对照品溶液,按“1.4”乌头碱类生物碱的分析方法连续进样6次。结果显示,苯甲酰新乌头原碱等6种目标待测物保留时间的相对标准偏差(RSD,%)均小于0.10%;峰面积的RSD 小于0.70%。同时取100 µg/mL 的人参皂苷混合对照品溶液,按照“1.4”人参皂苷的分析方法连续进样5 次。结果显示9 种人参皂苷保留时间的RSD 均小于0.08%;峰面积的RSD均小于2.0%。表明方法的精密度较好。
2.3 线性关系、检出限与定量下限
取10µg/mL的苯甲酰新乌头原碱等6个混合对照品溶液,以50%异丙醇(含0.1%甲酸)逐级稀释,制成质量浓度分别为2.0、1.0、0.2、0.1、0.05、0.02µg/mL的系列对照品溶液,按照乌头碱类生物碱的分析条件进样分析,进样体积200µL。以目标物的峰面积为纵坐标(y),质量浓度为横坐标(x),考察各目标待测物的线性关系。另取人参皂苷各标准品工作溶液适量至10 mL量瓶中,加甲醇稀释至刻度,制成100µg/mL的混合对照品溶液,再取混合对照品溶液适量,加甲醇逐级稀释制成质量浓度分别为40、20、8、4、1.6µg/mL的系列溶液,分别取混合对照品溶液和系列稀释后溶液,按照人参皂苷的分析方法进样分析,进样体积5µL,以目标物的峰面积为纵坐标(y),质量浓度为横坐标(x),考察各目标待测物的线性关系。结果显示,苯甲酰新乌头原碱等6个乌头碱类生物碱及9种人参皂苷的线性相关系数(r2)均大于0.999,按照信噪比(S/N)为3∶1计算检出限(LOD),得到BMA、BAC、BHA、MA、HA和AC的LOD分别为4.8、5.9、8.2、4.7、4.0、4.0 ng/mL;按照S/N=10∶1计算定量下限(LOQ),得到BMA、BAC、BHA、MA、HA和AC的LOQ分别为15.9、19.6、27.2、15.8、13.3、13.3 ng/mL。结果见表2。本文采用大体积进样结合高灵敏度UV检测器,得到的目标待测生物碱的检出限显著低于其他UHPLC-UV分析方法[13]。

表2 线性关系、定量下限和检出限结果Table 2 Results of linearity relationship,LOQs and LODs
2.4 重复性实验
取参附注射液样品5 份,按照样品溶液制备方法制备上机溶液,进样分析。结果参附注射液中BMA、BAC和BHA含量的RSD分别为1.3%、1.2%和0.59%,MA、AC和HA 3种双酯型生物碱未检出;9种人参皂苷含量的RSD在0.21%~1.6%之间。表明方法重复性较好。
2.5 稳定性实验
取“2.6”部分中等加标水平的参附注射液样品溶液,分别在0、2、4、12、16、18 h 按照“1.4”乌头碱类生物碱的色谱条件进样分析,考察6 种待测物的稳定性,结果BMA、BAC、BHA、MA、AC和HA 峰面积的RSD 分别为1.7%、0.47%、0.62%、0.29%、0.67%和0.53%,表明目标待测生物碱在18 h 内稳定性良好;另取参附注射液样品溶液,按照“1.4”中确定的人参皂苷分析条件,分别在0、2、4、6、12 h进样分析,结果各人参皂苷测得量的RSD均小于2.0%,表明待测的9种人参皂苷在12 h内稳定性较好。
2.6 回收率实验
取参附注射液样品12份,每份4 mL,置10 mL量瓶中,分别加入10µg/mL的BMA 等6种乌头碱类生物碱混合对照品溶液0.5、1.0 和1.5 mL,加水定容到刻度,摇匀;另取BMA 等混合对照品溶液相应体积置10 mL 量瓶中,加水定容至刻度,摇匀,作为随行参照溶液。再取参附注射液样品12 份,每份2 mL,置10 mL 量瓶中,分别加入100µg/mL 的9 种人参皂苷混合对照品溶液1.0、2.0 和3.0 mL,加水定容到刻度,摇匀;另取人参皂苷的混合对照品溶液相应体积置10 mL 量瓶中,加水定容至刻度,摇匀,作为人参皂苷的随行参照溶液。分别按照“1.4”乌头碱类生物碱和人参皂苷的分析条件进样分析,计算回收率。由表3 结果可知,6 种乌头碱类生物碱的平均回收率为95.1% ~98.6%,9 种人参皂苷的平均回收率为91.7%~104%。结果表明方法的准确度良好,完全满足测定要求。

表3 15个目标物的平均加标回收率(n=2)Table 3 The average spiked recoveries for fifteen target analytes(n=2)
2.7 实际样品测定
取3 批参附注射液,按照“1.3”样品溶液制备方法和“1.4”的色谱条件进样分析,测定目标待测物的含量。结果见表4。样品中未检测到乌头碱等3种双酯型生物碱,其他3种单酯型生物碱的总量为2.72 ~4.03µg/mL。
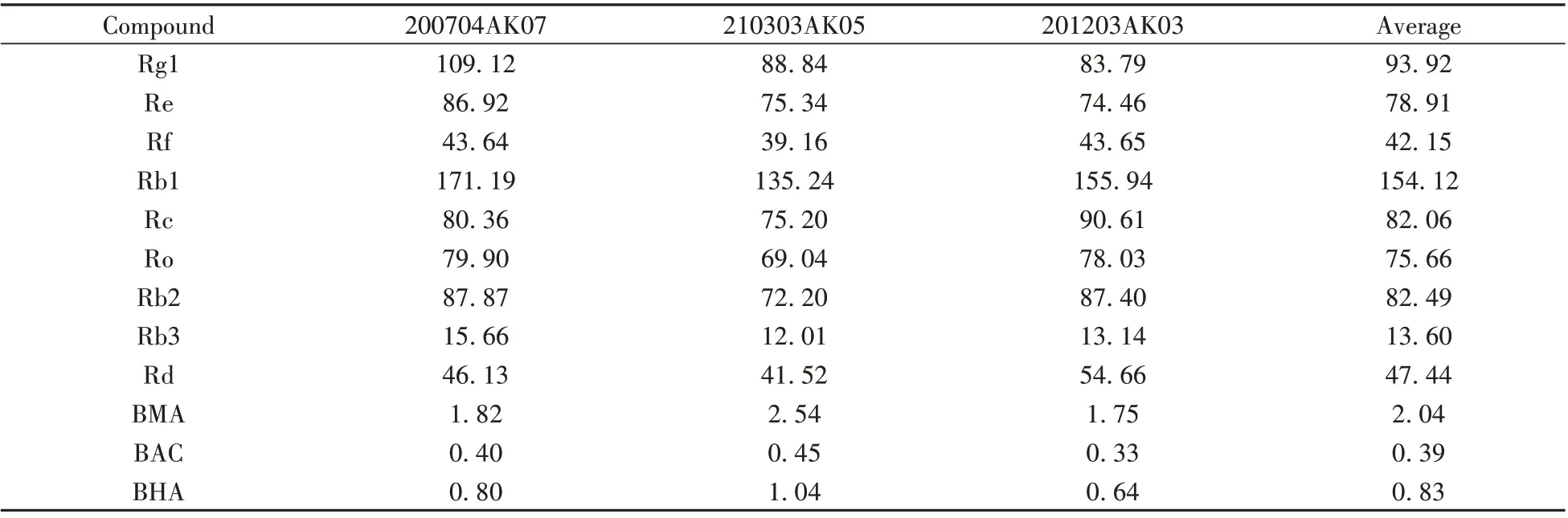
表4 样品含量测定结果(n=2)Table 4 Content results of samples(n=2) (µg/mL)
在人参皂苷测定中,由于样品基质复杂,当采用“1.4”人参皂苷的色谱条件直接进样分析时,在UV 203 nm检测波长下,前5 min内色谱图中包含大量吸收较高的弱保留基质成分(图4A),同时多次累加进样还会造成色谱柱和检测器的污染。而利用柱切换的方式能够有效去除0 ~5 min 内的极性差异较大的基质成分,避免对分析柱和后端检测器的污染,改善方法的整体耐用性(图4B)。

图4 直接进样方式(A)和柱切换方式(B)下参附注射液的分析谱图Fig.4 Chromatograms of SFI by direct injection(A)and column switching(B)peak 1-9:ginsenoside Rg1,Re,Rf,Rb1,Rc,Ro,Rb2,Rb3,Rd
3 结 论
本文建立了在线固相萃取/液相色谱分析方法对参附注射液中源于附子的乌头碱类生物碱进行测定。采用基于强阳离子交换的SPE 柱选择性富集生物碱类成分,结合优化的SPE 洗脱过程,有效去除了非生物碱类基质成分的干扰,实现了目标物的快速分析。方法学考察结果表明本法准确、可靠,可用于实际样品中BMA、BAC、BHA3 个单酯型生物碱的定量,同时兼顾了AC、MA 和HA3 个毒性较强的双酯型生物碱的限量检测。另外本文还建立了Rg1、Re、Rf、Rb1、Rc、Ro、Rb2、Rb3、Rd 9 种人参皂苷含量的测定方法,兼顾了红参中含量较高的齐墩果烷型人参皂苷Ro 的定量,缩短了整体分析时间;同时,采用柱切换的方式能够去除样品中极性较大、保留较弱的基质成分,有效保护色谱柱和检测器。由于本方法较常规分析方法复杂,且online SPE 柱的批间稳定性可能会影响方法整体的耐用性,因此后续工作将针对方法耐用性进行系统、深入的考察,以促进本法在实际样品质量控制中的应用。
