趋化因子CXCR7/CXCL11/CXCL12 生物轴在狼疮肾炎患者外周血中表达研究
2022-07-21祖蓓蓓马倩倩饶咏梅李美荣
祖蓓蓓 马倩倩 饶咏梅 李美荣 刘 琳 张 丽
1.江苏省徐州市医学科学研究所,江苏徐州 221009;2.江苏省徐州市中心医院风湿免疫科,江苏徐州 221009;3.江苏省徐州市中心医院肾内科,江苏徐州 221009
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种慢性多系统受累的自身免疫疾病,临床表现具有高度异质性、复杂性。发病机制尚不清楚,主要与免疫功能异常有关[1-2]。其中趋化因子可通过对免疫细胞调控,参与自身免疫病的发病[2-3]。
CXC 型趋化因子受体(CXC chemokine receptor,CXCR)7 属于7 次跨膜G 蛋白偶联受体超家族中一员,其与CXC 型趋化因子配体(CXC-type chemokine ligand,CXCL)12、CXCL11 双配体结合,发挥对免疫细胞迁移、促进炎症、增强血管生成和白细胞外渗等免疫调节作用[4-7]。近年来有研究报道CXCL11、CXCR7 在骨关节炎、银屑病、皮肌炎、类风湿关节炎、干燥综合征、系统性硬皮病、自身免疫性甲状腺炎、炎症肠病等免疫相关疾病中高表达[6-12]趋化因子CXCL11、CXCL12及其受体CXCR7 在狼疮肾炎(lupus nephritis,LN)患者中表达情况,目前国内外尚无统一的研究结论。本研究拟通过检测LN 患者及健康者外周血中CXCL11、CXCL12、CXCR7 表达水平,探讨CXCR7/CXCL11/CXCL12 生物轴在LN 发病中的作用。
1 资料与方法
1.1 一般资料
本研究获得江苏省徐州市中心医院(以下简称“我院”)伦理委员会批准及入组受试者签署知情同意书。依据SLE 分类标准(美国风湿病协会修订)[13-14],入组40 例我院风湿免疫科2018 年10 月至2020 年10 月就诊SLE 患者,再根据LN 必须满足尿蛋白>0.5 g/24 h或红细胞管型尿>5 个/幽门螺旋杆菌的要求[13-14],将入组的SLE 患者分为LN 组24 例,平均年龄(36.8±12.6)岁;男2 例,女22 例。无肾损害SLE 患者组(非LN 组)16 例,平均年龄(37.4±11.3)岁;男1 例,女15 例。对照组:20 名健康对照组为我院健康体检者,平均年龄(37.2±11.8)岁;男2 例,女18 例。三组性别、年龄比较,差异无统计学意义(P >0.05),具有可比性。
1.2 检测指标
各组外周血中CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 表达,及SLE患者24 h 尿蛋白定量、ANA、ANA 谱、免疫球蛋白、补体、红细胞沉降率临床指标检测。
1.3 检测方法
1.3.1 标本采集 分别采集研究对象空腹外周静脉血共8 ml,分2 管(4 ml/管)。其中1 管(肝素抗凝管)4 ml 血标本行流式细胞术检测,另一管(分离胶促凝管)4 ml 血标本离心,离心半径10 cm,3000 r/min,离心10 min,收集血清,-80℃冻存,用于酶联免疫吸附试验法检测。
1.3.2 流式细胞术 依次取荧光抗体CD3FITC 10 μl+CD19PE 10 μl+IgG2αAPC 10 μl+抗凝全血50 μl 加入1 支流式管中,取荧光抗体CD3FITC 10 μl+CD19PE 10 μl+CXCR7APC 10 μl+抗凝全血50 μl 荧光抗体加入第2 支流式管中(美国BD 公司,批号:9151960、7299982、8339984、9229185,FACS Calibur 流式细胞仪),混匀、室温避光孵育、溶血、孵育10 min、离心半径10 cm,1000 r/min 离心5 min,离心去上清液、1 ml PBS 离心洗涤2 次,去上清液、500 μl PBS 混匀、3 h内上机检测、软件获取数据及分析。
1.3.3 酶联免疫吸附试验法检测 严格按照试剂盒的说明书操作,将检测待测样本、标本品储存液稀释备用,分别加入检测孔、孵育、洗涤、吸干、加入样本结合物、孵育、洗涤、吸干、加底物溶液、反应、加入反应终止液、静置30 min 后测定吸光度,绘制标准曲线,计算待测样本中CXCL11、CXCL12 的浓度(美国R&D System 公司,货号:DCX110/891030、DSA00/890813)。
1.4 统计学方法
采用SPSS 25.0 对所得数据进行统计学分析,正态分布计量资料采用均数±标准差()表示,采用方差分析,非正态分布计量资料采用中位数(四分位)[M(P25,P75)]表示,采用非参数Kruskal-Wallis H 检验。相关分析数据为非正态分布资料,采用Spearman 相关分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 三组外周血中CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 表达情况
三组CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 表达水平比较,差异均有统计学意义(P <0.05)。其中LN 组CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 表达水平均高于非LN 组、健康对照组,差异均有统计学意义(P <0.05)。非LN 组CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 表达水平高于健康对照组,差异均有统计学意义(P <0.05)。见表1。
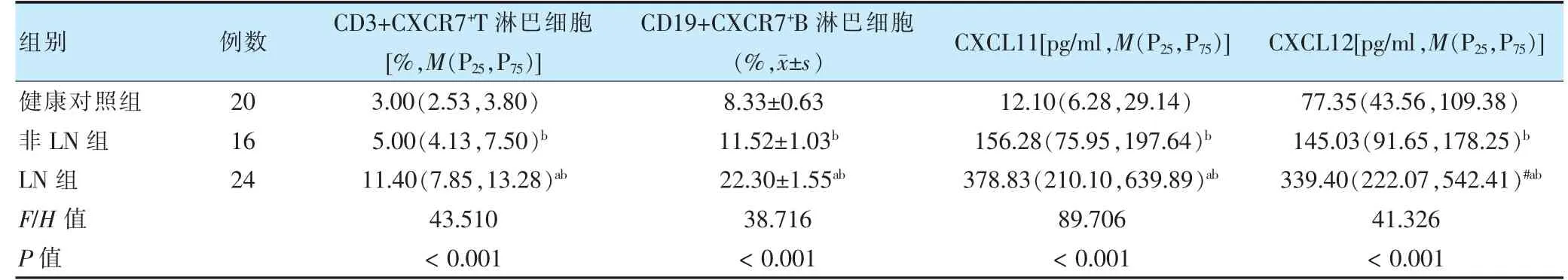
表1 三组外周血中CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞、CXCL11、CXCL12 比较
2.2 狼疮肾炎患者外周血中CXCL11、CXCL12、CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞与24 h 尿蛋白定量的相关性分析
狼疮肾炎患者外周血中CXCL11、CXCL12、CD3+CXCR7+T 淋巴细胞、CD19+CXCR7+B 淋巴细胞表达水平与24 h 尿蛋白定量呈正相关关系(r=0.860、0.853、0.740、0.816,P <0.001)。
3 讨论
SLE 是一种慢性、多系统多脏器受累的自身免疫疾病[1],临床表现具有高度异质性、复杂性和多样性。发病机制尚不清楚,主要的免疫异常表现为先天和适应性免疫异常、免疫细胞异常活化或功能异常,导致异常抗体、细胞因子、趋化因子生成,进一步引起组织脏器损伤[1-2]。
趋化因子是一组小分子量(7~12 kD)蛋白家族,是细胞因子家族中唯一作用于G 蛋白偶联受体的超家族的成员,趋化因子可以通过对免疫细胞时间和空间定位调控,发挥对免疫系统的发育、免疫监视、免疫启动、免疫调节等作用[5]。即可通过受体诱导吞噬细胞和淋巴细胞等效应细胞的游走和活化,保护机体防御外来致病物,同时趋化因子可在特定的环境中异常表达,过度活化免疫细胞进而攻击正常组织,导致自身免疫性疾病,故趋化因子和自身免疫性疾病密切相关[14-17]。
根据趋化因子N 端保守的半胱氨酸基序,趋化因子可分为4 个亚家族(XC、CC、CXC 和CX3C),相应结合受体分别命名(XCR、CCR、CXCR 和CX3CR)[16]。典型的跨膜趋化因子受体与配体结合,通过G 蛋白依赖途径向胞内传递信号,发挥趋化效应[16]。除了18 个典型的趋化因子受体外,趋化因子受体家族还包括4 种非典型趋化因子受体(Atypical chemokine receptor,ACKR),即ACKR1、ACKR2、ACKR3、ACKR4[18-20]。其中ACKR3 又命名为CXCR7,与CXCL11 和CXCL12双配体结合,通过非G 蛋白依赖性信号的β-arrestin通路途径,不具有经典的趋化性,但能调节趋化因子的趋化性、可用性和效应性,故又称为清道夫受体或诱骗受体[20-21]。
趋化因子CXCL12 是表达最广泛的趋化因子,其主要由单核细胞、中性粒细胞、活化的T 细胞、B 细胞表面及树突细胞表达[22]。CXCL11 为γ 干扰素诱导,白细胞、内皮细胞和成纤维细胞在内的多种细胞系产生[23]。CXCL11、CXCL12 共受体为CXCR7,其中CXCL11 依赖于CXCR7 的N 端和一些细胞外环位置进行初级结合,细胞外环残基介导次级结合和β-arrestin招募。而CXCL12 与CXCR7 结合需要关键残基Asp-1794.60 和Asp-2756.58,没有明显的N 端残基参与,提示CXCL11 与CXCR7 结合、CXCL12 与CXCR7 结合模式不同,其趋化效应、免疫学效应也有所不同[24-25]。
有文献报道,趋化因子CXCL11 在皮肌炎患者肌肉中的表达增加[6]。CXCL11 在正常的唾液腺中几乎不存在,在干燥综合征的唾液腺病变中高表达CXCL11mRNA,提示CXCL11 参与干燥综合征的唾液腺免疫损伤病理过程[11]。CXCL11 参与系统性硬化症毛细血管病变,并与系统性硬化症的严重程度呈正相关[9]。在类风湿关节炎中,CXCR7 在滑膜内皮细胞和未受刺激的人脐静脉内皮细胞上表达,CXCL12 在类风湿关节炎滑膜成纤维细胞表达升高,血管生成和促炎因子增强[10]。另外,CXCL11 在骨关节炎滑膜中上调,通过激活破骨细胞与脾细胞的分化,发挥促炎作用[12]。本课题组前期研究结果提示CXCL12 与其另一受体CXCR4 在SLE、LN 患者外周血T 细胞上高表达,且CXCL12、CXCR4 与SLE 疾病活动评分和肾损害、血液系统损害正相关[26-27]。
本研究结果显示,LN、非LN 的SLE 患者外周血中T、B 细胞表面CXCR7 和血清中CXCL11、CXCL12表达水平均高于健康对照组,差异均有统计学意义(P <0.05)。上述指标表达,LN 患者高于非肾损害SLE 患者,差异均有统计学意义(P <0.05),LN 组患者外周血中CXCR7、CXCL11、CXCL12 表达水平与24 h尿蛋白定量呈正相关,提示CXCR7、CXCL11、CXCL12在LN 患者体内有意义的高表达,与肾损害严重程度相关,CXCR7/CXCL11/CXCL12 生物轴参与LN 发生发展过程。笔者推测LN 患者体内高表达的CXCL11、CXCL12,可与T、B 细胞表面趋化因子受体CXCR7 结合,通过β-arrestin 途径,发挥趋化因子清除、内化、降解、胞吞及自我双向表达调控,诱导自身反应性B 细胞、T 细胞分化和活化,促进免疫复合物沉积在肾脏,促进补体活化和肾脏组织损伤[23-25]。
总结,本研究提示趋化因子CXCR7、CXCL11、CXCL12 高表达与SLE 合并肾脏损害有关联,CXCR7/CXCL11/CXCL12 生物轴可能是LN 发病过程中一种重要的免疫介质,CXCR7/CXCL11/CXCL12 生物轴可能成为LN 治疗的新靶点或有针对性地进行药物干预的关键因子,这也为LN 的临床治疗开辟了新的思路和视野。CXCR7/CXCL11/CXCL12 生物轴与LN 患者肾脏组织结构中的病理特点相关性如何?以及其参与肾损害的下游信号机制为何?本课题组将进一步探讨和研究。
