神经导航联合荧光素钠引导显微手术治疗成人高级别胶质瘤患者预后的影响因素
2022-07-21张义松张晓军孙鹏王忠张瑞剑
张义松 张晓军 孙鹏 王忠 张瑞剑
内蒙古自治区人民医院神经外科,内蒙古呼和浩特 010017
颅内胶质瘤是起源于神经胶质细胞的肿瘤,是最常见的中枢神经系统原发性肿瘤,世界卫生组织(World Health Organization,WHO)中枢神经系统肿瘤分类将胶质瘤WHO Ⅲ、Ⅳ级定义为高级别胶质瘤,治疗上以显微手术切除为主,术后结合放疗、化疗等综合治疗。手术治疗的原则是切除全部肿瘤,术后不增加神经功能损伤。由于胶质瘤与正常脑组织边界不清,沿纤维传导束呈浸润性生长,临床上要做到最大程度且安全的切除肿瘤,仍然是神经外科医生追求的终极目标。在中枢神经系统胶质瘤诊疗规范中推荐,常规应用神经导航、功能神经导航、术中皮层电生理监测和术中实时磁共振成像(magnetic resonance imaging,MRI)或超声影像等技术有助于实现胶质瘤最大范围地安全切除。神经导航技术又称无框架立体定向技术,把患者多种影像数据导入工作站进行数据融合,实时重建肿瘤三维模型。肿瘤周围的血管和传导束及肿瘤组织被三维立体呈现。在术前模拟手术入路及术中判断肿瘤边界及避开血管、传导束和功能区,增加手术的安全性和肿瘤切除程度方面优势明显。荧光引导技术是一种增强肿瘤边界的可视化技术,利用荧光药物标识显影肿瘤组织以增加肿瘤可辨识度,进而增加手术切除程度,减少术中肿瘤的残留,实现最大范围的安全切除肿瘤。采用神经导航技术联合荧光引导术中辅助技术,能够增加手术的安全性和肿瘤的切除程度[1-2]。本研究通过总结应用Brain Lab 神经导航联合荧光素钠荧光引导技术辅助下显微手术治疗成人高级别胶质瘤患者的临床资料,分析其临床特点、手术治疗效果及影响术后生存时间的影响因素。
1 资料与方法
1.1 一般资料
选取内蒙古自治区人民医院神经外科2016 年3 月至2020 年10 月收治的35 例成人高级别胶质瘤患者的临床资料,所有患者均采用在Brain Lab 神经导航联合荧光素钠荧光引导技术辅助下显微手术治疗,其中男21 例,女14 例;年龄29~87 岁,平均(59.3±12.8)岁;病程3~12 周;临床症状头痛及头晕20 例,肢体活动障碍10 例,癫痫发作9 例,意识障碍5 例,失语3 例。入组标准:①年龄>18 岁,术前影像学检查考虑颅内幕上肿瘤性占位病变,无手术禁忌;②术前患者未接受任何形式的治疗,并签署手术知情同意书;③应用Brain Lab 神经导航联合荧光素钠荧光引导术中辅助技术下完成显微手术;④术后病理诊断为高级别胶质瘤,并按照2007 年中枢神经系统肿瘤WHO 分类进行病理分级[3]。排除标准:①治疗中未执行医嘱,影响手术效果;②病例资料和随访资料不完整。本研究课题符合《赫尔辛基宣言》的伦理要求,符合伦理学标准。
1.2 影像学表现
头颅MRI 提示颅内幕上肿瘤性占位病变,T1 加权像为等或低信号,T2 加权像为高信号,大多数病例图像上呈混杂信号,病变形态不规则,占位效应和瘤周围水肿明显,坏死或囊变多见,病变增强均有强化,呈不规则花环样强化。肿瘤位于额叶11 例,颞叶7 例,岛叶4 例,额颞叶4 例,丘脑3 例,额顶叶3 例,颞顶叶2 例,其中多发胶质瘤3 例。肿瘤位于功能区16 例,非功能区19 例。
1.3 手术切除程度及术中辅助技术
1.3.1 手术切除程度的判断 根据术前及术后头颅MRI[(术前肿瘤体积-术后残留肿瘤体积)/术前肿瘤体积]评估肿瘤切除情况,肿瘤切除≥90%为全切除,肿瘤切除<90%为非全切除。
1.3.2 多模态神经导航术中辅助技术 患者术前头颅计算机断层扫描术、MRI、弥散张量成像、磁共振血管成像、磁共振静脉成像原始医学数字影像和通讯数据录入Brain Lab 导航工作站数据重建,设计皮肤切口、骨窗范围、皮层入路,勾画肿瘤,辨别重要纤维束与肿瘤的毗邻关系。全麻插管麻醉显效后May field 三钉头架固定头部,患者信息录入导航工作站,安装Brain lab 参考头架,使用Z-touch 激光和/或导航棒注册,注册成功后导航探针勾画肿瘤体表投影,确定头皮切口和骨窗大小。切开硬脑膜前,再次使用导航探针判断肿瘤深度、范围及边界,避开重要动脉、静脉及功能区,术中导航探针反复多次帮助辨别肿瘤边界,完成肿瘤切除。
1.3.3 荧光素钠荧光引导技术 在术前或切开硬膜前1.5 h 做荧光素钠皮试,荧光素钠注射液(历设得5 ml/500 mg 和广州梧州3 ml/600 mg)稀释为1% 5 ml 静脉滴注,观察患者生命体征有无变化,皮肤有无皮疹。15 min 后无异常者视为皮试阴性,随后缓慢静脉滴注荧光素钠注射液(1.5~2.0 mg/kg),完成荧光素钠的给药过程。6 h 内完成显微镜下操作的病例术中无需二次给药。切开硬脑膜后激活Yellow 560 荧光模式,在荧光显微镜模式下观察和完成肿瘤切除。白光模式和荧光模式切换方便,不额外增加手术时间。在荧光模式下肿瘤中心区域呈黄色,肿瘤周边区域呈浅黄色,肿瘤周围正常脑组织无黄染。
1.4 术后综合治疗
部分患者术后4~6 周接受放疗联合辅助化疗。放射治疗照射总剂量为54~60 Gy,1.8~2.0 Gy/次,1 次/d,分割为30~33 次。化疗采用替莫唑胺(厂家:杭州默沙东利药有限公司;批号:H20171;规格:100 mg/粒)同步放疗联合辅助化疗的标准给药方案(Stupp 方案)和剂量密度给药方案。
1.5 随访
据患者病情和肿瘤病理级别,术后间隔3~6 个月进行门诊复查,影像学复查判断肿瘤是否复发,计算生存时间。
1.6 统计学方法
采用SPSS 26.0 统计软件进行数据分析,用Kaplan-Meier 法计算总体生存率,单因素分析采用logrank 法检验,多因素分析采用Cox 回归模型评估独立危险因素。以P <0.05 为差异有统计学意义。
2 结果
2.1 病理结果
术后WHO Ⅲ级14 例(间变星形细胞瘤9 例和间变少突胶质细胞瘤5 例),WHO Ⅳ级胶质母细胞瘤21 例。Ki-67 阳性表达率≥20%的有17 例,Ki-67 阳性表达率<20%的有18 例。
2.2 手术切除程度与并发症
肿瘤全切24 例,非全切11 例。术后肺部感染4 例,其中2 例行气管切开。颅内感染1 例,1 例术后并发深静脉血栓并接受植入滤器介入治疗。
2.3 随访结果和生存情况
随访截至2021 年5 月,随访时间为6~60 个月,平均为(22.4±8.6)个月。术后肿瘤复发22 例,肿瘤复发死亡20 例,患者1 年生存率为76.4%,2 年生存率为44.4%,3 年生存率为23.8%(图1)。不同病理级别患者生存率见表1。

图1 患者的总体Kaplan-Meier 生存曲线

表1 不同病理级别患者的生存率[例(%)]
2.4 预后分析
不同性别、肿瘤部位、切除程度、病理级别、Ki-67指标、治疗方式及有无癫痫和并发症患者的存活率比较,差异有统计学意义(P <0.05),见表2。肿瘤部位(RR=0.105,P=0.001)、并发症(RR=7.406,P=0.026)和Ki-67 指标(RR=3.524,P=0.028)是成人高级别胶质瘤患者生存时间的影响因素。术后有无并发症和Ki-67 阳性指标是患者预后的独立危险因素(P <0.05),见表3。

表2 影响成人高级别胶质瘤患者术后生存时间的单因素分析
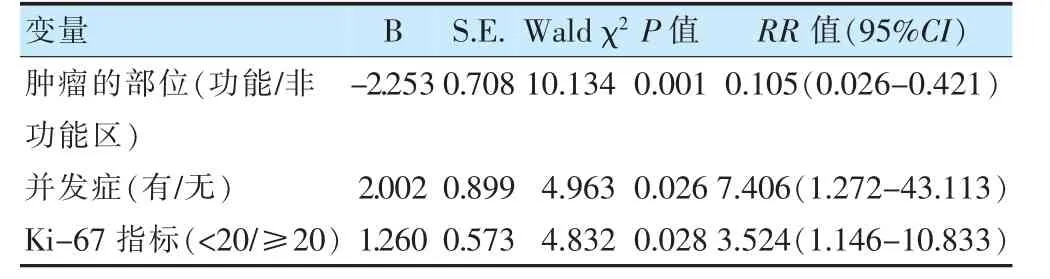
表3 Cox 多因素分析影响35 例成人高级别胶质瘤预后的因素
3 讨论
恶性肿瘤约占中枢神经系统肿瘤的29.7%,这其中约80%是神经胶质瘤[4]。在胶质瘤手术治疗中,胶质瘤切除程度直接影响着患者的预后[5]。临床上要做到肿瘤最大范围的切除和神经功能最小程度的损害之间的平衡,单纯依靠显微手术技术是远远不够的。基于多模态影像神经导航技术和术中荧光引导技术能够帮助神经外科医生实现这一目标[6]。
3.1 术中辅助技术
荧光引导技术是一种能增强肿瘤边界的可视化技术,利用荧光药物显影肿瘤细胞以增加肿瘤与正常脑组织可辨别性,进而增加肿瘤手术切除的程度,减少术中肿瘤的残留,实现最大范围的安全切除肿瘤组织,提高患者的生存率[7]。小剂量荧光素钠引导下胶质瘤与正常脑组织边界可辨识度高,能够提高肿瘤的切除程度,且无过敏和药物不良反应[8]。由于荧光素钠作用机制不同于5-氨基乙酰丙酸,周围正常脑组织也可以被荧光素钠染色呈黄色,术者仍需要依据影像学检查和临床经验来判断黄染的组织是否真正需要切除[9-10]。本研究使用的荧光素钠未出现过敏病例,无药物不良反应,提示荧光素钠引导下恶性胶质瘤切除是安全的。神经导航技术能将患者数字影像数据与实际解剖结构进行融合,实时重建肿瘤三维空间结构。模拟手术入路,判断肿瘤边界及肿瘤切除范围,增加手术的安全性和肿瘤切除程度,能够延长患者的无进展生存期和总生存期[11]。两种术中辅助技术的联合应用能够增加胶质瘤手术安全性和肿瘤切除率,实现最大安全切除肿瘤的目标[12-15]。
3.2 预后因素分析
患者性别、年龄、术前卡式功能状态评分、肿瘤部位、术前有无癫痫发作、术后WHO 病理分级、肿瘤的切除程度、术后有无并发症和术后是否接受放疗和化疗的治疗方案,这些因素均影响胶质瘤手术切除的预后效果[16-18]。Ki-67 是一种增殖细胞相关抗原,主要用于标记增殖周期中的细胞,Ki-67 阳性表达率越高,肿瘤分化越差,预后也越差[19]。Ki-67 的高表达与胶质瘤患者的无进展生存期和总生存期的降低有明显相关性,meta 分析显示Ki-67 阳性表达率是胶质瘤患者预后不良的预测因素[20-22]。本研究结果显示,Ki-67 阳性表达率是影响成人高级别胶质瘤患者总生存率的独立危险因素。临床上是否可以用Ki-67 阳性表达率20%来分界预后的好与差,尚需大样本病例加以验证。肿瘤的切除程度影响预后毋庸置疑,胶质瘤手术切除率是判断预后的独立危险因素[23]。本组病例肿瘤切除程度不是判断预后的独立危险因素,可能与本组病例偏少有关。对于胶质瘤术后放疗和化疗的作用也是非常重要的,直接影响患者的总生存率[24]。手术切除肿瘤术后联合放化疗是新诊断的胶质母细胞瘤的标准治疗方案[25]。
综上所述,神经导航联合显微镜下荧光素钠引导术中辅助技术,可以增加胶质瘤显微手术切除肿瘤的程度,提高手术的安全性。手术后并发症和Ki-67指标是成人胶质瘤预后的影响因素,可作为判断预后的重要指标。
