结肠癌患者血清miR-125b 和miR-18b 的表达及临床意义
2022-07-21苗金鱼何丽彩王春艳王敬然丁秋蕾
苗金鱼 何丽彩 刘 媛 王春艳 王敬然 丁秋蕾
1.石家庄市人民医院检验科,河北石家庄 050000;2.河北省优抚医院外一科,河北石家庄 050000;3.石家庄市人民医院肿瘤科,河北石家庄 050000
结肠癌是我国第二大癌症,2020 年我国新确诊结直肠癌患者55.5 万例,死亡28.6 万例,分别占我国全部癌症的12.2%和9.5%[1]。近年来,早期结肠癌检出率有所上升,但标准药物治疗仍存在局限,中晚期结肠癌患者生存率仍然较低[2-3]。及时判断结肠癌患者预后对早期采取相应措施和延长生存时间意义重大。微小RNA(microRNA,miRNA)是一种小RNA 分子,通过调控靶基因表达参与肿瘤的发生发展[4]。近年研究报道,miR-125b、miR-18b 在结肠癌细胞中表达上调,与细胞增殖、侵袭、迁移有关[5-6]。但关于二者在外周血循环中表达与结肠癌预后的关系尚无研究报道,本研究就此进行分析,以期为结肠癌诊治和预后评估提供参考。
1 资料与方法
1.1 一般资料
选取2015 年1 月至2016 年8 月石家庄市人民医院(以下简称“我院”)收治的134 例结肠癌患者为结肠癌组,其中男71 例,女63 例;年龄41~78 岁,平均(60.54±12.54)岁;肿瘤直径:52 例≥5 cm,82 例<5 cm;分化程度:低分化28 例,中高分化106 例;TNM分期[7]:Ⅰ~Ⅱ期87 例,Ⅲ~Ⅳ期47 例;淋巴结转移35 例。纳入标准:①经病理检查确诊为结肠癌;②初诊,未接受任何抗肿瘤治疗;③患者及家属知情并签署同意书。排除标准:①合并肠道感染性疾病、溃疡性结肠炎等其他肠道疾病或其他部位恶性肿瘤;②免疫和血液系统疾病。另选取同期我院70 名体检健康者为对照组,其中男37 名,女33 名;年龄26~78 岁,平均(60.68±11.57)岁。两组一般资料比较,差异无统计学意义(P >0.05)。本研究经医院伦理委员会批准。
1.2 检测方法
采集患者入院后次日清晨和对照组体检时空腹静脉血,3000 r/min 离心10 min(离心半径为10 cm),分离血清于-80℃冰箱中保存待测。TRIzol 试剂盒(上海雅吉生物科技有限公司,批号:2014007)提取血清总RNA,Takara 试剂盒(北京宝日医生物技术有限公司,批号:20140844)转录合成cDNA,Narodrop 验证cDNA 浓度及纯度,使吸光度(optical density,OD)260/OD280为1.8~2.0,使用伯乐CFX96 qRT-PCR 仪和qRT-PCR 试剂盒(广州市锐博生物科技有限公司,批号:20142522)进行扩增。miR-125b 正向引物:5’-TAAGGACAAAACGGGACTGG-3’,反向引物:5’-CCTCTTGCCACTTGCTTTTC-3’;miR-18b 正向引物:5’-CTCGCTACGCGGCAGCACA-3’,反向引物:5’-ACGCTFCACGAATTTGCGAT-3’。反应体系(20 μl):1 μl cDNR、1 μl上游引物、2μl上游引物、10μl SYBR Green Master Mix、6 μl ddH2O;反应条件:95℃30 s(1 个循环)、95℃15 s、62℃30 s、72℃20 s(40 个循环)。以U6(正向引物:5’-GGGCACGAAGGCTCATCATT-3’,反向引物:5’-AGCGAGCATCCCCCAAAGTT-3’)作为内参校正。2-ΔΔCt法计算血清miR-125b、miR-18b 相对表达量。
1.3 随访
以患者出院日为起点,通过门诊或电话随访5 年,随访截至2021 年8 月,记录患者生存情况。
1.4 统计学方法
采用SPSS 26.0 统计学软件进行数据分析,服从正态分布的计量资料用均数±标准差()表示,组间比较采用t 检验;计数资料用例数或百分率表示,组间比较采用χ2检验;K-M 法绘制不同miR-125b、miR-18b 表达结肠癌患者生存曲线,组间比较采用log-rank 检验;受试者操作特征(receiver operating characteristic,ROC)曲线分析血清miR-125b、miR-18b 表达对结肠癌预后不良的预测价值,曲线下面积(area under the curve,AUC)比较采用Z 检验。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组血清miR-125b、miR-18b 表达水平比较
结肠癌组血清miR-125b、miR-18b 表达为(0.828±0.201)、(1.205±0.166),对照组为(1.442±0.305)、(0.617±0.131)。结肠癌组血清miR-125b 表达水平低于对照组,miR-18b 表达水平高于对照组(t=15.194、25.749,P <0.001)。
2.2 临床病理特征与血清miR-125b、miR-18b 表达的关系
不同TNM 分期、淋巴结转移患者血清miR-125b和miR-18b 表达比较,差异有统计学意义(P <0.05)。不同性别、年龄、肿瘤直径、分化程度患者血清miR-125b 和miR-18b 表达比较,差异无统计学意义(P >0.05)。见表1。
表1 临床病理特征与血清miR-125b、miR-18b 表达的关系()
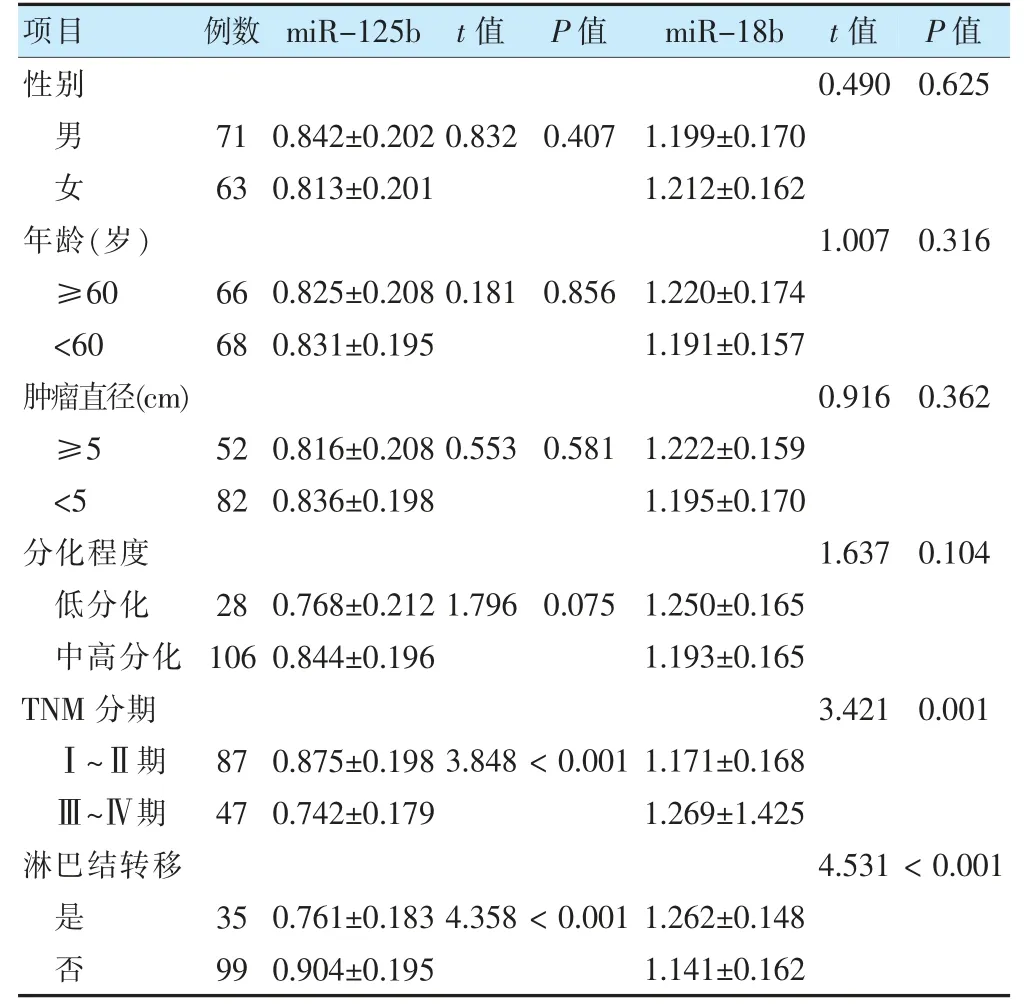
表1 临床病理特征与血清miR-125b、miR-18b 表达的关系()
2.3 血清miR-125b、miR-18b 表达与结肠癌患者生存率的关系
随访3~60 个月,中位时间36.50(17.75,49.00)个月,134 例结肠癌患者死亡52 例,总生存率为61.19%(82/134)。以血清miR-125b、miR-18b 表达均值为基准分为高低表达组,miR-125b 高表达组总生存率为77.61%(52/67),中位生存期为38.00(21.00,52.00)个月;低表达组总生存率为44.78%(30/67),中位生存期为33.00(16.00,45.00)个月。miR-18b 高表达组总生存率为41.79%(28/61),中位生存期为33.00(16.50,44.50)个月;低表达组总生存率为73.97%(54/73),中位生存期为38.00(20.50,51.50)个月。K-M 曲线显示,miR-125b 高表达组总生存率高于miR-125b 低表达组(log-rank χ2=15.601,P <0.001);miR-18b 高表达组总生存率低于miR-18b 低表达组(log-rank χ2=12.047,P <0.001)。见图1。

图1 不同血清miR-125b、miR-18b 表达结肠癌患者生存曲线
2.4 血清miR-125b、miR-18b 表达对结肠癌预后不良的预测价值
ROC 曲线显示,血清miR-125b 与miR-18b 联合预测结肠癌预后不良的AUC 值大于miR-125b、miR-18b 单独预测(P <0.05)。见表2、图2。

图2 血清miR-125b、miR-18b 表达预测结肠癌预后不良的ROC 曲线
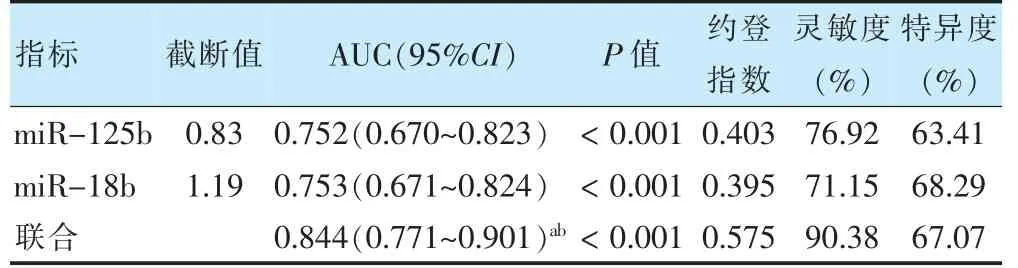
表2 血清miR-125b、miR-18b 表达对结肠癌预后不良的预测价值
3 讨论
结肠癌是常见的消化道恶性肿瘤,大多患者确诊时已为晚期,失去手术根治时机[8-9]。尽管近年术后化疗、放疗、靶向治疗等手段取得一定效果,但结肠癌细胞增殖能力和耐药性强,超过1/3 的结肠癌患者在术后会发生局部复发或远处转移,转移性患者5 年生存率仅为10%[10]。
表观遗传学在肿瘤中发挥重要作用[11]。miRNA 是表观遗传学的重要一环,可通过降解靶基因mRNA或抑制靶基因mRNA 的蛋白质翻译调控靶基因的表达,与肿瘤发生发展密切相关[12-13]。如miR-101 能靶向Zeste 同源物2 抑制结肠癌细胞迁移[14],miR-200c能靶向程序性死亡蛋白配体1 基因抑制结肠癌细胞增殖、迁移和侵袭[15]。miR-125b 的两个前体为miR-125b-1 和miR-125b-2,分别位于染色体11q24.1 和21q21.1。早期研究发现,其在多种恶性肿瘤中异常表达,如许伟先等[16]研究报道,上调胰腺癌细胞和组织中miR-125b 表达,能抑制胰腺癌细胞增殖和迁移。洪理泉等[17]研究报道,乳腺癌细胞中miR-125b 表达下调,能靶向结合ETV63’UTR 调控Hs578T 细胞,抑制乳腺癌细胞增殖和迁移。提示miR-125b 在不同肿瘤中发挥不同作用。本研究结果显示,结肠癌患者血清miR-125b 表达降低,且与TNM 分期、淋巴结转移有关,提示miR-125b 低表达导致结肠癌恶性进展。其机制可能与miR-125b 靶向抑制髓细胞白血病基因-1(myeloid cell leukemin-1,Mcl-1)和信号转导和转录激活因子3(signal transduction and transcription activator 3,STAT3)有关。Mcl-1 是一种凋亡调控基因,能通过维持线粒体膜稳定,抑制细胞色素C 释放,阻止癌细胞凋亡[18]。STAT3 为细胞信号和转录激活的重要激活因子,能通过激活Janus 激酶/STAT 信号通路,参与细胞增殖、分化[19]。研究表明,上调miR-125b 表达能靶向抑制Mcl-1 和STAT3 表达,进而抑制结肠癌细胞增殖、侵袭及促进凋亡[5,20]。通过绘制结肠癌患者5 年生存曲线发现,miR-125b 高表达组5 年总生存率显著升高,提示miR-125b 低表达与结肠癌患者预后不良有关,可能成为预后分子标志物。
miR-18b 位于染色体Xq26.2,早期研究多报道其与氧化应激的关系[21]。miR-18b 在胃癌细胞和组织中表达上调,能靶向Kruppel 样因子6 促进胃癌细胞增殖和侵袭[22]。Yang 等[23]研究显示,miR-18b 在肝癌细胞中表达下调,能靶向核仁纺锤体相关蛋白-1 抑制肝癌细胞增殖。说明miR-18b 也在不同肿瘤中发挥不同作用。本研究结果显示,结肠癌患者血清miR-18b 表达升高,且与TNM 分期、淋巴结转移有关,提示miR-18b 高表达导致结肠癌恶性进展,其机制可能与miR-18b 能靶向上调细胞周期蛋白依赖性激酶抑制剂2B(cyclin dependent kinase 2 inhibitor B,CDK2B)有关。CDK2B 是一种促癌基因,位于多种肿瘤中经常突变和缺失的区域,促进癌细胞生长和周期进展[24-25]。研究报道,沉默miR-18b 表达能抑制CDK2B 表达,抑制结肠癌细胞增殖和迁移[6]。进一步分析发现,miR-18b 高表达组5 年总生存率显著降低,说明miR-18b 高表达与结肠癌患者预后不良有关,可能成为预后分子标志物。ROC 曲线结果显示,血清miR-125b、miR-18b 均能作为结肠癌预后不良指标,且两指标联合预测结肠癌预后不良的AUC 较单独预测显著增加,提示联合检测血清miR-125b、miR-18b 能提升对结肠癌预后不良预测价值。
综上所述,结肠癌患者血清miR-125b 表达降低,miR-18b 表达升高,与TNM 分期和淋巴结转移相关,可作为预后不良预测指标。但本研究结果还需多中心大样本研究进一步验证,并深入研究miR-125b、miR-18b 影响结肠癌预后的机制。
