微生物发酵合成γ-PGA发酵条件优化
2022-07-20王风青冉光雨
王风青,冉光雨
(四川轻化工大学生物工程学院,四川 宜宾 644000)
引 言
γ-聚谷氨酸(γ-polyglutamic acid,γ-PGA)是谷氨酸通过α-氨基与γ-羧基之间形成γ-酰胺键连接而成的高分子聚合物,其相对分子量为100~1000 kD[1-2]。γ-PGA 有3 种化学立体结构:D-谷氨酸组成的均聚物γ-(D)-PGA、L-谷氨酸组成的均聚物γ-(L)-PGA 以及D-型与L-型谷氨酸按不同比例组成的γ-(D,L)-PGA[3-4]。纯品γ-PGA 的紫外吸收峰在216 nm 处,不同于蛋白质的紫外吸收峰280 nm 处[5]。杨革等[6]发现γ-PGA 的二级结构的80%是β-折叠和无规则卷曲。由于γ-PGA 主链上存在大量的游离亲水性羧基,使得γ-PGA 分子内或分子间会形成水分子与谷氨酸残基的氢键,从而让聚合物具有优异的吸水保湿性能[7]。γ-PGA 的一些活性部位为某些材料的功能化实现给予了结合位点,因此在生理学上,可以通过添加γ-PGA 来防止细胞被蛋白酶降解并阻止细胞脱水[8]。
γ-PGA 与其他高聚物材料相比在绿色环保方面具有诸多优势,让其在众多领域得到应用。γ-PGA 可在环保领域中使用,作为重金属离子和放辐射性物质的契合剂[9];添加钙离子可减少γ-PGA的用量[10];阳离子型γ-PGA 絮凝剂和氯化铁复配改性,可以高效去除海水中总悬浮固体与化学需氧量[11];王芳等[12]利用SY-Z5 巨大芽孢杆菌产生的生物絮凝剂与SY-ND 枯草芽孢杆菌产生的γ-PGA 复配能够有效去除焦化废水中65%的悬浮物。在食品领域,γ-PGA 能够有效改善面制品耐冻性质、韧性和耐压性[13-14];也可用于增强葡萄的抗冻性[15],还可以用于保护果汁中的双歧杆菌细胞,从而使其存活率提高[16];γ-PGA 完全水解后补充人体所需谷氨酸并增加食欲,同时也可以作为食品的增稠剂和除涩剂[17]。γ-PGA在应用于化妆品中能促进组织修复和细胞生长[18];且γ-PGA 制成的化妆品具有良好的抗菌活性、提高皮肤免疫力、抚平肌肤细纹[19]以及改善发质[20]等作用。γ-PGA在医疗领域可用作手术缝线和医用绷带等[21];γ-PGA 还能提高药物的耐久性和药物的有效性,控制药物释放速率[22];γ-PGA靶向性可以通过糖基修饰得到增强且不会在体内产生积蓄和毒副作用[23]。在农业领域,γ-PGA 的使用能显著提高种子的出苗率[24],还可作为农药、肥料的缓释剂[25];γ-PGA制成的吸水树脂,可以有改善土壤特性和保湿性[26];γ-PGA作为种子的理想包衣,从而提高种子的发芽率[27]。
基于此,首先通过单因素试验确定较优因素,然后将较优因素利用Minitab19 软件进行响应面设计找到最大γ-PGA 产量的最佳发酵条件,从而试图解决γ-PGA生产过程中原材料消耗高、γ-PGA产量低的问题,这对γ-PGA的工业生产具有重要意义。
1 试验方法
1.1 材料与仪器
枯草芽孢杆菌B.subtilisYSH18 是由实验室分离冷藏的菌种;氯化钠(AR),成都金山化学试剂有限公司;牛肉浸粉(AR),北京鸿润宝顺科技有限公司;无水氯化钙(AR),西格玛奥得里奇贸易有限公司;蛋白胨(生化试剂),北京奥博星生物技术有限责任公司;α-耐高温淀粉酶(生化试剂),酷尔化学科技有限公司;糖化酶(生化试剂),酷尔化学科技有限公司;谷氨酸钠(食品级),上海太太乐食品有限公司;磷酸氢二钾(K2HPO4,AR),成都市科隆化学品有限公司;氢氧化钠(AR),成都市科隆化学品有限公司;十六烷基三甲基溴化铵(CTAB,AR),上海麦克林生化科技有限公司;糊精(AR),成都市科隆化学品有限公司;玉米粉,市售;蔗糖(AR),成都市科隆化学品有限公司。
鼓风干燥箱(DHG-9070A),上海助蓝仪器科技有限公司;电热恒温培养箱(H10-50BS),天津宏诺仪器有限公司;压力蒸汽灭菌锅(DY04-13-44-00),上海东亚压力容器制造有限公司;气浴振荡器(THZ-A),上海助蓝仪器科技有限公司;电子天平(FA2004N),杭州万特电子仪器有限公司;生物洁净工作台(BCM-1000A),苏州安泰空气科技有限公司;电子天平(WT2002),杭州万特衡器有限公司;万用电炉(DL-1),北京市永光明医疗仪器有限公司;立式透明门冷藏柜(SC-240JA),青岛海尔特种电冰柜有限公;pH 计(pHS-3E),上海仪电科学仪器股份有限公司;落地振荡摇床(HZ-9610KB),太仓市华利达试验设备有限公司;紫外可见分光光度计(UV-1800),翱艺仪器(上海)有限公司;折光仪(LH-F90),杭州陆恒生物科技有限公司。
1.2 试验方法
1.2.1 培养基与培养条件
种子培养基:蛋白胨浓度为10 g·L-1,牛肉浸粉浓度为3 g·L-1,葡萄糖浓度为20 g·L-1,氯化钠浓度为10 g·L-1,水1000 mL,pH为7.0~8.0,装液量50 mL/250 mL、转速150 r/min、温度37 ℃,振荡培养18 h。
基础发酵培养基:蛋白胨浓度为5 g·L-1,谷氨酸钠浓度为30 g·L-1,氯化钠浓度为3 g·L-1,磷酸氢二钾浓度为1 g·L-1,玉米糖化液浓度(按可溶性固形物计)为40 g·L-1,装液量50 mL/250 mL、转速150 r/min、温度37 ℃,摇床培养48 h。
摇瓶培养:2%(v/v)的接种量,50 mL/250 mL的装液量,150 r/min的转速,37 ℃的培养温度,培养48 h。
1.2.2 玉米糖化液的制作
向锅中加入3000 mL 水,再加入3.0 g 无水CaCl2,调节pH 值为6.7~7.0,加入3000 g 市售玉米粉,搅拌均匀,再加入2.5 g α-耐高温淀粉酶(酶活为4000 U),加热至80~85 ℃,保持温度15~20 min,然后继续冷却至58~60 ℃。调节pH 值至4.5 左右,加糖化酶0.1 g(酶活为100 000 U),保持60 ℃左右加热4 h,再煮沸10 min,用纱布过滤残渣,再用棉花过滤,得到澄清玉米糖化液。测定还原糖浓度后,低温保存备用。
1.2.3 单因素试验
(1)不同碳源及浓度对γ-PGA 产量的影响:改变1.2.1 节“基础发酵培养基”中玉米糖化液浓度为30、50、70、90、110 g·L-1与130 g·L-1(按可溶性固形物计)配制每组发酵培养基并平行3 组进行发酵。分别用糊精与蔗糖代替1.2.1 节“基础发酵培养基”中的玉米糖化液,并按照糊精(或蔗糖)浓度为10、30、50、70、90 g·L-1与110 g·L-1配制每组发酵培养基并平行3 组进行发酵。发酵结束后以γ-PGA 的含量为指标确定最佳的碳源及其浓度。
(2)不同氮源及浓度对γ-PGA 产量的影响:分别用牛肉浸粉或酵母浸粉代替1.2.1节“基础发酵培养基”中的蛋白胨,并按照牛肉浸粉浓度为10、30、50、70、90 g·L-1与110 g·L-1(或酵母浸粉浓度为5、7、9、11、13 g·L-1与15 g·L-1)配制每组发酵培养基并平行3 组进行发酵。发酵结束后以γ-PGA 的含量为指标确定最佳的氮源及其浓度。
(3)氯化钠的浓度对γ-PGA 产量的影响:依据1.2.1节中“基础发酵培养基”,改变基础发酵培养基中的氯化钠浓度分别为6、8、10、12、14 g·L-1与16 g·L-1,配制每组发酵培养基并平行3 组进行发酵,发酵结束后以γ-PGA 的含量为指标确定最佳的氯化钠浓度。
(4)磷酸氢二钾浓度对γ-PGA 产量的影响:依据1.2.1节中“基础发酵培养基”,改变基础发酵培养基中的磷酸氢二钾浓度分别为1、2、3、4、5 g·L-1与6 g·L-1,配制每组发酵培养基并平行3 组进行发酵,发酵结束后以γ-PGA 的含量为指标确定最佳的磷酸氢二钾浓度。
(5)前体物质谷氨酸钠的浓度对γ-PGA 产量的影响:依据1.2.1 节中“基础发酵培养基”,改变基础发酵培养基中的谷氨酸钠浓度分别为0、10、20、30、40 g·L-1与50 g·L-1,配制每组发酵培养基并平行3组进行发酵,发酵结束后以γ-PGA 的含量为指标确定最佳的谷氨酸钠浓度。
1.2.4 Plackett-Burman设计
Plackett-Burman 设计比其他因子筛选方法更实用,能以较少的测试次数筛选出对响应值有显著影响的因子。本试验采用试验次数为12 组的Plackett-Burman 设计,以γ-PGA 产量为响应值,选取影响γ-PGA 产量的5 个主要因素,其中,高水平“1”是低水平“-1”的1.5~2 倍。对试验结果,首先各对因素的影响进行t检验。选α< 0.05 的因子作为显著因子进行进一步研究。Plackett-Burman 试验水平值见表1。

表1 Plackett-Burman设计各因素及其水平
1.2.5 最陡爬坡试验
响应曲面需要考虑在一定范围内的区域才能响应设计的可行性。当多个因子分别与各自的步长和方向进行移动时就可以大致找出这个范围,而这个移动过程就是最陡爬坡试验。依据Plackett-Burman 设计试验结果,选取对γ-PGA 产量影响显著的因素,设计对应的方向和步长。根据爬升方向上效应值的变化,如果有正效应,则取高水平再增加;如果有负效应,则取低水平,然后减少。步长可根据单因素试验的变化来确定。
1.2.6 Box-Behnken响应面设计
确定显著因素的最优水平:逼近最大γ-PGA 产量区后,进行Box-Behnken 响应面设计,以试验结果拟合建立描述响应量(γ-PGA 产量)与自变量(影响γ-PGA 产量的显著因素)关系的多项式回归模型,再对拟合方程进行规范性分析,寻找回归模型的稳定点,得到最大γ-PGA 产量时显著因素的水平此即最优水平,并进行试验验证。Box-Behnken 设计的因素水平见表2。
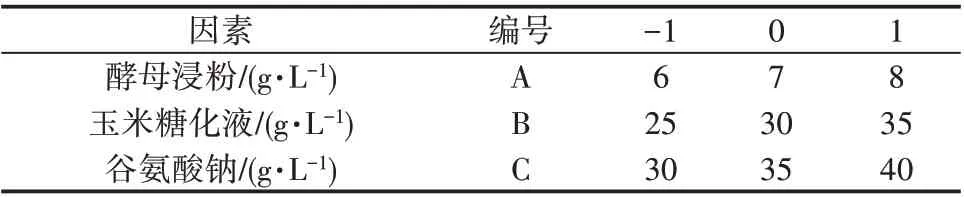
表2 Box-Behnken设计的因素水平
1.3 分析方法
1.3.1 CTAB-NaOH 溶液的配置
用天平在准确称取5.0000 g氢氧化钠于烧杯中,加入少量去离子水使其完全溶解,然后倒入100 mL容量瓶中,再取少量去离子水冲洗烧杯并倒入容量瓶,重复两次,最后用去离子水定容至100 mL,准确称取CTAB 0.2000 g,倒入NaOH溶液中。
1.3.2 γ-PGA浓度的测定(CTAB比浊法)
(1)标准曲线的制备[28]:用标准γ-PGA 样品配置成10、20、30、40 g·L-1与50 g·L-1的标液,分别与1.3.1 节配制的CTAB-NaOH 溶液1∶1 混合,室温下反应时间约3 min 后,用预热20 min 的紫外分光光度计在波长为250 nm 下测定其吸光度。绘制γ-PGA(g/L)-OD250nm标准曲线,如图1所示。3 min 后,倒入石英比色皿,用水作为校准管。在预热20 min 并设置波长250 nm 的紫外分光光度计下测定吸光度值(OD)。
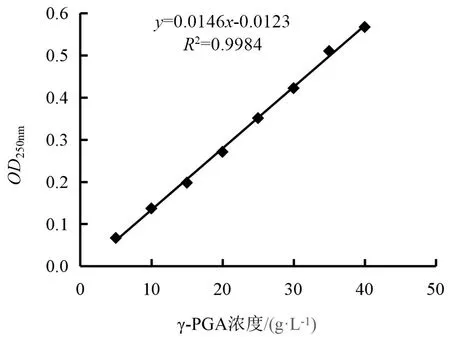
图1 γ-PGA标准曲线
1.3.3 可溶性固形物含量的测定
取适量液体于校准后的LH-F90 折光仪,对准光源,读取数值[29]。
1.3.4 数据分析
所有单因素试验,都进行3组平行试验并重复3次,响应面试验设计及数据分析,采用Minitab19 与Design Expert 11软件完成。
2 结果与讨论
(2)发酵液的测定:取稀释的发酵液,加入等体积CTAB 溶液反应,并用旋涡震荡仪震荡。反应
2.1 单因素试验
2.1.1 不同碳源及浓度对合成γ-PGA的影响
微生物培养基中碳源的类型和浓度对于微生物的生长及其合成产物具有重要影响。碳源在微生物生长代谢中的主要作用是为细胞提供碳骨架,为细胞生命活动提供能量。因此,碳源在微生物培养基或细胞培养基中起着重要的作用。蔗糖、玉米糖化液和糊精对合成γ-PGA 的影响如图2 所示。
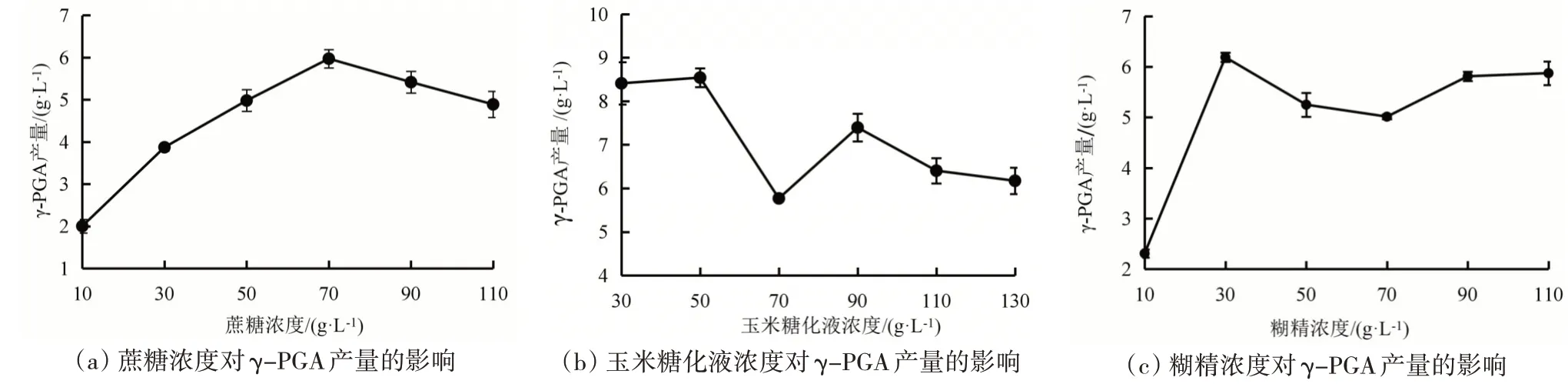
图2 不同碳源及浓度对合成γ-PGA产量的影响
由图2 可知,3 种碳源浓度均为50 g/L 时,玉米糖化液的浓度对γ-PGA 的产量影响最大,为8.54 g/L,而其他两种情况下的γ-PGA 的产量分别为4.98 g/L、5.25 g/L。这是因为采用双酶法制备的玉米糖化液是将长链的淀粉第一次酶解成相对小分子的糊精和麦芽糖等二糖,再由糖化酶进一步酶解成更小的葡萄糖,因此玉米糖化液中除了有大量的葡萄糖外还有糊精和其他可利用碳源[30]。所以在同一浓度的不同碳源下,玉米糖化液具有更多的可利用碳源种类,使得其较糊精和蔗糖对微生物发酵有更大碳源的吸收效率,提供的营养更加全面。因此选择50 g/L的玉米糖化液作为碳源较为适宜。
2.1.2 不同氮源及浓度对γ-PGA产量的影响
微生物生长和合成产物与氮源的种类和浓度息息相关,这能够很大程度上影响次级代谢产物的产生。酵母浸粉、牛肉浸粉对合成γ-PGA 的影响如图3所示。
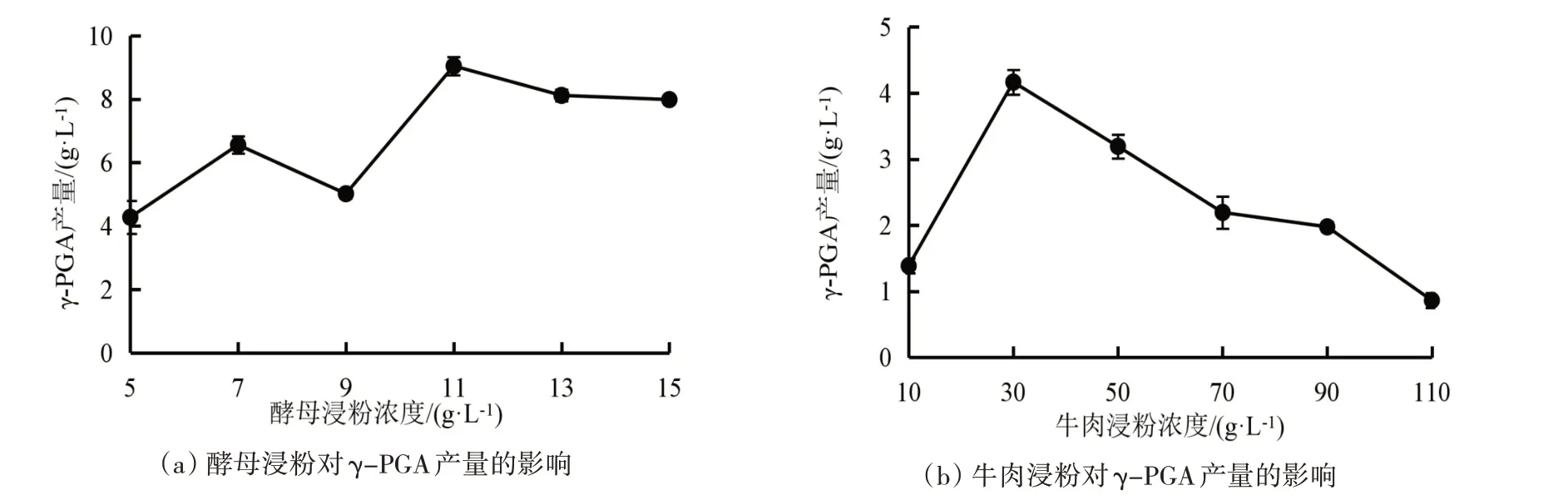
图3 不同氮源及浓度对γ-PGA产量的影响
从图3 可知,γ-PGA 的产量在酵母浸粉浓度为11 g/L 时可达到9.04 g/L;γ-PGA 的产量在牛肉浸粉浓度为30 g/L 时仅为4.17 g/L。因此酵母浸粉在含量较小时就可以使γ-PGA 的产量达到较高水平;而牛肉浸粉含量越大特别是30 g/L 以后γ-PGA 的产量反而越小。张雷等[31]在进行Bacillus subtilis菌株发酵产γ-PGA 的培养基优化研究中发现在有机氮源中,酵母浸粉对γ-PGA 的产量的影响大于牛肉粉,且酵母浸粉营养成分为酵母来源,其营养结构与微生物较为相似。综上所述,选择11 g/L 的酵母浸粉作为氮源较为适宜。
2.1.3 氯化钠、磷酸氢二钾与谷氨酸钠的浓度对γ-PGA产量的影响
氯化钠可以调节渗透压、pH值和氧化还原电位。氯化钠的浓度对γ-PGA 产量的影响如图4(a)所示。由图可知,γ-PGA 的产量在氯化钠浓度达到12 g/L时,γ-PGA 的产量最大,为6.55 g/L。而后γ-PGA 的产量随着氯化钠浓度增加反而下降,这可能是由于盐浓度增加引起渗透压增大,阻止了菌体正常的生命代谢活动。所以氯化钠浓度选择12 g/L。
磷酸氢二钾具有促进菌体生长的作用[32],磷酸氢二钾的浓度对γ-PGA产量的影响如图4(b)所示。由图4(b)所知,磷酸氢二钾浓度为4 g/L 时,γ-PGA的产量大幅增加,并在其浓度为5 g/L 时达到最大值,为5.20 g/L。所以磷酸氢二钾的最佳浓度为5 g/L。
生产γ-PGA 的产量较低的一般为γ-PGA 产生菌非谷氨酸依赖型菌株,但是非谷氨酸依赖型菌株的使用,可以用少量的谷氨酸钠作为前体物质得到大量的γ-PGA,这对于实际工业生产具有重要研究意义[33]。谷氨酸钠浓度对γ-PGA 产量的影响如图4(c)所示。由图可知,当谷氨酸钠浓度为0 时仍有γ-PGA 产生,这说明本研究所用的枯草芽孢杆菌B.subtilisYSH18 是一种非谷氨酸依赖型菌株,该类菌株添加少量谷氨酸钠就可使γ-PGA 产量增加[28]。当谷氨酸钠浓度为20 g/L时γ-PGA产量最大。
2.2 Plackett-Burman设计
利用minitab19 对试验进行设计与分析分别见表3 与表4。由表4 可知,R2=0.9722=0.8889,= 0.9491,均接近于1,这说明拟合得到的多项式γ-PGA=9.712-0.1288A-0.06783B+0.1311C+0.0444D+0.0746E 与试验很相符,可用来判别各种影响因素的显著性。统计分析所得Pareto图如图5所示。
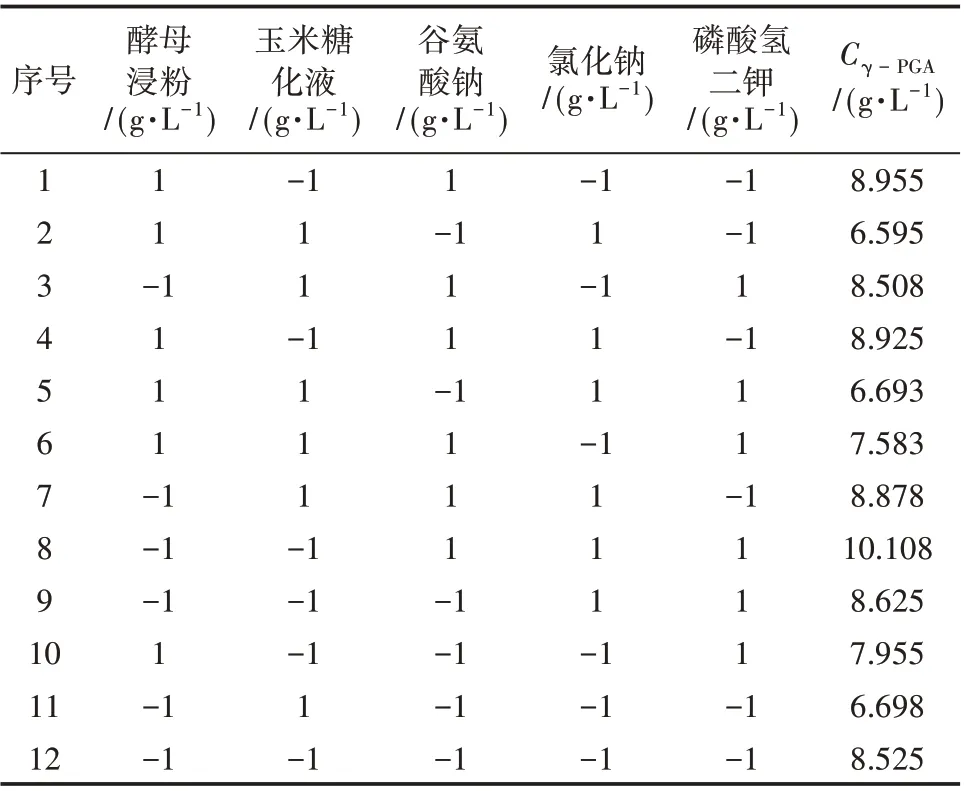
表3 Plackett-Burman设计及效应值(n=12)
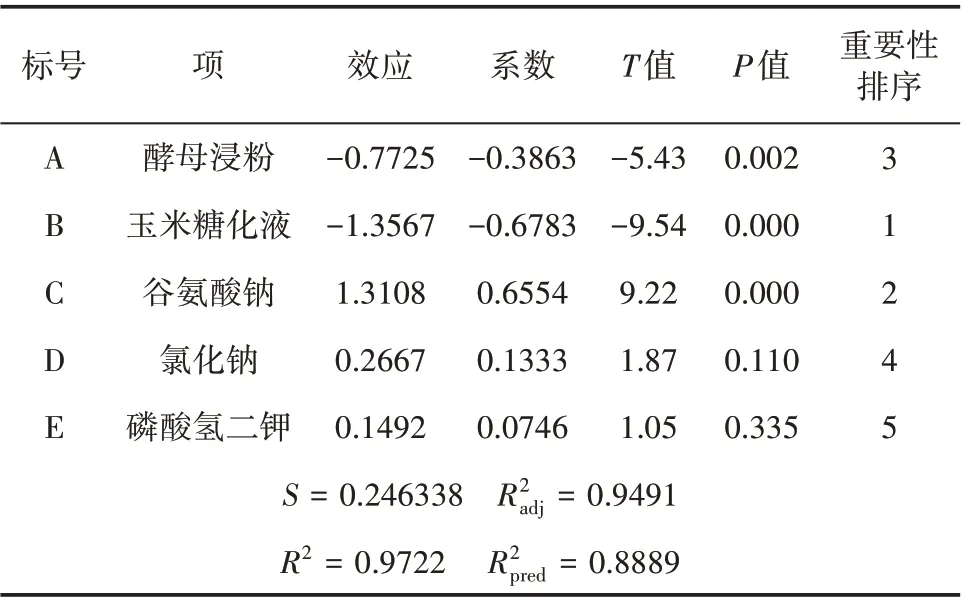
表4 Plackett-Burman 设计的各因素的系数的估计及效应评价
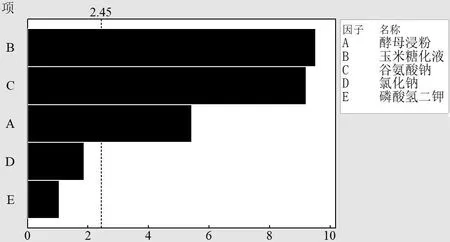
图5 帕累托标准化效应图
由图5可知,上述5个因素的重要性排序为B>C>A>D>E,即玉米糖化液>谷氨酸钠>酵母浸粉>氯化钠>磷酸氢二钾。由表4 可知,酵母浸粉、玉米糖化液、谷氨酸钠对γ-PGA 产量影响比较显著(置信度大于95%,P< 0.05)。同时由表4 中T值可知,酵母浸粉和玉米糖化液对γ-PGA产量影响呈现负效应。
2.3 最陡爬坡试验
由1.2.5 节的试验方法,并取玉米糖化液、谷氨酸钠、酵母浸粉的步长分别为-5、+5、-1,初始值分别为40、25 g/L与9 g/L,试验结果见表5。
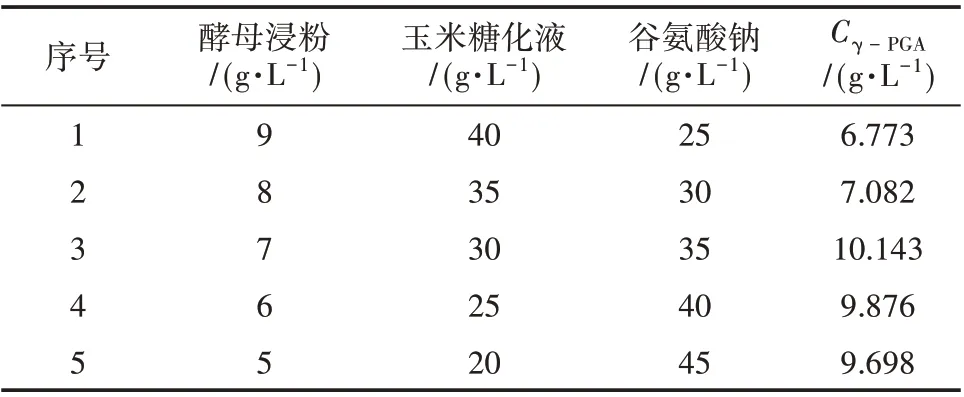
表5 最陡爬坡实设计及结果
由表5 可知,玉米糖化液浓度为30 g/L,谷氨酸钠浓度为35 g/L,酵母浸粉浓度为7 g/L 时γ-PGA 产量最大,可以作为参考点中心值进行Box-Behnken响应面设计。
2.4 Box-Behnken响应面设计
利用Minitab19软件对酵母浸粉、玉米糖化液和谷氨酸钠进行3 因素3 水平的Box-Behnken 响应面设计,试验结果见表6。
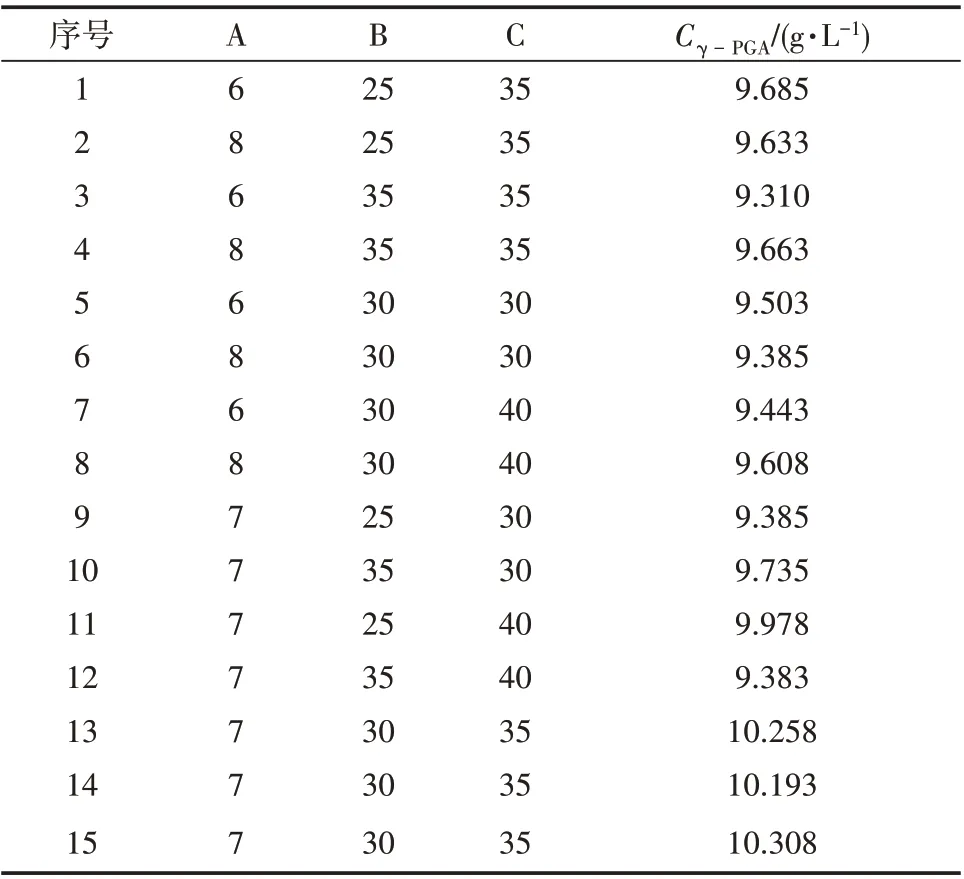
表6 Box-Behnken 试验设计及结果
由minitab19回归分析,γ-PGA产量对酵母浸粉(A)、玉米糖化液(B)和谷氨酸钠(C)的多元二次回归方程为:γ-PGA 产量(g/L)=-39.61+4.651A+0.8275B +1.2036C-0.4078A2-0.01089B2-0.01441C2+0.02025AB+0.01412AC-0.00945BC。
由响应值的方差分析(见表7)可知所选择的回归模型的P值为0.0002(< 0.1),并且R2= 0.9894,= 0.9704,= 0.8890、失拟项的P值为0.5350(> 0.05),这说明模型预测性良好且失拟程度不显著,具有统计学意义。二次项C2、交互项AB、AC、BC对结果影响极显著(P< 0.01)、一次项B对结果影响显著(P< 0.05),表明各因素间对γ-PGA 产量的影响并不是简单的线性关系[34]。
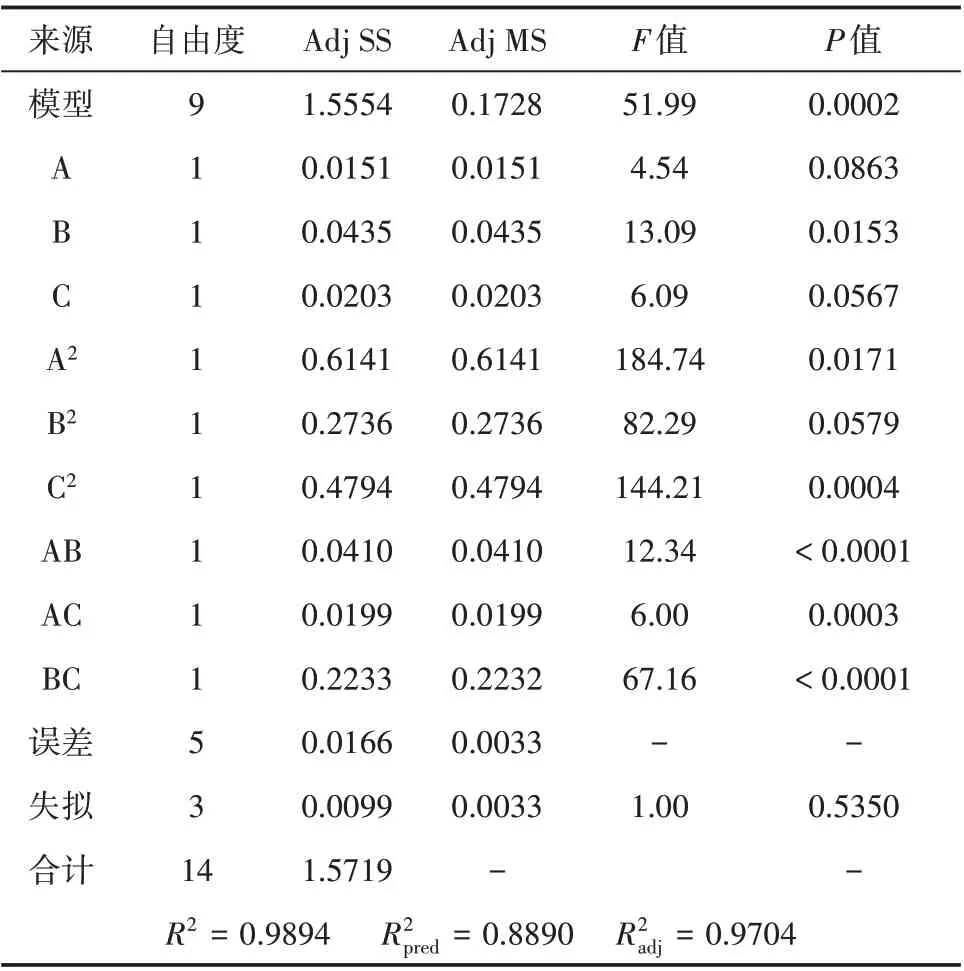
表7 响应值的方差分析
通过二次回归方程及不同因素对γ-PGA 产量影响的3D 响应面图(图6)可知,二次项系数为负值,其所代表的抛物面开口向下,表明方程具有最大值。最适酵母浸粉浓度为7.0505 g/L、玉米糖化液浓度为29.0404 g/L、谷氨酸钠浓度为35.6566 g/L时,γ-PGA 产量最大,为10.2636 g/L。为便于操作,将上述最优条件修正为酵母浸粉浓度为7 g/L、玉米糖化液浓度为30 g/L、谷氨酸钠浓度为36 g/L。以此作为最优条件进行3 次重复试验检验,测得γ-PGA 平均产量为10.2520 g/L,与预测产量拟合度达99.59%,表明优化模型可靠。
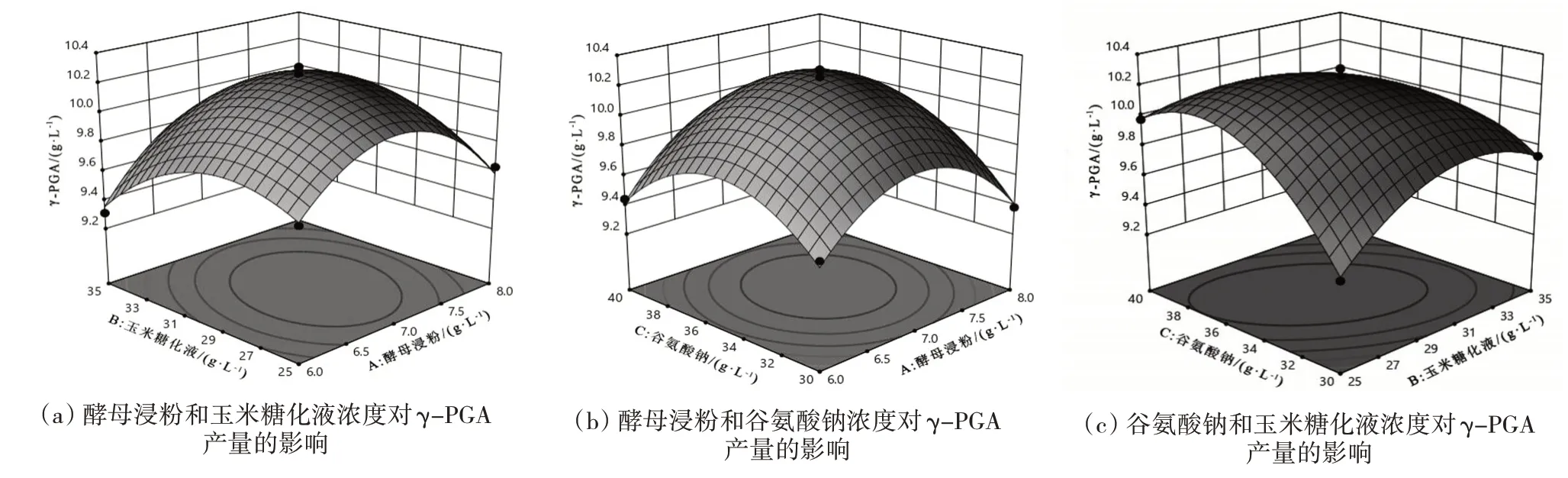
图6 不同因素对γ-PGA产量影响的3D Surface图
3 结束语
本文通过单因素及响应面试验设计对发酵条件优化后,枯草芽孢杆菌B.subtilisYSH18 发酵合成γ-PGA 产量达到优化前的2 倍。微生物发酵合成γ-PGA 研究较多,但多数都因生产成本高而处于实验室阶段。本研究所用碳源及能源为低成本的玉米糖化液,为进一步降低成本,培养基中的谷氨酸钠可以用价格更为低廉的味精生产原液或是味精厂废液[35]等代替,从而进一步推进了微生物发酵合成γ-PGA产业化的进程。
