厌氧水环境中噬菌体MS2的存活和团聚特性及理化因素的影响
2022-07-19张崇淼
张崇淼,赵 倩,王 真
厌氧水环境中噬菌体MS2的存活和团聚特性及理化因素的影响
张崇淼*,赵 倩,王 真
(西安建筑科技大学环境与市政工程学院,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,陕西 西安 710055)
为探究病毒在厌氧水环境中的存活特性,以噬菌体MS2为模式病毒,采用双层平板法进行噬菌体MS2的定量检测,研究温度、pH值、悬浮颗粒物、乙酸等理化条件对噬菌体MS2的影响,分析其衰减动力学特征,并通过测定Zeta电位和噬菌斑直径考察噬菌体颗粒在不同条件下的聚集状况.结果表明,在厌氧水环境中,噬菌体MS2的衰减符合一阶指数衰减模型.在众多研究因素中,温度是影响噬菌体MS2存活的最主要因素.噬菌体MS2在4,17,25和35℃时的90分别为20.36,6.14,5.15和0.46d.35℃条件下12h后噬菌体失活率高达2.44lg,而4℃条件下7d后噬菌体失活率仅有0.78lg.增加乙酸浓度能明显提高噬菌体MS2的衰减速率.低pH值和悬浮颗粒物条件会促进噬菌体的团聚,使噬菌体颗粒Zeta电位降低,水力学直径增大,但悬浮颗粒物浓度过高会影响颗粒间的静电作用. 噬菌体的团聚也增加了噬菌斑的直径,pH=6和20mg/L的悬浮颗粒物条件下,直径1.0mm以上的大噬菌斑数量占比分别达到了45.61%和57.74%.明确厌氧水环境中各种理化因素对噬菌体MS2的影响,可为水环境病毒控制提供科学依据.
厌氧水环境;噬菌体MS2;理化因素;存活;团聚
病毒在自然界分布广泛,水环境是其传播的一种重要途径,目前已知有700余种病毒可介水传播[1],包括肠道病毒[2]、诺如病毒[3]、冠状病毒[4]、腺病毒[5]等.病毒在各种水环境中均有检出,如废水[3]、再生水[5]、地下水[6]、河水[7]、海水[8]、景观用水[9]等,特别是城市污水管网、污水处理系统中通常存在大量的、种类繁多的病毒,其中也包括新型冠状病毒(SARS-CoV-2)[4].当人体接触受病毒污染的水体,会导致胃肠炎、腹泻、肝炎等疾病的发生,严重威胁着人类健康.
病毒在水环境中的传播潜力主要取决于其在水环境中的存活能力[10].因此,阐明病毒在水环境中的存活特性对于病毒风险评估和控制十分重要.对于水环境中病毒的存活,国外学者做了一些研究,主要包括病毒在不同水环境中的衰减[6-7,11]、病毒存活时间和影响因素[7].目前国内有关于病毒存活的研究报道很少.现有的病毒存活研究大都集中在有氧水环境,而在城市污水管网和湖库底部等一些区域,往往处于厌氧状态,厌氧处理在城市污水、养殖废水的处理中也是十分重要的环节,但迄今为止鲜有关于病毒在厌氧水环境中环境行为的报道,厌氧环境下病毒的存活特性及影响因素亟待阐明.
鉴于此,本文以大肠杆菌噬菌体MS2作为模式病毒,研究厌氧条件下水温、pH值、悬浮颗粒物、乙酸等理化因素对噬菌体MS2存活特性的影响.通过研究噬菌体MS2的数量变化、衰减特性以及不同环境因素下噬菌体MS2的行为特征,以期为水环境中病毒的风险控制提供科学依据.
1 材料与方法
1.1 噬菌体及其培养方法
噬菌体MS2及其宿主菌(大肠杆菌BW39773)均购自国家典型培养物保藏中心.将大肠杆菌BW39773培养至对数期,按照感染复数为1:1的比例将噬菌体MS2与宿主菌混匀,静置15min, 10000r/min离心10min,沉淀用5mL LB培养液重悬,37℃摇床培养5h后10000r/min离心10min,取上清液经0.22μm孔径的滤膜过滤后获得噬菌体MS2悬液,置于4℃保存备用.
1.2 厌氧水环境中噬菌体MS2的存活实验
将纯水置于具塞玻璃瓶中,使用水浴氮吹仪以5L/min的速率进行氮吹5min,使水样中的溶解氧低于0.09mg/L.使用注射器将噬菌体MS2悬液注入水样中,使其终浓度为(3391.90±526.45)×103PFU/mL.使用恒温箱控制水样温度分别为4,17,25,35℃,使用0.1mol/L HCl或NaOH溶液调节水样的pH值(pH=6、7、8、9),加入高岭土模拟水中的悬浮颗粒物(终浓度分别为0,10,20,50mg/L),加入2mol/L乙酸使水样中的乙酸浓度分别为0,200,400,800mg/L.采用单一变量原则,分别研究温度、pH值、颗粒物对噬菌体MS2存活的影响.除研究的变量之外,其他因素都保持在同一控制水平(温度25℃、pH=7、无悬浮颗粒物).研究乙酸对噬菌体MS2的影响时,控制温度为25℃,且无悬浮颗粒物存在.在上述不同条件下,连续测定水样中的噬菌体MS2含量.按照式(1)计算噬菌体MS2的失活率:
= lg(0/N) (1)
式中:为失活率;0为水样中噬菌体MS2初始浓度, PFU/mL;N为时刻水样中噬菌体MS2的浓度,PFU/mL.
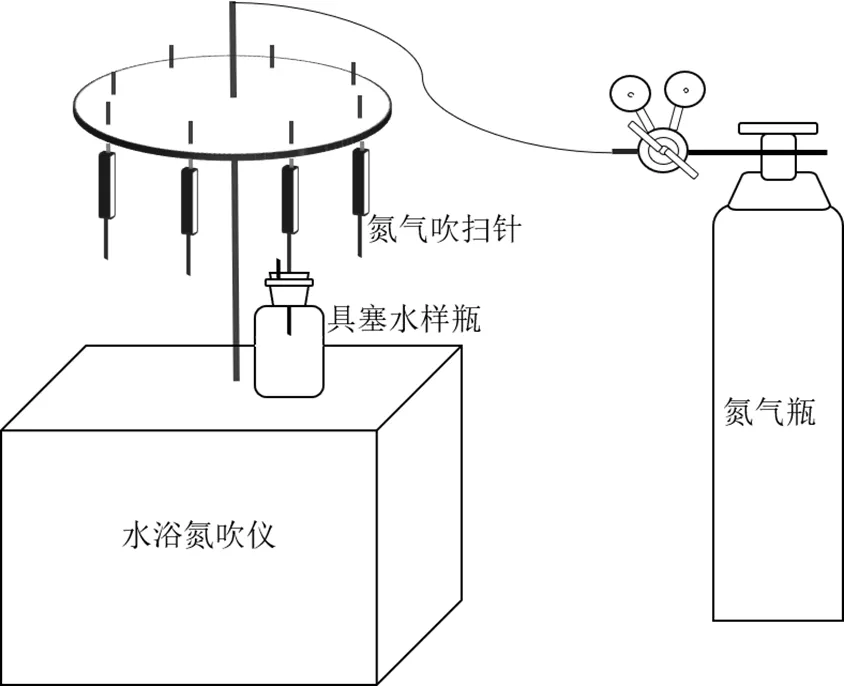
图1 厌氧水环境构建示意
1.3 噬菌体的双层平板法定量检测
噬菌体的检测参照ISO10705-1-1995[12]和EPA1602[13]标准方法进行.将含有噬菌体MS2的样品100μL与宿主菌悬液100μL混合均匀,再加入到3mL 0.45%琼脂(55℃)的玻璃管中混匀,快速倾倒至1.5%的琼脂平板表面.待上层琼脂凝固后,在37℃培养箱中倒置培养12h.菌落计数仪(Czone G6T,杭州迅数科技有限公司)拍照和测量噬菌斑.对噬菌斑在20~300的平板进行计数.
1.4 噬菌体MS2的衰减动力学分析
分别使用指数模型[14]和Fermi模型[15]对水样中噬菌体MS2的浓度随时间变化的数据进行拟合.
指数模型是一种典型的线性模型,如式(2)所示:
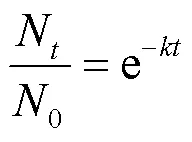
Fermi模型是一种非线性模型,如式(3)所示:
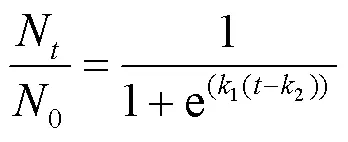
式中:N为时刻水样中噬菌体MS2的浓度, PFU/ mL;0为0时刻水样中噬菌体MS2的浓度, PFU/ mL;为指数模型中的衰减速率常数;1、2为Fermi模型中的衰减速率常数,表示噬菌体MS2在水样中的衰减速率;为时间.
90、99分别表示噬菌体MS2初始数量减少90%(1lg), 99%(2lg)所需要的时间(d)[7].利用最优的动力学模型,可计算出90、99值.
1.5 颗粒的水力学直径和Zeta电位的测定
采用Zeta电位仪(Zetasizer Nano ZS 90,马尔文仪器有限公司)测定噬菌体MS2颗粒、高岭土颗粒和高岭土吸附噬菌体MS2后形成的颗粒的水力学直径及Zeta电位.选择pH值、悬浮颗粒物浓度分别作为研究变量,控制噬菌体MS2的浓度为103PFU/mL,温度为25℃,平行测定3次.
1.6 数据处理与分析
使用ImageJ图像分析软件对噬菌斑进行直径测量,计算噬菌斑直径分布.所有实验数据均采用Excel 2019软件进行处理与分析,使用Origin 2018软件作图,并通过SPSS 26.0软件进行数据的方差分析和正态性检验分析.
2 结果与讨论
2.1 厌氧水环境中理化因素对噬菌体活性的影响
在无宿主菌存在的厌氧水环境中,噬菌体MS2的浓度会随时间延长而逐渐降低,直至低于检出限(图2).随着温度的升高,噬菌体MS2的衰减加快.在4℃时,7d后噬菌体浓度仍有5.73×102PFU/mL,相比初始浓度仅下降了0.78lg;而在35℃时,仅12h噬菌体浓度就下降了2.44lg,24h后则未检出.高温会对病毒衣壳蛋白和核酸造成破坏,还可以提高胞外蛋白酶和核酸酶的活性,从而引起病毒的失活[16].本研究的水样中并无大量细菌,也不存在胞外蛋白酶和核酸酶,因此温度升高导致噬菌体MS2失活加速主要是通过破坏噬菌体衣壳蛋白和核酸来实现的.
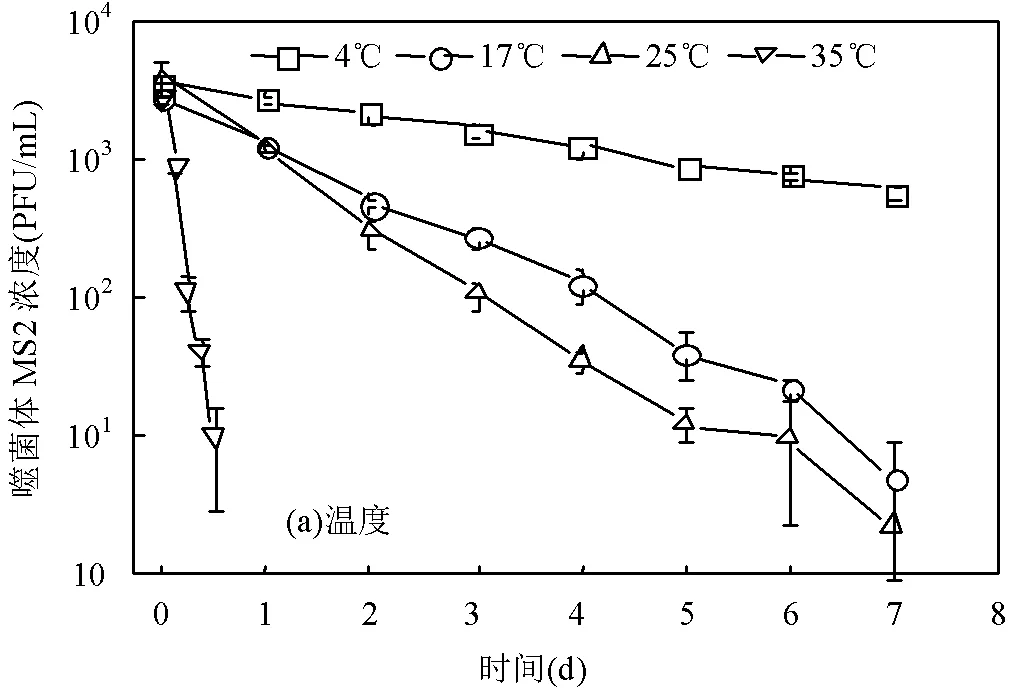
自然水环境及水处理过程中的pH值大都在6~9.在此范围内,pH值对噬菌体MS2存活并未造成明显的影响,各条件下4d后噬菌体MS2浓度的失活率都在2.83~3.49lg范围内,无显著差异(>0.05).水中悬浮物含量是衡量水污染程度的指标之一.在没有高岭土存在的条件下,噬菌体MS2的浓度在5d内降低了2.15lg,而高岭土浓度为10,20,50mg/L时,失活率分别为2.27,2.51,2.63lg.通过方差分析发现,不同悬浮颗粒物浓度条件下的噬菌体MS2的失活率并无显著差异(>0.05).这说明在厌氧水环境中无机悬浮颗粒物的存在不影响噬菌体的存活,何强等[17]在研究好氧水环境中高岭土对噬菌体MS2的影响时也有类似的结果.
从图2(d)可以看出,随着体系中乙酸浓度的升高,噬菌体MS2的衰减加快.当乙酸浓度增加到800mg/L时,36h后噬菌体的浓度下降2.83lg,而无乙酸体系中的噬菌体MS2失活率仅为0.80lg.乙酸是厌氧生物处理中产生的一种典型小分子有机酸,这种有机酸通常被认为是天然抗菌剂,且具有灭活病原体的能力[18],可作用于细胞壁、细胞质膜,影响细胞质中与核酸复制、蛋白质合成等相关代谢功能[19-20].
2.2 不同条件下的噬菌体MS2衰减动力学
图3为分别利用指数模型和Fermi模型对噬菌体MS2在不同情况下浓度衰减的拟合曲线.拟合曲线与实验数据的接近程度用可决系数2来表示,2越大,曲线拟合程度越高.由此可见,使用指数模型描述噬菌体MS2的衰减动力学特征更合适.
使用指数模型计算得到在不同条件下的噬菌体MS2衰减速率常数k、以及90和99值,以定量描述其衰减特征.如表1所示,噬菌体MS2在4,17,25和35℃时的90值分别为20.36,6.14,5.15和0.46d, 35℃时的90值仅为4℃时的2.26%.在实际水环境中,温度的升高还可能提高其他微生物的活性,从而间接促进噬菌体MS2的衰减.例如,Gordon等[21]研究发现,在地下水样品中,噬菌体MS2在15℃和28℃条件下的90值都不足3d,而在经过滤去除了微生物的地下水样品中,噬菌体MS2在这两个温度下的90值则均大于180d.
从表1可以看出, pH值、悬浮颗粒物浓度在一定范围内的改变并未对噬菌体MS2的衰减产生明显影响.与温度、悬浮颗粒物浓度、乙酸浓度这些单因素控制实验中同样条件的结果相比,在pH单因素控制实验中pH=7时噬菌体MS2的90和99值偏低.这可能与调节pH过程中生成了NaCl有关,有报道表明较高的盐度会降低病毒的存活率[10].乙酸会明显加速噬菌体MS2的衰减速率.在厌氧水处理体系中,乙酸浓度通常为50~800mg/L[22-23].根据本研究的衰减动力学特征来看,这种浓度范围的乙酸可能会使噬菌体MS2的衰减速率加快2.54~3.52倍.
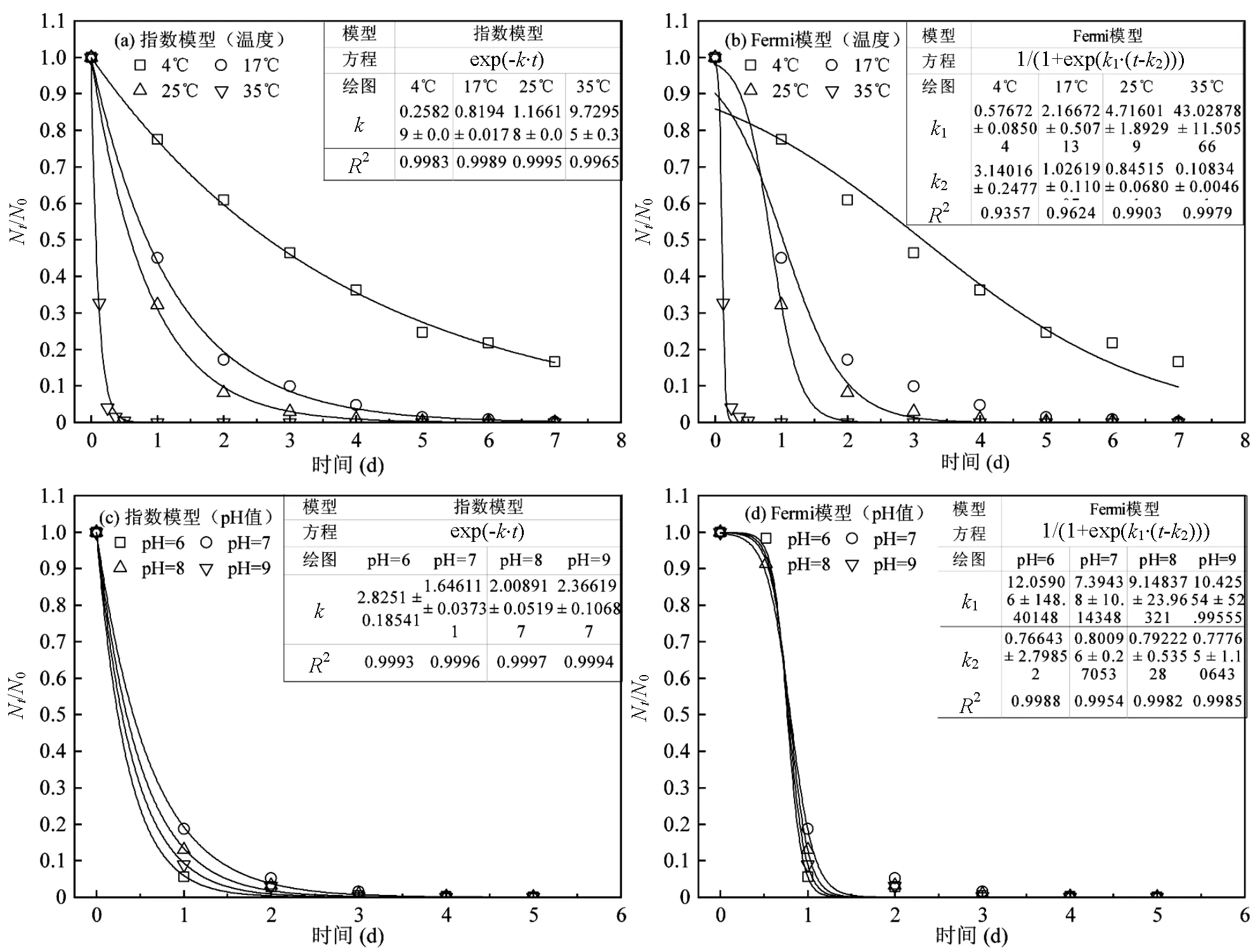
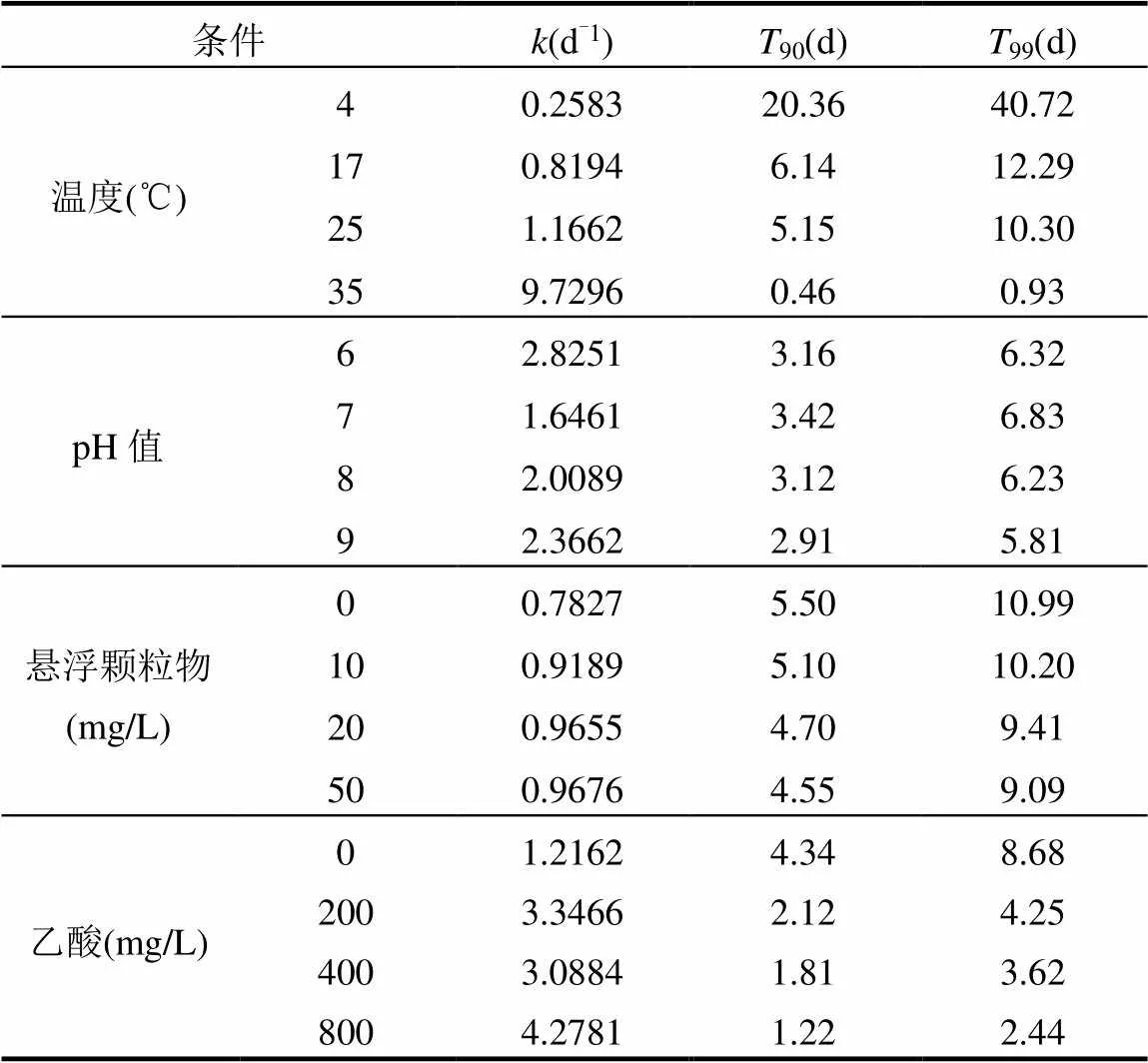
表1 不同条件下的噬菌体MS2衰减的k、T90和T99值
2.3 噬菌体颗粒的团聚性及影响因素
病毒颗粒的表面电荷与所处环境的pH值有关,改变pH值可以使病毒颗粒表面电荷以及病毒颗粒之间的静电作用发生变化,从而影响病毒颗粒在水环境中的稳定性[24].水中悬浮颗粒物能影响病毒颗粒表面电荷和亲疏水性,从而影响病毒在水环境中的状态[25].因此,本文对噬菌体MS2在厌氧水环境中的行为特征也进行了研究.
2.3.1 pH值和悬浮颗粒物对颗粒Zeta电位及水力学直径的影响 噬菌体MS2颗粒的等电点在2.2~3.9[26],因此在pH 6~9的水环境中,噬菌体颗粒表面都带负电.在pH=6、7、8、9时,噬菌体颗粒的Zeta电位分别为-13.68,-22.49,-25,-32.80mV(图4).其中,pH=6与pH=9时的Zeta电位存在显著性差异(<0.05).根据双电层理论,Zeta电位能反映胶体颗粒的稳定性,其绝对值越大,表明扩散层越厚,胶体颗粒越稳定[27].反之,胶体颗粒则易脱稳.显然,偏酸性的环境更接近噬菌体MS2的等电点,Zeta电位绝对值更小,噬菌体颗粒更易脱稳团聚.噬菌体颗粒的水力学直径分布可以更直观地显示出pH值对噬菌体MS2团聚的影响.当pH=6时,噬菌体颗粒的水力学平均直径为535nm,远大于pH=7、8、9条件下的(256.83,123.30,85.97nm).
高岭土在水溶液中带负电,不同浓度高岭土条件下的Zeta电位约为-20~-30mV,加入噬菌体MS2后,Zeta电位绝对值有所减小,说明高岭土和噬菌体MS2发生了相互作用.但颗粒的Zeta电位绝对值仍维持在20mV以上,这表明噬菌体能够吸附在高岭土颗粒上,并稳定存在于水中.这种情况与不同类型矿物颗粒的作用结果类似.例如,闵凡飞等[28]研究石英与高岭土悬浊液颗粒表面电位时发现,它们混合后形成的悬浊液的颗粒表面Zeta电位绝对值小于这两种单一矿物颗粒的,这归因于混合矿物颗粒间发生了聚集作用.
如图4所示,在噬菌体MS2浓度为103PFU/mL时,噬菌体颗粒的水力学直径为25.43nm.当体系中含有浓度为10,20,50mg/L的高岭土时,颗粒的水力学平均直径增至1730.67,2354.60和2785.43nm;而无噬菌体存在时,对应浓度的高岭土悬浊液中的颗粒水力学平均直径分别为1581,1485.67和1127.2nm.对照可以看出,高岭土会吸附噬菌体从而形成较大的颗粒.随着高岭土浓度的增加,颗粒物逐渐增大并最终趋于稳定.高岭土主要由SiO2组成,还有少量的无机氧化物[29].高岭土分散于水中,颗粒内部夹杂的一些盐类易溶解到溶液中,电离出的Ca2+,Mg2+等阳离子附着在高岭土表面[28-29],当带有负电的噬菌体颗粒与高岭土颗粒靠近时,高岭土表面的阳离子从表面解离,增强了悬浊液的离子强度,通过压缩双电层发生聚集作用,从而使颗粒的水力学直径增大[30].
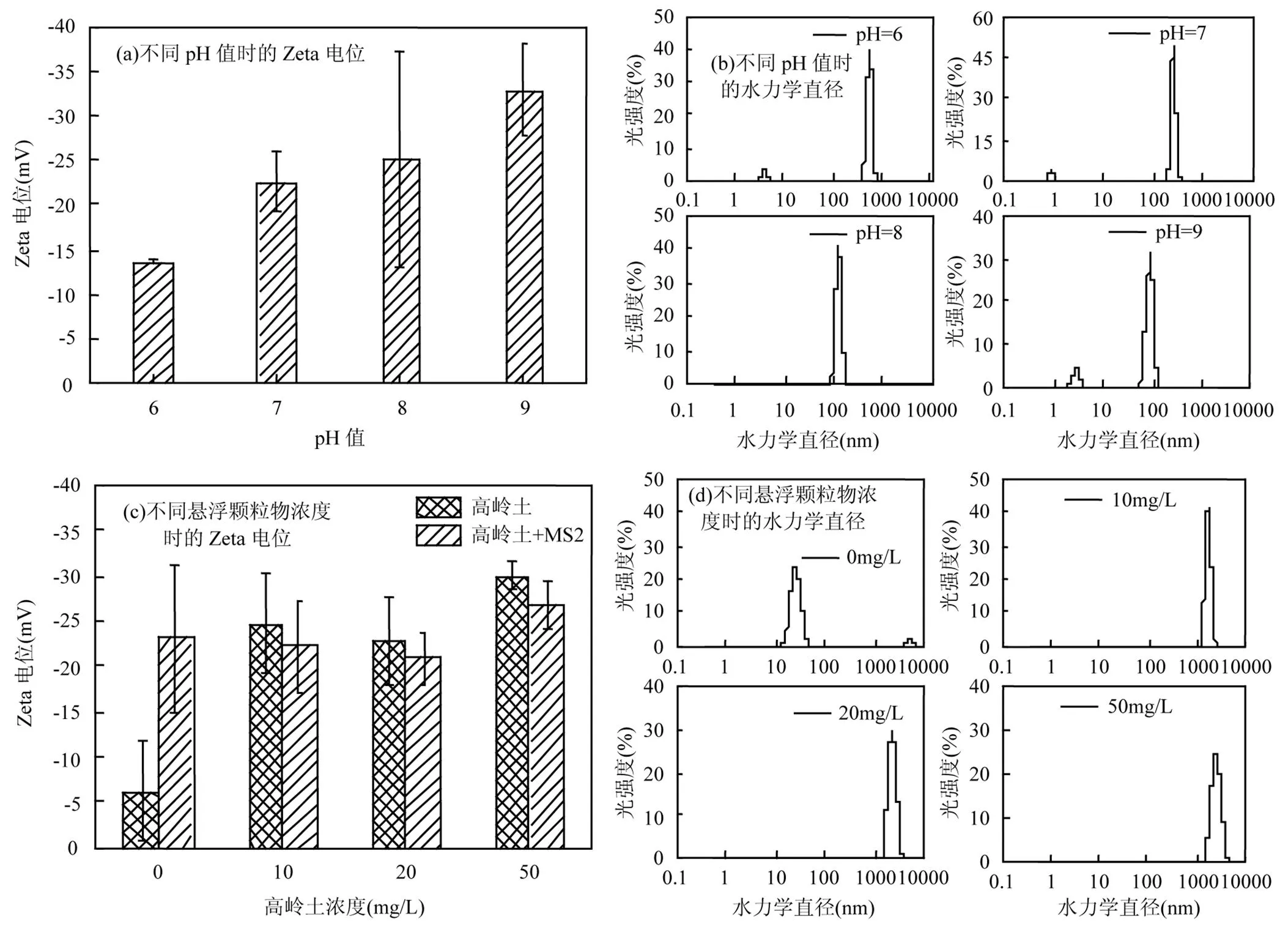
图4 不同pH值和悬浮颗粒物条件下噬菌体MS2的Zeta电位及水力学直径分布
2.3.2 噬菌斑的直径分布及影响因素 以大肠杆菌BW39773作为宿主菌,噬菌体MS2在双层平板上产生的噬菌斑的直径通常在0.5~1.0mm范围内.通过K-S检验,在本研究中不同条件下形成的噬菌斑直径分布均服从正态分布(>0.05).从图5可以看出,pH值对噬菌斑直径分布产生了一定的影响.当pH=6、7、8、9时,直径1.0mm以上的大噬菌斑在全部噬菌斑中所占的比例分别为45.61%、36.51%、29.67%、24.57%.特别是在pH=6时,还出现了直径为1.6~1.8mm的超大噬菌斑.
影响噬菌斑外观的因素包括:宿主菌细胞浓度、琼脂层组成、病毒株等[31].在确定的双层平板法检测体系条件下,初始侵染宿主菌的噬菌体的聚集行为就是影响噬菌斑最主要的因素[32].通常情况下,一个噬菌斑是由宿主菌受到单个噬菌体的初始侵染所形成的[32].但如果多个噬菌体颗粒聚集在一起,共同侵染同一个宿主菌,这样就会使噬菌斑直径增大.由上述实验结果可知,在偏酸性的环境中,噬菌体MS2容易发生团聚,从而形成较大的噬菌斑.
悬浮颗粒物会吸附多个噬菌体颗粒,并作为一种载体使多个噬菌体同时侵染宿主菌细胞[29].因此,增加水中的悬浮颗粒物浓度也会使形成的噬菌斑直径增大,但该变化趋势并非始终存在.当高岭土浓度为10,20,50mg/L时,直径1.0mm以上的大噬菌斑占比分别为46.74%、57.74%、47.68%.高岭土浓度为20mg/L时,大噬菌斑和超大噬菌斑的占比都高于50mg/L时(图6).这表明过高的悬浮颗粒物浓度可能会增加同种电荷粒子之间的相互排斥,干扰噬菌体在颗粒物表面的吸附.在目前的研究中,通常认为噬菌斑仅能提供噬菌体的“数量”信息,其能否在噬菌体环境行为的研究中发挥更大的作用尚有待研究.本研究结果表明了噬菌斑的直径分布能在一定程度上反映噬菌体MS2在不同环境下的行为.
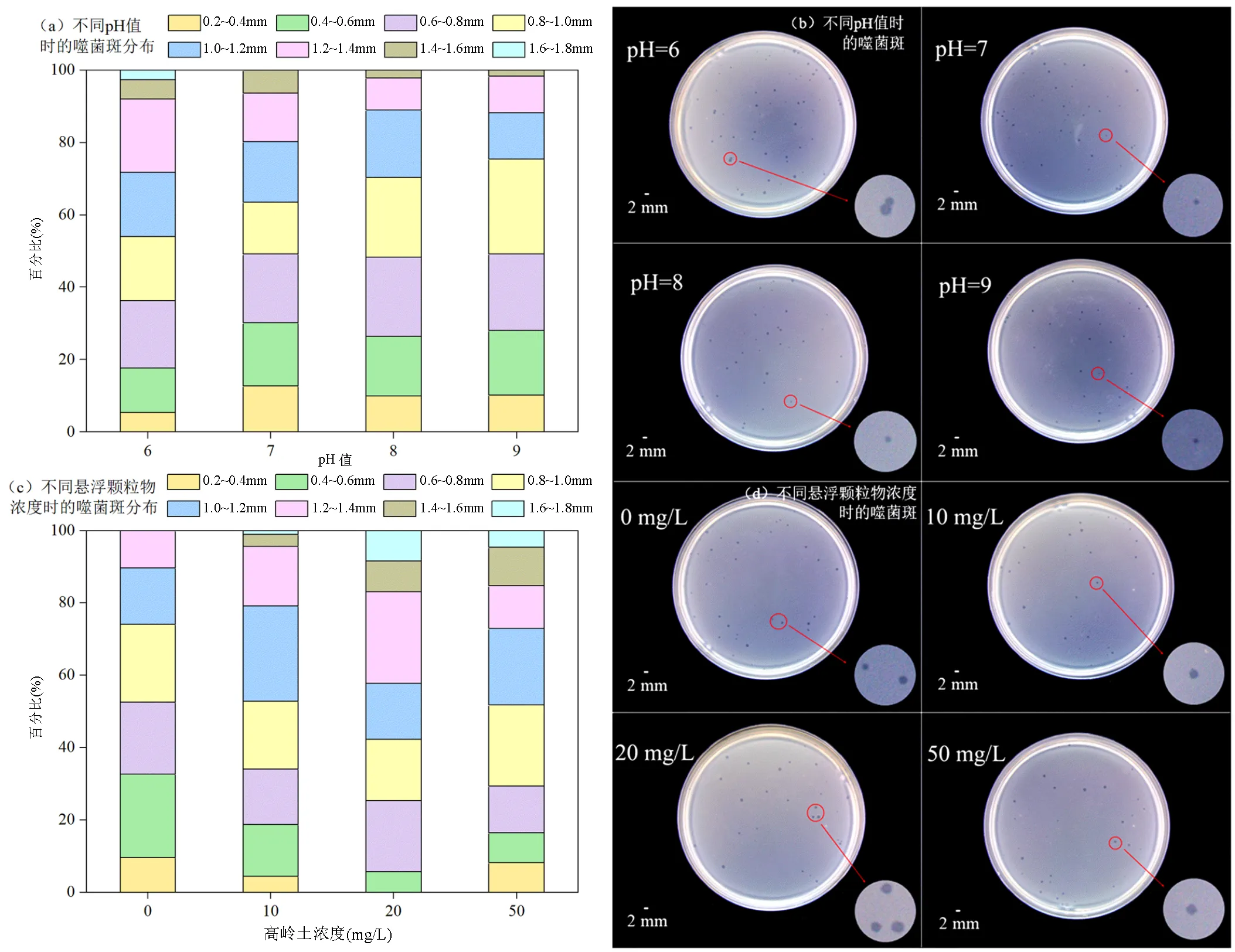
图5 不同pH值和悬浮颗粒物条件下噬菌体MS2的的噬菌斑直径分布
3 结论
3.1 在无宿主菌存在的厌氧水环境中,噬菌体MS2的数量会逐渐衰减,其衰减过程符合指数模型.温度是影响其衰减的最重要因素,35℃条件下,其浓度减少2.48lg仅用了12h,24h后已低于检出限.提高乙酸浓度都会显著加速噬菌体MS2的衰减.噬菌体MS2的.
3.2 噬菌体MS2颗粒在偏酸性的环境中容易发生团聚,其Zeta电位绝对值降低,水力学平均直径增大.水中的高岭土会吸附噬菌体MS2形成较大的颗粒.随着高岭土浓度升高,颗粒的水力学直径会逐渐增大,并最终趋于稳定.
3.3 噬菌斑的直径分布也能体现出pH值和悬浮颗粒物对噬菌体MS2的影响.在偏酸性和悬浮颗粒物浓度较高的条件下,直径1.0mm以上的大噬菌斑数量占比较高.这一发现有助于挖掘噬菌斑分析在噬菌体环境行为研究中的潜力.
[1] 郑 祥,张 巍,石 磊,等.新型冠状病毒在水环境中潜在传播途径与风险控制关键节点[J]. 环境保护, 2020,48(Z2):87-89.
Zheng X, Zhang W, Shi L, et al. Potential route of transmission of SARS-CoV-2in the water environment and key notes of risk control [J]. Environmental Protection, 2020,48(Z2):87-89.
[2] Pang X L, Qiu Y Y, Gao T J, et al.Prevalence, levels and seasonal variations of human enteric viruses in six major rivers in Alberta, Canada [J]. Water Research, 2019,153:349-356.
[3] Jahne M A, Brinkman N E, Keely S P, et al. Droplet digital PCR quantification of norovirus and adenovirus in decentralized wastewater and graywater collections: Implications for onsite reuse [J]. Water Research, 2020,169:115213.
[4] Bivins A, North D, Ahmad A, et al.Wastewater-based epidemiology: Global collaborative to maximize contributions in the fight against COVID-19 [J]. Environmental Science & Technology, 2020,54(13): 7754-7757.
[5] Aw T G, Howe A, Rose J B. Metagenomic approaches for direct and cell culture evaluation of the virological quality of wastewater [J]. Journal of Virological Methods, 2014,210:15-21.
[6] Sidhu J P S, Toze S, Hodgers L, et al. Pathogen decay during managed aquifer recharge at four sites with different geochemical characteristics and recharge water sources [J]. Journal of Environmental Quality, 2015,44(5):1402-1412.
[7] Ibrahim E M E, El-Liethy M A, Abia A L K, et al. Survival of E. coli O157:H7, Salmonella Typhimurium, HAdV2 and MNV-1in river water under dark conditions and varying storage temperatures [J]. Science of the Total Environment, 2019,648:1297-1304.
[8] 王海丽,杨季芳,屠霄霞,等.象山港海洋病毒时空分布特征及其环境影响因素 [J]. 中国环境科学, 2011,31(5):834-844.
Wang H L, Yang J F, Tu X X, et al. Spatiotemporal distribution of marine virus with related to environmental factors in the Xiangshan Bay. China Environmental Science, 2011,31(5):834-844.
[9] 周进宏,王晓昌,徐丽梅.小型景观水体中病原微生物的分布特性[J]. 环境工程学报, 2015,9(12):5689-5696.
Zhou J H, Wang X C, Xu L M. Distribution of pathogenic microorganisms in midget landscape water by real-time PCR methods [J]. Chinese Journal of Environmental Engineering, 2015,9(12): 5689-5696.
[10] 王珺瑜,赵晓丽,梁为纲,等.环境因素对病毒在水体中生存与传播的影响[J]. 环境科学研究, 2020,33(7):1596-1603.
Wang J Y, Zhao X L, Liang W G, et al. Influences of environment factors on survival and transmission of viruses in water [J]. Research of Environmental Sciences, 2020,33(7):1596-1603.
[11] Eregno F E, Tryland I, Myrmel M, et al. Decay rate of virus and faecal indicator bacteria (FIB) in seawater and the concentration of FIBs in different wastewater systems [J]. Microbial Risk Analysis, 2018, 8:14-21.
[12] ISO 10705-1-1995. Water Quality-Detection and Enumeration of Bacteriophages - Part 1: Enumeration of F-Specific RNA Bacteriophages [S]. 1995.
[13] EPA Method 1602. Male-specific(F+)and Somatic Coliphage in Water by Single Agar Layer (SAL) Procedure [S]. 2001.
[14] Chick H. An Investigation of the Laws of Disinfection [J]. The Journal of hygiene, 1908,8(1):92-158.
[15] Peleg M.A model of microbial survival after exposure to pulsed electric fields [J]. Journal of the Science of Food and Agriculture, 1995,67(1):93–99.
[16] John D E, Rose J B. Review of factors affecting microbial survival in groundwater [J]. Environmental Science & Technology, 2005,39(19): 7345-7356.
[17] 何 强,吴庆庆,马红芳,等.藻细胞和高岭土的存在对病毒MS2存活的影响[J]. 环境科学, 2014,35(8):3192-3197.
He Q, Wu Q Q, Ma H F, et al. Effects of algae and kaolinite particles on the survival of bacteriophage MS2 [J].Environmental Science,2014,35(8):3192-3197.
[18] Akbas M Y, Olmez H. Inactivation ofandon iceberg lettuce by dip wash treatments with organic acids [J].Letters in Applied Microbiology, 2007,44(6):619-624.
[19] Ricke S C. Perspectives on the use of organic acids and short chain fatty acids as antimicrobials [J]. Poultry Science, 2003,82(4):632-639.
[20] Bae Y M, Lee S Y. Effect of salt addition on acid resistance response of Escherichia coli O157: H7 against acetic acid [J].Food Microbiology, 2016,65:74-82.
[21] Gordon C, Toze S. Influence of groundwater characteristics on the survival of enteric viruses [J]. Journal of applied microbiology, 2003, 95(3):536-544.
[22] 刘彩霞,席晓晶,彭党聪,等.厌氧序批式反应器内挥发性脂肪酸积累特性研究[J]. 环境工程学报, 2009,3(12):2241-2244.
Liu C X, Xi X J, Peng D C, et al. Research on accumulation characteristics of volatile fatty acid in an anaerobic sequencing batch reactor [J].Chinese Journal of Environmental Engineering,2009, 3(12):2241-2244.
[23] 张建丰.活性污泥法工艺控制(第3版) [M]. 北京:中国电力出版社, 2021:50-52.
Zhang J F.Activated sludge process control(3rd edition) [M]. Beijing:China electric power press, 2021:50-52.
[24] Xagoraraki I, Yin Z Q, Svambayev Z. Fate of viruses in water systems [J]. Journal of Environmental Engineering, 2014,140(7):doi:10.1061/ (ASCE)EE.1943-7870.0000827.
[25] Fongaro G, Kunz A, Magri M E, et al. Settling and survival profile of enteric pathogens in the swine effluent for water reuse purpose [J]. International Journal of Hygiene and Environmental Health, 2016,219 (8):883-889.
[26] Dika C, Duval J F L, Francius G, et al. Isoelectric point is an inadequate descriptor of MS2, Phi X 174and PRD1phages adhesion on abiotic surfaces [J]. Journal of colloid and interface science, 2015, 446:327-334.
[27] 张文静,周晶晶,刘 丹,等.胶体在地下水中的环境行为特征及其研究方法探讨[J]. 水科学进展, 2016,27(4):629-638.
Zhang W J, Zhou J J, Liu D, et al. A review: research methods that describe the environmental behavior of colloids in groundwater [J]. Advances in Water Science, 2016,27(4):629-638.
[28] 闵凡飞,赵 晴,李宏亮,等.煤泥水中高岭土颗粒表面荷电特性研究[J]. 中国矿业大学学报, 2013,42(2):284-290.
Min F F, Zhao Q, Li H L, et al. Study of electrokinetic properties of kaolinite in coal slime [J]. Journal of China University of Mining & Technology, 2013,42(2):284-290.
[29] Xing Y, Ellis A, Magnuson M, et al. Adsorption of bacteriophage MS2 to colloids: Kinetics and particle interactions [J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2020,585: 124099.
[30] Langlet J G, Aboriaud F G, Antzer C. Effects of pH on plaque forming unit counts and aggregation of MS2 bacteriophage [J]. Journal of Applied Microbiology, 2007,103(5):1632-1638.
[31] Sabara M I, Larence J E. Plaque assay for avian metapneumovirus using a Japanese quail fibrosarcoma cell line (QT-35) [J]. Journal of Virological Methods, 2003,107(1):9-14.
[32] Cormier J, Janes M. A double layer plaque assay using spread plate technique for enumeration of bacteriophage MS2 [J]. Journal of Virological Methods, 2014, 196:86-92.
Survival and aggregation characteristics of bacteriophage MS2in anaerobic water environment and influence of physicochemical factors.
ZHANG Chong-miao*, ZHAO Qian, WANG Zhen
(Key Laboratory of Northwest Water Resource, Environment and Ecology, Ministry of Education, Shaanxi Key Laboratory of Environmental Engineering, School of Environmental and Municipal Engineering, Xi’an University of Architecture and Technology, Xi’an 710055, China)., 2022,42(7):3434~3442
Bacteriophage MS2 was chosen as the model virus to reveal the survival characteristics of virus in anaerobic water environment. The effect of physicochemical conditions, including temperature, pH, suspended particles, and acetic acid on bacteriophage MS2 were studied by double-layer plate method.The decay kinetics of bacteriophage MS2 were analyzed, and the aggregation of phage particles under different conditions was investigated by measuring Zeta potential and plaque diameter.The results showed that the decay of bacteriophage MS2 in anaerobic water environment followed the first-order exponential decay model. Among the above-mentioned factors, temperature was the most important factor affecting the survival of bacteriophage MS2. At 4℃, 17℃, 25℃ and 35℃, the T90values of bacteriophage MS2 were 20.36d, 6.14d, 5.15d and 0.46d, respectively.The inactivation rate of bacteriophage MS2 was as high as 2.44lg after 12h at 35°C, while the inactivation rate was only 0.78lg after 7days at 4°C. Increasing the concentration of acetic acid significantly enhanced the inactivation rate of bacteriophage MS2. Low pH value and suspended particles promoted the aggregation ofbacteriophage MS2, which caused Zeta potential decrease and the hydrodynamic diameter of phage particles increase, but excessively high concentrations of suspended particles affected the electrostatic interaction between particles.The aggregation of bacteriophage MS2 also increased the diameter of plaques. Under the condition of pH 6 and suspended particles at 20mg/L, the proportion of large plaques with diameter more than 1.0mm reached 45.61% and 57.74%, respectively.Clarification of the impact of various physicochemical factors on bacteriophage MS2 in anaerobic water environment can provide scientific basis for virus control in water environment.
anaerobic water environment;bacteriophage MS2;physicochemical factors;survival;aggregation
X172
A
1000-6923(2022)07-3434-09
张崇淼(1978-),男,河南郑州人,教授,研究方向为水环境微生物风险评价与控制,污水处理与资源化.发表论文80余篇.
2021-12-09
国家重点研发计划(2017YFE0127300);陕西省重点研发计划项目(2020ZDLNY06-07)
* 责任作者, 教授, cmzhang@xauat.edu.cn
