EDTA-2Na/Fe(Ⅱ)对自养生物体系下硝酸盐还原过程的影响
2022-07-19张文勃李晓玲刘心怡张佳颖周俊才张鹏程
张文勃,李晓玲,2*,刘心怡,张佳颖,周俊才,孟 雯,张鹏程
EDTA-2Na/Fe(Ⅱ)对自养生物体系下硝酸盐还原过程的影响
张文勃1,李晓玲1,2*,刘心怡1,张佳颖1,周俊才1,孟 雯1,张鹏程1
(1.长安大学建筑工程学院,陕西 西安 710061;2.长安大学建筑工程学院,住建部给排水重点实验室,陕西 西安 710054)
采用厌氧序批式生物膜反应器(ASBBR),以固定浓度的硝酸盐和硫酸亚铁为基质,按不同梯度条件添加EDTA-2Na,进行长时间的培养驯化,研究铁盐脱氮的启动过程,同时探究不同EDTA-2Na/Fe(Ⅱ)对铁自养反硝化过程以及硝酸盐异化还原为铵(DNRA)的影响.结果表明:经过65d的培养驯化,反应器成功稳定运行.当EDTA-2Na/Fe(Ⅱ)<1.50时,反应器只进行铁自养反硝化过程, NO3--N去除率最高仅为71.70%;当EDTA-2Na/Fe(Ⅱ)³1.50时,反应器同时进行铁自养反硝化与DNRA过程, NO3--N去除率最高为99.70%.值得注意的是,在EDTA-2Na/Fe(Ⅱ) =1.50时,铁自养反硝化速率达到最大值1.63mg/(L·h)的同时,DNRA的产氨量也达到最大值9.75mg/L.Visual MINTEQ模拟结果表明:EDTA-2Na与Fe(Ⅱ)的摩尔比会影响进水中EDTA-2Na与Fe(Ⅱ)的存在形态,物质的量比越大,FeEDTA2-浓度越高,Fe(Ⅱ)的生物可利用性越强.通过对不同样本进行微生物种群分析,发现优势菌属有Brucella、Castellaniella、Ochrobactrum、Pseudomonas、Citrobacter,前4种菌属均与反硝化过程有关,Citrobacter菌属与DNRA过程有关,且该菌属只在EDTA-2Na/Fe(Ⅱ) =1.50和1.75两个条件下出现.上述研究结果可为更深入探究DNRA与反硝化之间的作用关系提供参考.
厌氧序批式生物膜反应器(ASBBR);铁自养反硝化;硝酸盐异化还原为铵(DNRA);EDTA-2Na
近年来,铁盐脱氮技术由于其原料价格低廉、无二次污染等优点受到人们越来越多的关注[1],已有研究[2]在厌氧环境中观察到以Fe(Ⅱ)为电子供体,将硝酸盐还原为氮气的化能自养型细菌.近年来, Robertson等[3]又在澳大利亚河口梯度下发现了可以基于Fe(Ⅱ)进行DNRA过程的细菌,该细菌可以直接利用Fe(Ⅱ)作为电子供体将硝酸盐转化为可供其他生物利用的铵盐.
在自然环境中,Fe(Ⅱ)介导的化能自养型细菌与基于Fe(Ⅱ)进行DNRA过程的细菌存在协同竞争关系[4],其竞争机制主要受温度、pH值、Fe(Ⅱ)浓度、硝酸盐浓度及亚硝酸盐浓度等环境因子影响[5],多数研究采用单一Fe(Ⅱ)作为基质,结果显示铁的利用效率很低[6-7],因而,如何提高微生物对含铁物质的利用率这个问题逐渐受到重视.
EDTA是一种用途广泛的螯合剂,具有较强的螯合作用和低毒性,能与Fe(Ⅱ)、Fe(III)等不同金属离子形成稳定的配合物,可以在不损失其螯合性能的情况下有效回收再利用[8],许多研究人员[8-10]在各自的研究中均通过使用EDTA螯合Fe(Ⅱ)改善实验效果.鉴于此,为了提高Fe(Ⅱ)在水中的保留率和生物利用度,改善Fe(Ⅱ)介导的微生物脱氮效果,本文将在基于Fe(Ⅱ)的自养脱氮体系中添加EDTA-2Na,探究不同EDTA-2Na添加量对铁自养反硝化以及DNRA过程的影响,同时,定量分析Fe(Ⅱ)与EDTA在反应器中的存在形态,深入分析EDTA对微生物的影响.
1 材料与方法
1.1 实验装置
本实验采用4个ASBBR反应器,均为玻璃烧杯搭建而成,内径130mm,高度165mm,有效容积2L.反应器内悬挂移动床生物流化床填料(MBBR).反应器使用恒温磁力搅拌器进行搅拌和温度控制,转速控制在350~400r/min,温度保持在( 30±1)℃.实验期间反应器应进行避光和密闭处理,防止可进行光合作用的微生物和藻类对实验结果产生影响[11].在实验开始前,将取自西安市第四污水处理厂的异养活性污泥在合适的水质条件下进行培养驯化,同时投加生物膜载体进行微生物挂膜,挂膜稳定后的生物膜载体供ASBBR反应器使用.
1.2 实验用水
ASBBR反应器进水采用人工配制废水,主要成分分别为NO3--N 40mg/L, Fe(Ⅱ) 480mg/L, KH2PO420.00mg/L, NaHCO3800.00mg/L, CaCl250.00mg/L, EDTA-2Na浓度随反应阶段变化.NO3--N、Fe(Ⅱ)和EDTA-2Na分别由NaNO3、FeSO4·7H2O和EDTA-2Na·2H2O提供,微量元素[12]1mL/L.使用1mol/L HCl和1mol/L NaOH控制进水pH值.实验用水需提前通入氮气15min,将溶解氧浓度降至0.05mg/L.
1.3 实验方法
1.3.1 反应器的启动与稳定运行 取若干挂膜稳定的生物膜载体,平均分给4个编号为A、B、C、D的ASBBR反应器.各反应器中Fe(Ⅱ)与NO3--N的物质的量比均取3,EDTA-2Na和Fe(Ⅱ)的物质的量比依次为0.75、1.00、1.50、1.75,具体投加量见表1.4个反应器同时连续运行105d,根据运行条件可以分为两个阶段,第一阶段主要研究铁(Ⅱ)介导下的硝酸盐还原过程的启动,水力停留时间由96h逐渐缩短至60h ,第二阶段为稳定运行阶段,水力停留时间控制在60h,两个阶段中进水pH值为(6.50±0.30).
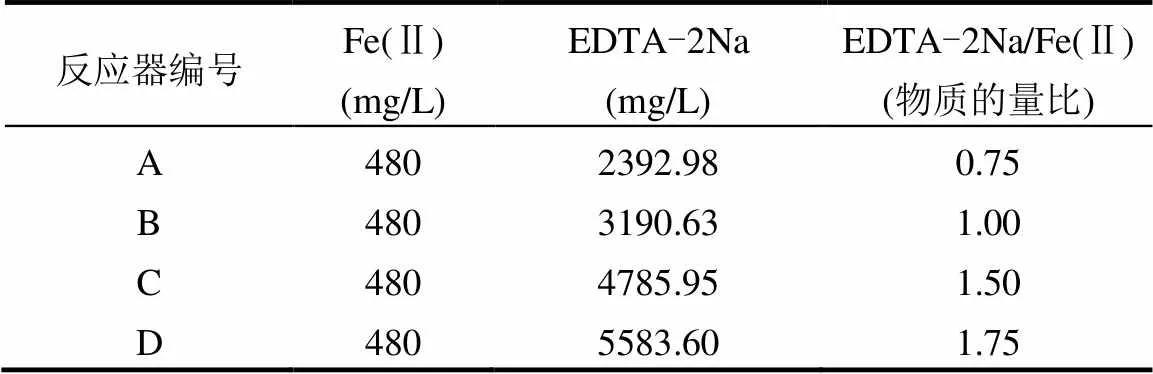
表1 不同EDTA-2Na/Fe(Ⅱ)下的进水负荷
1.3.2 连续测定与取样分析 各反应器安装pH值、ORP和N2O探头,连续测定反应器内pH值、ORP值以及N2O值的变化.每隔一段时间进行取样,样品需离心过滤处理,冷藏保存.
1.4 分析项目与方法
1.4.1 常规分析 NH4+-N采用纳氏试剂分光光度法;NO2--N采用N-(1-萘基)-乙二胺分光光度法;NO3--N采用紫外分光光度法;Fe(Ⅱ)采用邻菲罗啉分光光度法[13];EDTA采用高效液相色谱法;pH值和DO使用德国Multi 3630IDS数字化便携多参数水质分析仪监测,氧化还原电位(ORP)使用雷磁PHSJ-3F实验室ORP计监测,溶解态N2O使用丹麦Unisense微电极系统测得(每10s读取1个数据).
1.4.2 微生物群落分析 取各反应器稳定运行阶段的生物样品,采用Illumina MiSeq测序平台对样品中的微生物进行高通量测序分析,测序实验流程包括:DNA提取、设计合成引物接头、PCR扩增、Miseq文库构建、Miseq测序[14].
1.4.3 计算方法 硝酸盐去除效率(NRE)评价反应器的脱氮性能,其计算式为(1):
式中:i和e分别为进水和出水NO3--N浓度.
批次实验中,对NO3--N降解过程进行线性拟合,通过式(2)计算NO3--N的降解速率.
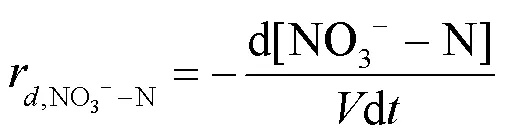
式中:是每批实验活性污泥的有效体积.
2 结果与讨论
2.1 反应器启动过程分析
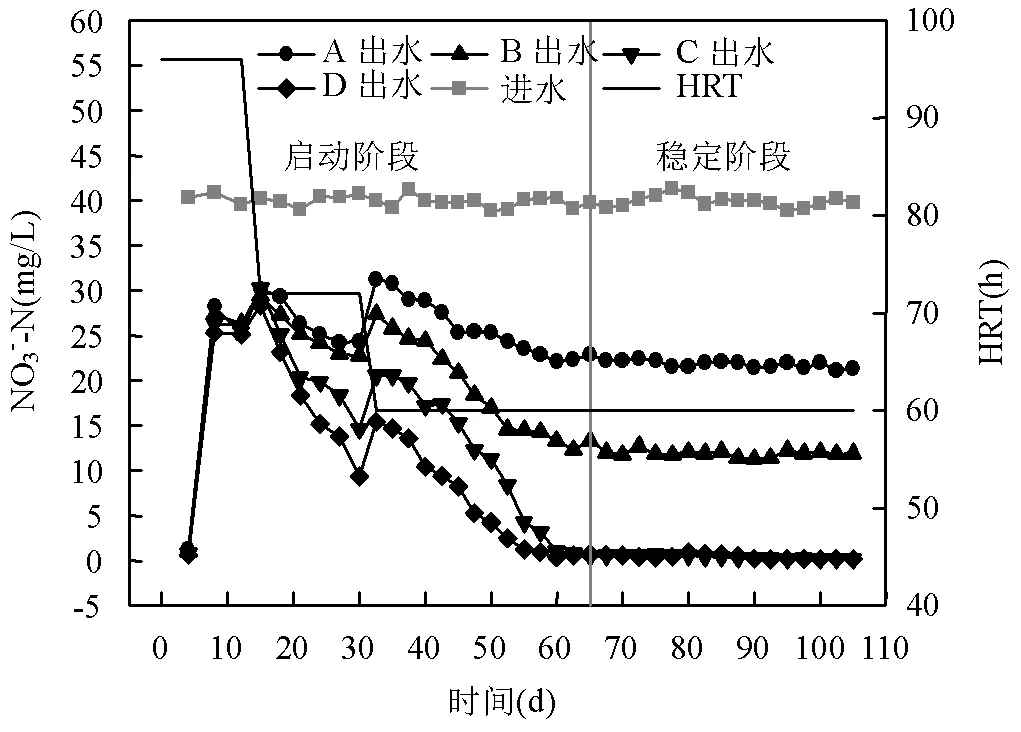
图1 反应器运行阶段脱氮性能
如图1所示,第4d测得各反应器出水NO3--N浓度基本为零,这是因为初始生物膜中携带少量有机物,同时大量反硝化菌利用体内有机物进行异养反硝化[15],故该阶段称之为内源代谢期.第9d污泥中的有机物消耗殆尽,出水NO3--N浓度明显增加.而后进入适应期(10~64d),微生物逐渐适应自养环境,利用Fe(Ⅱ)进行硝酸盐还原过程,出水NO3--N浓度逐渐减少.
65~105d为稳定运行阶段,该阶段各反应器出水NO3--N浓度基本保持不变.A,B,C,D4个反应器出水NO3--N最高去除率依次为47.85%,71.70%,99.53%, 99.70%.该阶段后期,生物膜载体出现红褐色附着物,附着量与EDTA-2Na添加量成反比,推测可能是菌体为红褐色的细菌.
2.2 EDTA-2Na/Fe(Ⅱ)对脱氮过程的影响
2.2.1 EDTA-2Na/Fe(Ⅱ)对反硝化的影响 在稳定阶段,不同EDTA-2Na/Fe(Ⅱ)的铁自养反硝化过程均已占据主导地位,其在一个周期内各种氮素随时间的变化如图2所示.在EDTA-2Na/Fe(Ⅱ)等于0.75、1.00、1.50和1.75四种条件下,出水NO3--N浓度均表现为先快速减小然后缓慢减小最后趋于稳定,NO3--N的最大降解速率依次为0.73,0.76, 1.63,1.62mg/(L·h),NO3--N最高去除率逐渐增大, 由此说明在一定范围内, EDTA-2Na/Fe(Ⅱ)增大有利于NO3--N的去除,EDTA-2Na/Fe(Ⅱ)=1.75为 NO3--N完全转化为N2的最优比例.
如图2所示,当EDTA-2Na/Fe(Ⅱ)等于0.75、1.00、1.50和1.75时,NO2--N的最大积累量依次为3.64,4.70,19.60,27.35mg/L,尤其是当EDTA- 2Na/Fe (Ⅱ)从1.50增加到1.75时,NO3--N的降解速率保持不变, 但NO2--N的最大积累量从19.60增加至27.35mg/L,这说明EDTA-2Na的加入会导致反应过程中NO2--N大量积累.在亚硝酸盐反硝化过程中, NO2--N首先转化为NO,然后转化为N2O,最后转化为N2[16].观察图2(c)(d)发现, EDTA-2Na导致NO2--N大量积累的同时,也会导致N2O大量积累.
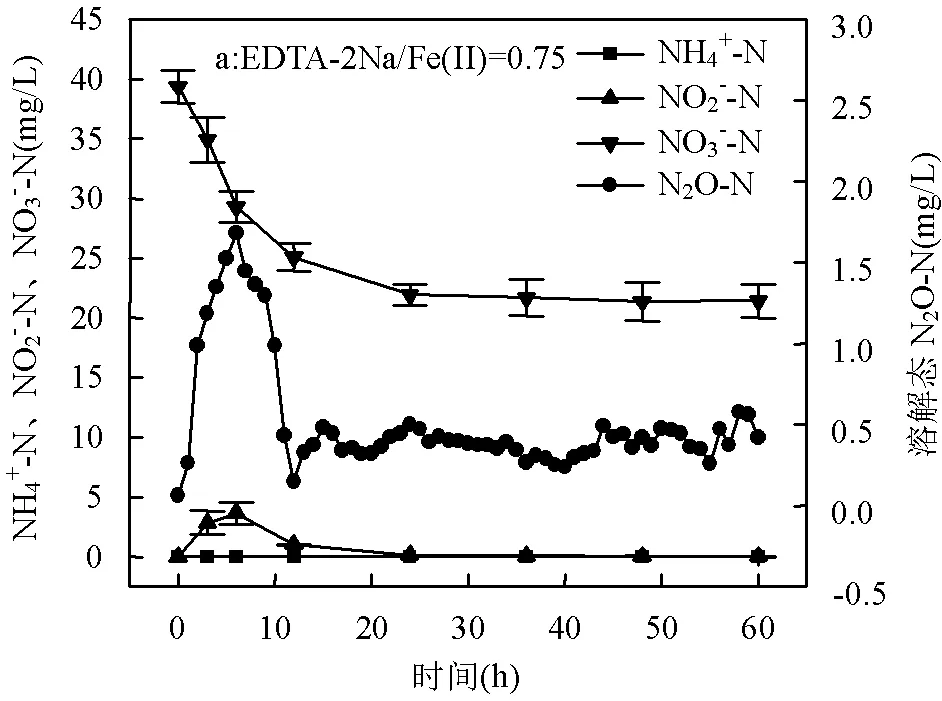
2.2.2 EDTA-2Na/Fe(Ⅱ)对DNRA的影响 如图2(a)(b)所示,当EDTA-2Na/Fe(Ⅱ)等于0.75与1.00时,整个脱氮阶段反应器出水均未检测到NH4+-N,当增加EDTA-2Na/Fe(Ⅱ)为1.50时,发现在12~30h时反应器出水开始快速积累NH4+-N,积累量高达9.747mg/L,说明当EDTA-2Na/Fe(Ⅱ)=1.50时,反应体系中Fe(Ⅱ)的生物可利用性以及Fe(Ⅱ)与电子供体NO3--N和NO2--N的比例均有利于DNRA过程发生,然而当继续增加EDTA-2Na/Fe(Ⅱ)为1.75时,却发现NH4+-N积累量降至4.08mg/L,这与Li等[9]在研究EDTA-2Na对厌氧氨氧化过程的影响时发现的现象类似.Roberts等[17]认为添加高含量的Fe(Ⅱ)时会大大抑制反硝化作用,促进DNRA过程,因此理论上,EDTA-2Na越多,作为电子供体的可生物利用的Fe(Ⅱ)就会越多,DNRA现象越显著,然而本实验结果并不如此,推测可能是因为:过多的EDTA-2Na可能会产生许多在相关EDTA离子中具有最强螯合能力的EDTA4-,根据Henneken等[18]的研究,EDTA4-会对微生物的脂多糖产生负面作用,是对微生物最具毒性的EDTA离子.
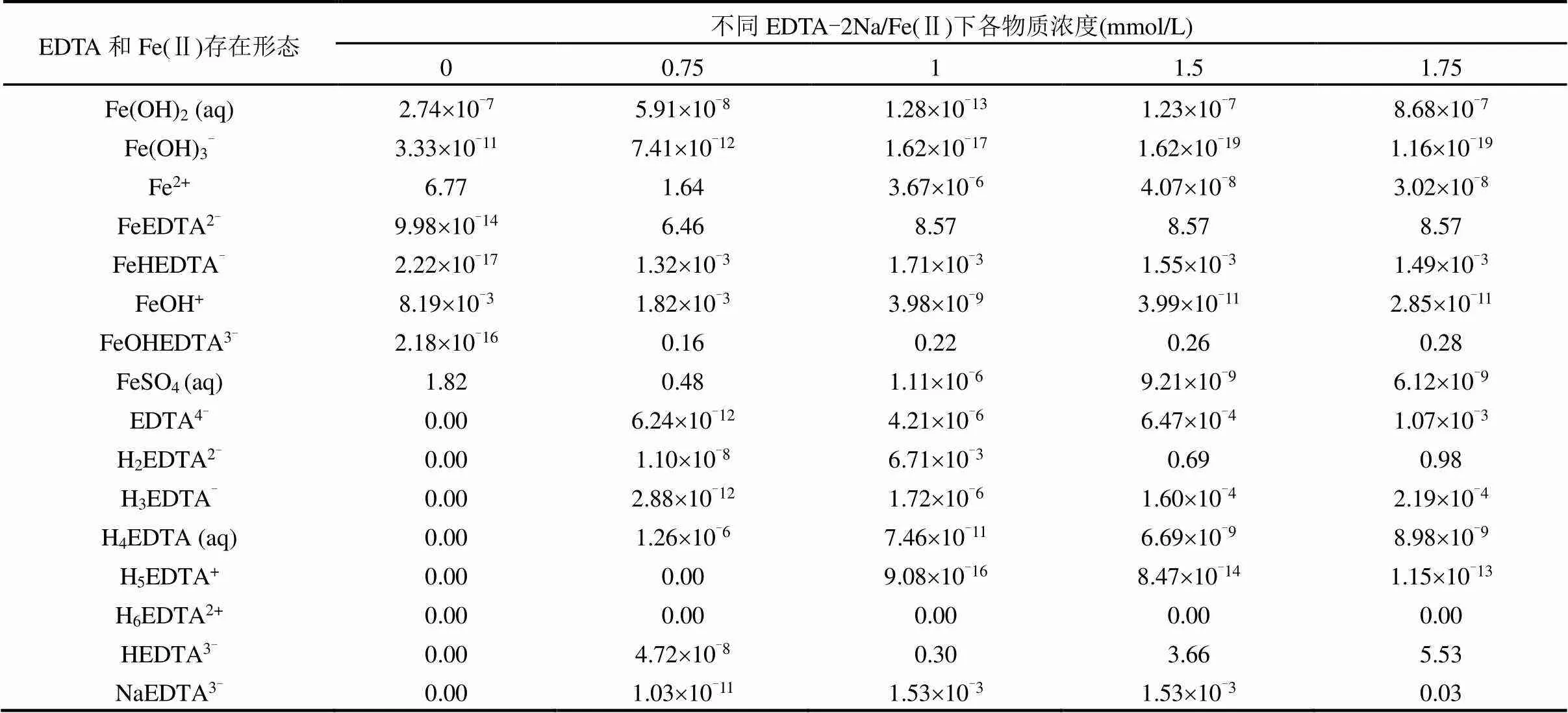
表2 不同EDTA-2Na/Fe(Ⅱ)下EDTA与Fe(Ⅱ)存在形态模拟
2.3 Visual MINTEQ分析
表2中是不同EDTA-2Na/Fe(Ⅱ)下通过Visual MINTEQ 3.1模拟的EDTA和Fe(Ⅱ)主要存在形态及其浓度变化.在比例为0和0.75的条件下,非EDTA螯合铁(Fe(OH)2、Fe(OH)3-、FeOH+和FeSO4)的浓度明显高于其他比例,随着EDTA-2Na/Fe(Ⅱ)的增加,铁与EDTA的络合反应将伴随一系列复杂的副反应,各类非EDTA螯合铁的形成会阻碍络合反应的进行,同时络合反应的产物FeEDTA2-也会发生各种副反应,如酸性络合物FeHEDTA-和碱性络合物FeOHEDTA3-的形成.如表2所示,非EDTA螯合铁的浓度在比例为1.5和1.75时相差不大,在比例为1.0时比前者大102左右.此外,FeEDTA2-、FeHEDTA-和FeOHEDTA3-的浓度均与EDTA- 2Na/Fe(Ⅱ)成正比关系,说明EDTA-2Na增加有利于EDTA与Fe(Ⅱ)络合.EDTA4-、H2EDTA2-和HEDTA3-的浓度在比例为1.5和1.75之间增加了近1倍,据报道[18],当EDTA浓度高于9.6mmol/L时,微生物的生长速率会下降,这印证了2.2.2中的推测.
2.4 不同EDTA-2Na/Fe(Ⅱ)下pH值变化特征
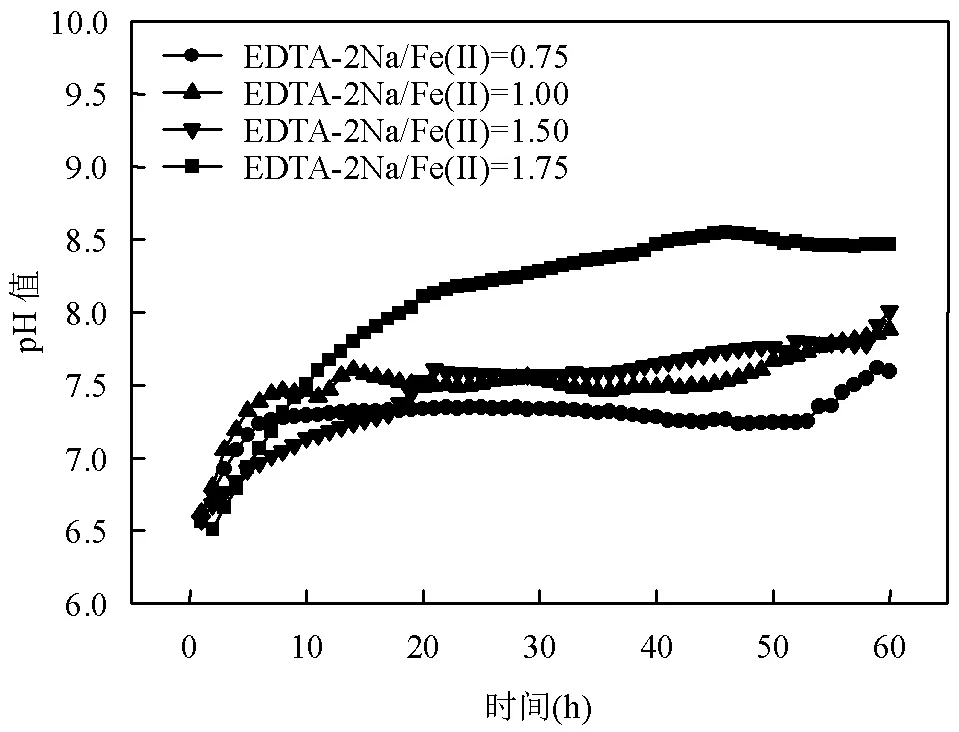
图3 不同EDTA-2Na/Fe(Ⅱ)下pH值的变化
由图3可知,4组不同EDTA-2Na/Fe(Ⅱ)实验的初始pH值皆控制在(6.50±0.30),因为Fe(Ⅱ)在偏酸性环境下更容易与EDTA-2Na形成螯合物.根据反应式(3)可知,铁自养反硝化是一个产酸的过程[19],因此理论上pH值是随着反应进行逐渐减小,然而图3中4种条件下pH值均为缓慢增加,并且当EDTA- 2Na/Fe(Ⅱ)=1.75时,pH值的增加幅度变大,说明这种现象很大可能是EDTA-2Na引起的.因为EDTA- 2Na的加入导致反应最终产物由Fe(OH)3变为可溶性的FeEDTA-,值得注意的是,此变化减小了Fe(OH)3附着微生物细胞表面产生的钝化影响,促进了细胞对Fe(Ⅱ)的吸收.考虑到反应产物为可溶性的FeEDTA-,故可加入单质铁使其还原为FeEDTA2-作为反应物循环利用.
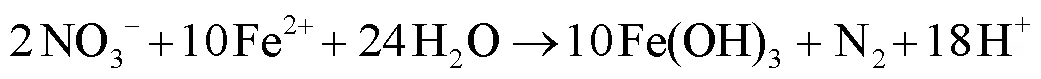
2.5 不同EDTA-2Na/Fe(Ⅱ)下ORP的变化特征
如图4所示, 0~12h内各反应器ORP基本一致,且都不断增加,表明在此阶段各反应器中正在进行硝酸盐还原过程,Fe(Ⅱ)正在被快速利用.在EDTA-2Na/Fe(Ⅱ)等于0.75和1.00的条件下,12~ 60h时ORP继续增加,因为根据图2(a)(b)所示,该时间段内系统只进行铁自养反硝化过程,NO3--N被还原为N2.同时由于EDTA-2Na添加量不足, Fe(Ⅱ)会随着pH值的增加逐渐形成氢氧
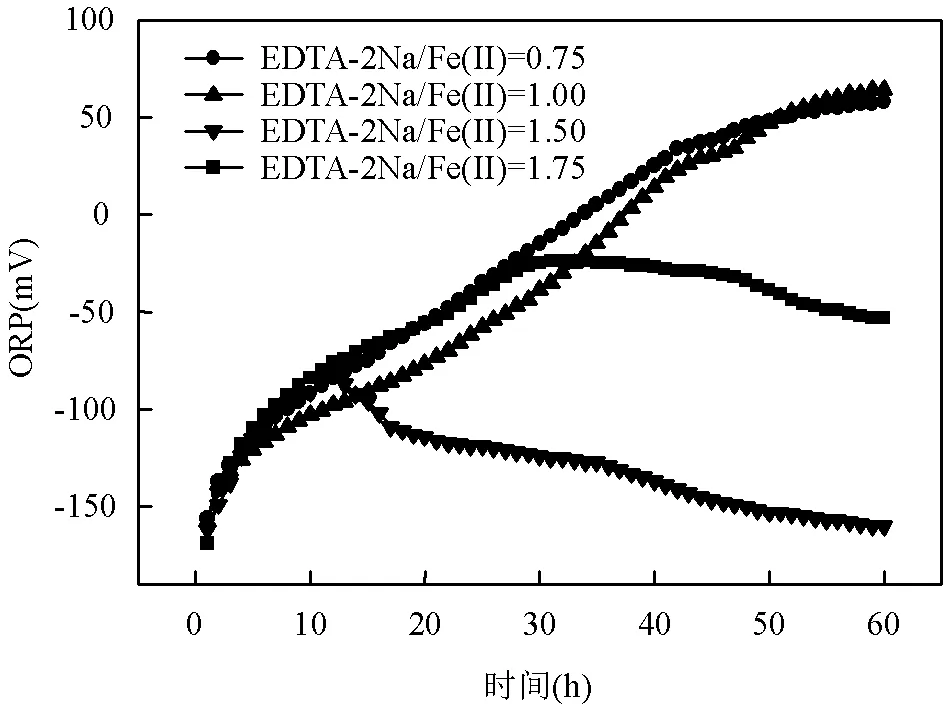
图4 不同EDTA-2Na/Fe(Ⅱ)下ORP的变化
化亚铁沉淀,因此, ORP总体上呈现上升态势.在EDTA-2Na/Fe(Ⅱ)等于1.50的条件下,12~60h时ORP由-81mV快速减小至-160mV,表现与前者截然不同,因为根据图2(c)所示,在该时间段内系统正在进行DNRA过程,NO3--N被异化还原成NH4+-N,反应器ORP快速减小.同样,在EDTA-2Na/Fe(Ⅱ)等于1.75的条件下,30~60h内系统亦进行DNRA过程,导致ORP由-24mV缓慢减小至-53mV,由此可见,ORP对系统的反应进程和反应类型均有一定的指示作用.刘双等[20]和张鹏程等[21]在研究COD:N:S对DNRA过程的影响时发现,只有当初始ORP在-400mV以下时,才有明显的DNRA现象,本文中当初始ORP等于-160mV时系统内出现DNRA现象,表明EDTA-2Na可以使得DNRA过程在较高的ORP环境下发生.
2.6 微生物群落分析
提取A、B、C、D号反应器稳定后微生物样品的DNA,采用16SrRNA高通量测序技术,在属水平上对微生物进行群落结构分析.不同EDTA-2Na/ Fe(Ⅱ)下微生物群落丰度变化如图5所示,4种不同条件下样本中微生物种群主要以Brucella、Castellaniella、Ochrobactrum、Pseudomonas为主,根据高峰等[22]和骆灵喜等[23]研究发现,这4种菌属都具有与反硝化过程有关的、和功能基因, Brucella菌属在EDTA-2Na/Fe(Ⅱ)=0.75、1.00、1.50、1.75下所占微生物比重依次为38.02%、24.15%、76.79%、47.72%,表明该菌属在铁自养反硝化过程起主导作用,且EDTA-2Na/ Fe(Ⅱ)=1.50的条件最适合其生存.
另外, Pseudomona在EDTA-2Na/Fe(Ⅱ)=0.75、1.00、1.50、1.75下所占微生物比重分别为9.54%、2.88%、0、0,由此可见随着EDTA-2Na添加量的增加,对该菌属活性的抑制持续增强.Ochrobactrum与Castellaniella菌属在EDTA-2Na/ Fe(Ⅱ)等于0.75与1.00条件下未发现,在EDTA-2Na/ Fe(Ⅱ)=1.50条件下占微生物比重分别为0.11%、7.91%,在EDTA- 2Na/ Fe(Ⅱ)等于1.75条件下占微生物比重分别为11.67%、30.36%,表明EDTA-2Na添加量越大,这两种菌属占比越大,对铁自养反硝化的贡献越大.
在EDTA-2Na/Fe(Ⅱ)=1.50和1.75时, Citrobacter菌属占比分别为4.10%、0.73%,根据李倩霞等[24]研究,Citrobacter菌属具有与DNRA过程有关的功能基因,这也印证了图2(c)、(d)中NH4+-N的积累与Citrobacter菌属进行DNRA过程有关.
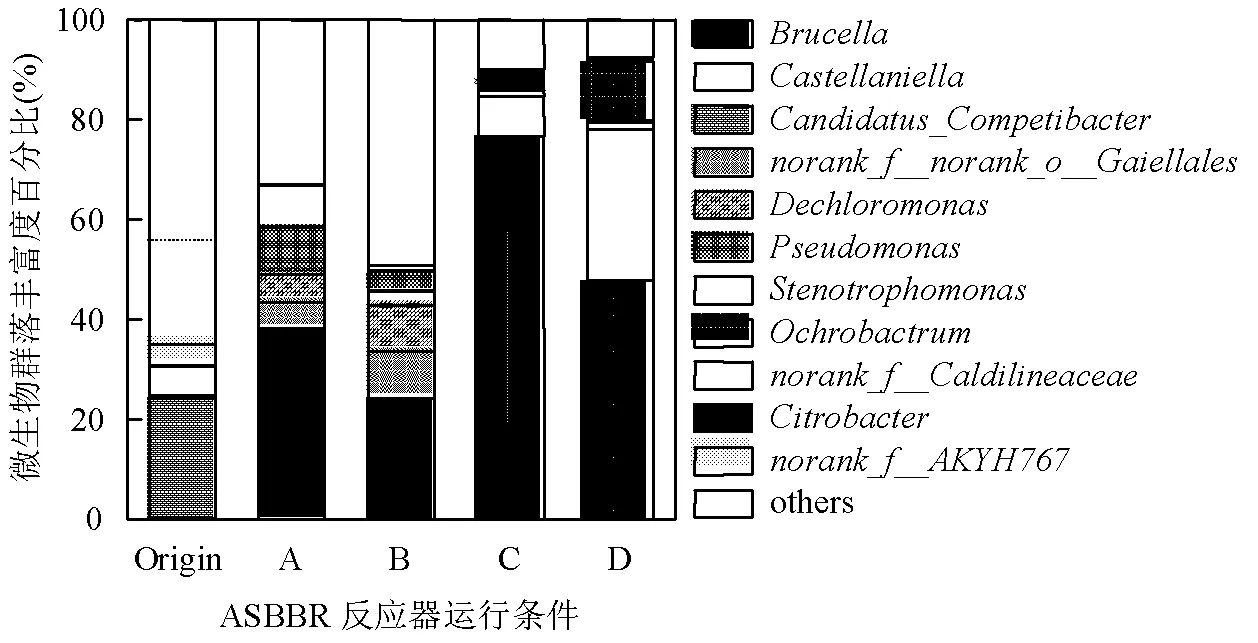
图5 微生物在属级水平上的相对丰度
A~D组为反应器编号,Origin为反应器初始污泥
3 结论
3.1 EDTA-2Na/Fe(Ⅱ)增大有利于FeEDTA2-的形成,提高Fe(Ⅱ)的生物可利用性,提高NO3--N去除率,但当该比例从1.5增至1.75时,反应副产物EDTA4-对微生物抑制严重, NO3--N去除率逐渐降低.
3.2 ORP对系统的反应进程和反应类型均有一定的指示作用.当发生反硝化过程时ORP会逐渐升高,而发生DNRA过程时ORP会逐渐降低. EDTA-2Na可降低DNRA发生所需ORP,提高DNRA在较高ORP条件下的出现几率.
3.3 系统优势菌属主要有Brucella、Castellaniella、Ochrobactrum、Pseudomonas、Citrobacter,其中前4种细菌的存在表明反应体系中存在铁自养反硝化,而后一种细菌则与DNRA过程有关.
[1] 周 可,潘 元,田 天,等.铁自养反硝化污泥富集培养过程中化学与生物作用的变化规律 [J]. 环境工程学报, 2021,(8):1-12.
Zhou K, Pan Y, Tian T, et al. Deciphering the evolution of biological and chemical process in acclimatization of autotrophic iron-dependent denitrifying sludge [J]. Chinese Journal of Environmental Engineering, 2021,(8):1-12.
[2] Straub K L, Benz M, Schink B, et al. Anaerobic, nitrate-dependent microbial oxidation of ferrous iron [J]. Applied and environmental microbiology, 1996,62(4):1458-60.
[3] Robertson E K, Roberts K L, Burdorf L D W, et al. Dissimilatory nitrate reduction to ammonium coupled to Fe(II) oxidation in sediments of a periodically hypoxic estuary [J]. Limnology and Oceanography, 2016,61(1):365-381.
[4] 卜翠娜.异化硝酸盐还原菌(DNRA)的环境分布及富集培养研究 [D]. 青岛:山东大学, 2018.
Bu C N. Study on environmental distribution and enrichment culture of dissimilatory nitrate reduction to ammonium (DNRA) bacteria [D]. Qingdao: Shandong University, 2018.
[5] 万雨轩,王 鑫.废水处理中异化硝酸盐还原为铵的研究进展[J]. 土木与环境工程学报(中英文), 2021,43(6):134-144.
Wan Y X, Wang X. Research progress of dissimilatory nitrate reduction to ammonium in wastewater treatment [J]. Journal of Civil and Environmental Engineering, 2021,43(6):134-144.
[6] 王晓婷.铁介导的活性污泥反硝化体系中DNRA过程的驯化与富集研究[D]. 西安:长安大学, 2021.
Wang X T. Study on domestication and enrichment of DNRA process in the iron-mediated activated sludge denitrification system [D]. xi’an:Chang'an University, 2021.
[7] 张文静,黄 勇,毕 贞,等.ANAMMOX菌铁自养反硝化工艺的稳定性[J]. 环境科学, 2019,40(7):3201-3207.
Zhang W J, Huang Y, Bi Z, et al. Stability of ZVI-dependent Autotrophic Denitrification by ANAMMOX Bacteria [J]. Environmental Science, 2019,40(7):3201-3207.
[8] Wang J Q, Yang M, Liu R P, et al. Anaerobically-digested sludgeconditioning by activated peroxymonosulfate: Significance of EDTA chelated-Fe2+[J]. Water Research, 2019,160.
[9] Li Z X, Peng Y Z, Gao H J. Enhanced long-term advanced denitrogenation from nitrate wastewater by anammox consortia: Dissimilatory nitrate reduction to ammonium (DNRA) coupling with anammox in an upflow biofilter reactor equipped with EDTA-2Na/Fe (II) ratio and pH control [J]. Bioresource Technology, 2020,305.
[10] 唐政坤,李 军,张 硕,等.Fe2+和EDTA对厌氧氨氧化工艺快速启动及菌群特性的影响[J]. 中国环保产业, 2018,(11):66-71.
Tang Z J, Li J, Zhang S, et al. Impact of Fe2+and EDTA on speed startup of anaerobic ammonia oxidation process and bacterial bevy Characteristics [J]. China Environmental Protection Industry, 2018, (11):66-71.
[11] 芦昭霖,李晓玲,苟文均,等.S/N对自养硝酸盐异化还原成铵过程的影响 [J]. 环境工程, 2019,37(12):17-21.
Lu Z L, Li X L, Gou W J, et al. Effects of S / N on process of autotrophic dissimilatory nitrate reduction to ammonium [J]. Environmental Engineering, 2019,37(12):17-21.
[12] 何秋来.厌氧/好氧/缺氧同步硝化反硝化除磷颗粒污泥系统构建及强化策略研究 [D]. 武汉:武汉大学, 2019.
He Q L. Start-up and enhancement of simultaneous nitrification, denitrification and phosphorus removal system based on aerobic granular sludge in the anaerobic/oxic/anoxic mode [D]. Wuhan: Wuhan University, 2019.
[13] 国家环境保护总局.水和废水监测分析方法.第4版 [M]. 北京:中国环境科学出版社, 2002.
National Environmental Protection Administration. Water and wastewater monitoring and analysis methods [M]. Beijing: China Environmental Science Press, 2002.
[14] 陈重军,汪瑶琪,姜 滢,等.有机物对连续流Anammox脱氮及微生物群落影响 [J]. 中国环境科学, 2019,39(12):5049-5055.
Chen C J, Wang Y Q, Jiang Y, et al. Effects of organic matter on nitrogen removal and microbial community in anammox reactor [J]. China Environmental Science, 2019,39(12):5049-5055.
[15] 常尧枫,郭萌蕾,谢军祥,等.厌氧氨氧化脱氮除碳功能菌群结构及代谢途径 [J]. 中国环境科学, 2022,42(3):1138-1145.
Chang Y F, Guo M L, Xie J X, et al. The structure and metabolic pathway of functional bacteria for nitrogen and carbon removal in Anammox [J]. China Environmental Science, 2022,42(3):1138-1145.
[16] 张兴兴,赵日祥,赵剑强.碳氮比对亚硝酸盐反硝化过程NO与N2O积累的影响研究 [J]. 给水排水, 2020,56(4):86-91.
Zhang X X, Zhao R X, Zhao J Q. Research of contrast the nitration- back process of BCN and nitrite effect on the accumulations in NO and N2O [J]. Water & Wastewater Engineering, 2020,56(4):86-91.
[17] Roberts K L, Kessler A J, Grace M R, et al. Increased rates of dissimilatory nitrate reduction to ammonium (DNRA) under oxic conditions in a periodically hypoxic estuary [J]. Geochimica et Cosmochimica Acta, 2014,133:313-324.
[18] Henneken L, Nörtemann B, Hempel D C. Influence of physiological conditions on EDTA degradation [J]. Applied Microbiology and Biotechnology, 1995,44(1/2):190-197.
[19] 张宁博,李 祥,黄 勇.pH值对零价铁自养反硝化过程的影响 [J]. 环境科学, 2017,38(12):5208-5214.
Zhang N B, Li X, Huang Y. Effect of pH value on autotrophic denitrification process of zero valent iron substrate [J]. Environmental Science, 2017,38(12):5208-5214.
[20] 刘 双,赵剑强,王 莎,等.硫自养与异养混合亚硝酸盐反硝化过程铵生成机制[J]. 环境工程学报, 2019,13(6):1366-1373.
Liu S, Zhao J Q, Wang S, et al. Ammonia production mechanism in a simultaneous occurrence of sulfur autotrophic and heterotrophic mixed nitrite denitrification process [J]. Chinese Journal of Environmental Engineering, 2019,13(6):1366-1373.
[21] 张鹏程,李晓玲,王晓婷,等.活性污泥体系中C/N/S对硝酸盐还原过程的影响 [J]. 中国环境科学, 2021,41(5):2117-2122.
Zhang P C, Li X L, Wang X T, et al. Effect of C/N/S on nitrate reduction process in activated sludge system [J]. China Environmental Science, 2021,41(5):2117-2122.
[22] 高 峰,蔡 凯,赵振华.高效反硝化菌株的分离鉴定及功能验证 [J]. 广东化工, 2020,47(10):33-36.
Gao F, Cai M, Zhao Z H. Isolation, identification and functional verification of high efficiency denitrification strains [J]. Guangdong Chemical Industry, 2020,47(10):33-36.
[23] 骆灵喜,刘 欢,王 枫,等.CRI系统反硝化细菌的筛选及脱氮性能研究 [J]. 环境工程, 2014,32(4):9-13.
Luo L X, Liu H, Wang F, et al. Screening and denitrification performance of denitrifying bacteria in constructed raoid Infiltration System [J]. Environmental Engineering, 2014,32(4):9-13.
[24] 李倩霞.异化硝酸盐还原菌(DNRA)对不同碳源的适应性及其在自然环境中的分布研究 [D]. 青岛:山东大学, 2020.
Li Q X. Study on the adaptability of DNRA to different carbon sources and distribution in natural environment [D]. Qingdao: Shandong University, 2020.
Effect of EDTA-2Na/Fe(Ⅱ) on nitrate reduction in autotrophic biological system.
ZHANG Wen-bo1, LI Xiao-ling1,2*, LIU Xin-yi1, ZHANG Jia-ying1, ZHOU Jun-cai1, MENG Wen1, ZHANG Peng-cheng1
(1.School of Civil Engineering, Chang’an University, Xi’an 710061, China;2.Key Laboratory of Water Supply & Sewage Engineering, Ministry of Housing and Urban-Rural Development, School of Civil Engineering, Chang’an University, Xi’an 710054, China)., 2022,42(7):3149~3155
The initiation of iron mediated denitrification was studied in an anaerobic sequenced batch biofilm reactor (ASBBR) with a fixed concentration of nitrate and ferrous sulfate, supplemented with EDTA-2Na according to different gradient conditions for a long period of cultivation domestication. Meanwhile, the effects of different EDTA-2Na/Fe(Ⅱ) on iron autotrophic denitrification process and the dissimilatory nitrate reduction to ammonium (DNRA) were also explored in this study. The results showed that after 65days of cultivation and domestication, the reactor operated successfully and stably, and the removal rate of NO3--N was up to 99.70%. When EDTA-2Na/Fe(Ⅱ) < 1.50, only iron autotrophic denitrification was performed with the highest removal rate of NO3--N of 71.70%; When EDTA-2Na/Fe(Ⅱ)³1.50, iron autotrophic denitrification and DNRA were carried out simultaneously in the reactor, and the highest removal rate of NO3--N was 99.70%. It was worth noting that when EDTA-2Na/Fe(Ⅱ)=1.50, the iron autotrophic denitrification rate reached the maximum value of 1.63mg/(L·h), and the ammonia production of DNRA also reached the maximum value of 9.75mg/L. Visual MINTEQ simulation results showed that the molar ratio of EDTA-2Na to Fe (Ⅱ) affected the existing forms of EDTA-2Na and Fe (Ⅱ) in the influent. The larger the molar ratio, the higher the concentration of FeEDTA2-and the stronger the bioavailability of Fe (Ⅱ). Through microbial population analysis, it was found that the dominant bacteria were Brucella, Castellaniella, Ochrobactrum, Pseudomonas as well as Citrobacter. Among them the first four bacteria were related to denitrification process, while Citrobacter was related to DNRA process and was only appeared under the conditions of EDTA-2Na/Fe(Ⅱ)=1.50 and 1.75 in this research. Therefore, the above results could throw light on further exploring the relationship between DNRA and denitrification.
ASBBR;iron autotrophic denitrification;dissimilatory nitrate reduction to ammonium (DNRA);EDTA-2Na
X703
A
1000-6923(2022)07-3149-07
张文勃(1997-),男,陕西宝鸡人,长安大学建筑工程学院硕士研究生,主要研究方向为污水脱氮及污泥资源化.发表论文1篇.
2021-12-20
陕西省自然科学基金(2019JQ-686);中央高校基金(300102282104)
* 责任作者, 副教授, lixiaoling20030327@126.com
