白腐菌联合纳米零价铁强化去除水中Cd(II)
2022-07-19曾峤婧郑小雨王梦欣
曾峤婧,周 鑫,黄 超*,王 平**,程 豪,郑小雨,王梦欣,刘 昊
白腐菌联合纳米零价铁强化去除水中Cd(II)
曾峤婧1,2,周 鑫1,黄 超1,2*,王 平1,2**,程 豪1,2,郑小雨1,2,王梦欣1,2,刘 昊1,2
(1.中南林业科技大学环境科学与工程学院,湖南 长沙 410004;2.稻米品质安全控制湖南省工程实验室,湖南 长沙 410004)
采用白腐菌和纳米零价铁(nZVI)联合体系强化去除水中Cd(II),并考察pH值、Cd(II)初始浓度、温度、nZVI投加量对Cd(II)去除的影响,分析nZVI对白腐菌胞内外富集镉的影响特性,同时结合扫描电镜、红外光谱、X射线光电子能谱、三维荧光光谱等手段分析联合体系对Cd(II)的强化去除机制.结果表明,在pH=6, Cd(II)初始浓度为50mg/L,温度为30 ℃,nZVI投加量为0.1g/L的条件下反应180min后,Cd(II)的去除率可达到99.5%以上.联合体系对Cd(II)的去除过程符合准二级动力学,主要去除机制为白腐菌对Cd(II)的胞外络合吸附,添加nZVI能促进白腐菌对Cd(II)的胞外吸附,FTIR和 XPS分析表明,羟基、羧基和氨基参与了Cd(II)的吸附,白腐菌胞外聚合物(EPS)能与铁发生内层配位形成P-O-Fe键,加速富含羟基官能团的纤铁矿、磁铁矿等铁矿物形成,从而促进对溶液中Cd(II)的吸附去除.
白腐菌;纳米零价铁;胞外聚合物;镉
近年来,重金属污染问题已成为影响人类生存和发展的全球性环境问题,其中镉(Cd)是重金属污染中最受关注的元素之一.目前针对镉污染水体的修复技术主要包括化学沉淀法、离子交换法、膜分离法以及吸附法等[1-2].其中微生物吸附法因其成本低、环境友好,已成为水体镉污染修复的研究热点.
白腐菌是一类研究广泛的对众多重金属具有优良吸附能力的丝状真菌,可依靠其胞外多聚物及细胞壁上的官能团等对重金属进行胞外吸附和胞内积累[3].白腐菌中的典型菌株黄孢原毛平革菌在最适吸附条件下对Pb(II)、Cd(II)、Cu(II)的吸附容量可分别达到85.86,27.79和26.55mg/g[4].其细胞壁上的氨基、羧基和羰基等官能团的吸附络合作用是白腐菌去除重金属的主要途径.且白腐菌胞外聚合物(EPS)中多糖类物质相较于蛋白质在镉去除中发挥更重要的作用[5].尽管利用白腐菌去除镉的研究已有诸多报道,但仍存在处理时间较长、对Cd(II)去除效率不高等问题,如何提高白腐菌对镉的吸附效率是目前研究值得关注的问题.
纳米零价铁(nZVI)具有粒径小、比表面积大、反应活性高、环境友好等优点,近年来已被广泛应用于水体和土壤镉污染治理中[6].但nZVI易团聚和易被氧化,使其表面形成一层铁氧化膜降低其反应活性[7-8].因氧化还原电位接近,nZVI对Cd(II)的去除效率不高且不稳定[9].因此广大研究者开展了对nZVI的改性研究,包括添加高分子稳定剂[10]、制成负载型材料[11]等.
近年来,nZVI与微生物联合修复技术开始受到研究者的关注,主要集中在脱卤、脱氮和重金属修复方面[12-13].nZVI腐蚀产生的自由氢可为微生物提供电子供体,促进微生物生长[14].同时微生物可为nZVI提供附着位点,抑制nZVI的团聚,从而提高nZVI的反应活性[15].部分微生物如异化铁还原菌能破坏nZVI表面的氧化膜,促进铁的还原与循环,提升nZVI对Cr(VI)的去除性能和稳定性[16].研究证实,白腐菌也具有铁还原能力,能通过胞外氧化酶系统还原三价铁来实现对有机物的氧化降解[17].因此,将白腐菌与nZVI联合有望克服单一修复技术的不足,解决纳米零价铁易团聚氧化而活性降低的问题,实现对重金属的协同高效去除.
本研究拟构建nZVI与白腐菌联合体系,考察其对水体中Cd(II)的协同去除性能与动力学规律,通过单因素实验考察反应参数对联合体系去除Cd(II)的影响特性,并研究nZVI对白腐菌胞内外富集镉特性及EPS组分含量的影响,再结合现代表征手段分析联合体系对Cd(II)的强化去除机理,为水体重金属Cd(II)污染治理提供新的方法.
1 材料与方法
1.1 主要试剂与仪器
实验用到的主要试剂有七水合硫酸亚铁(FeSO4·7H2O)、硼氢化钠(NaBH4)、磷酸二氢钾(KH2PO4)、七水硫酸镁(MgSO4·H2O)、氯化钙(CaCl2)、氯化钠(NaCl)、氯化镉(CdCl2)等,均为分析纯,购自国药集团化学试剂有限公司.琼脂粉、马铃薯葡萄糖肉汤(PDB)培养基购自杭州微生物试剂有限公司.
1.2 实验材料
1.2.1 实验菌种本研究选择白腐真菌中的典型菌株—黄孢原毛平革菌BKM-F-1767开展研究,该菌株购自北京北纳创联生物技术研究院,经活化后转移至马铃薯葡萄糖琼脂培养基上30℃培养5d,然后保存于4℃冰箱.
1.2.2 nZVI的制备采用液相还原法制备nZVI[18],具体制备方法如下:将100mL 0.25mol/L的FeSO4溶液加入到250mL的三口烧瓶中,在氮气保护和机械搅拌下,将等体积0.75mol/L的NaBH4溶液逐滴匀速滴入三口烧瓶中,滴定结束后继续搅拌半小时至反应完全.然后沉淀用磁铁分离,再依次用脱氧去离子水和无水乙醇各洗2次,最后于60℃真空干燥过夜.
1.3 Cd(II)去除实验
从冰箱中取出菌种,置于培养箱中30℃活化30min,用无菌棉签将适量白腐菌孢子从琼脂培养基上刮下溶解到无菌水中,充分摇匀制成孢子悬液,调节OD650=0.5(孢子悬液浓度约为 2.5´106个/mL),取2mL孢子悬液接种到冷却的马铃薯葡萄糖肉汤(PDB)培养基中,体系总体积为100mL,置于30℃, 150r/min培养48h待菌株进入对数生长期后,继续向体系中添加一定量的CdCl2和nZVI进行Cd(II)去除模拟实验.默认条件为温度30℃,pH 6.0,nZVI添加量0.1g/L,Cd(II)初始浓度50mg/L.每隔一段时间在无菌条件下从体系中取适量溶液并经0.22μm滤膜过滤后,用石墨炉原子吸收分光光度计测定滤液中镉的浓度,用邻菲罗啉分光光度法测定滤液中总溶解性铁的含量.反应结束后,离心收集沉淀物,经超纯水和无水乙醇清洗后于60℃真空干燥过夜.同时收集白腐菌菌球,经无菌水清洗后,真空冷冻干燥48h再研磨成菌粉,过80目筛,用于后续表征分析.
1.4 白腐菌胞内外镉含量测定
收集不同反应时间的白腐菌,使用50mL 0.2mol/L HNO3溶液清洗后,150r/min震荡30min收集上清液,上清液中的镉含量即为胞外镉富集量.收集菌球,用超纯水清洗3遍,再经微波消解、赶酸、定容后测定溶液中镉含量,即为胞内镉积累量[19].
1.5 EPS的提取和EPS中蛋白质及多糖测定
采用高速冷冻离心法提取反应过程中白腐菌EPS[20].将培养得到的菌球经超纯水清洗后于4℃, 10000r/min下离心20min,得到的上清液即为 EPS 溶液.EPS溶液中多糖浓度采用蒽酮硫酸比色法,以葡萄糖作为标准品,在波长620nm处测定.EPS溶液中蛋白质浓度采用考马斯亮蓝 G250法在595nm波长下比色测定,以牛血清蛋白作为标准物质.
1.6 样品表征
采用场发射扫描电子显微镜能谱(SEM-EDS)分析白腐菌的表面微观形貌及元素组成特征,采用三维荧光光谱(3D-EEM)分析白腐菌EPS组分,采用红外光谱(FTIR)分析白腐菌的主要化学官能团,采用X射线光电子能谱(XPS)分析nZVI的元素组成及化学价态.
1.7 数据分析与统计
为了研究白腐菌/nZVI吸附Cd(II)的速率控制步骤及潜在吸附机理.本研究采用准一级动力学模型(式(1))、准二级动力学模型(式(2))分析反应的吸附动力学规律,并用Arrhenius方程(式(4))分析吸附反应活化能.
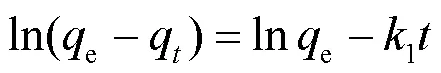
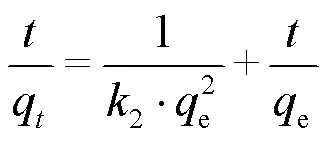
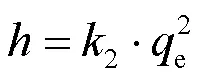
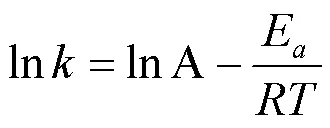
式中:e和t分别为反应平衡时和时刻Cd(II)的吸附去除量,mg/g;为反应时间,min;1为准一级反应速率常数,min-1;2为准二级反应速率常数,g/(mg·min);为准二级反应初始吸附速率,mg/(g·min);E为活化能,kJ/mol;为理想气体常数,8.314J/(mol·K);为吸附温度,K.
本研究实验组均设置3个平行实验,取其数据的平均值±标准偏差作为实验结果,采用Microsoft Excel 2013对试验数据进行整理,采用Origin Pro 8.5进行作图,采用SPSS Statistics 18.0对数据进行单因素方差分析,显著性水平为<0.05.
2 结果与讨论
2.1 白腐菌/nZVI对水中Cd(II)的吸附动力学
如图1所示,与单独的白腐菌和nZVI相比,白腐菌/nZVI联合体系对水中Cd(II)的吸附量有显著提高.反应420min后,nZVI和白腐菌对Cd(II)的吸附量仅为55.2mg/g和76.3mg/g,说明单独的白腐菌和nZVI对Cd(II)的吸附能力有限.而当反应时间为180min时,白腐菌/nZVI联合体系对Cd(II)的吸附量已达到131.5mg/g,说明白腐菌和nZVI对水中Cd(II)的去除有协同作用.
为了考察白腐菌、nZVI、白腐菌/nZVI对Cd(II)的去除动力学规律,本研究采用准一级动力学模型、准二级动力学模型对不同体系去除Cd(II)的实验数据进行拟合,结果如表1所示.准一级动力学模型适合于描述受颗粒内扩散控制的吸附过程,而准二级动力学则由液体/固体界面的吸附反应所控制.本研究结果发现,白腐菌/nZVI体系对水中Cd(II)的去除过程更符合准二级动力学.白腐菌/nZVI对Cd(II)的初始吸附速率和平衡吸附量e分别为3.45mg/ (g·min)和131.58mg/g,分别是白腐菌的5.21倍和1.72倍,nZVI的2.66倍和2.38倍,表明白腐菌/nZVI具有更快的Cd(II)吸附速率和更高的平衡吸附量.
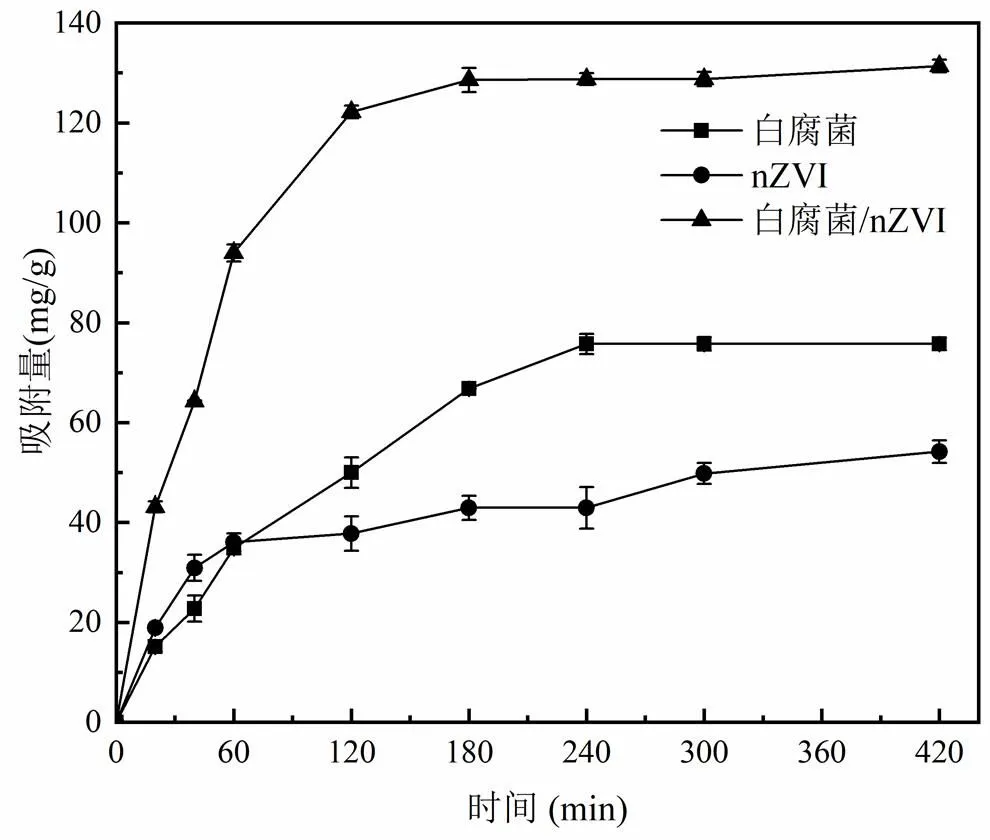
图1 不同体系对Cd(II)的去除率
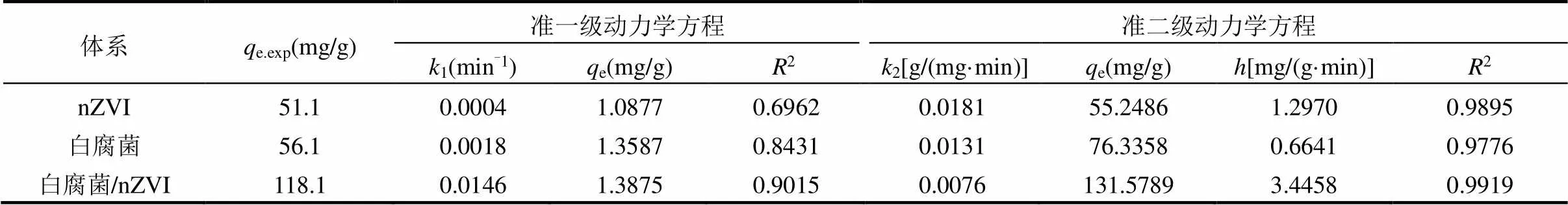
表1 不同体系的动力学方程拟合结果
2.2 白腐菌/nZVI对水中Cd(II)的去除影响因素
2.2.1 pH值的影响由于碱性条件下,Cd(II)易形成Cd(OH)2沉淀,所以本实验仅考察酸性条件下pH值(3,4,5,6,7)对白腐菌/nZVI去除Cd(II)的影响,溶液pH值用0.1mol/L HCl和NaOH进行调节.由图2(a)可知,溶液pH值对Cd(II)去除影响较大,提高溶液pH值能一定程度上增加白腐菌/nZVI对Cd(II)的去除率.当pH值为3和4时,Cd(II)去除效果不明显,均低于15%,这是因为在强酸性条件下,溶液中的H+与Cd(II)会竞争白腐菌和nZVI上的活性位点[21],白腐菌官能团中的羧基、羟基上的质子难以解离,使Cd(II)与官能团的结合机会减少,同时菌的生长也受到限制,因此不利于Cd(II)的吸附[22-23].当pH=6时,反应420min后Cd(II)去除率达到99.5%,这是因为pH值升高,体系表面官能团的去质子化作用加强,负电荷增加,其与Cd(II)之间的结合能力增强,从而导致Cd(II)吸附量增加.当pH值高于6.5时,溶液中的OH-与白腐菌细胞壁上的官能团会对镉离子发生竞争作用,导致吸附率降低[24].
由图2(b)可知,随着pH值增大,铁的溶解逐渐减少,当pH值为6和7时,整个反应过程中总溶解性铁含量均低于2.0mg/L,说明体系中铁对环境的二次污染较小,结合体系对Cd(II)的去除效果,本研究其他实验选择pH =6开展实验.
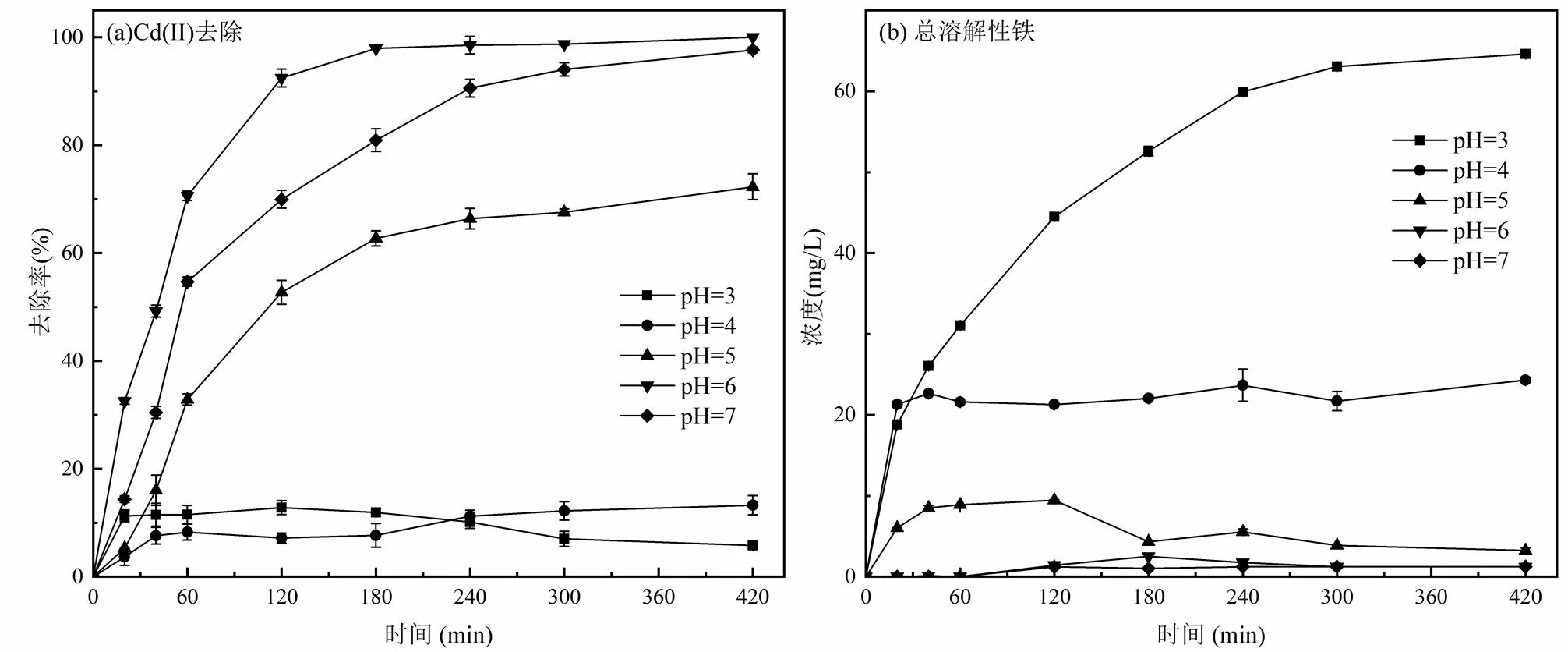
图2 pH值对Cd(II)去除及溶液中总溶解性Fe含量的影响
2.2.2 Cd(II)初始浓度的影响Cd(II)初始浓度会影响白腐菌的生长和代谢活性,从而影响白腐菌/nZVI对Cd(II)的去除.本文考察了25,50,75,100mg/ L 4个不同Cd(II)初始浓度下白腐菌/nZVI对Cd(II)的去除效果.由图3(a)可知,随着初始浓度增大,白腐菌/nZVI对Cd(II)的去除率逐渐降低,且单位吸附量趋于平稳(图3(b)),这是因为Cd(II)浓度升高,材料表面的吸附位点逐渐趋向饱和.同时过高的Cd(II)浓度会对白腐菌产生较大毒性,产生大量能攻击细胞膜、蛋白质甚至DNA的自由基,造成细胞变形和氧化损伤,影响细胞壁上官能团(酰胺和羟基)与Cd(II)之间的络合,从而导致Cd(II)去除能力下降[25].
2.2.3 温度的影响温度是影响生长和代谢活动的重要因素,本文考察了3个不同温度(20,30,40℃)下白腐菌/nZVI对Cd(II)的去除效果.由图3(c)所示,随着温度升高,白腐菌/nZVI体系对Cd(II)的去除逐渐加快,反应420min后最终的去除率均可达到99.5%以上,表明白腐菌/nZVI具有较好的温度耐受性和稳定性. 30~40 ℃为适宜的温度范围,在该条件下白腐菌/nZVI体系在180min内即可基本实现对Cd(II)的完全去除.另外,根据动力学模型和Arrhenius公式分析反应速率常数与温度的相关关系得到该吸附过程的活化能=68.02kJ/mol,大于物理吸附所需的能量4.18kJ/mol,表明白腐菌/nZVI体系对Cd(II)的吸附为化学吸附过程.
2.2.4 nZVI投加量的影响nZVI投加量对白腐菌/nZVI去除Cd(II)的影响如图3(d)所示,随nZVI投加量增大,白腐菌/nZVI对Cd(II)的去除率逐渐升高,当nZVI投加量为0和0.05g/L时,白腐菌/nZVI对Cd(II)的去除能力有限,反应420min后,Cd(II)去除率分别仅为51.2%和65.9%.而当nZVI投加量增加到0.1和0.15g/L时,反应180min后即可达到平衡,Cd(II)去除率均达到99%以上,表明此时溶液中Cd(II)的去除率受nZVI投加量影响较小,其原因可能在于溶液中材料提供的有效吸附位点多于去除溶液中Cd(II)所需的吸附位点.所以本研究中nZVI投加量默认采用0.1g/L,以保证具有高效的Cd(II)去除性能,同时节约成本.
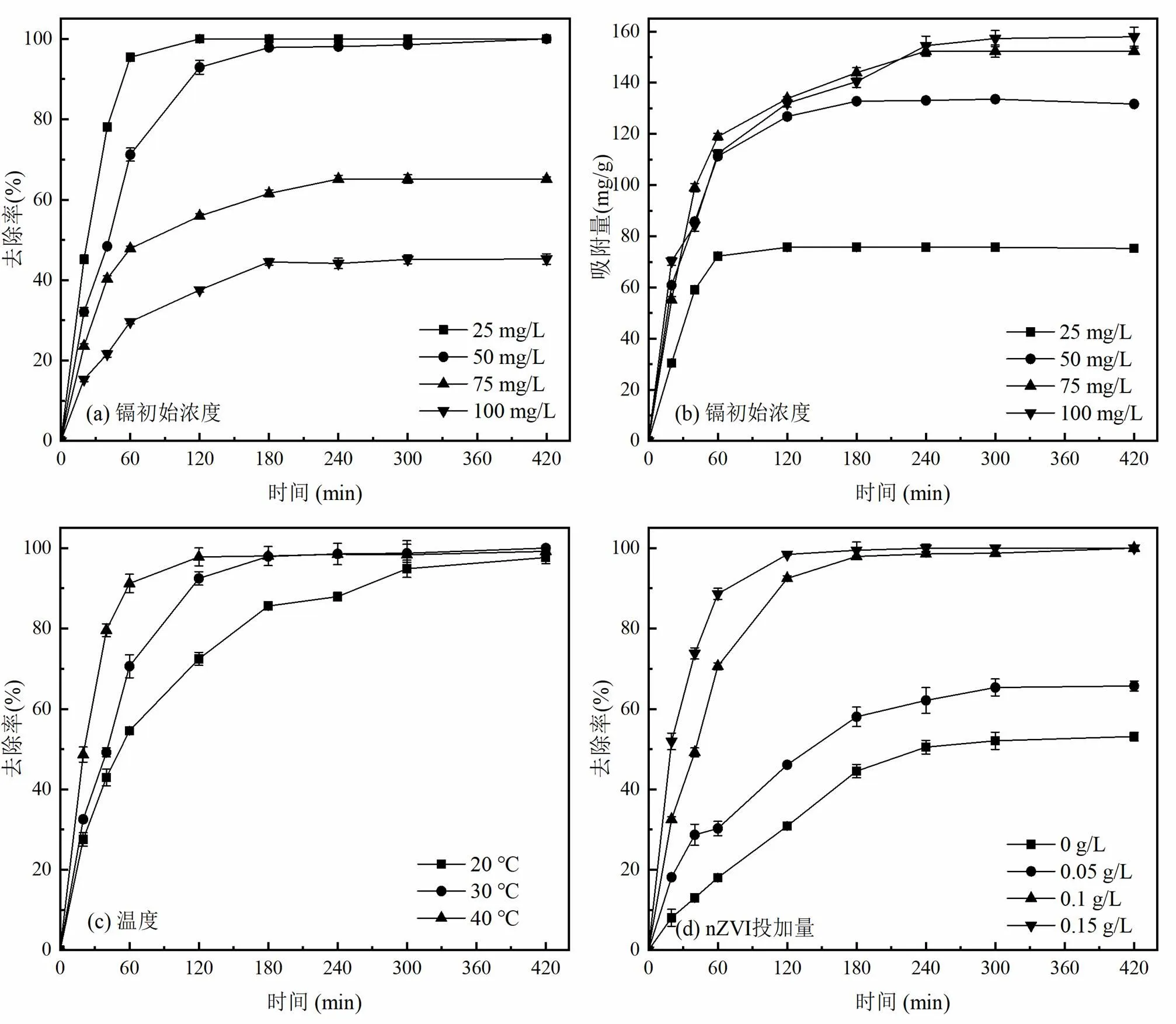
图3 不同条件对去除Cd(II)的影响
2.3 白腐菌/nZVI对Cd(II)的去除机制
2.3.1 白腐菌/nZVI对Cd(II)的吸附热力学白腐菌/nZVI吸附Cd(II)的热力学参数如表2所示(Δ0为吸附熵变化, Δ0为吸附焓变化, Δ0为吉布斯自由能变化).可以看出不同温度条件下Δ0的绝对值随着温度升高而增大,表明白腐菌/nZVI对Cd(II)的吸附反应是自发进行的且温度升高有利于吸附进行.ΔH0为正值进一步说明白腐菌/nZVI对(II)的吸附是吸热过程.
2.3.2 nZVI对白腐菌胞内外富集镉的影响前期研究表明,白腐菌不仅能通过其细胞表面的活性官能团或分泌的具有络合功能的多糖类等物质胞外吸附环境中的重金属离子,还能将其吸收积累在自身细胞内[26-27].因此本文考察了nZVI添加前后白腐菌对镉的胞内外富集量变化情况,结果如图4所示.添加nZVI和未添加nZVI的实验组中白腐菌胞内均能检测到低含量的镉(<10mg/g),且白腐菌对镉的胞内积累量随时间呈现先升高后降低的趋势,添加nZVI能显著提高反应中后期(>60min)白腐菌对镉的胞内积累量.这说明白腐菌可通过细胞壁和细胞膜上的离子通道等途径将Cd(II)运输到菌体内部,然后在细胞内富集[28],nZVI的添加可能有助于提高白腐菌对Cd(II)的主动运输能力.同时分析发现,白腐菌胞外镉富集量显著高于胞内镉富集量,且随着反应进行,白腐菌对镉的胞外富集量逐渐增加,添加nZVI同样能显著提高反应中后期白腐菌对镉的胞外富集量,420min后胞镉外富集量分别达到100.5mg/g和40.0mg/g,说明白腐菌对镉的去除主要以胞外络合、离子交换、胞外螯合沉淀等方式为主,胞内积累起次要作用,添加nZVI后附着在白腐菌菌丝上的nZVI能增加体系的吸附位点,从而提高白腐菌的胞外镉吸附量.
2.3.3 nZVI对白腐菌EPS中各组分含量的影响 真菌EPS中包含多糖、蛋白质、脂肪和色素等物质,尤其是多糖和蛋白质在重金属的表面吸附、络合、还原等作用机制方面处于重要地位.上述结果已发现添加nZVI能显著提高白腐菌对镉的胞外富集量,因此本文考察了nZVI对白腐菌EPS中多糖和蛋白组含量的影响.由图5可知,随着反应进行,EPS中蛋白质含量先增加后减少,多糖含量先短暂上升再逐渐减少后期再上升,且添加nZVI的实验组中EPS多糖和蛋白质含量低于对照组,表明nZVI的投加抑制了EPS的产生,这可能是由于EPS上的官能团(羟基、羧基、酚羟基等)与nZVI氧化生成的Fe(II)发生相互作用,促进了EPS的降解[29].此外,EPS中磷酸基可作为成核位点与铁离子形成P-O-Fe键,促进含氧铁矿物的形成,其表面丰富的羟基官能团能促进Cd(II)的表面络合与沉淀.

表2 不同温度下的吸附热力学参数
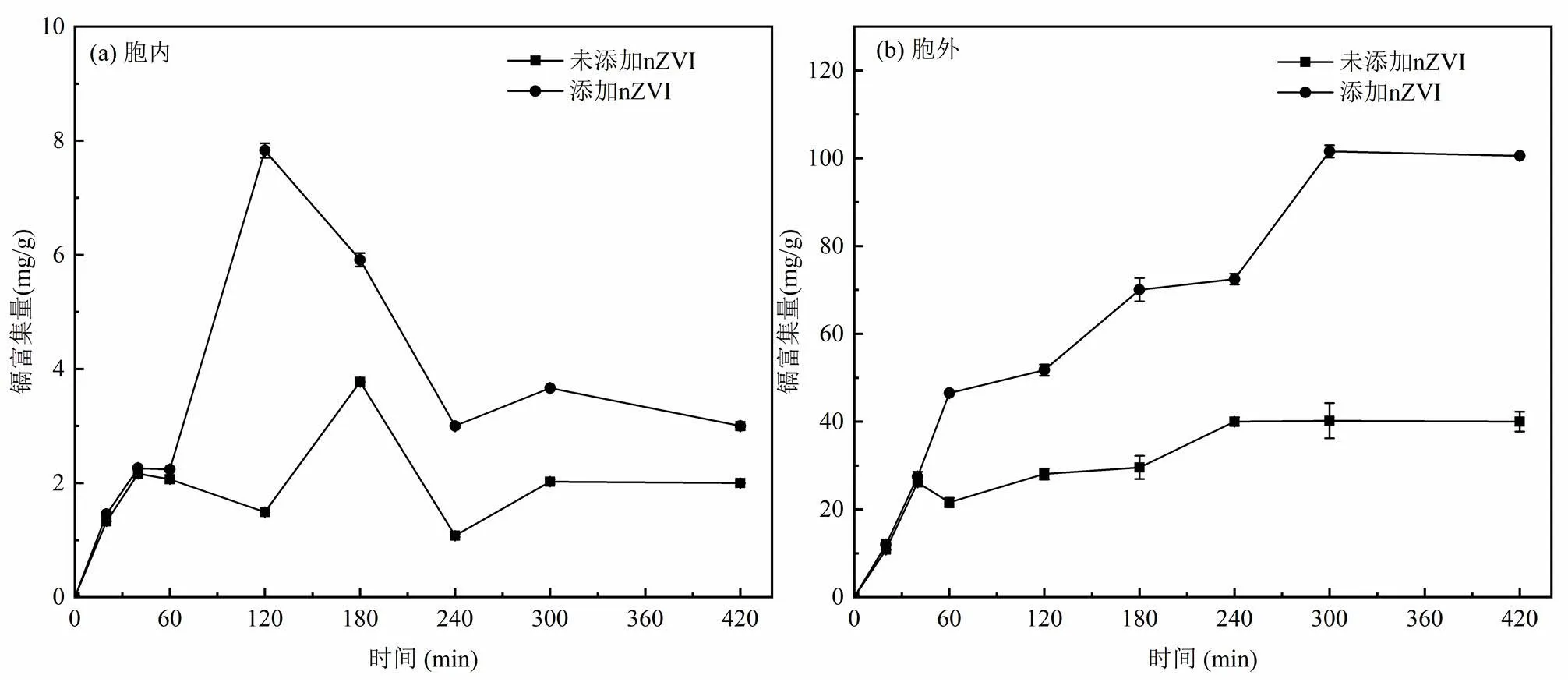
图4 nZVI对白腐菌胞内外富集镉的影响
2.3.4 白腐菌EPS的3D-EEM分析采用3D-EEM考察白腐菌EPS组分变化,结果如图6所示.从对照组和添加Cd(II)后白腐菌EPS的荧光光谱中可识别出两个主峰(峰A为芳香类蛋白,x/m= 225~230nm/310~330nm,峰B为色氨酸x/m=275~ 280nm/328~344nm)[30-31].添加Cd(II)和nZVI后的白腐菌出现了强度较低的峰C(峰C为类富里酸:x/m=240nm/442~448nm)[32].可能是因为添加nZVI后,促进了EPS中蛋白表达的多样性[33].添加Cd(II)的B峰位置相比对照组的B峰位置发生了一定程度的红移.红移是由于荧光团结构中羰基、羟基、烷氧基、氨基和羧基的增加[34].这是因为蛋白质吸附重金属离子,有助于减轻其毒性.但添加nZVI的B峰位置相比未添加Cd(II)的B峰位置发生了一定程度的蓝移,这与之前EPS中蛋白质含量的变化一致.这是因为nZVI破坏了EPS中荧光物质的特定官能团,并导致聚合物主链中的键断裂[35],导致EPS与铁离子结合,促进含铁矿物形成,从而促进对Cd(II)的去除.
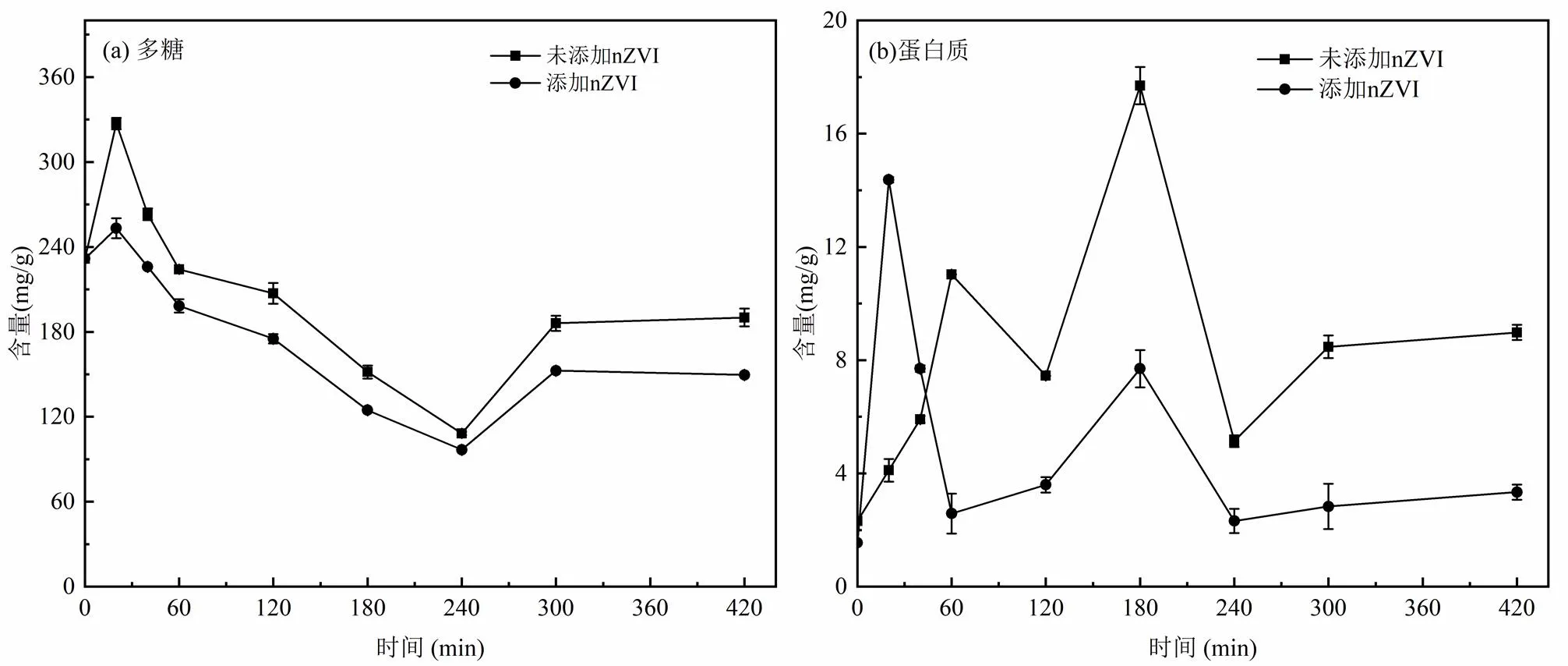
图5 nZVI对白腐菌EPS中组分含量的影响
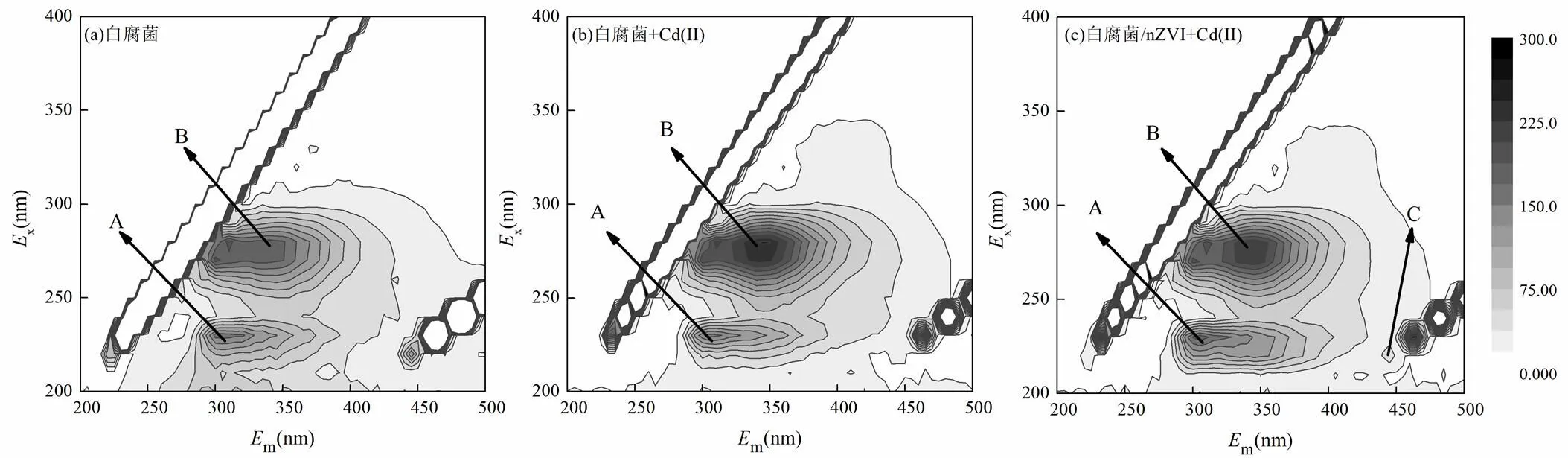
图6 白腐菌EPS的三维荧光光谱
2.3.5 白腐菌的形貌分析采用SEM考察白腐菌的微观形貌,结果如图7所示.未添加Cd(II)的白腐菌菌丝呈现高度分枝化并相互缠绕,菌丝表面光滑无明显附着物,未观察到任何物理损伤.添加Cd(II)后的菌丝光滑度明显下降,菌丝缠裹着大量颗粒物质[36],能谱元素分析证实被缠裹的为含镉的颗粒物(图7(e)).添加nZVI后菌丝表面附着更为密集的球状颗粒,对白腐菌菌丝上的颗粒物质进行能谱元素分析发现新增了Cd和Fe元素的峰(图7(f)),说明nZVI能有效负载到白腐菌菌丝表面并协同白腐菌高效吸附Cd(II).
2.3.6 白腐菌的官能团分析真菌细胞壁上的羟基、羧基、氨基等官能团都能参与重金属的吸附.本文利用FTIR对白腐菌吸附Cd(II)前后的主要官能团进行鉴定,如图8所示,反应前3426cm-1处的强宽吸收峰是—OH和N—H伸缩振动峰[37],1648cm-1处的吸收峰为酰胺Ⅰ带,是C=O的伸缩振动, 1548cm-1处的吸收峰分别为多肽或蛋白质中N—H的弯曲振动[38],1251cm-1是酰胺Ⅲ带,代表C—N伸缩振动和N—H弯曲振动,也可能有PO伸缩振动的贡献.吸附Cd(II)后吸收峰从3426cm-1偏移到3411和3417cm-1,说明白腐菌表面的羟基参与了Cd(II)的吸附. 1648cm-1处的吸收峰在Cd(II)吸附后均偏移至1650cm-1处,说明羟基、羧基和氨基官能团均参与了去除水中Cd(II)的反应.对比未添加nZVI的FTIR图,添加nZVI反应后的白腐菌出现了Fe—O吸收峰(572cm-1),表明白腐菌通过Fe—O键将nZVI结合在了菌丝表面[39].同时可观察到吸收峰从1251cm-1偏移到1246和1243cm-1,这可能是因为P—O—Fe的伸缩振动所引起[40],其原因在于白腐菌的EPS中核酸及磷酸化蛋白质中的磷酸基作为成核位点与溶液中的铁发生内层配位形成P—O—Fe键,固定溶液中生成的铁离子,促进含氧铁矿物的形成及Cd(II)的表面络合与沉淀.
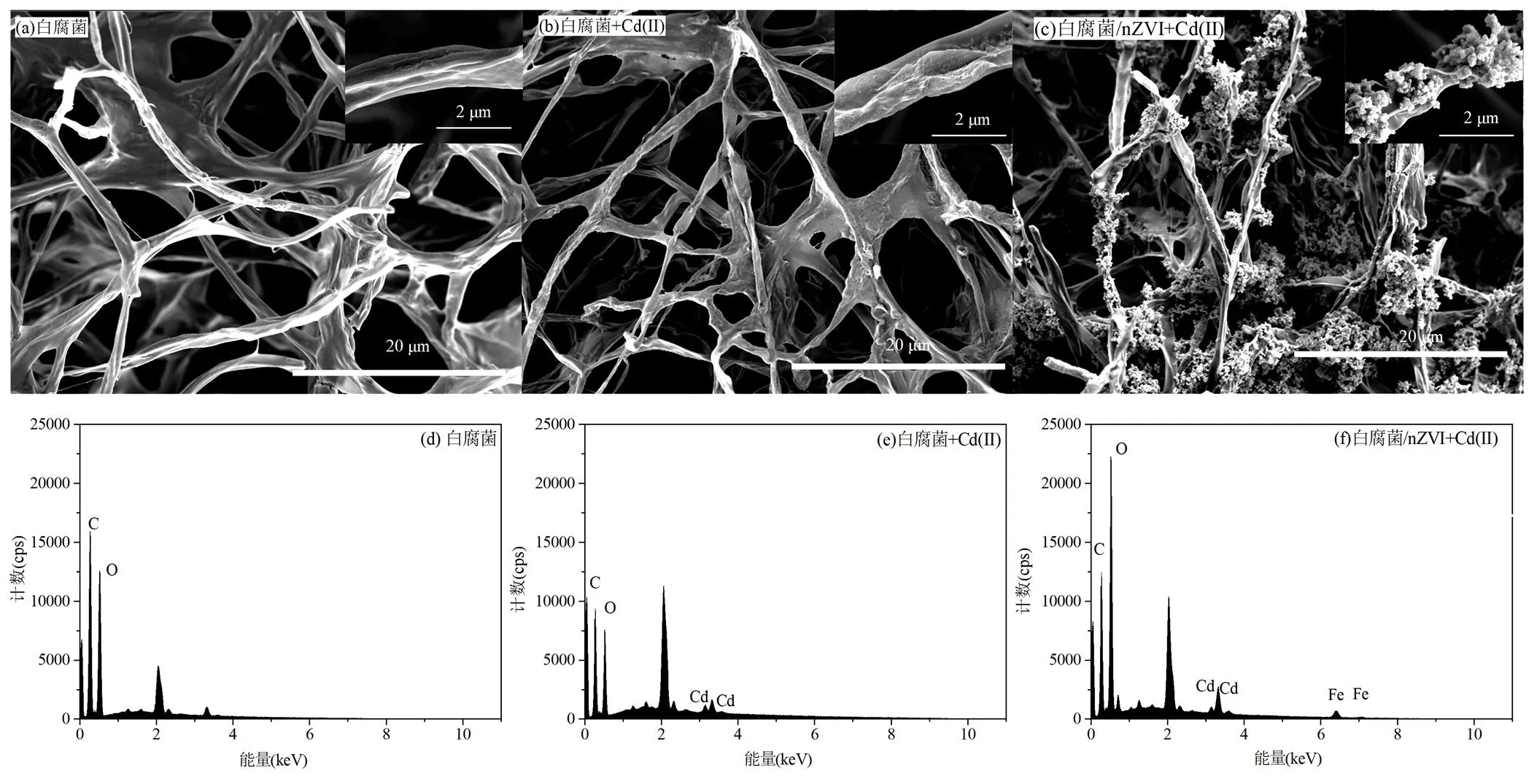
图7 白腐菌的SEM和EDS图
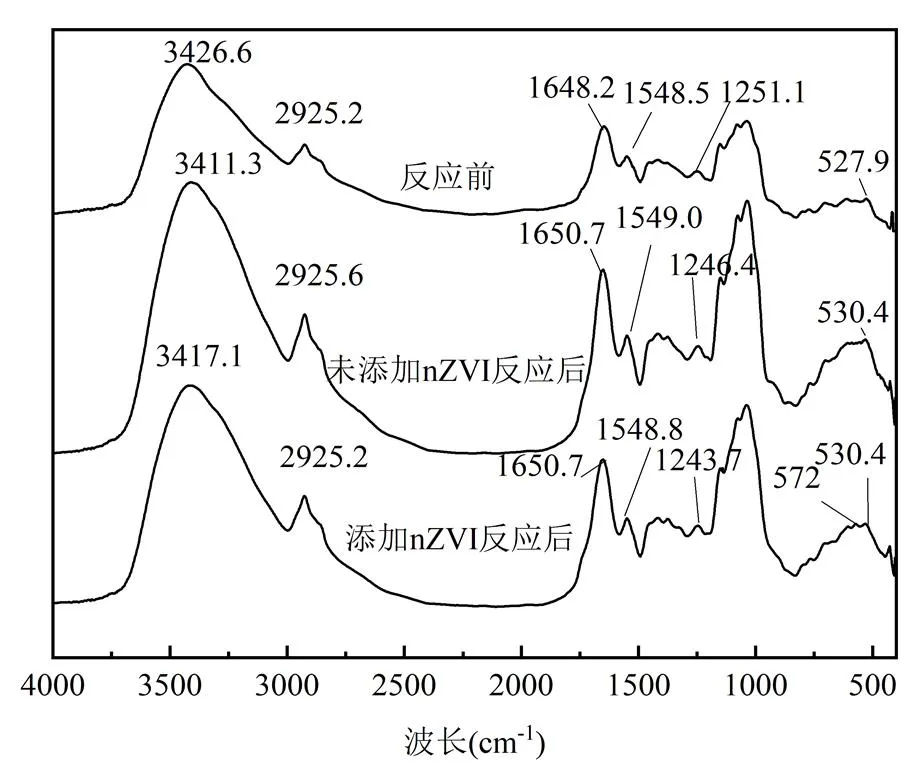
图8 白腐菌的FTIR图
2.3.7 nZVI的XPS分析如图9所示,XPS全谱图显示除了C、O、Fe特征峰外,在412.1和405.4eV出现了2个明显的特征峰,分别归属于Cd3d3/2和Cd3d5/2(图9(a)),表明nZVI表面的镉仍以Cd(II)为主,即主要通过其氧化生成的铁氧化物和氢氧化物对Cd(II)的吸附和表面络合(式(5)和(6)).同时反应后还出现了P2p的特征峰(133.8eV处),这表明白腐菌EPS中的磷酸基能作为成核位点固定和聚集nZVI氧化生成的Fe(II)和Fe(III),形成富含羟基官能团的纤铁矿、磁铁矿等铁矿物,从而促进对溶液中Cd(II)的吸附固定[41].
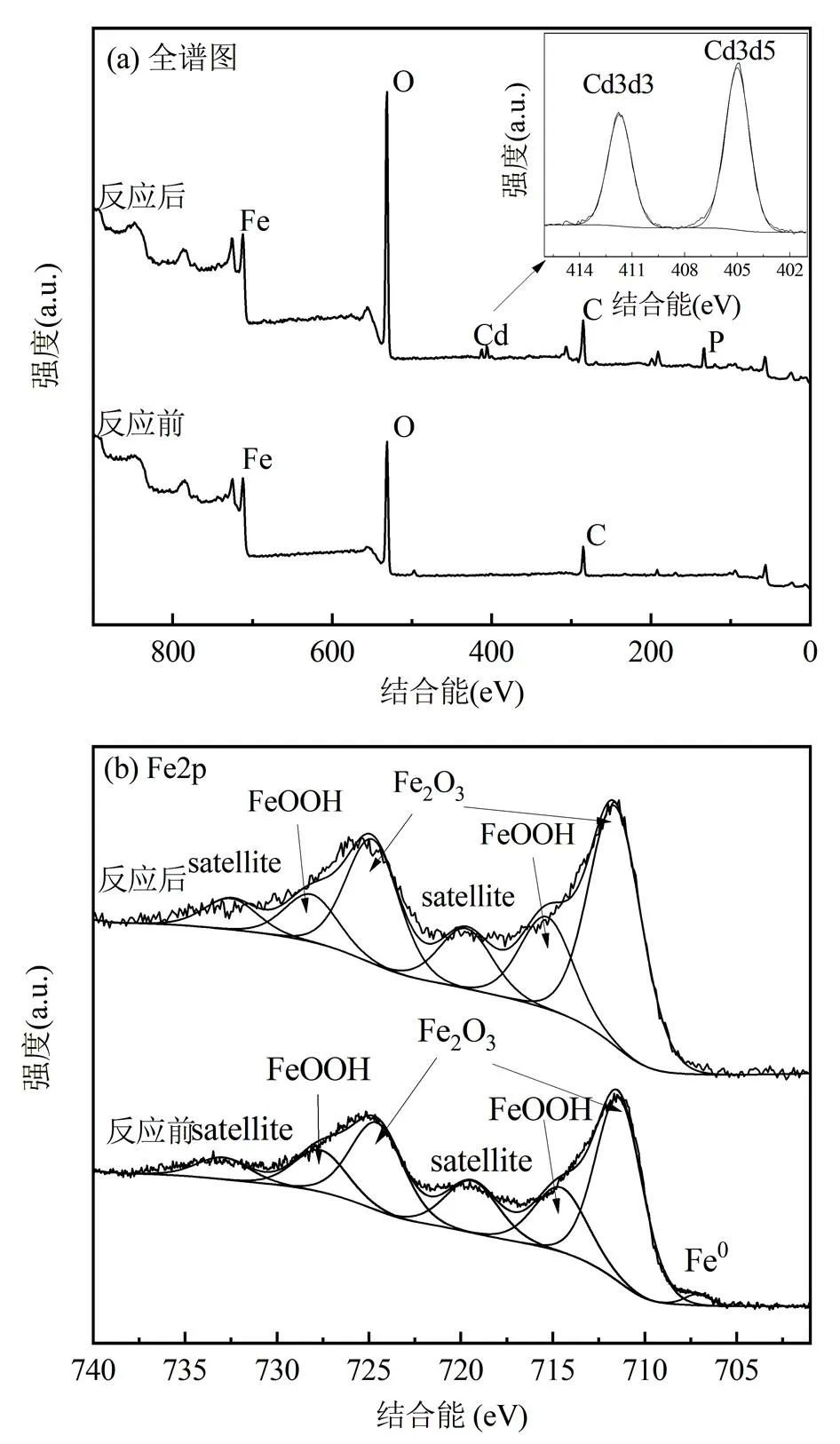
图9 nZVI的XPS全谱图和Fe2p的窄轨道谱图
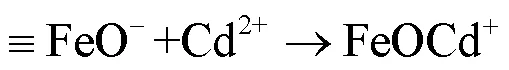
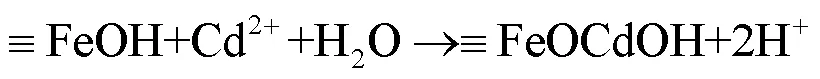
图9(b)为白腐菌/nZVI吸附Cd(II)前后Fe元素的XPS窄谱图,结果显示反应前Fe在711.6和724.9eV、715.2和728.1eV、706.7eV处出现特征峰[42],这分别对应于FeOOH、Fe2O3和Fe0.表明FeOOH和Fe2O3是覆盖在nZVI表面的主要铁(氢)氧化物,反应之后未检测出Fe0表明反应过程中Fe0已经被完全氧化,进一步证实富含羟基官能团的铁氢氧化物的形成.
3 结论
3.1 相比单独的白腐菌和nZVI,白腐菌/nZVI能显著提高水体中Cd(II)的去除速率和去除效果,且反应过程中基本无Fe离子溶出,无二次污染产生.
3.2 白腐菌/nZVI在pH值为6~7和温度为30~40℃的条件下对Cd(II)的去除率较高.在pH值为6,温度为30℃,nZVI投加量为0.1g/L,Cd(II)初始浓度为50mg/L的条件下,反应180min后体系对Cd(II)的去除率可达到99.5%以上.
3.3 白腐菌/nZVI去除Cd(II)主要以胞外富集为主,添加nZVI能显著提高白腐菌的胞外镉富集量.
3.4 白腐菌/nZVI对Cd(II)的去除过程符合准二级动力学模型,FTIR及XPS分析表明,羟基、羧基和氨基参与了Cd(II)的吸附,白腐菌EPS中的磷酸基作为成核位点与溶液中的铁发生内层配位形成P-O-Fe键,促进富含羟基官能团的纤铁矿、磁铁矿等铁矿物形成,从而强化对溶液中Cd(II)的吸附去除.
[1] Yin G C, Bi L L, Song X W, et al. Adsorption of Cd(II) from aqueous solution by Pennisetum sp. straw biochars derived from different modification methods [J]. Environmental science and pollution research international, 2019,26(7):7024-7032.
[2] 魏啸楠,张 倩,李 孟,等.磷酸改性生物炭负载硫化锰去除废水中重金属镉 [J]. 中国环境科学, 2020,40(5):2095-2102.
Wei X N, Zhang Q, Li M, et al. Removal of cadmium in wastewater by phosphoric acid modified biochar supported manganese sulfide [J]. China Environmental Science, 2020,40(5):2095-2102.
[3] Wang L, Chen G Q, Zeng G M, et al. Extracellular polymeric substances (EPS) of white-rot fungus and their effects on Pb2+adsorption by biomass [J]. Environmental Science, 2011,32(3):773- 778.
[4] Say R, Denizli A, Arca M Y. Biosorption of cadmium(II), lead(II) and copper(II) with the filamentous fungus[J]. Bioresource Technology, 2001,76(1):67-70.
[5] 吴 磊,张学洪,李宁杰,等.胞外聚合物在白腐真菌去除镉过程中的作用 [J]. 桂林理工大学学报, 2020,40(1):177-181.
Wu L, Zhang X H, Li N J, et al. Roles of extracellular polymeric substances in cadmium removal by white rot fungi [J].Journal of Guilin University of Technology, 2020,40(1):177-181.
[6] Yan W, Herzing A A, Kiely C J, et al. Nanoscale zero-valent iron (nZVI): Aspects of the core-shell structure and reactions with inorganic species in water [J]. Journal of Contaminant Hydrology, 2010,118(3/4):96-104.
[7] Lin C C, Chen Y H. Feasibility of using nanoscale zero-valent iron and persulfate to degrade sulfamethazine in aqueous solutions [J]. Separation and Purification Technology,2018,194:388-395.
[8] Li S, Wei W, Liang F, et al. Heavy metal removal using nanoscale zero-valent iron (nZVI): Theory and application [J]. Journal of Hazardous Materials, 2017,322:163-171.
[9] Calderon B, Fullana A. Heavy metal release due to aging effect during zero valent iron nanoparticles remediation [J]. Water Research, 2015, 83:1-9.
[10] Huang D, Hu Z, Peng Z, et al. Cadmium immobilization in river sediment using stabilized nanoscale zero-valent iron with enhanced transport by polysaccharide coating [J]. Journal of Environmental Management, 2018,210:191-200.
[11] Tasharrofi S, Rouzitalab Z, Maklavany D M, et al. Adsorption of cadmium using modified zeolite-supported nanoscale zero-valent iron composites as a reactive material for PRBs [J]. Science of The Total Environment, 2020,736:139570.
[12] Fu F, Dionysiou D D, Hong L. The use of zero-valent iron for groundwater remediation and wastewater treatment: A review [J]. Journal of Hazardous Materials, 2014,267:194-205.
[13] 宋 歌,张文静,毕 贞,等.多因素对ANAMMOX菌利用零价铁还原硝酸盐过程影响 [J]. 中国环境科学, 2019,39(11):4666-4672.
Song G, Zhang W J, Bi Z, et al.Effects of multiple factors on the process of ANAMMOX bacteria strengthening nitrate reduction by zero-valent iron [J]. China Environmental Science, 2019,39(11):4666- 4672.
[14] 袁梦姣,王晓慧,赵 芳,等.零价铁与微生物耦合修复地下水的研究进展 [J]. 中国环境科学, 2021,41(3):1119-1131.
Yuan M J, Wang X, H Zhao F, et al. Research progress of zero- valent-iron microbial coupled system in remediating contaminated groundwater [J]. China Environmental Science,2021,41(3):1119- 1131.
[15] 马建鹏,马安周,王愉琬,等.纳米零价铁耦合假单胞菌协同高效降解五氯苯 [J]. 微生物学通报, 2019,46(11):2857-2864.
Ma J P, Ma A Z, Wang Y W, et al. Integrated zero-valent iron nanoparticles andstrains system enhance degradation of pentachlorobenzene [J]. Microbiology China, 2019, 46(11):2857-2864.
[16] 谭 媛,黄 超,王 平,等.嗜水气单胞菌强化老化纳米零价铁去除水中Cr(Ⅵ) [J]. 环境科学学报, 2021,41(8):3211-3218.
Tan Y, Huang C, Wang P, et al. Activation of aged nano zero-valent iron byto enhance the removal of Cr(VI) from aqueous solution [J]. Acta Scientiae Circumstantiae, 2021,41(8): 3211-3218.
[17] Arantes V, Milagres A. The synergistic action of ligninolytic enzymes (MnP and Laccase) and Fe3+-reducing activity from white-rot fungi for degradation of Azure B [J]. Enzyme & Microbial Technology, 2008,42(1):17-22.
[18] 侯素珍,田浩然,黄 超,等.氨基改性生物炭负载纳米零价铁去除水中Cr(VI) [J]. 环境科学学报, 2020,40(11):3931-3938.
Hou S Z, Tian H R, Huang C, et al. Removal of Cr(VI) from aqueous solution by amino modified biochar supported nano zero valent iron [J]. Acta Scientiae Circumstantiae, 2020,40(11):3931-3938.
[19] Jing W, Lang L, Lin Z, et al. Cadmium bioaccumulation and elimination in tissues of the freshwater mussel[J]. Chemosphere, 2019,219:321-327.
[20] Guibaud G, Bordas F, Saaid A, et al. Effect of pH on cadmium and lead binding by extracellular polymeric substances (EPS) extracted from environmental bacterial strains [J]. Colloids & Surfaces B Biointerfaces, 2008,63(1):48-54.
[21] Li X Q, Zhang W X. Sequestration of metal cations with zerovalent iron nanoparticles-A Study with high resolution X-ray photoelectron spectroscopy (HR-XPS) [J]. Journal of Physical Chemistry C, 2007,111(19):6939-6946.
[22] 杨朝晖,邓恩建,曾光明,等.黄孢原毛平革菌用于煤炭脱硫的特性 [J]. 中国环境科学, 2006,(2):192-196.
Yang Z H, Deng E J, Zeng G M, et al. Desulfurization of coal by[J]. China Environmental Science, 2006,26(2):192-196.
[23] 封 觅,周家华,张 军,等.黄孢原毛平革菌降解磷酸三苯酯的性能和机理 [J]. 中国环境科学, 2020,40(11):4919-4926.
Feng M, Zhou J H, Zhang J, et al. The performance and mechanism of triphenyl phosphate biodegradation by.[J]. China Environmental Science, 2020,40(11):4919-4926.
[24] Chen G Q, Zhang W J, Zeng G M, et al. Surface-modifiedas a biosorbent for Cr(VI)- contaminated wastewater [J]. Journal of Hazardous Materials, 2011, 186(2/3):2138-2143.
[25] Chen G Q, Zhou Y, Zeng G G, et al. Alteration of culture fluid proteins by cadmium induction in[J]. Journal of basic microbiology, 2015,55(2):141-147.
[26] Huang C, Lai C, Xu P, et al. Lead-induced oxidative stress and antioxidant response provide insight into the tolerance ofto lead exposure [J]. Chemosphere, 2017,187:70-77.
[27] Chao H, Wang R Z, Zeng G M, et al. Transcriptome analysis reveals novel insights into the response to Pb exposure in[J]. Chemosphere, 2018,194:657-665.
[28] Asuquo E D, Martin A D. Sorption of cadmium (II) ion from aqueous solution onto sweet potato (L.) peel adsorbent: Characterisation, kinetic and isotherm studies [J]. Journal of Environmental Chemical Engineering, 2016,4(4):4207-4228.
[29] Nakhla G F, Suidan M T, Pfeffer J T. Operational control of an anaerobic GAC reactor treating hazardous wastes [J]. Water science & Technology, 1988,21(4/5):167-173.
[30] Draft W O, Chen R, Fan L, et al. Construction of fungi-microalgae symbiotic system and adsorption study of heavy metal ions [J]. Separation and Purification Technology, 2021,268:118689.
[31] Hou J, Yang Y Y, Wang P F, et al. Effects of CeO2, CuO, and ZnO nanoparticles on physiological features ofand the production and composition of extracellular polymeric substances. [J]. Environmental Science and Pollution Research, 2017,24(1):226- 235.
[32] Liu J, Yang Q, Wang D, et al. Enhanced dewaterability of waste activated sludge by Fe(II)-activated peroxymonosulfate oxidation [J]. Bioresource Technology, 2016,206:134-140.
[33] Zhen G, Lu X, Wang B, et al. Synergetic pretreatment of waste activated sludge by Fe(II)–activated persulfate oxidation under mild temperature for enhanced dewaterability [J]. Bioresource Technology, 2012,124:29-36.
[34] Zhen G, Lu X, Li Y, et al. Novel insights into enhanced dewaterability of waste activated sludge by Fe(II)-activated persulfate oxidation [J]. Bioresource Technology, 2012,119:7-14.
[35] Ye B, Luo Y, He J, et al. Investigation of lead bioimmobilization and transformation bySL2 [J]. Bioresource Technology, 2018,264:206-210.
[36] Sharma K R, Giri R, Sharma R K. Lead, cadmium and nickel removal efficiency of white-rot fungus[J]. Chemicals & Chemistry, 2020,71(6):637-644.
[37] Chen A, Ming G, Chen G Q, et al. Simultaneous cadmium removal and 2,4-dichlorophenol degradation from aqueous solutions by[J]. Applied Microbiology & Biotechnology, 2011,91(3):811-821.
[38] Abhijit M, Ellairaja S, Chinnaiah A, et al. Efficient removal of cadmium using edible fungus and its quantitative fluorimetric estimation using (Z)-2-(4H-1,2,4-Triazol-4-yl) iminomethylphenol [J]. Chemicals & Chemistry, 2018,3(6):6243-6250.
[39] Zhang X, Xin-Gang L I, Jiang B. Preparation and characterization of nanometer magnetite [J]. Chemical Industry and Engineering, 2006, 1:45-48.
[40] Omoike A, Chorover J, Kwon K D, et al. Adhesion of bacterial exopolymers to α-FeOOH: inner-sphere complexation of phosphodiester groups [J]. Langmuir, 2004,20(25):11108-11114.
[41] 唐 婕,郝鑫瑞,易筱筠,等.胞外聚合物对微生物还原含镉聚合硫酸铁絮体过程次生矿物形成及镉迁移转化的影响 [J]. 环境科学学报, 2021,41(5):1828-1839.
Tang J, Hao X R, Yi X Y, et al. The role of extracellular polymeric substances on secondary mineral formation and cadmium migration and transformation during microbial reduction of cadmium-loaded polyferric sulfate [J]. Acta Scientiae Circumstantiae, 2021,41(5): 1828-1839.
[42] Yamashita T, Hayes P. Analysis of XPS spectra of Fe2+and Fe3+ions in oxide materials [J]. Applied Surface Science, 2008,254(8):2441-2449.
Enhanced removal of Cd(II) from aqueous solution by nanoscale zero-valent iron coupled with white rot fungus.
ZENG Qiao-jing1,2, ZHOU Xin1, HUANG Chao1,2*, WANG Ping1,2**, CHENG Hao1,2, ZHENG Xiao-yu1,2, WANG Meng-xin1,2, LIU Hao1,2
(1.College of Environmental Science and Engineering, Central South University of Forestry and Technology, Changsha 410004, China;2.Hunan Engineering Laboratory for Control of Rice Quality and Safety, Changsha 410004, China)., 2022,42(7):3174~3183
A combined system of white rot fungus and nanoscale zero-valent iron (nZVI) was used to enhance the removal of Cd(II) from water. The effects of pH, Cd(II) initial concentration, temperature and nZVI dosage on Cd(II) removal were examined, and the impact of nZVI on intracellular and extracellular accumulation of cadmium by white rot fungus was investigated. The removal mechanism was analyzed by scanning electron microscopy (SEM), Fourier-transform infrared spectroscopy (FTIR), X-ray photoelectron spectroscopy (XPS) and three-dimensional excitation emission matrix fluorescence spectroscopy (3D-EEM). The results showed that the removal efficiency of 50mg/L Cd(II) reached 99.5% after 180 minutes at the conditions of pH 6, nZVI dosage of 0.1g/L and 30℃. The removal process of Cd(II) was found to follow the pseudo second-order kinetic model, and the extracellular adsorption by white rot fungus accounted for the main removal. The addition of nZVI promoted the extracellular adsorption of Cd(II) by white rot fungus. FTIR and XPS analysis showed that the hydroxyl, carboxyl and amino were involved in the adsorption of Cd(II), and the extracellular polymeric substances (EPS) of white-rot fungus could coordinate with iron in the inner layer to form a P-O-Fe bond, accelerating the formation of iron minerals such as lepidocrocite and magnetite that are rich in hydroxyl functional groups, thereby promoting the adsorption and removal of Cd(II) from the solution.
white rot fungus;nanoscale zero-valent iron;extracellular polymeric substances;cadmium
X703.1
A
1000-6923(2022)07-3174-10
曾峤婧(1997-),女,湖南株洲人,中南林业科技大学硕士研究生,主要从事水体重金属污染治理研究.发表论文2篇.
2021-12-25
国家自然科学基金资助项目(51809293);中国博士后基金面上资助项目(2018M633004);湖南省教育厅优秀青年基金资助项目(19B588);湖南省重点研发计划(2019SK2191);湖南省高新技术产业科技创新引领计划(2020SK2039);湖南省大学生创新创业训练计划(湘教通[2021]197号)
* 责任作者, 副教授, huangchao@csuft.edu.cn; ** 责任作者, 教授, pingwang@csuft.edu.cn
