FeS对CW-MFC系统降解活性艳红X-3B效果及过程的影响
2022-07-19赵联芳于雪晴路宗仁
赵联芳,于雪晴,路宗仁,刘 成,李 颖
FeS对CW-MFC系统降解活性艳红X-3B效果及过程的影响
赵联芳1,2*,于雪晴1,路宗仁3,刘 成1,李 颖1
(1.河海大学环境学院,江苏 南京 210098;2.浅水湖泊综合治理与资源开发教育部重点实验室,江苏 南京 210098;3.上海勘测设计研究院有限公司,上海 200335)
在自行构建的人工湿地-微生物燃料电池(CW-MFC)系统中,以砾石填料为对照,研究了FeS对活性艳红X-3B脱色效果及降解过程的影响.结果表明,加在底层区域的FeS能够显著提高CW-MFC对活性艳红X-3B的脱色效果和系统产电性能.FeS的投加使得系统脱色率在进水活性艳红X-3B浓度200mg/L、葡萄糖浓度100mg/L条件下达到99.83%.在进水活性艳红X-3B浓度100mg/L、葡萄糖浓度200mg/L条件下,FeS组最大功率密度达到0.849W/ m3.活性艳红X-3B在系统中的脱色主要发生在底层和阳极区域,由紫外-可见全波长扫描图谱和GC-MS扫描图谱可知FeS在该区域促进了偶氮双键的断裂,并有利于脱色产物苯胺、三嗪结构、萘环结构的进一步降解.
人工湿地微生物燃料电池;活性艳红X-3B;FeS;脱色效果;降解过程
目前,偶氮染料是品种最多、应用最广的一类合成染料[1],被广泛应用于印染、皮革、化工等行业[2].偶氮染料废水对于自然环境和人体健康构成严重威胁[2-3].研究表明,偶氮染料的偶氮双键在厌氧环境中容易被还原断开,生成的苯胺类物质在好氧环境中被进一步降解[4].人工湿地微生物燃料电池(CW-MFC)同时拥有厌氧、好氧环境,有利于偶氮染料的降解,同时伴随着电能输出[5].研究表明进水中葡萄糖和染料含量的比例显著影响染料脱色率和系统产电效果[6].这是由于偶氮染料中存在吸电子基团,在进行脱色处理时需要额外的电子供体为偶氮双键还原和阳极产电提供电子[7],但是为提高脱色率而大量投入易降解有机物势必会增加偶氮染料废水的处理成本和运行管理难度[8],脱色率和系统产电效果随着染料浓度的提高而下降也限制了系统的实际应用.
研究者发现Fe元素和S元素在相应微生物作用下发生价态转换,可以作为电子供体和电子受体,提高难降解有机物的降解效果和产电效果[9-11]. Fe3O4/污泥碳(SC)强化了上流式厌氧污泥床反应器对偶氮染料的处理[12],较高的硫化物浓度可以提高单室空气阴极微生物燃料电池的产电能力和染料脱色能力[13].然而目前Fe元素和S元素对偶氮染料在CW-MFC降解过程的影响还鲜有报道.
因此,本文采用自然界中储量丰富的磁黄铁矿(主要成分为FeS)作为CW-MFC耦合系统底部和阳极区域的填料,采用旋转空气生物阴极增加阴极的DO浓度,以典型偶氮染料活性艳红X-3B为目标污染物,考察FeS在多种进水条件下对活性艳红X-3B脱色降解及系统产电性能的影响,并分析了活性艳红X-3B在系统中的降解过程及FeS的作用机理,为利用FeS提高偶氮染料的降解效率及CW-MFC系统产电效率提供理论依据.
1 材料与方法
1.1 试验装置
采用2组结构和尺寸完全相同的柱形有机玻璃装置模拟升流式人工湿地,其长、宽和高分别为20,20和80cm.将电极埋入装置底部厌氧区域作为阳极,位于装置表层的电机以电动机驱动旋转作为旋转空气阴极,构成CW-MFC系统,如图1所示.
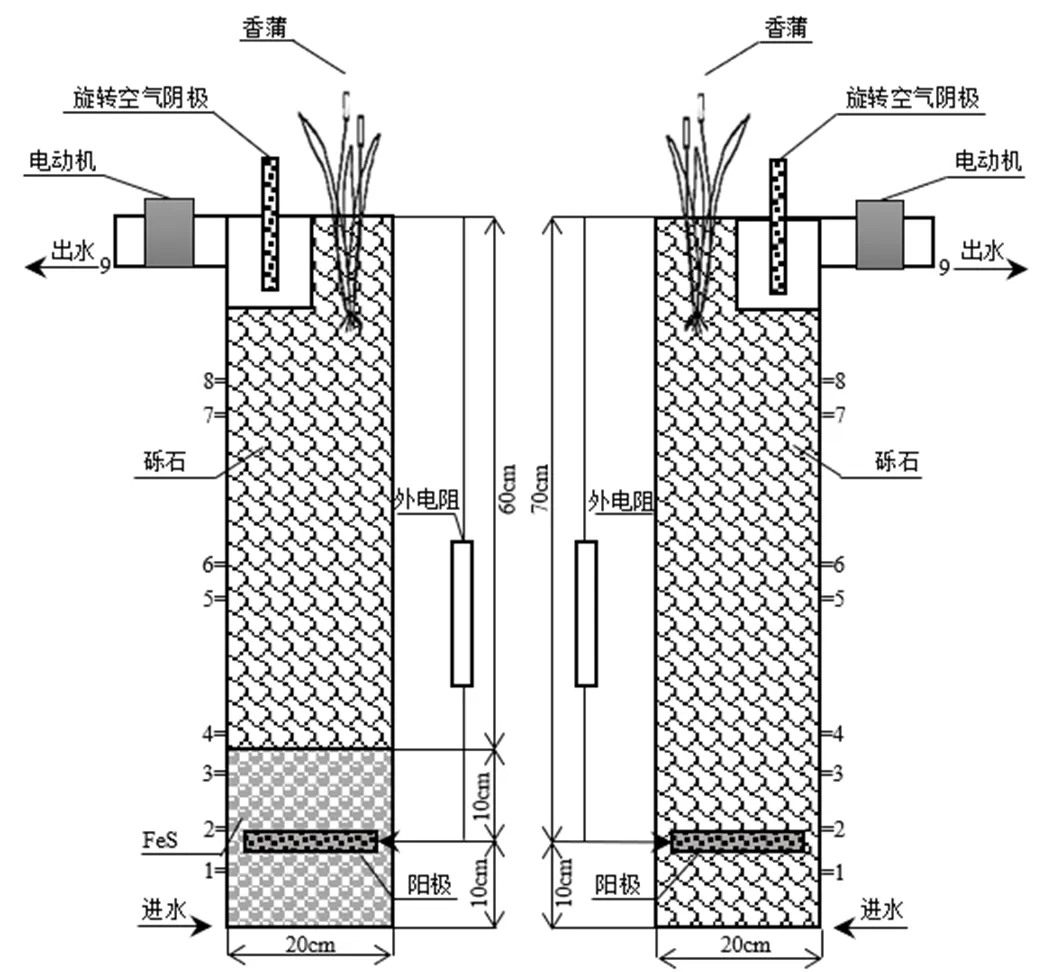
图1 装置示意
左为FeS组;右为砾石组
FeS组装置底部填充高度为20cm、粒径为5~8mm的磁黄铁矿(FeS),试验所用的FeS购自河南豫中新材料有限公司,主要成分:Fe(³45.0%), S(25%~35%),C(£0.40%),Si(£7.0%),Mn(£0.40%),P(£0.30%),As(£0.15%).其余60cm高度填充粒径为5~8mm的砾石;另一组填充高度为80cm,粒径为5~8mm的砾石作为对照组(砾石组).装置由下往上分为底层区域(8cm),阳极区域(4cm),中间区域(50cm)和阴极区域(18cm).在距离底部8,12,18,22,38,42, 58,62cm处以及阴极出口设置9个取样口,从下往上依次命名为取样点1~9.阴阳极间距为70cm,电极材料采用不锈钢网外包厚度为1cm的导电碳毡,用不锈钢丝缝制,具有较好的导电性和生物附着性,每个电极厚度和直径分别为2和18cm,阴极、阳极面积比为1:1.阴极与阳极采用铜导线及1000Ω的电阻相连构成回路.装置总容积为32L,有效储水容积为11.2L,水力停留时间设置为2d.湿地植物采用根系发达、耐污性强的南京本地水生植物香蒲,种植密度为25株/m2.
1.2 试验进水
两个试验装置均采用人工配水,进水方式为连续流,进水成分和流速一致.本试验中采用的偶氮染料为活性艳红X-3B(南京都莱生物技术有限公司),为分析纯,分子式为C19H10Cl2N6Na2O7S2,分子量为615.3,采用葡萄糖作为外加碳源,改变进水中活性艳红X-3B浓度和葡萄糖浓度,探究FeS对CW-MFC的作用效果,具体配水方案及COD值见表1.人工配水中其他主要成分和微量元素浓度[14]如表2所示,微量元素用量为1mL/L,进水pH值为7.21±0.15.
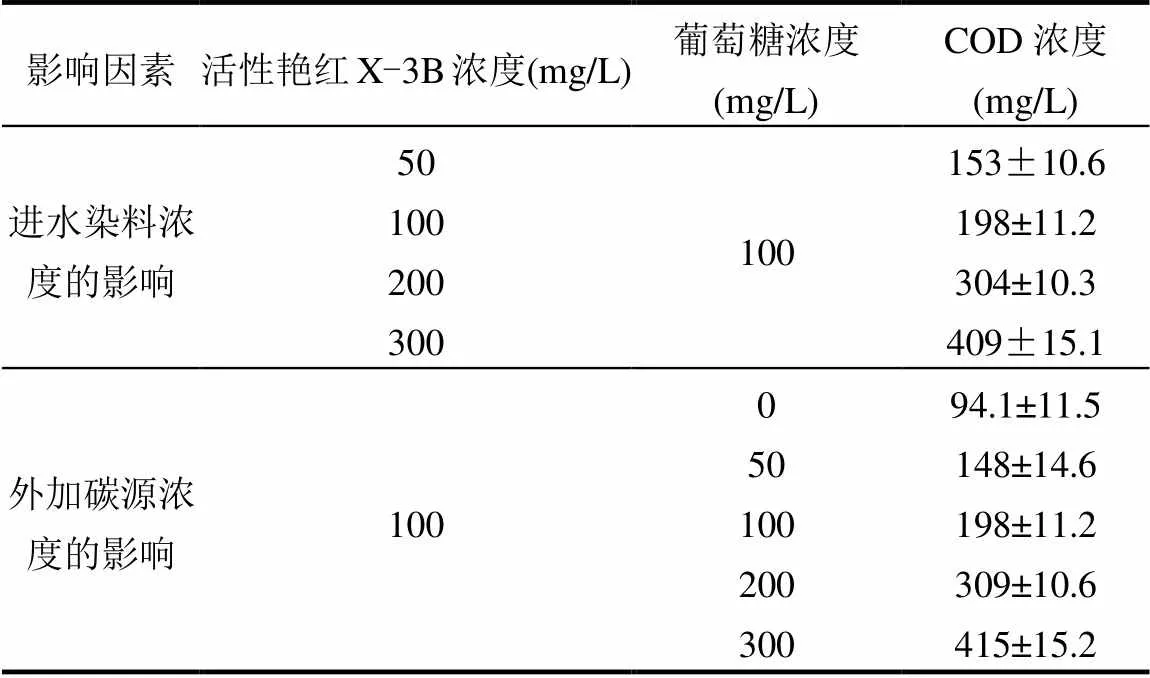
表1 人工配水方案
表2 人工配水中其他主要成分和微量元素组成
1.3 接种与运行
从南京某污水厂厌氧段取回的浓缩厌氧污泥,在经过3周的厌氧培养后,去除其中的大颗粒物质,再接种到系统中进行挂膜,当观察到基质表面有生物膜生成后意味着系统挂膜成功.在启动阶段,上述的人工配水(葡萄糖100mg/L、活性艳红X-3B 100mg/L)通过蠕动泵进入装置内,对出水染料浓度、COD浓度以及系统电压值进行监测,这些指标稳定后意味着系统启动成功,可以进行后续试验.
系统在每个进水条件下运行8d,分别对FeS组与砾石组沿程出水水样中的染料浓度和COD含量进行检测,产电方面对电压、功率密度及内阻等指标进行检测.此外,对2个试验组沿程出水进行紫外-可见光全波长扫描、气相质谱联用分析(GC-MS)以分析FeS对活性艳红X-3B降解过程的影响.
1.4 测定方法
通过紫外分光光度计(UV-1801,北分瑞利)全波长扫描发现活性艳红X-3B最大吸收波长为540nm,在此波长下得到染料浓度与吸光度的线性关系,由此可得到试验水样中的染料浓度.脱色率按照公式:脱色率(%)=(i-e)/i×100%进行计算,其中i为进水染料浓度,e为出水染料浓度.COD采用国家规定的标准方法[15]进行测定,COD去除率按照公式:COD去除率(%)=(CODi-CODe)/CODi´100%进行计算,其中CODi为进水COD浓度,CODe为出水COD浓度.当进水活性艳红X-3B浓度、葡萄糖浓度分别为100和100mg/L时降解效果较好,因此在该阶段对两个试验组沿程出水进行紫外-可见光全波长扫描、气相质谱联用分析(GC-MS),在做检测之前水样均通过孔径为0.45μm的滤膜过滤.
采用便携式溶氧仪(DR6000,美国哈希)测定沿程DO浓度,采用pH计(PHS-3G,雷磁)确定进水pH值.FeS组沿程出水中的Fe(Ⅱ)和Fe(Ⅲ)浓度采用邻菲啰啉分光光度法进行测定.
本试验采用可调电阻作为外电阻,将外电阻从104Ω逐渐减小,系统稳定1h后测得输出电压,通过万用电表测得电压值,V.由于本试验采用的电极具有一定的厚度,因此采用体积密度计算电流密度V(A/m3)和功率密度V(W/m3),计算公式为V/;VV,其中为外电阻,Ω;为阳极体积,m3.本试验采用电流中断法测得欧姆内阻R,电流中断瞬间输出电压会产生突跃值U,根据公式R=U/得到欧姆内阻R,其中为电路中断前输出电流值,A.
2 结果与讨论
2.1 活性艳红X-3B的去除效果
在系统沿程不同位置取样对出水染料浓度及COD浓度进行检测,如图2所示,在系统底部添加FeS能够显著促进活性艳红X-3B脱色,并有利于COD的去除.
两个试验组的主要脱色区域均为底层区域(进水-取样点1)和阳极区域(取样点1~2),FeS的强化作用也主要发生在此区域.随着进水中活性艳红X-3B浓度和葡萄糖浓度的变化,FeS组底层和阳极区域的总脱色率相较砾石组提高23.38%~51.18%.在上述进水条件下,FeS组的总体脱色率均稳定在95%以上.
Li等[9]研究发现偶氮染料酸性橙7(AO7)在厌氧环境下偶氮双键断开生成无色的中间产物1-氨基-2-萘酚能够作为氧化还原介体来催化AO7脱色.本试验观察到在一定范围内(图2A1:50~200mg/L)系统的脱色率随着染料浓度增加而增加,推测活性艳红X-3B脱色产物可能也发生了上述的自催化脱色反应.由于中间产物氧化态不能以化学方式还原成还原态,这种自催化脱色反应效率被限制,而FeS组中Fe、S元素可使氧化态的中间产物在微生物的作用下被还原,促进了这种自催化脱色反应[9].共代谢是生物法处理难降解污染物的一种有效方式[16],由于偶氮染料可生化性较差[17],其厌氧脱色需要额外的易降解有机物作为电子供体提供电子断开偶氮双键,进一步诱导产生更多的还原酶[18].因此,随着葡萄糖浓度的升高,试验组的脱色率明显上升(图2A2).但是,即使在葡萄糖浓度为200mg/L时,砾石组达到其最高脱色率(85.13%),仍低于葡萄糖浓度为0mg/L时FeS组的脱色率(95.14%),意味着FeS发挥了作为电子供体的作用.
对于FeS组,由图3可知FeS层(取样点1~3)出水中的Fe(Ⅱ)的浓度达到1.45~5.22mg/L,还测得浓度为0.35~0.68mg/L 的Fe(Ⅲ).这是由于磁黄铁矿发生了水相氧化反应,生成Fe(Ⅱ)和Fe(Ⅲ),Fe(Ⅱ)和Fe(Ⅲ)之间的转化为偶氮双键的裂解提供了电子[19].此外,Li等[9]研究发现Fe的转化能够显著提高溶液的电导率和细胞色素c浓度,促进微生物将电子传递给偶氮染料进行脱色降解.推测在本试验中FeS对于电子传递的促进作用也是FeS组脱色率能够稳定在高水平的重要原因,Fe(Ⅱ)与Fe(Ⅲ)作为一种催化剂促进了偶氮染料的脱色降解.后续研究可以通过XRD对Fe元素和S元素的固相物质结构进行分析,进一步探究磁黄铁矿在试验过程中的变化.
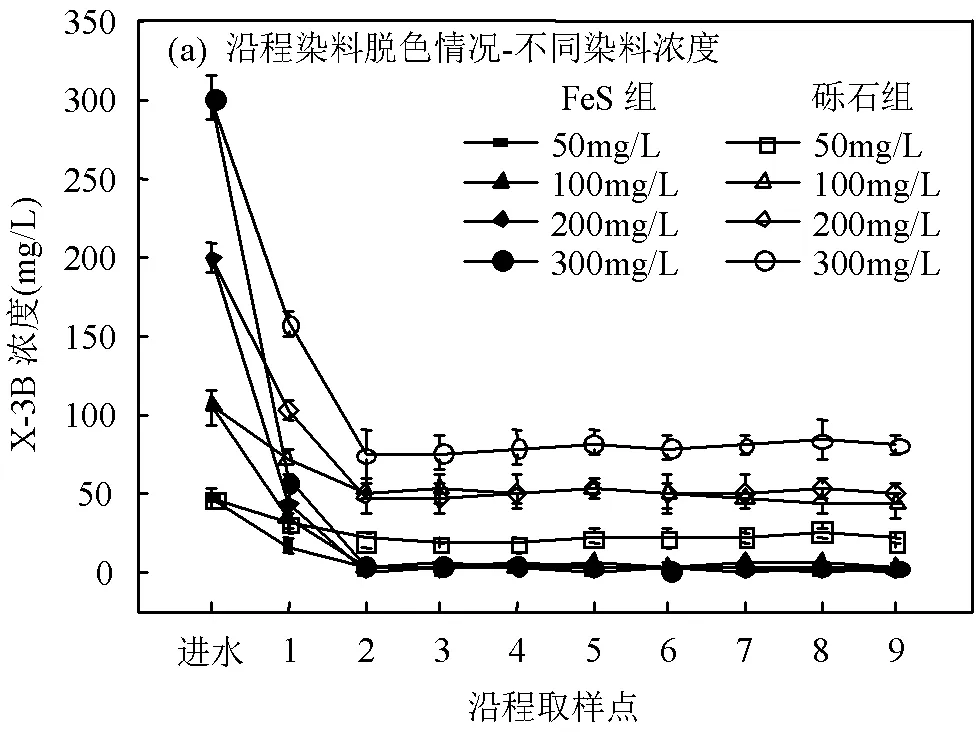
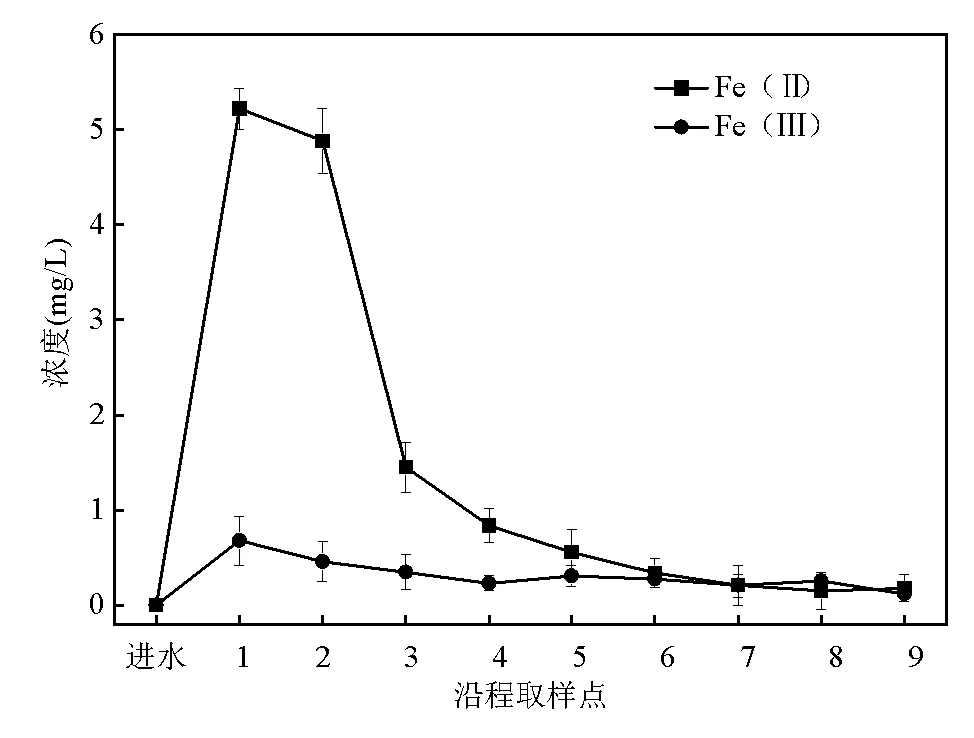
图3 FeS组沿程出水中Fe的转化情况
两个试验组沿程出水COD浓度在底层区域(进水-取样点1)、阳极区域(取样点1~2)和阴极区域(取样点8~9)有明显的下降.随着进水中活性艳红X-3B浓度和葡萄糖浓度的变化,FeS组系统总体COD去除率较砾石组提高了2.41%~19.90%.相对于偶氮染料及其脱色中间产物而言,葡萄糖更易于被微生物利用,因此推测认为,底层区域的COD去除主要是由于葡萄糖的降解.另一方面,脱色小分子产物相对于染料大分子可能更易于被微生物利用降解,因此FeS组阳极区域COD去除量要高于砾石组.由图4可知,旋转空气阴极的曝气作用使得阴极区域溶解氧浓度显著提高,微生物的代谢活性得到加强,从而促进脱色产物的进一步降解,两个试验组的COD浓度在阴极区域均有较明显的降低.总体而言,不同进水条件下,相较于对活性艳红X-3B脱色效果的提高作用,FeS组对COD去除效果的提高作用不明显,分析认为可能是因为FeS组促进活性艳红X-3B脱色,生成更多分子量较小的脱色产物,这些脱色产物虽可能较原染料易被微生物利用,但对微生物有一定的毒性作用[20],其在系统内难以被彻底去除.这些脱色产物在被重铬酸钾完全氧化后会呈现更高的COD[21].因此,后续将深入研究如何进一步提高微生物活性,促进脱色中间产物的彻底降解,进而降低出水COD浓度.
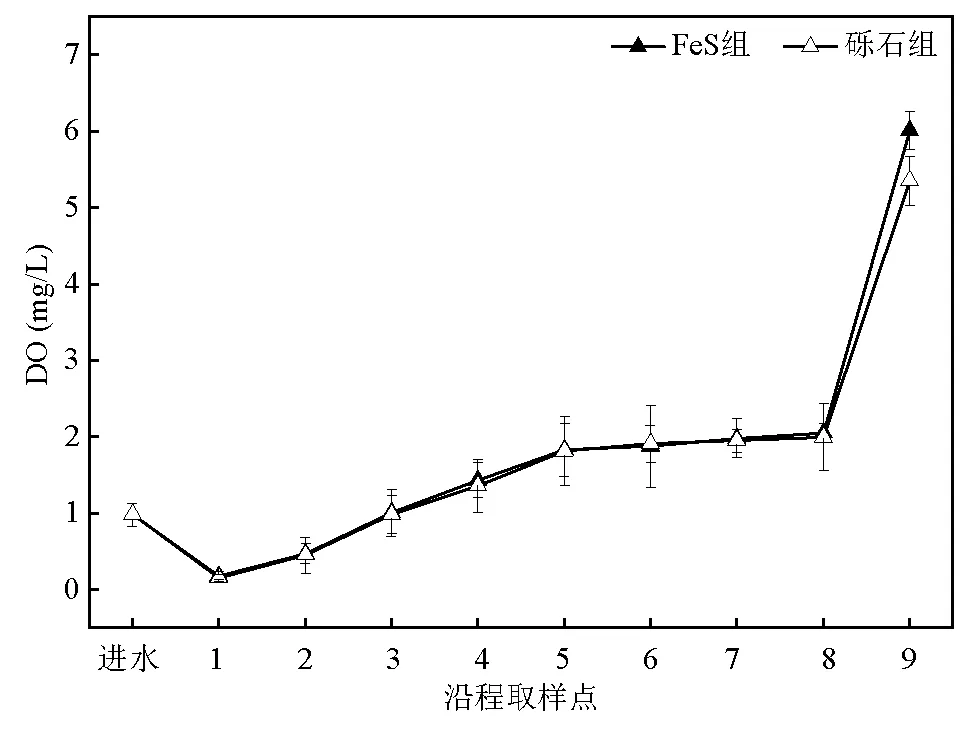
图4 两个试验组沿程出水中DO浓度
活性艳红X-3B浓度:100mg/L;葡萄糖浓度:100mg/L
为了进一步明确CW-MFC系统的耦合作用效果,对两个试验组进行了开闭路试验(断开外电路即为CW;闭合外电路即为CW-MFC),结果如图5所示.两个试验组在闭路条件下的脱色效果和COD去除效果均优于开路条件,且主要体现在阳极区域(取样点1~2).分析认为,活性艳红X-3B主要依靠厌氧菌分泌出的偶氮还原酶进行脱色,MFC的加入使得厌氧菌活性在电极的催化作用下得到增强[22].偶氮染料脱色生成的分子量较小的降解产物更易于被微生物利用降解,使得闭路条件下COD去除效果优于开路条件.另一方面,闭路条件下产电菌的活性增强,促进了产电菌将电子传递给偶氮染料X-3B进行脱色,并有利于脱色产物的进一步降解[23],这也解释了FeS组在脱色和COD去除效果优于砾石组的现象.
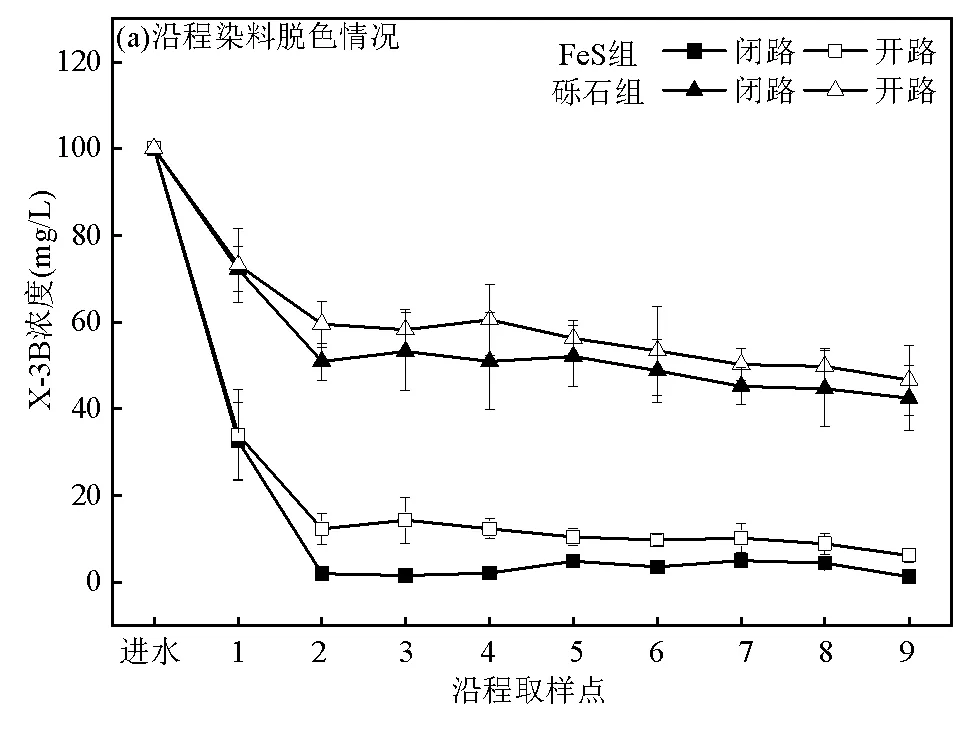
活性艳红X-3B浓度:100mg/L;葡萄糖浓度:100mg/L
2.2 系统的产电性能
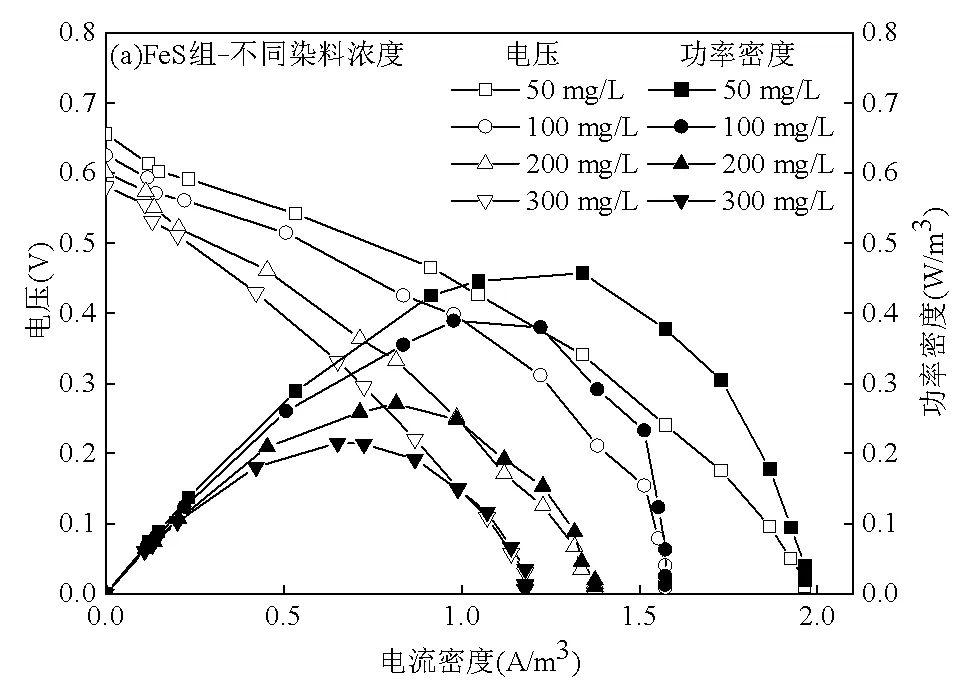
由图6可知,在相同进水条件下,FeS组的输出电压和最大功率密度均高于砾石组.随着进水染料浓度和外加碳源浓度的变化,FeS组的输出电压和最大功率密度较砾石组分别提高了0.090~ 0.106V、0.070~0.420W/m3.对极化曲线欧姆极化区进行线性拟合后发现,在相同进水条件下,FeS组内阻始终低于砾石组, FeS的加入起到了加快电子传递的作用.
由图6可知,随着进水活性艳红X-3B浓度的增加,两个试验组的最大功率密度均逐渐下降,内阻均上升,其中FeS组内阻从309.6Ω增大到498.6Ω,砾石组内阻从339.0Ω增大到548.4Ω.由前述的脱色效果试验(图2A1)可知,在活性艳红X-3B浓度为50~ 200mg/L的范围内,脱色率随其浓度升高而升高.分析认为,此时主要由于染料降解菌和电化学活性细菌(EAB)竞争电子[24],从而影响了系统的产电效果.当活性艳红X-3B浓度升至300mg/L时,此时过高的染料浓度及其脱色产物不仅对微生物的活性产生抑制作用造成脱色率显著下降,也阻碍了电子传递造成系统内阻增大[23,25].
当进水葡萄糖浓度在0~200mg/L范围内,两个试验组的最大功率密度随着葡萄糖浓度的升高而升高,但是当葡萄糖浓度过高(300mg/L)时,最大功率密度不升反降,此时两个系统的内阻呈相反的变化趋势,其中FeS组内阻从524.7Ω降低至276.2Ω而后升高至295.7Ω,砾石组内阻从583.9Ω降低至344.2Ω而后升高至369.3Ω.分析认为,进水中提高葡萄糖浓度增加了可利用的电子数,增强了产电菌活性,加快了电子产生和传递速率,内阻减小[26].对于FeS组,由于FeS使得生成的脱色产物能够作为氧化还原介质,系统中的电子数量增加,更有利于系统产电[9,27].当葡萄糖浓度过高时,进入阴极区域的有机物增加,消耗了更多的DO,阴极DO不足使得其产电性能下降[28-29].
2.3 紫外-可见全波长扫描图谱分析
图7为紫外-可见全波长扫描图谱,从进水的扫描图可以看出,主要含有5个吸收峰,分别为235,285, 332,513和540nm.由有机波谱分析理论可知.位于紫外光区235,285及332nm的吸收峰分别对应苯环、三嗪结构及萘环结构的特征吸收峰,位于可见光区513~540nm区间内的吸收峰对应偶氮结构特征吸收峰[30].
由图7(a)可以看出,阳极进水在513~540nm区间内的吸收峰有较大幅度的降低,说明有大量偶氮结构在底层区域被断开,这与底层区域脱色率达68.89%相一致.在250~259nm区间内出现了新吸收峰,苯环结构对应的吸光度有所降低,而三嗪结构与萘环结构对应的吸光度有较大幅度升高,说明偶氮染料X-3B在底层区域被降解转化生成更多这些结构.阳极出水(取样点2)在513~540nm区间内的吸收峰进一步大幅降低,吸光度接近于0,这与FeS组底层区域和阳极区域脱色率达到97.01%相一致.同样在250~259nm区间内出现了新吸收峰,但吸光度有了大幅降低,苯环结构、三嗪结构与萘环结构对应的吸光度也有大幅降低.从中间出水(取样点5)、阴极进水(取样点8)和阴极出水(取样点9)分析来看,上述结构对应的吸光度均有一定程度的降低,说明活性艳红X-3B在FeS组中逐渐被降解转化成分子量更小的产物.
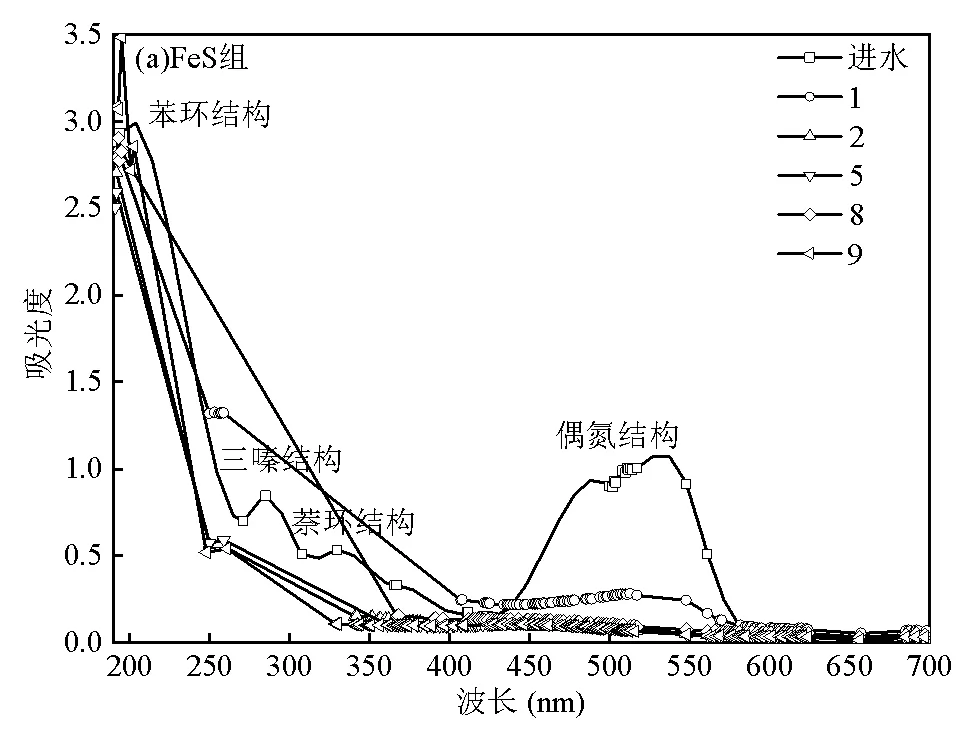
由图7(b)可知,阳极进水(取样点1)在513~ 540nm区间内的吸收峰有一定幅度的降低,与FeS组相比,降低幅度要小得多,这与砾石组底层区域脱色率为31.17%相一致.另外,苯环结构对应的吸光度有所降低,但三嗪结构与萘环结构对应的吸光度有所升高,与FeS组相比升高幅度较小.阳极出水(取样点2)在513~540nm区间内的吸收峰进一步大幅降低,同时苯环结构、三嗪结构与萘环结构对应的吸光度也有一定幅度的降低.从中间出水(取样点5)、阴极进水(取样点8)和阴极出水(取样点9)分析来看,上述结构对应的吸光度变化幅度不大,这与先前这些区域脱色效果及COD去除效果不佳相吻合.
2.4 气相质谱联用分析
FeS组和砾石组各层进出水GC-MS扫描图如图8所示.由图可知FeS组和砾石组阳极进水GC-MS扫描图中均出现了保留时间为8.46min的苯胺峰,说明活性艳红X-3B进入耦合系统后,偶氮双键在底层区域断裂,生成苯胺类物质.从扫描图谱丰度来看,FeS组苯胺峰丰度明显高于砾石组,说明FeS组底层区域有更多的活性艳红X-3B得到脱色.另外,苯胺类物质进一步降解生成了一些烃类、酚类、醚类物质,但与苯胺相比丰度要小的多.经过阳极处理后,两个试验组苯胺峰丰度进一步升高,且FeS组苯胺峰丰度升高幅度更大,这与FeS组阳极区域脱色率和砾石组阳极区域脱色率分别为28.12%、20.33%相吻合;另一方面,这一现象可能是由于FeS组对活性艳红X-3B的脱色效果好而对脱色产物苯胺的去除效果不佳,导致了苯胺在阳极区域的积累.研究表明苯胺在厌氧环境中难以进一步被降解,其毒性作用会对微生物活性产生一定程度的抑制[31].通过对两个试验组阳极出水进行质谱分析,苯胺仍是主要的脱色产物,另外还出现了一些结构较为复杂的烃类、酸类、醇类、酯类、酚类等物质.
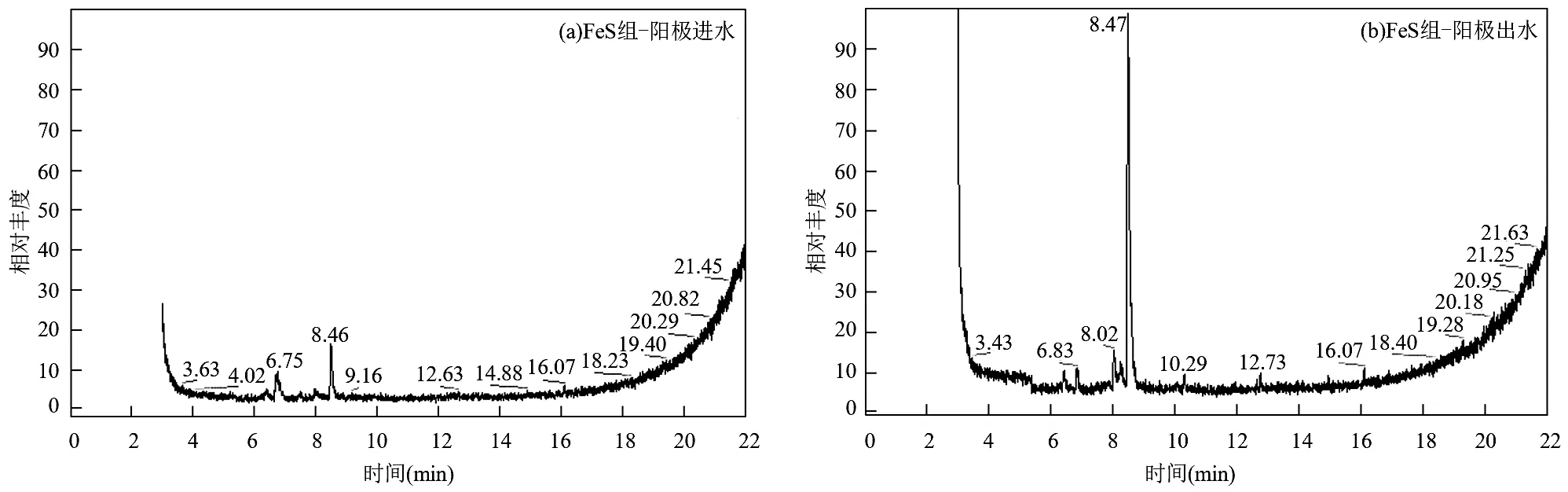
由于中间区域DO浓度有一定程度的升高(图4),促进了脱色产物的降解,由图8可见,阴极进水中两个试验组苯胺峰丰度均有一定程度的降低,且FeS组降低幅度更为显著.说明部分阳极出水中的脱色产物如苯胺、烃类物质仍在,但丰度有所降低,还多了一些结构相对简单一些的酸类、酯类物质.经过阴极区域处理后,两个试验组阴极出水中降解产物丰度进一步降低,出现了一些结构相对简单的物质,但部分脱色产物仍然存在,说明尽管脱色产物在阴极区域得到了进一步的降解,最终出水中仍存在带有苯环的芳香类物质,这些难降解污染物使得耦合系统对COD去除较为困难,出水水质不佳,可以考虑处理工艺的组合,在以FeS为底层填料的CW-MFC中对偶氮染料进行快速脱色,脱色产物再在曝气好氧水处理工艺中降解.
2.5 活性艳红X-3B降解路径分析
结合紫外-可见全波长扫描图谱和气相质谱联用的试验结果,对活性艳红X-3B在FeS作用下的降解途径的初步分析如下:(1)活性艳红X-3B从系统底部进入后,在底层区域偶氮双键被还原断裂,生成苯胺、萘环结构与三嗪结构结合体,萘环结构与三嗪结构结合体在—C—N—键断开后转化成萘环结构和三嗪结构;(2)经过阳极区域后活性艳红X-3B被进一步脱色,同时部分苯胺类物质被氧化分解,萘环结构上的基团在相应酶的作用下与萘环断开,生成萘环和其它小分子,三嗪结构部分降解;(3)随着水流上升,中间区域和阴极区域DO浓度逐渐升高,更多的苯胺类物质被氧化分解,苯环被打开后生成醛或酸类物质,萘环进一步被氧化降解,打开后生成邻苯二甲酸等物质,三嗪结构也进一步被氧化降解.在活性艳红X-3B的降解过程中,FeS既可以作为电子供体增加电子数量,又可以加快电子传递,从而显著促进偶氮双键的断裂,有利于脱色产物的进一步降解.
3 结论
3.1 在CW-MFC耦合系统底部添加FeS能够显著提高活性艳红X-3B的脱色降解效率和系统的产电效果.在多种进水条件下,FeS组的系统总体脱色率均近乎达到100%,系统的输出电压为0.581~0.755V.活性艳红X-3B的脱色降解主要发生在底层区域和阳极区域,FeS提高了系统中电子的数量和传递速率,有利于偶氮双键断裂,并使得中间产物氧化态能够作为氧化还原介质促进偶氮染料自催化脱色反应.
3.2 旋转空气生物阴极提高了阴极区域的DO浓度,但仍有部分脱色产物未能被完全降解,系统对COD的去除相对比较困难.
[1] Kapoor R T, Danish M, Singh R S, et al. Exploiting microbial biomass in treating azo dyes contaminated wastewater: Mechanism of degradation and factors affecting microbial efficiency [J]. Journal of Water Process Engineering, 2021,43:102255.
[2] Zhang C, Chen H, Xue G, et al. A critical review of the aniline transformation fate in azo dye wastewater treatment [J]. Journal of Cleaner Production, 2021,321:128971.
[3] 曾红杰,余 静,王盈盈.磁性吸附剂MZFS吸附偶氮染料中性红的性能及机理[J]. 中国环境科学, 2019,39(9):3814-3823.
Zeng H Y, Yu J, Wang Y Y. The performance and mechanism of adsorption azo dye neural red from aqueous solution using magnetic adsorbent MZFS [J]. China Environmental Science, 2019,39(9):3814- 3823.
[4] Zhu Y L, Wang W Z, Ni J, et al. Cultivation of granules containing anaerobic decolorization and aerobic degradation cultures for the complete mineralization of azo dyes in wastewater [J]. Chemosphere, 2020,246:125753.
[5] Yadav A K, Dash P, Mohanty A, et al. Performance assessment of innovative constructed wetland-microbial fuel cell for electricity production and dye removal [J]. Ecological Engineering, 2012,47(5): 126-131.
[6] Fang Z, Song H L, Cang N, et al. Electricity production from azo dye wastewater using a microbial fuel cell coupled constructed wetland operating under different operating conditions [J]. Biosensors and Bioelectronics, 2015,68:135-141.
[7] Saba B, Kjellerup B V, Christy A D. Eco-friendly bio-electro- degradation of textile dyes wastewater [J]. Bioresource Technology Reports, 2021,15:100734.
[8] 严登华,王 浩,周 梦,等.全球治水模式思辨与发展展望[J]. 水资源保护, 2020,36(3):1-7.
Yan D H, Wang H, Zhou M, et al. Scientific ideas and development prospects of global water management models [J]. Water Resources Protection, 2020,36(3):1-7.
[9] Li S Y, Cao Y, Bi C C, et al. Promoting electron transfer to enhance anaerobic treatment of azo dye wastewater with adding Fe(OH)3[J]. Bioresource Technology, 2017,245(Pt A):138-144.
[10] Amruta A K, Annette R R, Mohamed Y E. An electrochemical investigation of interfacial electron uptake by the sulfur oxidizing bacterium Thioclava electrotropha ElOx9 [J]. Electrochimica Acta, 2019,324:134838.

Tang H, Zhang H N, Duan S F, et al. Mechanism research for degradation of azo dying wastewater based on persulfate activated by sulphite [J].China Environmental Science, 2018,38(3):959-967.
[12] Zhuang H F, Shi J X, Shan S D, et al. Enhanced anaerobic treatment of azo dye wastewater via direct interspecies electron transfer with Fe3O4/sludge carbon [J]. International Journal of Hydrogen Energy, 2020,45(53):28476-28487.
[13] Dai Q, Zhang S, Liu H, et al. Sulfide-mediated azo dye degradation and microbial community analysis in a single-chamber air cathode microbial fuel cell [J]. Bioelectrochemistry, 2020,131:107349.
[14] 路 通.模拟人工湿地耦合微生物燃料电池体系净化海水养殖废水的研究 [D]. 济南:山东大学, 2021.
Lu T. Study on the purification of mariculture wastewater by simulated constructed wetland-microbial fuel cell system [D]. Jinan: Shandong University, 2021.
[15] HJ/T 399-2007 水质化学需氧量的测定快速消解分光光度法 [S].
HJ/T 399-2007 Water quality-Determination of the chemical oxygen demand-Fast digestion-Spectrophotometric method [S].
[16] 侯 俊,王岩博,张 明,等.微生物-物化耦合法降解毒死蜱研究进展 [J]. 水资源保护, 2021,37(2):15-20.
Hou J, Wang Y B, Zhang M, et al. Research progress on degradation of chlorpyrifos by microbial-physicochemical coupling method [J]. Water Resources Protection, 2021,37(2):15-20.
[17] Thangaraj S, Bankole P O, Sadasivam S K. Microbial degradation of azo dyes by textile effluent adapted, Enterobacter hormaechei under microaerophilic condition [J]. Microbiological Research, 2021,250: 126805.
[18] 朱丹丹,赵联芳.梧桐浸泡液为基质的微生物燃料电池与人工湿地耦合系统偶氮染料X-3B脱色及产电效果[J]. 科学技术与工程, 2018,18(11):225-230.
Zhu D D, Zhao L F. Performance of the microbial fuel cell coupled constructed wetland system for decolorization of azo dye X-3B and bioelectricity generation with the soak solution of P. acerifolia leaf litter as the co-substrate [J]. Science Technology and Engineering, 2018,18(11):225-230.
[19] Yang Y, Zhao Y Q, Tang C, et al. Dual role of macrophytes in constructed wetland-microbial fuel cells using pyrrhotite as cathode material: A comparative assessment [J]. Chemosphere, 2020,263: 128354.
[20] Li R X, Li T, Wan Y X, et al. Efficient decolorization of azo dye wastewater with polyaniline/graphene modified anode in microbial electrochemical systems [J]. Journal of Hazardous Materials, 2022, 421:126740.
[21] 汪 莲,曹 羡,冯羽中,等.双层阳极微生物燃料电池系统降解偶氮染料及同步产电[J]. 中南大学学报(自然科学版), 2019,50(2):264- 271.
Wang L, Cao X, Feng Y Z, et al. Degradation of azo dye and electricity production by dual-anode microbial fuel cell system [J]. Journal of Central South University (Science and Technology), 2019, 50(2):264-271.
[22] 李薛晓.CW-MFC对难降解有机物的去除特性及同步产电研究[D]. 南京:东南大学, 2017.
Li X X. Research on CW-MFC for bio-refractory organics removal and electricity production [D]. Nanjing:Southeast University, 2017.
[23] Fang Z, Cao X, Li X X, et al. Electrode and azo dye decolorization performance in microbial-fuel-cell-coupled constructed wetlands with different electrode size during long-term wastewater treatment [J]. Bioresource Technology, 2017,238:450-460.
[24] Li T, Song H L, Xu H, et al. Biological detoxification and decolorization enhancement of azo dye by introducing natural electron mediators in MFCs [J]. Journal of Hazardous Materials, 2021,416: 125864.
[25] Zhao L F, Zhu D D, Tan S W, et al. The performance of a novel sleeve-type CW-MFC-CW system for acid orange 7 (AO7) removal and electricity generation with leaves as a carbon source on winter days [J]. Journal of Engineering, 2018,120:335-342.
[26] Tao M N, Jing Z Q, Tao Z K, et al. Improvements of nitrogen removal and electricity generation in microbial fuel cell-constructed wetland with extra corncob for carbon-limited wastewater treatment [J]. Journal of Cleaner Production, 2021,297:126639.
[27] Khan M D, Thimmappa R, Anwer A H, et al. Redox mediator as cathode modifier for enhanced degradation of azo dye in a sequential dual chamber microbial fuel cell-aerobic treatment process [J]. International Journal of Hydrogen Energy, 2021,46(79):39427-39437.
[28] Taşkan B. Increased power generation from a new sandwich-type microbial fuel cell (ST-MFC) with a membrane-aerated cathode [J]. Biomass and Bioenergy, 2020,142:105781.
[29] 吴旅州,杨 敏,陈 宏,等.光合微生物燃料电池处理餐厨沼液的性能研究 [J]. 中国环境科学, 2020,40(12):5308-5317.
Wu L Z, Yang M, Chen H, et al. Study on the performance of photosynthetic microbial fuel cell in the treatment of kitchen biogas slurry [J]. China Environmental Science, 2020,40(12):5308-5317.
[30] Wu F, Deng N S, Hua H L. Degradation mechanism of azo dye C. I. reactive red 2by iron powder reduction and photooxidation in aqueous solutions [J]. Chemosphere, 2000,41(8):1233-1238.
[31] Peng H J, Zhang Q, Tan B, et al. A metagenomic view of how different carbon sources enhance the aniline and simultaneous nitrogen removal capacities in the aniline degradation system [J]. Bioresource Technology, 2021,335:125277.
Effect of FeS on reactive brilliant red X-3B removal effect and degradation process in CW-MFC system.
ZHAO Lian-fang1,2*, YU Xue-qing1, LU Zong-ren3, LIU Cheng1, LI Ying1
(1.College of Environment, Hohai University, Nanjing 210098, China;2.Key Laboratory of Integrated Regulation and Resource Development on Shallow Lake, Ministry of Education, Nanjing 210098, China;3.Shanghai Survey and Design Research Institute Co., Ltd, Shanghai 200335, China)., 2022,42(7):3093~3102
In the self-constructed wetland-microbial fuel cell (CW-MFC), the effect of FeS on the decolorization and degradation process of reactive brilliant red X-3B was studied by using gravel filter as a control. The results showed that the addition of FeS in the underlying region could significantly improve the decolorization effect and the system electricity generation performance of CW-MFC on reactive brilliant red X-3B. The addition of FeS made the system decolorization rate reach 99.83% under the conditions of influent of 200mg/L reactive brilliant red X-3B and glucose of 100mg/L. The maximum power density in FeS group reached 0.849W/m3with influent of 100mg/L reactive brilliant red X-3B and glucose of 200mg/L. The decolorization of reactive brilliant red X-3B in the system mainly occurred in the bottom layer and anode regions, which could be seen from the UV full-wavelength scanning and GC-MS spectrum that FeS promoted the breakage of azo double bonds in this region, and was conducive to the further degradation of the decolorization products aniline, triazine structure and naphthalene ring structure.
CW-MFC;reactive brilliant red X-3B;FeS;decolorization;degradation process
X703
A
1000-6923(2022)07-3093-10
赵联芳(1972-),女,河北易县人,副教授,博士,研究方向为水体污染控制与生态修复技术与理论.发表论文50余篇.
2021-12-16
江苏省科技支撑计划重点项目(BE2016357)
* 责任作者, 副教授, lfzhao@hhu.edu.cn
