麻疹病毒作为溶瘤病毒的研究进展
2022-07-19党昱东张欣综述马雷钧审校
党昱东,张欣 综述,马雷钧 审校
上海生物制品研究所有限责任公司,上海 200051
恶性肿瘤以异常且不受控制的细胞生长、迁移和侵袭为主要特征,且能够逃避凋亡机制[1],是造成人类死亡的重要原因之一。目前的治疗手段如手术治疗、放射治疗、化学药物治疗等均存在一定局限性,迫切需要寻找新的治疗方法。
溶瘤病毒是一类具有复制能力的肿瘤杀伤型病毒,是肿瘤的新型疗法之一,其抗肿瘤作用包括直接的肿瘤选择性溶瘤作用以及激活宿主先天性和适应性免疫反应,有良好的应用前景。最早被研究并使用的溶瘤病毒是人腺病毒,其他病毒如麻疹病毒(measles virus,MV)、单纯疱疹病毒、M1 病毒、腺病毒、牛痘病毒和新城疫病毒等也被视为潜在的候选[2]。迄今为止,已有3 种可用于治疗癌症的溶瘤病毒获得批准上市,分别为在拉脱维亚、乔治亚州和亚美尼亚批准的Rigvir(源自肠道病毒ECHO-7),在中国批准的腺病毒Oncorine H101(由腺病毒经基因修饰获得),在美国批准的T-VEC(由单纯疱疹病毒经基因改造获得)[3]。理想的溶瘤病毒应具有复制速度快、细胞病变效应高等特性,同时选择性破坏癌组织而不对正常组织造成过度损害[4]。MV 作为具有溶瘤活性的病毒之一,近年来获得了研究人员的极大关注,临床前研究和临床试验证实了MV 对于多种肿瘤均具有良好的治疗作用。
本文阐述了MV 作为溶瘤病毒的抗肿瘤机制及活性,重点介绍了基因工程改造对MV 溶瘤活性的影响,并对麻疹溶瘤病毒的研究进展作一展望。
1 MV 概述
MV 属于副黏病毒科麻疹病毒属,多呈球形,核酸组成为不分节段的单负链RNA,基因组由6 个基因组成,见图1,分别编码6 种结构蛋白(N、P、M、F、H、L)以及2 种非结构蛋白(C、V)。其中,病毒表面突出的F 和H 蛋白负责病毒的黏附和入侵。H 蛋白与病毒受体的结合导致H 和F 构象发生变化,F 蛋白则介导膜融合[5]。目前认为与H 蛋白作用的MV 受体有3 种:信号淋巴细胞激活分子(SLAM / CD150)、CD46 和nectin-4(也称为PVRL4)。其中,CD46 迄今为止在所测试癌细胞表面基本均高表达,如间皮瘤细胞[6]、恶性周围神经鞘瘤细胞[7]等,给麻疹溶瘤病毒的靶向性识别和入侵创造了条件。
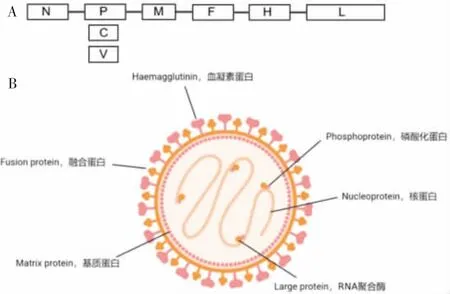
图1 MV 基因组(A)及结构蛋白(B)Fig.1 Genome and structural protein of MV
MV 的抗肿瘤活性可追溯至1949 年发表的第1例关于野生型MV 感染后霍奇金淋巴瘤消退的病例报告[8]。近年来,越来越多的临床前研究表明,MV通过形成合胞体发挥溶瘤活性,可优先感染、破坏多种癌症组织[9],并验证了其安全性[10]。LAL 等[11]评估了注射麻疹疫苗和MV 易感转基因小鼠脑脊液中MV-人类碘化钠同向转运蛋白(sodium iodide symporter,NIS)的安全性,未在任何接受治疗的动物中观察到任何与麻疹相关的毒性作用或行为异常,且所有的全血细胞计数和血液化学分析结果均在正常范围内。
2 MV 的抗肿瘤机制
MV 可在细胞水平和全身水平介导抗肿瘤作用。MV 的抗肿瘤机制包括直接感染并通过自噬或凋亡途径裂解肿瘤细胞,裂解的肿瘤细胞作为抗原激发机体的免疫应答,见图2。在细胞层面,MV 通过感染肿瘤细胞形成合胞体,使细胞膜的完整性受到破坏,继而引发细胞死亡[12]。但MV 诱导的细胞死亡类型尚不清楚。早期的研究表明,MV 感染后细胞发生凋亡,但有研究提示,自噬也是细胞死亡的一种重要形式[13-14]。在全身水平上,MV 介导的溶瘤是免疫原性的,麻疹溶瘤病毒的感染可引发机体的抗肿瘤免疫反应,包括免疫原性细胞死亡、抗原呈递细胞激活、T 细胞激活和转运、效应阶段几个过程。裂解的肿瘤细胞释放出的病毒和肿瘤抗原可再次刺激机体的免疫应答,使麻疹溶瘤病毒的时效性得以延长。MV 与免疫系统的相互作用不局限于DC 和T 细胞,还包括其他细胞群,如中性粒细胞和巨噬细胞等。
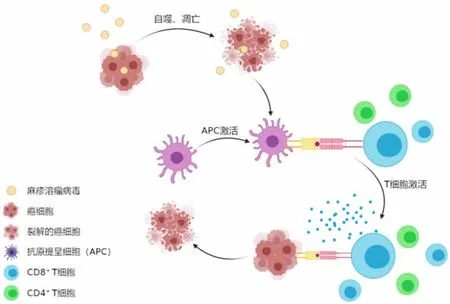
图2 MV 的抗肿瘤机制Fig.2 Anti-tumor mechanism of MV
机体的抗病毒反应会在一定程度上限制MV 的溶瘤活性,但在某些情况下,机体的适应性抗病毒反应可能有利于溶瘤病毒疗法[15]。总体来说,抗肿瘤和抗病毒免疫之间存在复杂的平衡,二者共同协调溶瘤病毒疗法的有效性和安全性。
3 MV 的抗肿瘤活性
溶瘤性MV 感染细胞后形成合胞体,表现出明显的杀伤力,抑制肿瘤细胞增殖、抵抗肿瘤生长、引发抗肿瘤免疫反应,进而发挥溶瘤效应。作为麻疹疫苗用毒株之一的MV-Edm 株在MV 的溶瘤活性研究中应用较为广泛[6]。
溶瘤病毒治疗肿瘤的关键是病毒在肿瘤组织中的感染和传播效率。然而大多数患者对MV 具有免疫力,降低了溶瘤性MV 的治疗活性。旨在增强溶瘤性MV 疗效的方法包括使用细胞载体作为运载工具、将MV 疗法与其他治疗方式相结合、操纵免疫系统以保护病毒免受先天和特异性免疫并刺激抗肿瘤免疫反应[16]、通过基因操作产生具有理想治疗特性的重组MV 等[17]。
3.1传统MV 的抗肿瘤活性 MV 对多种肿瘤均有溶瘤效应,如非小细胞肺癌(non-small cell lung cancer,NSCLC)[14]、伊拉克乳腺癌[18]、多发性骨髓瘤[19]、间皮瘤[6]、恶性胸膜间皮瘤[20-21]、弥散性髓母细胞瘤[22]、非典型类畸胎瘤样横纹肌瘤[23]等。溶瘤性MV 可抑制伊拉克乳腺癌细胞(尤其是AMJ13 细胞)的增殖[18]、增加多发性骨髓瘤患者对肿瘤相关抗原的细胞毒性T 细胞反应[19]、缩小弥散性髓母细胞瘤小鼠模型的肿瘤体积并延长其生存期[22]、延长颅内和转移性非典型类畸胎瘤样横纹肌瘤(AT / RT)动物的存活期[23]。XIA 等[14]研究表明,麻疹溶瘤病毒可通过诱导线粒体持续性自噬、减少细胞色素C 释放,使病毒不断复制,最终由于ATP 耗尽而导致NSCLC细胞坏死;JACOBSON 等[6]发现,麻疹溶瘤病毒通过表面高表达的CD46 进入间皮瘤细胞,降低细胞活力、抑制增殖并引起细胞凋亡;ACHARD 等[20]及DELAUNAY 等[21]的研究共同提示,MV 利用Ⅰ型干扰素(IFNⅠ)反应缺陷[最常见的为IFNⅠ基因的纯合缺失(homozygous deletion,HD)]治疗恶性胸膜间皮瘤(malignant pleural mesothelioma,MPM);FONTENEAU 等[24]及ACHARD 等[25]研究表明,MV 通过人髓样和浆细胞样树突状细胞诱导肿瘤坏死因子相关的凋亡诱导配体(TNF related apoptosis inducing ligand,TRAIL)介导细胞毒性,刺激树突细胞以引发抗肿瘤免疫反应。
了解肿瘤、溶瘤病毒、局部微环境和免疫反应之间的动态相互作用,进而探究MV 在肿瘤内扩散的动力学具有重要意义。KEMLER 等[26]通过背侧皮肤折叠腔的活体成像系统对肿瘤细胞以单细胞分辨率进行连续的非侵入性成像,发现虽然融合型和低融合型MV 均形成合胞体,但其复制动力学和表型差异很大,且细胞间的空间关系对溶瘤效果有较大影响。
另外,针对H 蛋白的抗麻疹中和抗体是MV 溶瘤效果的主要障碍。针对这一问题,可采用特定类型的细胞作为病毒载体,需要注意的是,加载持续时间是载体细胞中H 蛋白表达的主要决定因素[27];XU等[28]发现,不可复制的MV 也可充当中和抗MV 抗体的诱饵,使溶瘤性MV 保持抗肿瘤活性;MV 也可触发SQSTM1 / p62 介导的线粒体自噬,从而导致线粒体抗病毒信号蛋白(mitochondrial antiviral signaling,MAVS)减少,削弱DDX58 / RIG-I 样受体信号传导而增强MV 复制,进而削弱先天免疫应答[13]。
3.2基因工程改造MV 的抗肿瘤能力
肿瘤特异性和溶瘤效力是治疗效应的关键决定因素[29],基因修饰和改造可改善溶瘤病毒的肿瘤选择性和递送能力,提高治疗效果,见表1。
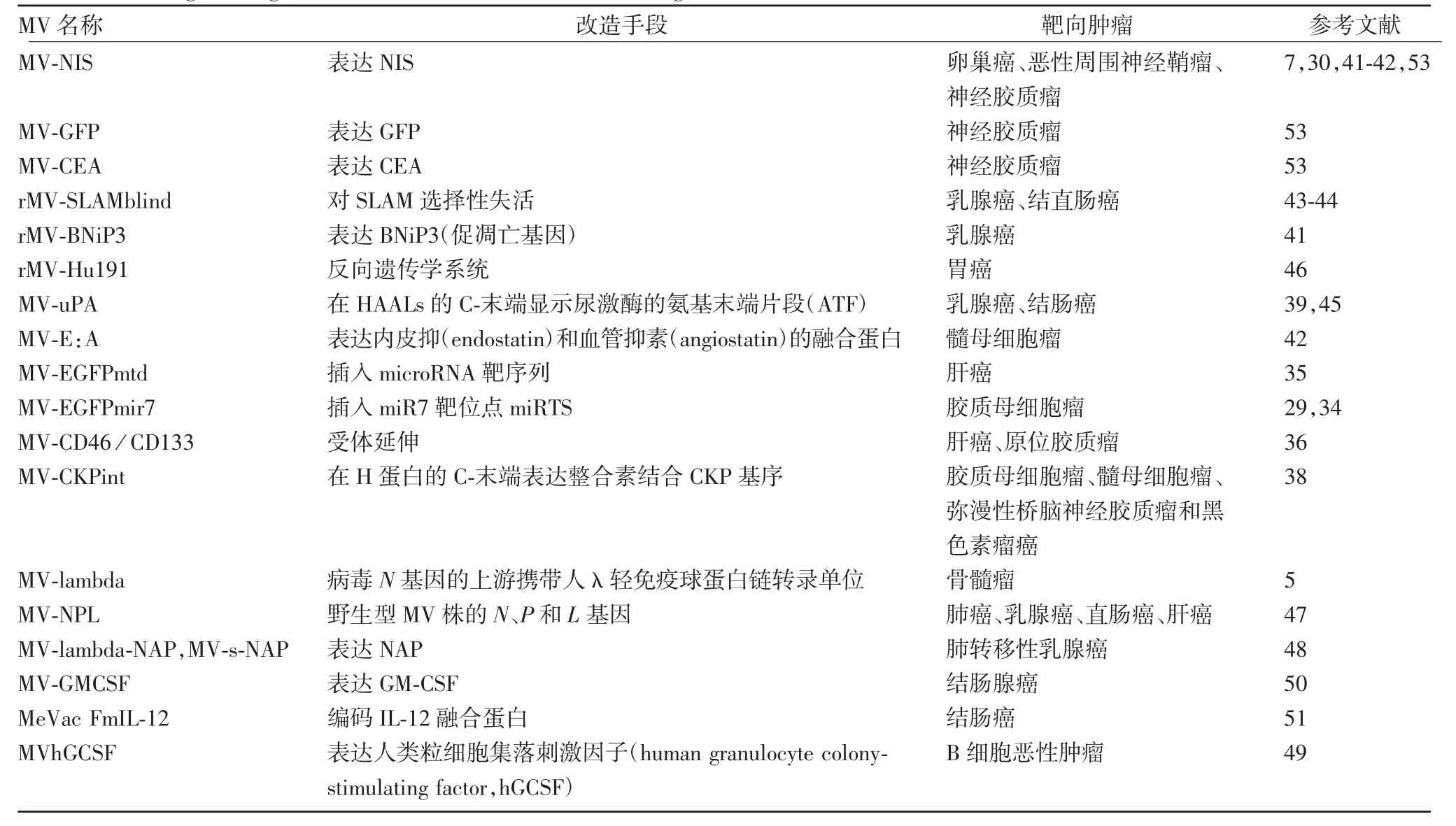
表1 基因工程改造的重组MV 及靶向的肿瘤Tab.1 Gene engineering-modified recombinant MV and its target tumors
3.2.1监测MV 的体内定位 基因工程改造可使MV-Edm 表达可追踪的蛋白质,从而监测MV 在体内的定位及扩散。如表达人类癌胚抗原(carcinoembryonic antigen,CEA)的MV-CEA,病毒中循环CEA水平的测定可提供患者在接受治疗时基因表达动力学的关键数据,该技术已在临床试验中展开应用(NCT00390299)。MV-NIS 通过表达NIS,使MV 在体内的生物分布可视化,从而对肿瘤内的病毒进行动态测定[30],解决了体内数据的缺乏使研究模型难以参数化的问题。SCHEUBECK 等[31]将绿色荧光蛋白(GFP)插入MV 基因组,使MV 表达GFP 并根据荧光强度探究了饥饿处理对MV 溶瘤效力的影响。
3.2.2调控MV 的肿瘤细胞靶向性 利用microRNA及其靶序列的互补性及利用受体与配体的特异性结合对MV 进行相应的设计和改造等方式调控MV 的肿瘤细胞靶向性,可保证MV 感染的特异性[32-33]。
神经元特异性microRNA 在神经胶质瘤中下调,而在正常脑组织中高表达。LEBER 等[34]发现,microRNA 敏感的病毒能完全抵抗胶质母细胞瘤的异种移植物,且microRNA 介导的抑制作用避免了易受MV 感染的遗传修饰小鼠受到潜在的致命性脑内攻击。表明插入microRNA 靶序列可控制并重塑病毒的细胞向性,且不会损害溶瘤功效;但基于microRNA 的载体控制机制比较复杂,不仅仅依赖于microRNA 与microRNA 靶位点(microRNA target site,miRTS)之间的互补性,尚有待进一步研究[29,35]。
水泡性口炎病毒(vesicular stomatitis virus,VSV)的受体扩展或嵌合靶向CD133 的MV(MV-CD133)[36]、以肿瘤标志物人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)/ neu 或癌症干细胞(cancer stem cell,CSC)标志物上皮细胞黏附分子(epithelial cell adhesion molecule,EpCAM)作为靶受体[37]的研究,均证实了利用受体与配体的特异结合原理改造MV,从而提高其靶向能力的可行性。另外,MV-CKPint 通过引入可指导MV 活动的胱氨酸结蛋白(cystine knot protein,CKP),对人胶质母细胞瘤、髓母细胞瘤、弥漫性桥脑神经胶质瘤和黑色素瘤等多种肿瘤均有抵抗效力[38]。
为研究基质靶向对于MV 在肿瘤模型中溶瘤效果的影响,JING 等[39]开发了一种能同时感染小鼠基质(通过小鼠uPAR)和人癌(通过CD46)细胞的双靶向溶瘤MV(MV-CD46-muPA)。MV-CD46-muPA能感染、复制并诱导小鼠和人癌细胞的细胞毒性,并且比载体或CD46 靶向的MV 疗效更高。MSAOUEL等[5]研究表明,在MVN基因的上游携带人λ 轻免疫球蛋白链转录单位,可生成肿瘤特异性感染的独特标记。
3.2.3增强MV 的溶瘤活性 通过基因重组技术,MV 可获得外源治疗性基因,随着病毒的复制而得以表达,进而发挥特有的功效。
NIS 既可被追踪也可作为治疗性转基因,当与治疗性同位素131I 组合使用时能增强病毒的抗肿瘤功效[8]。MV-NIS 可触发针对肿瘤的细胞免疫且具有良好的耐受性,对紫杉醇和铂耐药的卵巢癌[40]以及恶性周围神经鞘瘤(malignant peripheral nerve sheath tumor,MPNST)衍生的肿瘤[7]具有良好的临床治疗效果。另外,带有野生型MV 毒株IC-B 的P基因的重组MV[9]、带有BNiP3(人类的促凋亡基因)的重组MV[41]、可表达内皮抑素和血管抑素的融合蛋白的重组MV[42]、用反向遗传学生成无法选择性利用SLAM 而依赖于nectin-4(PVRL4)的表达感染的重组MV(rMV-SLAMblind)[43-44]、用新型生物靶标[尿激酶受体(urokinase type plasminogen activator receptor,uPAR)]的重组MV(MV-uPA)[45],均能明显减弱细胞生长及迁移,表现出增强的减弱裂解肿瘤细胞的作用、诱导癌细胞凋亡的能力以及提高的扩散效率。LV 等[46]发现,另一种MV 毒株rMV-Hu191通过诱导caspase 依赖性凋亡,诱导胃癌(gastric carcinoma,GC)中细胞病变及抑制肿瘤增殖,在病毒的成功感染以及随后的细胞凋亡过程中脂质筏的完整性十分重要。
3.2.4规避宿主的抗病毒免疫反应 病毒疗法的有效性受到宿主免疫反应的限制,调节或规避抗麻疹免疫有3 种主要策略:使用细胞作为溶瘤性MV 的载体;与免疫抑制药物联合作用;使用野生型MV 基因武装MV-Edm 株来抑制对病毒感染的先天免疫应答。
NOSAKI 等[47]研究表明,具有野生型MV 株的N、P和L基因的MV-NPL 与离子聚合物逐层沉积的多层病毒涂层方法结合使用后,无论是在体内还是体外,溶瘤活性均有所提高。表达中性粒细胞激活蛋白(neutrophil-activating protein,NAP)的重组MV[48]、表达细胞因子粒细胞-巨噬细胞集落刺激因子(granulocyte macrophage colony factor,GM-CSF)的MV[49]、编码免疫调节剂的麻疹Schwarz/Moraten 疫苗株[50]、编码白介素-12 的MV(MeVac FmIL-12)[51]均可增强抗癌免疫反应,具体表现为刺激促炎细胞因子释放、支持肿瘤免疫应答不同阶段、增强肿瘤靶标的嗜中性粒细胞反应、导致TRAIL 直接释放等。LECH等[52]将单链抗体(single chain antibody fragment,scFv)或天然存在的配体与病毒表面的H 糖蛋白连接,也可使MV 重新靶向特定肿瘤细胞,但MV 仍会被人血清中和,可能是因为多个中和表位需要同时受到保护。值得注意的是,基因重组的MV 诱发的抗肿瘤T 细胞反应会受到免疫检查点尤其是programmed death ligand 1(PD-L1)的抑制。因此,免疫检查点抑制剂与麻疹溶瘤病毒结合可提高溶瘤效果。
4 总结与展望
MV 可通过不同机制对多种肿瘤发挥溶瘤效应。但MV 作为溶瘤病毒疗法也存在一定的局限性,如人体内广泛存在的MV 中和抗体可直接与病毒结合,继而将病毒移除;麻疹溶瘤病毒的肿瘤组织靶向性以及肿瘤杀伤能力还有待提高;MV 在体内溶瘤时需要较高的滴度,而高滴度的病毒不易获得等。
在MV 作为溶瘤病毒疗法的研究过程中,需要更深入地了解MV 疫苗的减毒机制、复制位点和免疫原性,同时要特别注意回复突变等安全性问题。另外,监测病毒在体内的复制和传播可对治疗方案提供指导;针对MV 溶瘤效力的测试系统以及生物学的数学模型的建立可为MV 治疗策略提供新思路。
溶瘤病毒作为单一疗法的功效有一定的限制,与其他治疗方法联合可增强其抗肿瘤活性,如与化学治疗剂喜树碱(camptothecin,Cpt)共同治疗可加快乳腺癌细胞凋亡[54],与紫杉醇和H2 复合物联合使用会降低癌细胞的整体生存能力[42],与吉西他滨联合使用诱导肿瘤细胞衰老[55],与前药5-氟胞嘧啶(5-flucytosine,5-FC)联合使用增强靶向治疗恶性黑色素瘤的效用[56],也可与CAR-T 技术结合使用等,将在后续研究中进一步探讨。
除了实验室的研究工作,临床试验数据(表2)还将进一步增加对MV 溶瘤活性的了解,并对病毒疗法的临床应用提供指导。作为一种治疗肿瘤的新型手段,溶瘤性MV 技术的研究和成熟必将推动人类健康事业的发展。

表2 麻疹溶瘤病毒的临床应用Tab.2 Clinical application of measles virus as oncolytic virus
