人乳头瘤病毒疫苗的研究现状及前景
2022-07-19高飞张姝玥王致萍夏宁邵
高飞,张姝玥,王致萍,夏宁邵,2
1.厦门大学生命科学学院国家传染病诊断试剂与疫苗工程技术研究中心,福建厦门 361102;
2.厦门大学公共卫生学院分子疫苗学和分子诊断学国家重点实验室,福建厦门 361102
人乳头瘤病毒(human papillomavirus,HPV)是女性生殖道及皮肤黏膜常见病原体,其感染较常见,80%以上女性一生至少感染过1 次HPV。HPV 主要通过性接触、皮肤-皮肤接触、母婴传播3 种途径进行传播。持续感染高危型HPV 可促进鳞状上皮细胞增殖,并有可能引起宫颈病变[1]。宫颈癌发病率在女性恶性肿瘤中高居第2 位,但我国青少年女性HPV 疫苗接种率仍然较低。因此,提高HPV 疫苗覆盖率、增强民众对宫颈癌和HPV 疫苗的了解和认识迫在眉睫。本文简述了HPV 的分子生物学和流行病学特征,梳理了国内外HPV 疫苗的研究现状,展望了HPV 疫苗的研究前景,旨在提供HPV 疫苗的探索思路,促进新型疫苗的发展,提高接种率以响应WHO 提出的全球消灭宫颈癌的目标。
1 HPV 分子生物学
1.1HPV 基因组及编码蛋白 HPV 属乳头瘤病毒科乳头瘤病毒属,是一类无包膜的双链环状DNA 病毒。基因组长约8 000 bp,包括:①早期区域(early region,ER),编码与病毒基因组复制、病毒颗粒合成及释放周期相关的非结构蛋白,可诱导细胞发生恶性转化;②晚期区域(late region,LR),主要编码衣壳蛋白;③上游调控区域(upstream regulatory region,URR),为非编码区,含复制起点和转录因子结合位点,能够调控基因表达。HPV 基因组的表达高度依赖于细胞分化,并在转录和转录后水平上被严格调控。
ER 主要编码E1、E2、E4、E5、E6、E7 六类早期蛋白。E1 与E2 蛋白形成高亲和力的六聚体起始复合物,促使双链解旋,启动病毒DNA 复制。E2 蛋白帮助病毒DNA 整合至宿主染色体中[2],还可激活或抑制病毒转录;E4 蛋白在晚期表达。E4 与E1 共表达,可将分化细胞的细胞周期阻滞在G2 期。研究表明,E1 及E4 蛋白复合物还可促进角质细胞分解,从而释放病毒粒子[3]。E5 蛋白是一种跨膜蛋白,定位于内质网,通过激活如表皮生长因子受体信号转导等途径促进细胞增殖;其通过抑制主要可溶性复合分子形成病毒肽、干扰素κ(interferon κ,IFNκ)及生长信号通路来逃避宿主免疫[4-5]。E6 蛋白包含150 个氨基酸,由2 个锌指结构组成[6]。E7 蛋白是酸性磷蛋白,含约100 个氨基酸[7]。E6 和E7 蛋白的主要功能是通过调节增殖和分化的平衡,营造有利于病毒复制的细胞环境,同时维持感染基底细胞的储存库,是主要的病毒癌蛋白。具体来说,E6 蛋白与p53 蛋白相互作用[8],E7 蛋白与视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)相互作用[9],协同靶向多种致癌蛋白、抑癌蛋白和小RNA(micro-RNA,mi-RNA)以破坏细胞周期检验点。研究发现,高危型HPV 和低危型HPV 在启动子定位、启动子调控以及信使RNA(messenger RNA,mRNA)剪接模式上存在显著差异,这些差异影响了E6、E7 基因的表达[10]。E6、E7 表达水平的升高与肿瘤严重程度的增加直接相关,这些基因表达的失调导致错误的遗传信息在受感染细胞中积累,并最终将病毒片段整合至宿主细胞染色体中。
晚期区域主要编码2 类高度保守的晚期蛋白,分别为L1 主要衣壳蛋白(55 kD)和L2 次要衣壳蛋白(55 kD)。HPV 通过L1 与基底膜上的硫酸肝素蛋白聚糖结合感染上皮细胞;而L2 基因在体内会影响L1 蛋白的表达、定位、转运和组装。20 世纪90 年代初,有研究者发现,L1 在体外重组表达系统中能够自发组装成病毒样颗粒(virus-like particle,VLP)[11]。5 个L1 首先形成五聚体,72 个五聚体通过二硫键、离子键等相互作用组装成T = 7 的正二十面体结构,直径52~55 nm[12],这种颗粒不含致癌病毒基因组,免疫功能与天然病毒粒子类似,是疫苗开发的一个重大发现。进一步研究表明,接种L1 VLP 疫苗,即使没有佐剂,也能引起持久的高滴度中和抗体[13]。因此,目前已上市的疫苗均是基于混合的多种型别HPV L1 VLP 制备的疫苗,可诱导强烈的体液免疫应答。
1.2HPV 生活史 HPV 在宿主黏膜和皮肤上皮细胞中感染及复制。不同类型HPV 具有相似的生活史。上皮细胞中的基底层细胞通过对称分裂自我更新,不断补充基底层,通过不对称分裂产生子细胞,形成组织的分化层。HPV 充分利用上皮细胞这一特点,通过微裂缝进入上皮细胞后利用细胞的还原性环境脱壳,将DNA 运输至细胞核内[14]。病毒基因组在基底层细胞中保持低拷贝数,细胞分化期间,p97 启动子介导E6、E7 蛋白表达,p670 启动子上调,激活病毒增殖,病毒复制蛋白(E1、E2、E4 和E5)表达量增加,促进病毒DNA 扩增和衣壳蛋白合成[15]。最后,病毒粒子以鳞片的形式从上皮细胞表面脱落,释放至环境中。在通常情况下,HPV 感染后症状并不明显,也有少部分患者在感染HPV 后,会诱发上皮层增生,从而导致良性乳头状皮肤肿瘤。这种在自我更新细胞中建立低水平持续性感染,同时利用最终分化的细胞建立生产性感染的策略,是非常有效的,有利于HPV 长期感染和免疫逃逸。
1.3HPV 流行病学研究
1.3.1HPV 感染引发的相关疾病 HPV 主要通过性行为传播,由于其特有的分子病毒学特征和免疫逃逸机制,传播十分广泛,人群感染率极高。
目前已分离出近450 种HPV 型别的基因组并进行了测序[16]。根据病毒基因组结构和组织嗜向性,HPV 主要分为5 个属(α、β、γ、μ 和ν-HPV)。其中α属(65 种)是从生殖器和口腔病变的皮肤或黏膜中分离出来的,能够导致癌症。其他均来自皮肤标本,主要为β-HPV(54 种)和γ-HPV(98 种)[17],β-HPV和γ-HPV 在感染过程中,患者通常无症状,但呈免疫抑制状态,有可能诱发产生皮肤乳头状瘤或增加皮肤癌的易感性。
世界卫生组织(World Health Organization,WHO)将12 种型别的HPV(16、18、31、33、35、39、45、51、52、56、58 和59)定义为1 类高危致癌类型,HPV68[18]被认为是可能致癌的(2A 类)。基于与已知致癌类型在进化上的相似性,其他几种HPV 类型(26、30、34、53、66、67、69、70、73、82、85 和97)也属于高危进化枝,被认为是可能致癌的(2B 类)[19],见表1。全世界每年因HPV 感染导致宫颈癌病例604 127 例,其中死亡341 831 例[20]。此外,HPV 也与其他部位癌症有关,包括男性阴茎,女性阴道和外阴,男、女肛门转化区、扁桃体、口咽和舌根。高危HPV 在不同感染部位表达不同,尤其是子宫颈鳞柱交接部更易生成肿瘤。
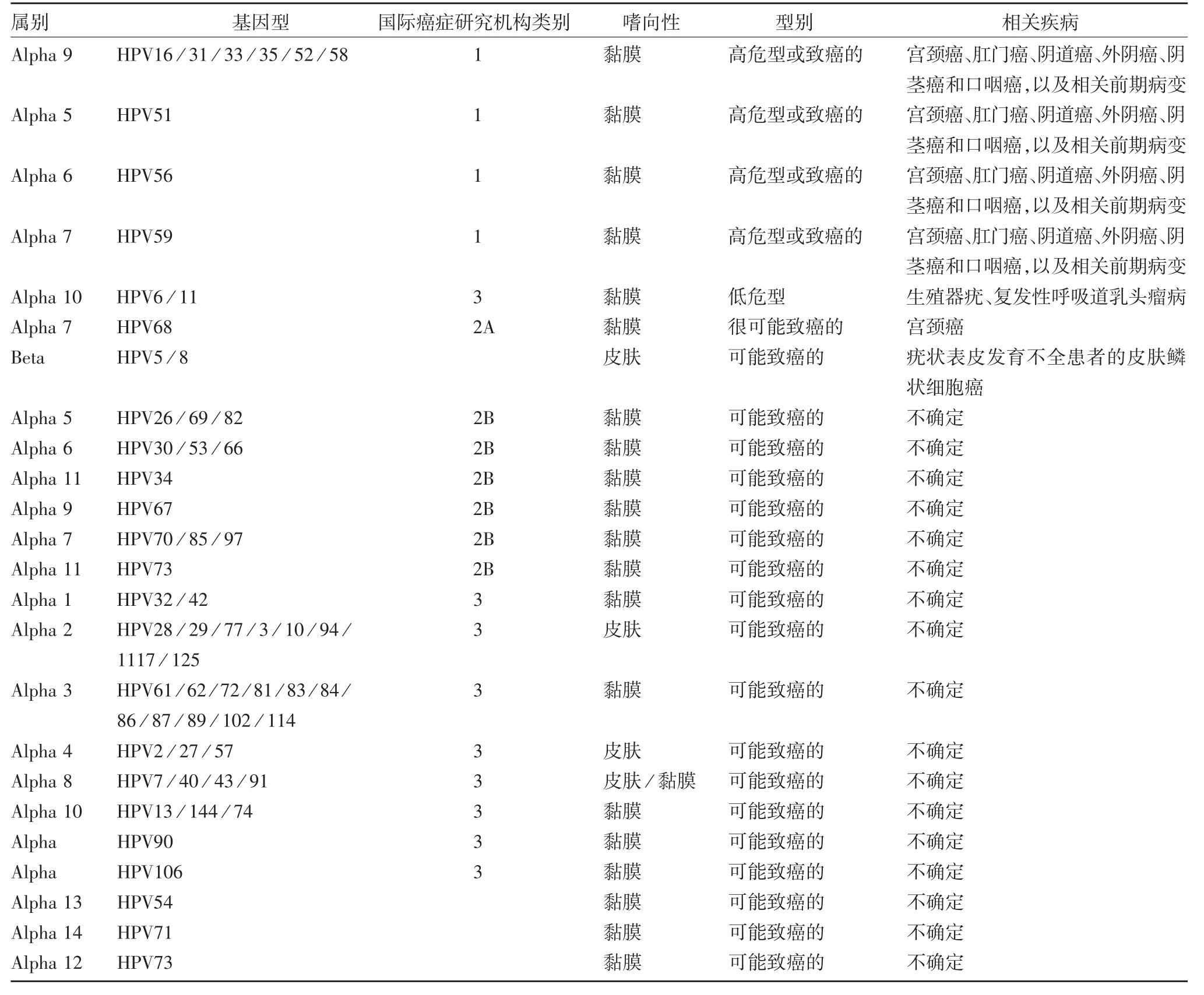
表1 国际癌症评估研究机构对HPV 的致癌风险和相关疾病的分类Tab.1 Classification of HPV according to oncogenic risk and associated diseases by the International Agency for Research on Cancer Evaluation
但大多数高危HPV 并不会导致被感染个体患癌,如轻度鳞状上皮病变(low-grade squamous intraepithelial lesion,LSIL),基本会在18 个月内自行消退[21]。一般来说,低危型HPV 仅引起良性和自限性病变,但在特殊情况下,也会引发癌症,如对于严重联合免疫缺陷(severe combined immunodeficiency,SCID)[22]、疣状表皮发育不全(epidermodysplasia verruciformis,EV)[23]者和器官移植受者等,由α、β、γ、μ 型HPV 引起的皮肤病将很难治愈。
1.3.2HPV 流行病学现状 HPV 是目前导致女性癌症的最常见病原体,99%的宫颈癌均与该病毒相关。因此,HPV 已成为全球当前亟待解决的公共卫生问题。
调查显示,在全球范围宫颈细胞学检查正常的女性中,2020 年HPV 感染率为15.6%,但各地HPV流行率存在一定差异。WHO 报告显示,五大洲中,女性HPV 感染率最高的为非洲(17.5%)和亚洲(15.5%),其次为欧洲(15%)、美洲(14.3%)和大洋洲(11.8%)[20]。统计结果发现,发展中地区女性HPV感染率(16.4%)高于发达地区(11.6%)[20]。HPV 流行率与妇女年龄相关性统计结果表明,在所有地区,HPV 流行高峰通常出现在35 岁以下,老年妇女发病率降低,但在一些国家,特别是非洲、南美和北美以及欧洲地区,HPV 流行率在45 岁或45 岁以上出现第2 个高峰[24],这种延迟增加的原因尚不明确。
在男性中,全球HPV 感染率与女性相似(3.5%~45% vs.2% ~ 44%)[25],传播速率也相似。2014 年进行的一项研究中,经调查统计发现,在4 065 名来自非洲、美洲、亚洲和欧洲的健康男性中,9.0%为HPV 携带者[26]。与异性恋男性相比,同性恋和已感染艾滋病病毒的男性的HPV 感染风险更高,其HPV肛周感染发病率更高(≥90%);然而在异性恋男性中,性伴侣数量决定了HPV 感染风险的高低[27]。此外,HPV 流行率与男性年龄相关性不大,年轻及年长男性的HPV 感染率一样高,且随年龄变化很小[20]。
宫颈癌在中国女性最常见的癌症中排名第6。仅在2020 年,中国就报告了109 741 例宫颈癌新发病例和590 60 例死亡病例,占全球宫颈癌确诊病例(604 127 例)的18.2%和死亡病例(341 831 例)的17.3%[20]。
69.1%的浸润性宫颈癌归因于HPV16 或18。在中国宫颈细胞学检查正常的女性中,45 ~ 54 岁是HPV 流行高峰。中国HPV 感染的总体流行率为15.54%。各地区流行率存在一定差异,华东、华北、华中、华南、西南、西北、东北地区,HPV 感染的患病率分别为15.99%、18.43%、12.96%、13.51%、12.92%、12.57%和19.85%[28]。
数据分析显示,世界范围内最流行的5 种HPV型别分别为HPV16、HPV18、HPV52、HPV31 和HPV-58,在中国细胞学检查正常女性中,最常见的5种 型 别 分 别 为HPV52、HPV16、HPV58、HPV33 和HPV18[20]。
2 HPV 疫苗研究现状
2.1已上市HPV 疫苗 HPV 感染是一个重要的公共卫生问题。HPV 疫苗是降低HPV 感染和随后癌症发病率的重要手段。尽管2020 年美国青少年中HPV 疫苗接种率(≥1 剂)从2019 年的71.5%提高至75.1%,3 针HPV 疫苗接种率从2019 年的54.2%增加至58.6%[29],但接种率仍不理想,远远低于2030 年“健康人群”的目标,即90%的女孩在15 岁之前完成HPV 疫苗全程接种。
截至2022 年6 月,已上市HPV 疫苗有5 种,分别为2006 年上市的四价疫苗Gardasil®(Merck公司生产)[30]、2007 年上市的二价疫苗Cervarix®(GlaxoSmithKline 公司生产)[31]、2014 年上市的九价疫苗Gardasil®9(Merck 公司生产)[32]、2019 年上市的二价疫苗馨可宁®(Cecolin®,厦门大学联合厦门万泰沧海生物技术有限公司研发生产)、2022 年上市的二价疫苗沃泽惠®(玉溪泽润生物技术有限公司生产),疫苗详情见表2,这5 种疫苗均为基于L1 自发组装的VLP 进行研制的预防性HPV 疫苗,但表达系统和佐剂存在不同,见表3。
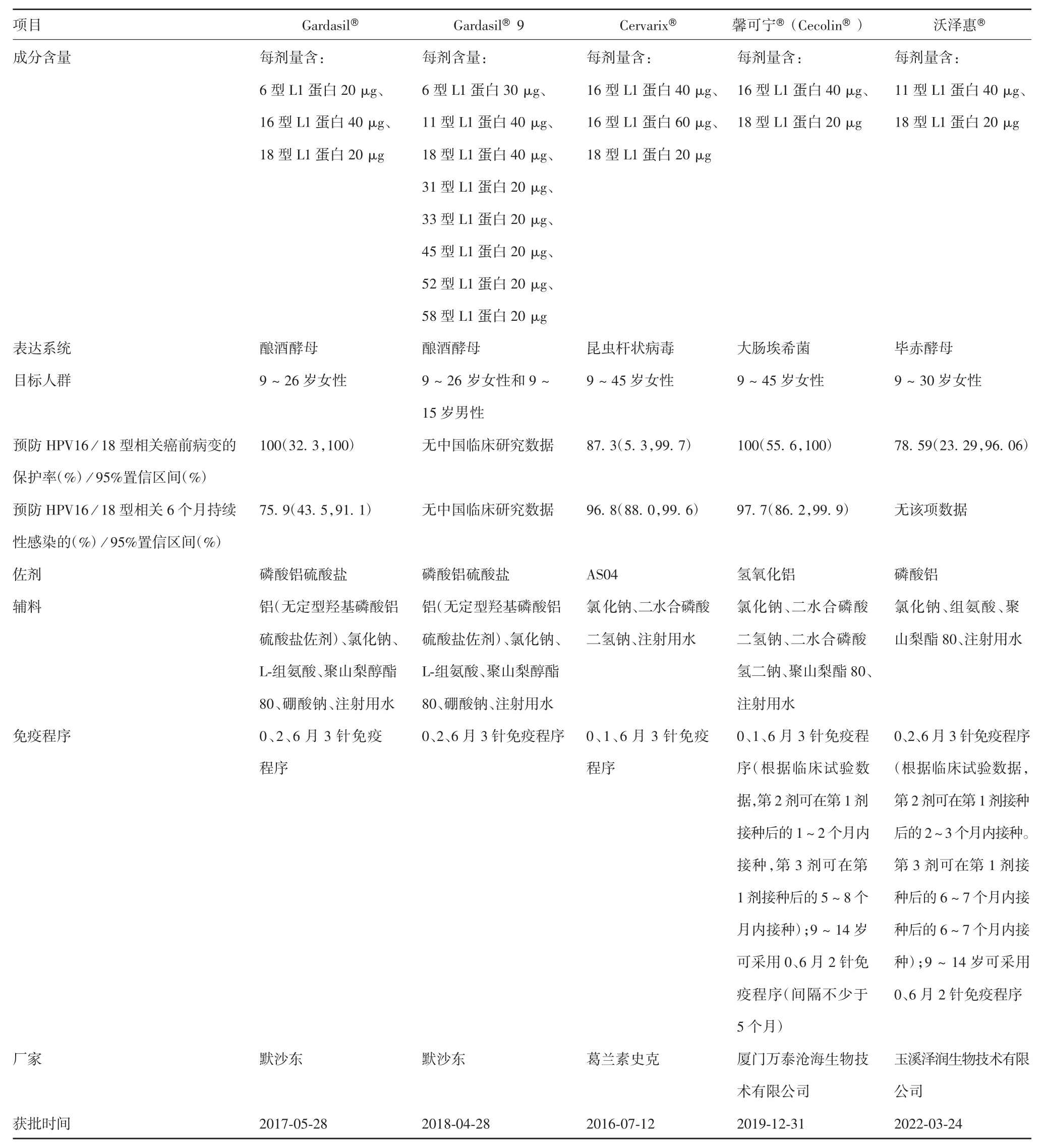
表2 全球已上市的5 种HPV 疫苗的特点Tab.2 Characteristics of five kinds of HPV vaccines licensed for use in the world

表3 HPV 疫苗不同表达系统优缺点对比Tab.3 Comparison of advantages and disadvantages of different expression systems of HPV vaccine
2019 年发布的首个中国国产二价HPV 疫苗(馨可宁®)为中国及其他发展中国家的全国性HPV疫苗接种规划带来了希望。尽管进口疫苗,如二价疫苗Cervarix®、四价疫苗Gardasil®和九价疫苗Gardasil®9 自2016 年以来已在中国获得许可,但这些疫苗价格昂贵且供应有限,主要由18 ~ 45 岁妇女购买,而9 ~ 14 岁女性大部分仍未接种疫苗。新疫苗馨可宁®每剂售价约为Cervarix®价格的1 / 2,却与Cervarix®疗效相似。馨可宁®因其免疫原性已被证明非劣效于3 剂接种方案被批准用于9 ~ 14岁女孩的2 剂接种计划。Gardasil®、Cervarix®、馨可宁®、沃泽惠®4 种疫苗预防HPV16 / 18 型相关癌前病变的保护率(95%置信区间)分别为100%(32.3%,100%)、87.3%(5.3%,99.7%)、100%(32.3%,100%)和78.59%(23.29%,96.06%)。Gardasil®、Cervarix®和馨可宁®3 种疫苗预防HPV16 / 18 型相关6 个月持续性感染的保护率(95%置信区间)分别为75.9%(43.5%,91.1%)、96.8%(88.0%,99.6%)、97.7%(86.2%,99.9%),表明馨可宁®的2 个关键性保护性数据均高于或等于其他HPV 疫苗。馨可宁®和沃泽惠®对于9 ~ 14 岁女性可采用2 剂次接种,但馨可宁®采用原核表达系统,生产成本更低,产量更高,很好地解决了进口疫苗昂贵且供应有限的问题。
2.2处在临床阶段的HPV 疫苗
目前除已上市的5 款HPV 疫苗外,国内外许多HPV 疫苗也已进入临床试验阶段。其中,国内疫苗以基于L1 的重组多价HPV 疫苗为主,包含二价、三价、四价、九价、十一价、十四价、十五价等不同价数,目前已有多种疫苗进入Ⅲ期临床阶段,除此之外,还有2 种治疗性疫苗进入Ⅰ期临床阶段。而国外临床阶段的疫苗以治疗性疫苗为主,针对宫颈癌、头颈癌、口咽癌等多种HPV 导致的实体癌症进行治疗,目前多处于Ⅰ和Ⅱ期临床阶段,仅2 种疫苗进入Ⅲ期临床。
2.2.1国内临床阶段HPV 疫苗现状 目前国内处于临床阶段的疫苗可分为预防性和治疗性疫苗2类,预防性疫苗占多数,其中基于L1 的重组多价HPV 疫苗共15 种。处于Ⅲ期临床阶段的疫苗共8种,其中包含九价疫苗5 种。另外,2022 年3 月31日,国药集团HPV 十一价疫苗进入Ⅲ期临床阶段,也成为第1 种进入Ⅲ期临床阶段的价数高于九价的疫苗。多价重组HPV 疫苗采用的表达系统包括汉逊酵母、毕赤酵母、大肠埃希菌和昆虫细胞,其中汉逊酵母表达的疫苗共8 种,毕赤酵母表达的疫苗共2 种,大肠埃希菌表达的疫苗共4 种,昆虫细胞表达的疫苗为1 种。除此之外,还有2 种治疗性疫苗进入Ⅰ期临床阶段,分别为治疗用HPV16 型重组腺病毒载体疫苗和靶向HPV16 / 18 E6 / E7 蛋白的治疗性树突状细胞疫苗。见表4。

表4 国内临床阶段HPV 疫苗汇总Tab.4 Summary of HPV vaccines at clinical stages in China
2.2.2国外临床阶段HPV 疫苗现状 相比于国内多家公司大力研制的预防性HPV 疫苗,国外处于临床阶段的疫苗则以治疗性疫苗为主。其中AAVLPHPV 和PANHPVAX 2 种预防性疫苗均基于HPV L2 研发,而治疗性疫苗则多基于HPV E6 和E7 蛋白研发,也有少数针对E2 蛋白。根据疫苗类型可分为以下4 类:蛋白和多肽疫苗、重组载体疫苗、核酸疫苗、树突状细胞疫苗。其中以核酸疫苗为主,其中多数为DNA 疫苗。DNA 疫苗与诱导产生特异性中和抗体的预防性疫苗不同,针对HPV 诱导的恶性肿瘤的治疗性DNA 疫苗通常编码不同HPV 抗原,通过诱导细胞介导的免疫反应来消除持续性感染患者体内HPV 感染或转化的细胞[33]。蛋白和多肽疫苗主要通过E6 和E7 的合成肽段来诱导细胞介导的免疫反应,与DNA 疫苗相比免疫原性较强,但对细胞毒性更大。重组载体疫苗通过将目的蛋白肽段构建至载体蛋白上并通过载体蛋白对目的蛋白进行运输和展示,可显著提高免疫原性,但安全性相对较低。树突状细胞疫苗通过导入树突状细胞的靶抗原基因在细胞内表达并呈递至细胞表面,激发CD4+、CD8+细胞反应,利用患者自身免疫系统的潜力来消除肿瘤细胞[34]。目前治疗性疫苗多处于Ⅰ和Ⅱ期临床阶段,但临床难以达到较好治疗效果,仅VGX-3100 和MVA-E2 2 种疫苗进入Ⅲ期临床。VGX-300 是 针 对HPV16 / 18 的E6 和E7 设 计 的DNA 疫苗,在VGX-3100 的临床试验中,91%患者在治疗完成后18 个月的评估中有效消除了HPV DNA[35]。MVA-E2 是用改良型痘苗病毒安卡拉株作为载体的递送E2 蛋白的重组载体疫苗,其临床结果表明,接受MVA-E2 治疗的患者中有89.3%可有效消除HPV DNA[36]。虽然2 种治疗性疫苗均拥有不错的治疗效果,但想要成功上市仍面临一些问题,特别是对于治疗晚期HPV 阳性的癌症,虽然在许多临床试验中疫苗对部分患者可达到某种程度的效果,但有效果患者与无效果患者之间的潜在差异仍未解决[37]。在解决这些问题后,HPV 治疗性疫苗最终可成功上市,并为HPV 阳性癌症患者带来希望。见表5。

表5 国外临床阶段HPV 疫苗汇总Tab.5 Summary of HPV vaccines at clinical stages abroad
3 HPV 疫苗研究前景
目前已经上市的HPV 预防性疫苗面临的最大问题是保护型别有限且跨型别交叉保护效果差,因此,想要获得对更多HPV 型别的保护效果,就必须增加抗原种类,但增加抗原种类就意味着更高的免疫剂量,也会带来更多的不良反应及风险。之前疫苗的临床数据可以看出,与默克四价疫苗(846 / 1 000人)相比,接种默克九价疫苗的志愿者产生局部不良反应(905 / 1 000 人)人数更多[38],提示HPV 疫苗的研发不能一味通过增加抗原种类来提高价数,而应该从免疫原入手,设计出能够“以一防多”的交叉抗原,或打破传统预防性疫苗均以L1 作为免疫原的思路,使用具有更广谱性的L2 蛋白作为免疫原,最终实现HPV 预防性疫苗的跨型别保护,为通用疫苗的设计提供更多可能性。
与预防性疫苗不同,对于治疗性疫苗来说,在清除已感染细胞时,细胞免疫比体液免疫发挥了更重要的作用,HPV 感染后机体对感染细胞的自发清除过程与强烈的细胞介导的免疫反应相关,主要涉及免疫细胞包括表达CD4+和CD8+的Ⅰ型辅助性T 细胞和细胞毒性T 淋巴细胞(cytotoxic lymphocyte,CTL)等[39]。理想的治疗性疫苗策略是靶向诱发癌症的HPV E6 / E7 蛋白,诱导机体产生强烈的肿瘤特异性Ⅰ型T 细胞反应并通过CTL 对受感染细胞进行消除。但治疗性疫苗目前也面临着许的问题,如个体差异大、抗原性弱、安全性低、成本高等,由于不同种类疫苗的差异和优劣势各不相同,多种免疫原或药物的联合治疗可能是解决这些问题的关键。目前也有多项临床试验结合不同免疫原及药物进行了尝试,同时一些新型免疫原的设计以及表达系统的优化也均为解决上述问题提供了思路。
3.1HPV 疫苗的新型研发策略
3.1.1预防性HPV 疫苗的新型研发策略 目前市面上保护范围最广的HPV 预防性疫苗是默克公司的Gardasil®9,在全球范围内对宫颈癌的保护率为89.9%,但仍有许多可能导致宫颈癌的高危型别不在其保护范围内,且HPV 不同型别在不同国家和地区也呈现不同的流行情况,如在非洲HPV35 的流行率排名第5,在欧洲流行率排名第6,占比分别为3.4%和1.4%,但其并不在九价疫苗的保护范围内,这也导致Gardasil®9 在一些国家和地区保护效果降低,如在澳大利亚,Gardasil®9 对宫颈癌的保护率仅为86.5%,显著低于平均水平[40]。
为了提高疫苗价数,增强保护率,急需解决HPV型别间无法诱导产生交叉中和抗体的问题。厦门大学研究团队于2017 年的研究指出[41],HPV58 和HPV59 的环区上存在一些关键的氨基酸位点,将这些位点进行突变会降低型特异性中和抗体结合能力,而将这些特定表位移植至其他近缘HPV L1 环区后,HPV 的VLP 可与上述型特异性抗体发生结合,即特定的关键表位氨基酸移植可在近缘型别之间构建出新的免疫表位,实现单个VLP 的跨性别保护,也为在不增加抗原种类的条件下增加疫苗保护率提供了可能。
随后厦门大学研究团队于2018 年的进一步研究指出[42],为实现“以一防多”的新型疫苗设计,将18 种常见高危型别以及2 种低危型别HPV 根据进化亲缘关系的远近分成了7 组,希望通过特定表位移植的方式让1 个抗原可以刺激产生2 或3 种型别HPV 的中和抗体。首先对HPV33 / 52 / 58 这组分子进行探索,以3 种型别野生型L1 为骨架,将其余2个型别分别选择1 个不同的环区对骨架环区进行替换,构建环区移植的嵌合VLP,其中HPV58-33BC-52HI 这个嵌合分子在小鼠及食蟹猴模型中均可诱导出与野生型VLP 混合免疫组相当水平的中和抗体。这一研究结果为开发新一代HPV 预防性疫苗提供了方向,运用嵌合VLP 的策略,可通过构建7组嵌合VLP 分子免疫产生对于20 个型别的中和抗体水平,可在抗原种类低于Gardasil®9 的情况下,对宫颈癌的保护率提高至99%。
为进一步提高单个HPV VLP 的保护范围,厦门大学又开展了杂合体研究[43],研究指出,HPV L1 五聚体形成VLP 是通过175 和428 位半胱氨酸形成的二硫键,在突变HPV L1 的175 或428 位点后,L1五聚体无法组装形成VLP,当2 种不同型别五聚体分别突变这2 个位点后再进行组装,便可形成包含2 种不同型别五聚体的杂合VLP,免疫杂合VLP 可诱导产生杂合五聚体对应型别的抗体,这一设计思路理论上最多可将72 种不同型别的五聚体杂合至同一VLP 颗粒上,达到“以一防多”的目的。若是将嵌合与杂合策略进行结合,便可进一步提高单一免疫原的保护范围,为设计更广泛保护的疫苗提供了设计思路。
与L1 不同,L2 蛋白N-末端表位可诱导产生广泛的交叉中和保护性抗体,是非常有潜力的HPV 疫苗候选分子,但单独使用L2 蛋白或肽段进行免疫产生的抗体滴度相对较低,无法保护机体免受HPV 感染。为解决这一问题,提高L2 的免疫原性呈递,研究者们尝试了许多方法,如HPV VLP 呈递、非HPV VLP 呈递、多联肽纳米颗粒呈递、融合免疫刺激剂等。SCHELLENBACHER 等[44]的研究表明,将HPV16 L2 RG1 表位(aa 17~36)插入HPV 16 L1 的DE 环中,构建的RG1-VLP 分子可在不影响诱导产生HPV16高滴度中和抗体的情况下,诱导针对HPV18 / 31 /33/45/52/58/26/70 的强交叉中和效价。YADAV等[45]和ZHAI 等[46]借助噬菌体MS2 VLP-L2 颗粒为载体,将L2 肽段插入载体构建颗粒化重组抗原,并将MS2-31L2(20-31)16L2(17-31)VLP 和MS2-L2(69-86)VLP 进行混合免疫,混合的MS2-L2 VLP 中和保护小鼠免受与约87% 宫颈癌相关的6 种HPV类型感染。JAGU 等[47]在细菌中高水平表达了一种多聚体蛋白(11-88x8),其融合了8 种多肽,对应以下8 个型别的L2 残基:HPV6、HPV16、HPV18、HPV31、HPV39、HPV5、HPV56 和HPV73,在免疫兔抗血清中,发现了对HPV18 的中和效果,这也为更广谱的交叉保护带来了思路。综上所述,颗粒化载体展示和多肽融合的策略均能有助于提高L2 的免疫原性,且L2 的保守性会刺激产生具有交叉保护效果的中和抗体,与基于L1 的预防性疫苗相比,基于L2 的疫苗通常是单价的,因此更利于生产,成本也会更低,相信在能够解决稳定性、免疫原性和个体差异问题后,基于L2 的疫苗会成为推动全球疫苗接种的关键一环。
3.1.2治疗性HPV 疫苗的新型研发策略 与HPV预防性疫苗依赖体液免疫产生高滴度中和抗体不同,HPV 的治疗性疫苗针对的是由HPV 感染所导致的宫颈癌、肛门癌、头颈癌、口腔癌等实体癌,通过刺激机体细胞免疫来消灭病变细胞。其中的关键是将E6 和E7 的抗原高特异性地附着在组织相容性复合MHC 分子上,与抗原特异性T 细胞受体相互作用后,引发细胞介导的免疫反应[48]。无论是蛋白和多肽疫苗、重组载体疫苗、核酸疫苗还是树突状细胞疫苗,均面临免疫原性弱,个体差异性大等问题。目前较好的解决方案是将疫苗与手术、化学疗法、放射性疗法等其他疗法一同使用进行联合治疗,在临床阶段的研究中,也有将免疫激活性单抗药物以及多种抗原联合使用的策略,这也提示多种抗原及药物的联合治疗可能是解决免疫原性的最佳方案。
值得一提的是,目前免疫相关的机制研究尚未处于完全成熟阶段,因此很多时候无法对抗原设计和呈递提供很好的指导性意见,随着免疫学发展,对免疫机制的更深入了解,会为提高抗原免疫原性及抗原递呈效率提供更多思路,同时为疫苗设计提供更多、更成熟的新型策略。也希望治疗性疫苗能够早日上市,为已感染HPV 的患者带来福音。
3.2疫苗佐剂的研究 佐剂是疫苗中不可或缺的成分,有提高疫苗免疫原性、稳定性的作用。目前Gardasil®9 疫苗采用的AS04 佐剂包含氢氧化铝和单磷酰脂质A(3-O-desacyl-4’-monophosphoryl lipid A,MPL),与仅用明矾佐剂的相同抗原相比,诱导了更高水平的抗体,这依赖于AS04 激活Toll 样受体4(Toll-like receptor 4,TLR4)[49]。同时,对于HPV 疫苗新型佐剂的探索也从未止步,LABIANO 等[50]的研究探讨了激动剂CD40 抗体作为佐剂用于癌症治疗的效果。激动性CD40 mAb 的初步临床试验表明,其在无致残毒性的情况下具有临床活性,具有作为疫苗佐剂的潜力。另一类潜在的佐剂是干扰素基因蛋白刺激剂(stimulator of interferon gene,STING)激动剂。STING 是一种位于内质网中的跨膜蛋白,其激活会触发对细胞内DNA 的Ⅰ型干扰素反应[51]。环状二核苷酸(cyclic dinucleotide,CDN)是普遍存在的小分子第2 信使,由细菌合成,可调节多种过程,是一类相对较新的佐剂,已被证明可提高疫苗效力。CDN 通过直接结合内质网驻留受体STING 激活先天免疫,激活诱导干扰素β(IFNβ)和核因子-κB(NF-κB)表达的信号通路炎性细胞因子[52],从而达到提高免疫反应的效果,也是具有潜力的新型佐剂。除此之外,还有很多能够刺激人体免疫途径的小分子药物正在被尝试用作疫苗佐剂,安全性和毒性评估对于佐剂的研究也至关重要,只有在具有良好的有效性和安全性的条件下,新型佐剂才有可能用于疫苗中。
4 总结与展望
目前虽然已经上市了5 种HPV 预防性疫苗,并且有数十种预防性和治疗性疫苗正在进行临床试验,但HPV 预防性疫苗面临的最大问题仍未解决,即广谱通用预防性疫苗的研制。为了解决这个问题,科研人员通过多种策略来进行探索,包括优化免疫原、优化佐剂、联合药物治疗等方式,相信很快就可研发出更高效的预防性疫苗。同时,治疗性疫苗的研究也取得了一定的进展,对于已经感染HPV并出现实体瘤的患者,随着免疫学的不断发展,免疫机制的不断完善,会有更多的治疗性疫苗方案以及更多的个性化治疗策略来帮助患者摆脱癌症困扰。WHO 于2020 年11 月17 日发布《加速消除宫颈癌全球战略》,全球194 个国家首次承诺消除一种癌症。战略设定2030 年HPV 疫苗接种覆盖率达90%、筛查覆盖率达70%以及宫颈癌前病变和宫颈癌治疗可及性达90%。在全体科研工作者的努力下,宫颈癌将成为人类历史上第一个可以消灭的癌症。
