湿法合成高致密碱式碳酸钴粉末及Co(Ⅱ)-NH3-CO32−-H2O体系热力学分析
2022-07-18徐伟夏捷张克军胡斌柏德鸿贺凯袁铁锤李瑞迪
徐伟,夏捷, ,张克军,胡斌,柏德鸿,贺凯,袁铁锤,李瑞迪
湿法合成高致密碱式碳酸钴粉末及Co(Ⅱ)-NH3-CO32−-H2O体系热力学分析
徐伟1,夏捷1, 2,张克军1,胡斌1,柏德鸿1,贺凯1,袁铁锤2,李瑞迪2
(1. 衢州华友钴新材料有限公司,衢州 324000;2. 中南大学 粉末冶金研究院,长沙 410083)
以CoCl2和4种工业常用沉淀剂NaHCO3、Na2CO3、NH4HCO3和(NH4)2CO3为原料,湿法制备碱式碳酸钴粉末,用激光粒度仪、扫描电镜、X射线衍射仪、振实密度仪等,研究溶液pH值和NH3浓度对碱式碳酸钴粉末粒径、微观形貌和晶体结构与密度的影响,并进行Co(II)-NH3-Co32−-H2O体系热力学分析。结果表明:溶液pH值和NH3浓度可对钴离子的络合、沉淀行为产生影响。基于络合沉淀过程,用NH4HCO3和(NH4)2CO3沉淀剂制备的碱式碳酸钴粉末振实密度较高。基于同时平衡和质量守恒原理,绘制不同溶液组成下lg[Co]total对pH的热力学图,进一步研究溶液pH值对沉淀过程的影响。结果表明,pH为6~8时,钴离子的沉淀率均达到90%以上。在Na2CO3和NaHCO3为沉淀剂的反应体系中,瞬态下游离Co2+占主导地位,接触沉淀剂后快速沉淀,形成松散的絮凝碱式碳酸钴粉末;而在(NH4)2CO3和NH4HCO3两种沉淀剂体系中,Co2+与氨配位,Co2+的沉淀过程伴随着从多配位Co(NH3)2+(=1, 2, …, 6)中释放Co2+而缓慢进行,从而形成致密的碱式碳酸钴粉末。
碳酸钴;沉淀;钴氨配位;热力学平衡;振实密度
微米/亚微米级四氧化三钴(Co3O4)和单质钴(Co)粉末是重要的基础材料,广泛应用于催化剂[1]、储能材料[2−3]、硬质合金[4]等领域。在应用中,Co3O4和Co粉末的致密度、化学成分、形状/形貌、粒度等特性会影响最终产品的性能,因此对粉末的以上特性进行调控具有重要意义[4−6]。通常微米/亚微米级金属氧化物/单质粉末是先将金属离子湿法沉淀,然后分别在氧化/还原气体氛围中通过干燥和煅烧制得[7−10]。相对干燥和煅烧阶段,湿法沉淀阶段由于条件温和、传质便捷等特点,更容易实现对粉末性质的调节。湿法沉淀反应体系通常可以采用热力学理论计算进行合理设计,以获得理想的反应产物。如何利华等[11]针对室温下湿法制备LiFePO4的Li-Fe(II)-P-H2O体系进行热力学分析,然后采用溶液法制备LiNi0.5Co0.2Mn0.3O2复合物;姚永林等[12]通过构建Ni2+-C2H8N2-C2O42−-H2O体系的沉淀−配位模型,合理设计反应体系,制备出微米级镍纤维;李运姣等[13]首先绘制Li-Ni-Co-Mn-H2O体系电位-pH图,进一步湿法制备出LiNi0.5Co0.2Mn0.3O2复合氧化物。目前对于钴离子沉淀反应体系的研究较少,苏继桃等[14]对M2+(Ni2+,Co2+,Mn2+)-NH3- CO32−-H2O体系进行热力学分析,绘制该体系的lg(M2+)−pH关系图,并以NH4Cl为配位剂,以Na2CO3为沉淀剂,采用共沉淀法制备出可用于锂离子电池正极材料的镍、钴、锰复合碳酸盐,共沉淀的最佳pH值为8.0左右。工业应用中,钴离子沉淀剂的选择需要满足工艺设计要求(如沉淀率),同时应具有成本低、纯度高的优点,(NH4)2CO3、NH4HCO3、Na2CO3、NaHCO3被广泛用作钴离子沉淀剂。本文作者分别采用CoCl2和该4种沉淀剂为原料制备碱式碳酸钴粉末,并对Co(Ⅱ)-NH3- CO32−-H2O体系进行热力学分析。基于实验研究和理论分析,加深对不同沉淀体系下制备碱式碳酸钴粉体材料过程的理解,通过设计不同反应体系来控制Co2+沉淀过程,进而调控碱式碳酸钴粉末的性质,研究结果对于制备高致密的碱式碳酸钴粉末,进而获得高致密的Co3O4和单质钴粉具有指导意义。
1 实验
1.1 碱式碳酸钴粉末的制备
所用原料包括六水氯化钴(CoCl2·6H2O)、碳酸氢钠(NaHCO3)、碳酸钠(Na2CO3)、碳酸氢铵(NH4HCO3)和碳酸铵((NH4)2CO3),均由上海阿拉丁生化科技股份有限公司生产的分析纯粉末。
分别取7 L浓度均为0.2 mol/L的NaHCO3、Na2CO3、NH4HCO3、(NH4)2CO3溶液作为底液,倒入50 L推进式搅拌玻璃反应釜中,室温下以300 r/min转速搅拌,同时以5 mL/min速度向底液中加入浓度为2 mol/L的氯化钴溶液,持续投料2 h,投料结束后继续搅拌2 h。将反应后的溶液抽滤洗涤3次,50 ℃烘干,用玛瑙研钵磨细,得到碱式碳酸钴粉末。所有溶液均使用蒸馏水制备,并通过过滤去除溶液中的不溶性杂质。图1所示为采用不同沉淀剂的反应过程中溶液pH值变化,由图可知反应溶液的初始pH值为Na2CO3体系>(NH4)2CO3体系>NH4HCO3体系>NaHCO3体系,反应过程中体系的pH值总体亦是如此。所有体系的pH值均大于7。

图1 采用不同沉淀剂的反应过程中溶液pH值变化
1.2 组织与性能表征
用激光粒度仪(MASTERSIZER 3000,英国)测定碱式碳酸钴粉末的粒径,用扫描电镜(SEM) (JEOL-5600LV,日本)观察粉末的微观形貌,用X射线衍射仪(XRD)(3014Z,日本)对粉末的晶体结构进行表征。用振实密度测定仪(FZS4-4B,宁波海曙瑞柯仪器有限公司)测粉末的振实密度(tap density, TD),用全自动比表面积仪(3H-2000A,贝士德仪器科技(北京)有限公司)测定粉末的比表面积(specific surface area, SSA)。
2 结果与讨论
2.1 理化性质
图2所示和表1所列为分别采用NaHCO3、Na2CO3、NH4HCO3和(NH4)2CO3作为沉淀剂制备的碱式碳酸钴粉末的粒度分布。由图2和表1可知粉末粒径分布呈现宽/窄粒径分布两种模式,结合图2(a)和(c)发现,在较低pH值的反应体系下,即采用NaHCO3和NH4HCO3作为沉淀剂,更有利于得到粒径分布较窄的沉淀产物。值得注意的是,不同反应体系下,产物粒径分布均延伸至1 μm以下,表明碱式碳酸钴粉末是通过一次粒子逐步堆积生长为更大粒子,这一结果与图3高倍SEM图像中粒子的多级堆积形态相符。
图3所示为采用不同沉淀剂制备碱式碳酸钴粉末的SEM照片,表2所列为粉末的振实密度和比表面积。从图3可见,用NaHCO3制备的粉末比用NH4HCO3和(NH4)2CO3制备的粉末堆积更疏松,二次团聚体、三次团聚体尺寸明显更大。用NaHCO3、NH4HCO3和(NH4)2CO3制备粉末的振实密度分别为0.35、1.20和1.28 g/cm3,与SEM观察结果一致。此外,用NaHCO3体系制得的粉末比表面积较大,其他3种粉末的比表面积较接近。

图2 不同沉淀剂制备碱式碳酸钴粉末的粒径分布
(a) NaHCO3; (b) Na2CO3; (c) NH4HCO3; (d) (NH4)2CO3
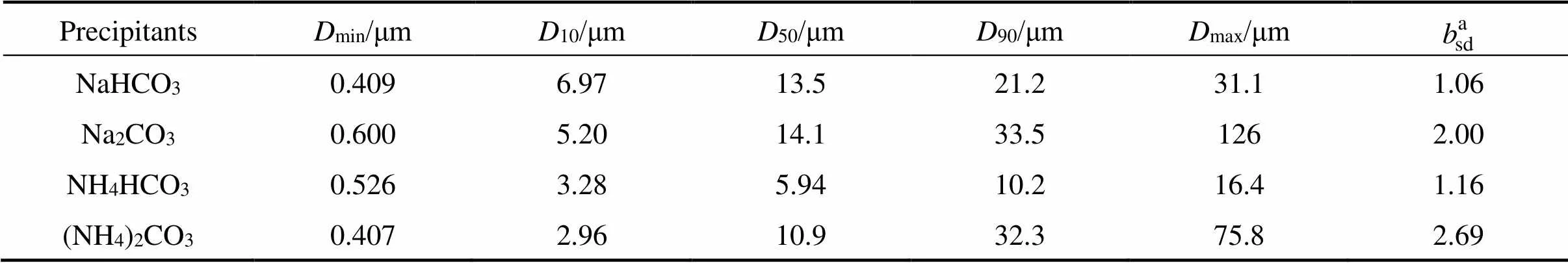
表1 不同沉淀剂制备碱式碳酸钴粉末的粒径统计
a:sdis breadth of size distribution,sd=(90−10)/50.

图3 不同沉淀剂制备碱式碳酸钴粉末的SEM照片
(a), (b), (c), (d) NaHCO3; (e), (f), (g), (h) Na2CO3; (i), (j), (k), (l) NH4HCO3; (m), (n), (o), (p) (NH4)2CO3

表2 不同沉淀剂制备碱式碳酸钴粉末的振实密度和比表面积
图4所示为采用不同沉淀剂制备的碱式碳酸钴粉末的XRD谱。由图4可知,由于反应体系浓度较大,反应时间较短,产物晶体发育时间较短,因此结晶度较低;4种粉末的成分均为碱式碳酸钴/碳酸钴。值得注意的是,用Na2CO3制备的粉末位于约39°处的衍射峰明显较强,表明其组成中碱式碳酸钴与碳酸钴的含量比与其他3种粉末存在差异。
2.2 反应体系热力学分析
为了研究湿法制备碱式碳酸钴粉末的形成机理,针对Co(Ⅱ)-NH3-CO32−-H2O合成体系进行热力学分析。该体系中发生的化学反应主要包括Co2+与氨的配位[15]、Co2+与CO32−的反应[14]、Co2+的水解以及弱酸和弱碱的分解[16−17]。考虑到溶液中的沉淀过程,环境变量如温度、压力通常为常数,因此,绘制不同溶液组成下lg[Co]total与pH的关系曲线。从实验部分和图1可知,投料和反应时间一共4 h,反应过程中溶液pH值在7~11范围内逐渐减小,这里绘制lg[Co]total−pH曲线进行热力学分析时适当拓宽pH值范围至5~14。
根据合成体系中各反应的平衡常数,基于同时平衡与质量守恒原理[18],则有:
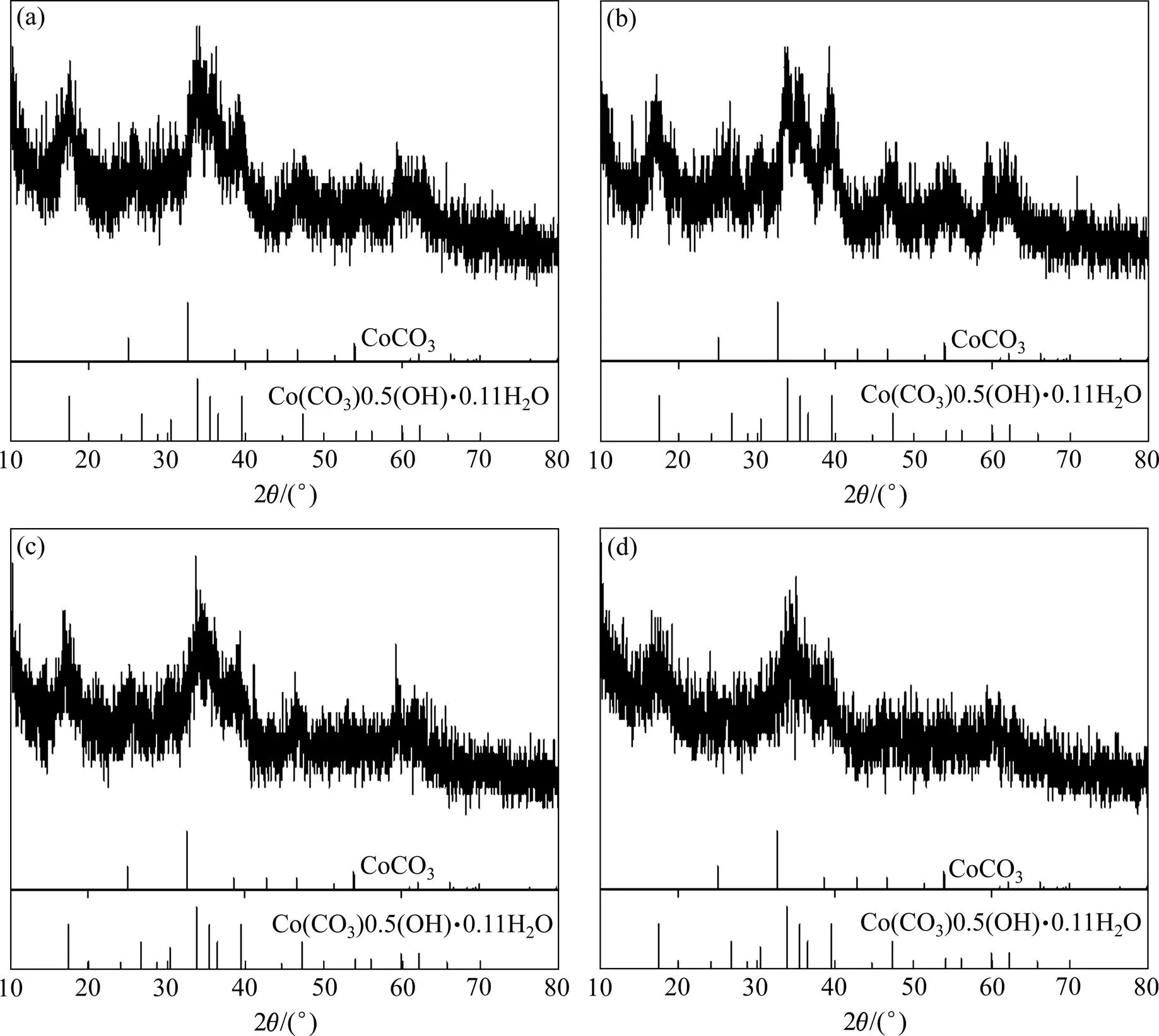
图4 不同沉淀剂制备碱式碳酸钴粉末的XRD谱
(a) NaHCO3; (b) Na2CO3; (c) NH4HCO3;(d) (NH4)2CO3
[Co2+]=min{[Co2+]=sp(CoCO3(s))/[CO32−],
sp(Co(OH)2(s))×1028-2pH} (1)

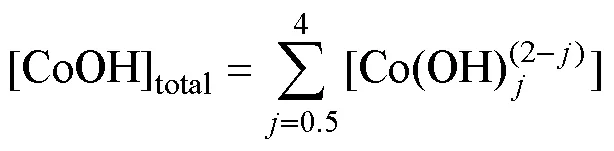
考虑到溶液体系中Co2+分别与氨和OH−配位
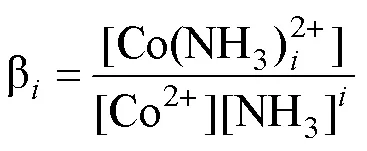

式中:=1, 2, 3, 4, 5, 6;=0.5, 1, 2, 3, 4。进一步推导出各反应体系下lg[Co]T对pH的数学模型,即:
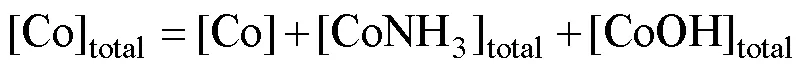
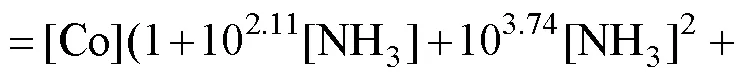
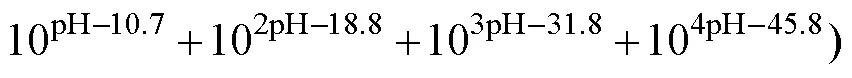
对于一定的总碳浓度[C]total和总氮浓度[N]total,可通过牛顿迭代法(Newton iteration)确定[NH3][19],用式(4)计算出一定pH值下的[CO32−]和[Co2+]。在浓度分别为0.001、0.005、0.010、0.050、0.100、0.500、1.000、2.000、3.000、4.000和5.000 mol/L的NaHCO3溶液中,[C]total与[NaHCO3]的浓度相同,[N]total均为0 mol/L,按上述过程分别计算出不同pH值下的lg[Co]total,由此绘制不同浓度NaHCO3溶液的lg[Co]total−pH关系曲线。同样地,绘制不同浓度的(Na2CO3、NH4HCO3、(NH4)2CO3)溶液的lg[Co]total−pH曲线图,如图5所示。
2.3 溶液状态对离子行为影响分析
首先分析不同沉淀体系下,不同浓度溶液中的钴物种(包括钴离子、钴氨络离子、钴羟基络离子)的总浓度[Co]total。从图5(a)和(b)看出,在pH为5~10范围内,随溶液pH值升高、NaHCO3和Na2CO3的浓度增加,[Co]total逐渐减小,在pH为10~14范围内,随溶液pH值升高,[Co]total稍有增大,但[Co]total不随NaHCO3和Na2CO3浓度变化而变化。图5(c)和(d)中曲线包含两种形状,当NH4HCO3和(NH4)2CO3浓度较低(0.001~0.100 mol/ L)时,曲线的形状与图5(a)和(b)类似,当NH4HCO3和(NH4)2CO3浓度较高(0.500~5.000 mol/L)时,曲线由两段抛物线组成,显示随溶液的pH值增大,[Co]total先降至最小值,然后升至最大值,随后又逐渐减小。由图5可知,不同沉淀剂浓度(>0.100 mol/L)的体系中,当溶液pH为6~8时,钴离子的沉淀率均达到90%以上(钴离子初始浓度为2 mol/L),但当NH4HCO3溶液pH值为9~11、(NH4)2CO3溶液pH值为8~12时,钴离子的沉淀率不到90%,因此单纯考虑沉钴效率时,选择pH值为6~8。
图5(a)和(b)跟图5(c)和(d)中的lg[Co]total−pH曲线形状存在明显差异,可认为是体系中氨的存在造成的。以图5(c)中[NH4HCO3]=2.000 mol/L下的lg[Co]total−pH曲线为例,当pH<7.0时,游离氨浓度较低,且钴以游离Co2+形式存在;随pH增加,游离Co2+随反应的发生而减少,从而导致溶液中[Co]total降低。当7.0<pH<9.0时,溶液中游离氨浓度增加,形成更多的钴氨配位物,因此[Co]total随pH值升高而升高。当9.0<pH<13.0时,由于碱性物质的强破坏能力,随pH值升高,钴氨配位物逐渐分解,溶液中的钴以Co(OH)2和碱式碳酸钴的形式沉淀,导致[Co]total降低。当pH>13.0时,OH−与Co2+的配位增强,因此一些沉淀物重新溶解,从而增加溶液中钴物种的浓度。此外,从图5(c)和(d)还发现,随溶液中总氨浓度增加,稳定钴物种的pH值范围变得更宽。这表明通过降低溶液pH值或加热溶液,可使钴离子与氨、氢氧根的配位平衡被打破,络合平衡向释放钴离子的方向移动,钴离子与氢氧根、碳酸根离子结合,生成氢氧化钴与碳酸钴晶核,直至产生新的平衡为止,从而实现对沉淀过程的干预和调控。

图5 4种反应溶液在不同沉淀剂浓度下的lg[Co]total−pH曲线(T=298 K)
(a) NaHCO3; (b) Na2CO3;(c) NH4HCO3; (d) (NH4)2CO3
进一步对不同沉淀剂溶液中的钴物种组成进行热力学分析。图6所示为各反应体系中沉淀剂浓度为0.200 mol/L下各钴物种和钴氨物种的浓度()与pH值关系曲线,即lg−pH曲线。图6(a)和(b)中,当pH<8.5时,溶液中的游离Co2+是主要的钴物种,pH>8.5时,钴羟基配位物是钴的主要存在形式。图6(c)和(d)中当pH<7.0时,溶液中的游离Co2+是主要的钴物种,而pH>7.0时,钴氨配位物是钴的主要存在形式。图6(e)和(f)进一步表明,当pH<7.5时,Co(NH3)2+为主要钴物种;当7.5<pH<14.0时,Co(NH3)2+(=2~6)为主要的钴物种。

图6 沉淀剂浓度为0.200 mol/L的4种反应溶液中各物种浓度与pH值关系曲线(lg c−pH曲线) (T=298 K)
(a), (b), (c), (d) lg-pH curves of cobalt specie in NaHCO3, Na2CO3, NH4HCO3and (NH4)2CO3solutions; (e), (f) lg-pH curves of cobalt ammonium species in NH4HCO3and (NH4)2CO3solutions
基于热力学理论分析,在Na2CO3和NaHCO3体系中,瞬态下游离Co2+占主导地位,接触沉淀剂后发生快速的直接沉淀;而在(NH4)2CO3和NH4HCO3体系中,由于Co2+与氨配位,因此络合沉淀过程伴随着从多配位Co(NH3)2+(=1, 2, …, 6)中释放Co2+而缓慢进行。结合图3和表2可知,在NaHCO3体系中直接沉淀容易形成松散的絮凝状碱式碳酸钴粉末,在(NH4)2CO3和NH4HCO3体系中络合沉淀有利于形成致密的碱式碳酸钴粉末。由Na2CO3体系制备的沉淀粉末,其SEM形貌和振实密度与热力学理论分析存在差异,推测是由于Na2CO3体系的pH值过高(图1),一方面Co2+与OH—配位效应增强,事实上形成了络合沉淀;另一方面造成产物的物相组成与其他三者差异过大,共同导致其SEM形貌和振实密度与理论分析产生偏差。
3 结论
1) 以CoCl2和4种沉淀剂NaHCO3、Na2CO3、NH4HCO3和(NH4)2CO3制备碱式碳酸钴,其中采用沉淀剂NH4HCO3和(NH4)2CO3制得的粉末振实密度较高。
2) 通过求解Co(Ⅱ)-NH3-CO32−-H2O体系的配位−沉淀平衡模型,从理论上验证了通过向沉淀体系中引入钴氨络离子,可改变溶液组成,进而影响钴离子的沉淀路径,对碱式碳酸钴粉末的性能产生影响。
3) 采用(NH4)2CO3和NH4HCO3沉淀剂基于络合沉淀制得的碱式碳酸钴粉末,其致密度显著高于用NaHCO3沉淀剂基于直接沉淀制得的粉末。
[1] LÜ X W, LIU Y, HAO R, et al. Urchin-like Al-doped Co3O4nanospheres rich in surface oxygen vacancies enable efficient ammonia electrosynthesis[J]. ACS Applied Materials & Interfaces, 2020, 12(15): 17502−17508.
[2] ZHAO S, WEI Z. Shape-controlled Co3O4as advanced electrode materials for high-performance supercapacitor[J]. International Journal of Electrochemical Science, 2019, 14(7): 6276−6282.
[3] PARK J S, CHO J S, KIM J H, et al. Electrochemical properties of micron-sized Co3O4hollow powders consisting of size controlled hollow nanospheres[J]. Journal of Alloys and Compounds, 2016, 689(12): 554−563.
[4] 胡雷, 刘志宏. 四氧化三钴粉末的制备与应用现状[J]. 粉末冶金材料科学与工程, 2008, 13(4): 195−200.
HU Lei, LIU Zhihong. Preparation and application of Co3O4powder[J]. Materials Science and Engineering of Powder Metallurgy, 2008, 13(4): 195−200.
[5] ARDIZZONE S, SPINOLO G, TRASATTI S. The point of zero charge of Co3O4prepared by thermal decomposition of basic cobalt carbonate[J]. Electrochimica Acta, 1995, 40(16): 2683− 2686.
[6] 李艳, 林晨光, 曹瑞军. 超细晶WC-Co硬质合金用纳米钴粉的研究现状与展望[J]. 稀有金属, 2011, 35(3): 451−457.
LI Yan, LIN Chenguang, CAO Ruijun. Research status and prospect of nanometer cobalt powder for ultrafine WC-Co hard alloys[J]. Chinese Journal of Rare Metals, 2011, 35(3): 451−457.
[7] 宇文超, 刘秉国, 彭金辉, 等. 响应曲面法优化碱式碳酸钴煅烧制备Co3O4工艺研究[J]. 矿冶工程, 2021, 41(1): 114−118.
YU Wenchao, LIU Bingguo, PENG Jinhui, et al. Optimization of calcination with basic cobalt carbonate for preparation of Co3O4by response surface methodology[J]. Mining and Metallurgical Engineering, 2021, 41(1): 114−118.
[8] 黄草明, 教光辉, 肖发新, 等. 沉淀法制备微米四氧化三钴试验研究[J]. 湿法冶金, 2019, 38(3): 243−248.
HUANG Caoming, JIAO Guanghui, XIAO Faxin, et al. Preparation of micron cobaltosic oxide by precipitation method [J]. Hydrometallurgy of China, 2019, 38(3): 243−248.
[9] 刘人生, 王丽平, 秦鸣飞, 等. 液相沉淀−煅烧法制备大粒径球形四氧化三钴[J]. 精细化工, 2019, 36(2): 206−211.
LIU Rensheng, WANG Liping, QIN Mingfei, et al. Synthesis of spherical Co3O4with large-sizeliquid phase precipitation- calcination method[J]. Fine Chemicals, 2019, 36(2): 206−211.
[10] 王崇国, 陈卫东. 超细球形钴粉制备[J]. 有色金属工程, 2014, 4(6): 18−20.
WANG Chongguo, CHEN Weidong. Preparation of ultrafine spherical cobalt powder[J]. Nonferrous Metals Engineering, 2014, 4(6): 18−20.
[11] HE L H, ZHAO Z W, LIU X H, et al. Thermodynamics analysis of LiFePO4precipitation from Li-Fe(II)-P-H2O system at 298 K [J]. Transactions of Nonferrous Metals Society of China, 2012, 22(7): 1766−1770.
[12] YAO Y L, ZHANG C F, ZHAN J, et al. Thermodynamics analysis of Ni2+-C2H8N2-C2O42−-H2O system and preparation of Ni microfiber[J]. Transactions of Nonferrous Metals Society of China, 2013, 23(11): 3456−3461.
[13] LI Y J, LI L, SU Q Y, et al. Thermodynamic analysis of Li-Ni-Co-Mn-H2O system and synthesis of LiNi0.5Co0.2Mn0.3O2composite oxide via aqueous process[J]. Journal of Central South University, 2019, 26(10): 2668−2680.
[14] 苏继桃, 苏玉长, 赖智广, 等. 共沉淀法制备镍、钴、锰复合碳酸盐的热力学分析[J]. 硅酸盐学报, 2006, 34(6): 695−698.
SU Jitao, SU Yuchang, LAI Zhiguang, et al. Thermodynamic analysis of preparation of multiple carbonate of Ni, Co and Mn by coprecipitation method[J]. Journal of the Chinese Ceramic Society, 2006, 34(6): 695−698.
[15] 李洪桂, 郑清远, 张启修, 等. 湿法冶金学[M]. 长沙: 中南大学出版社, 2002: 362−364.
LI Honggui, ZHENG Qingyuan, ZHANG Qixiu, et al. Hydrometallurgy[M]. Changsha: Central South University Press, 2002: 362−364.
[16] GUO X Y, HUANG K, ZHANG D M. Preparation of basic nickel carbonate particles in solution system of Ni(Ⅱ)-NH3-CO32−-H2O[J]. Transactions of Nonferrous Metals Society of China, 2004, 14(5): 1006−1011.
[17] 彭忠东, 杨建红, 邹忠, 等. 共沉淀法制备掺杂氧化锌压敏陶瓷粉料热力学分析[J]. 无机材料学报, 1999, 14(5): 733−738.
PENG Zhongdong, YANG Jianhong, ZOU Zhong, et al. Thermodynamic analysis of doped zinc oxide varistor ceramic powders by coprecipitation process[J]. Journal of Inorganic Materials, 1999, 14 (5): 733−738.
[18] 傅崇说. 有色冶金应用基础研究[M]. 北京: 科学出版社, 1993: 18−20.
FU Chongyue. Fundamental Research on Nonferrous Metallurgy Application[M]. Beijing: Science Press, 1993: 18−20.
[19] 李庆扬. 数值分析[M]. 北京: 清华大学出版社, 2008: 222−228.
LI Qingyang. Numerical Analysis[M]. Beijing: Tsinghua University Press, 2008: 222−228.
Wet synthesis of high-density basic cobalt carbonate powder and thermodynamic analysis of Co(Ⅱ)-NH3-CO32--H2O system
XU Wei1, XIA Jie1, 2, ZHANG Kejun1, HU Bin1, BAI Dehong1, HE Kai1, YUAN Tiechui2, LI Ruidi2
(1. Quzhou Huayou Cobalt New Material Co., Ltd., Quzhou 324000, China;2. Powder Metallurgy Research Institute, Central South University, Changsha 410083, China)
CoCl2and four kinds of precipitants commonly used in industry, namely (NH4)2CO3, NH4HCO3, Na2CO3and NaHCO3, were used as raw materials to prepare basic cobalt carbonate by wet synthesis. The as-prepared basic cobalt carbonate were studied by means of lazer particle analyzer, scanning electron microscope, X-ray diffractometer and vibrating densitometer. The effects of solution pH value and NH3concentration on particle size, microscopic morphology, crystal structure and density of basic cobalt carbonate powder were evaluated, and the thermodynamic analysis of Co(II)-NH3-CO32−-H2O system was performed as well. The results show that the pH value and NH3concentration of the solution have a great influence on the complexation and precipitation behavior of cobalt ions. Based on the complexing precipitation process, the tap density of the basic cobalt carbonate solid powders prepared with NH4HCO3and (NH4)2CO3precipitant is higher. Based on the principle of simultaneous equilibrium and mass conservation, the thermodynamic diagram of lg[Co]totalon pH under different solution compositions was drawn, and the effect of solution pH value of different systems on the precipitation process was further studied. The results show that the precipitation rate of cobalt ions is more than 90% when the pH is 6−8. In the Na2CO3and NaHCO3precipitant systems, free Co2+is dominant during the transient, and it precipitates rapidly after contacting the precipitant to form loose flocculated basic cobalt carbonate powders. In the (NH4)2CO3and NH4HCO3precipitant systems, Co2+is coordinated with ammonia, the precipitation process procees slowly with the release of Co2+from multi coordinated Co(NH3)2+(=1, 2,…, 6), results in dense powders.
cobalt carbonate, precipitation; cobalamin coordination; thermodynamic equilibrium; tap density
10.19976/j.cnki.43-1448/TF.2022040
TQ138.12
A
1673-0224(2022)04-310-09
国家自然科学基金资助项目(51874369)
2022−03−24;
2022−05−24
夏捷,工程师,博士。电话:0570-8059025;E-mail: xiaj@huayou.com
(编辑 汤金芝)
