CPNE7在结直肠癌组织中的表达及临床意义△
2022-07-18师鑫鹏罗晓勇
师鑫鹏 李 宾 罗晓勇
(1.郑州大学附属洛阳中心医院放疗科 洛阳 471009;2.河南洛阳市肿瘤临床诊疗研究中心 洛阳 471009)
结直肠癌(CRC) 作为临床常见消化系统恶性肿瘤疾病,其全球发病率居全部恶性肿瘤的第3位,而死亡率排名第2,对人们生存质量造成严重影响。临床上,肿瘤疾病的发生、发展是一个多生物学机制共同参与的复杂过程,涉及表观遗传、基因、蛋白质、转录等多路径的异常改变。而近年来,随着现代分子生物学技术的快速发展及肿瘤病理学机制研究进程的不断推进,在相关基因、细胞因子检测的基础上,探讨其表达水平与肿瘤疾病发生、病情特征及预后的关系,以提高肿瘤疾病临床诊治效果成为临床研究的热点。CPNE7为磷脂结合蛋白 Copine 家族的重要成员,在EMT、细胞分化等过程中发挥重要作用[1]。目前,CPNE7在结直肠癌中的表达及其作用研究少见报道,本研究主要探讨结直肠癌中CPNE7表达及其临床意义,现报道如下。
1 材料与方法
1.1 一般材料
回顾性选择2020年1月-2021年12月期间于我院行外科手术治疗的90例结直肠患者为研究对象。经手术获取结直肠癌组织标本和癌旁正常黏膜组织标本(距离癌组织边缘>5cm),将标本放置液氮中冷冻保存备用。患者病历资料:男58例,女32例;年龄50~68岁,平均年龄(58.45±2.31)岁。病例纳入标准:(1)手术病理检查确诊;(2)本研究方案经患者知悉,且签署知情同意书;(3)原发性病灶。排除标准:(1)术前有肿瘤相关放化疗及免疫治疗史者;(2)合并其他严重疾病者;(3)所收集的病历资料不能满足本研究需求者。
1.2 方法
1.2.1CPNE7表达检测
实验试剂、细胞系及组织样本准备齐全后予以肿瘤细胞培养,培养条件:37℃,5% CO2的湿化培养箱。培养完成后,采用Western blotting免疫印迹法检测标本组织(结直肠癌组织和癌旁组织)和肿瘤细胞系中CPNE7的表达,采用免疫组化检测结直肠癌组织芯片中CPNE7的表达。(1)免疫印迹检测:参照免疫印迹检测程序予以标本组织和肿瘤细胞裂解、提取全蛋白,并予以蛋白浓度测定,孵育后用化学发光法检测印迹。(2)免疫组化:取结直肠癌组织芯片烤片、脱蜡、脱水、修复抗原、孵育、PBS冲洗,滴加一抗、抗兔二抗后再孵育1h,与DAB反应后复染,脱水,二甲苯透明后,中性树胶封片。(3)建立CPNE7稳定过表达株:取CPNE7特异性引物行RT-PCR扩增,获得与CPNE7对应的cDNA,并予以亚克隆,同时建立稳定的细胞系。(4) 划痕及Transwell侵袭实验:将肿瘤细胞接种后予以划痕、培养,后开展侵袭实验,于显微镜下对发生侵袭的细胞数量进行计数。
1.3 观察指标
1.3.1CPNE7在结直肠癌细胞系及组织中的表达
根据免疫印迹检测结果,统计CPNE7在结直肠癌细胞系及组织中的表达。
1.3.2CPNE7在结直肠癌组织芯片中的表达
本组90例患者共取180份组织芯片进行检测。采用公式H-score=Σpi(i+1)计算肿瘤组织CPNE7表达水平,其中i表示着色强度,pi为(阳性细胞数量/切片总细胞数量)×100%。
1.3.3CPNE7表达水平与肿瘤病理特征及预后的关系
根据患者病历资料的收集,统计患者肿瘤病理特征,包括肿瘤分化、浸润、位置、淋巴结转移、TNM分期,并统计患者总生存时间(OS),分析CPNE7表达水平与肿瘤病理特征及预后的关系。
1.4 统计学方法
采用SPSS22.0统计学软件进行数据分析,计数数据记录为百分比[n(%)], 采用χ2检验。采用Kaplane-Meier法分析CPNE7表达水平与患者总生存时间(OS)的关系,log-rank检验。
2 结果
2.1 CPNE7在结直肠癌细胞系及组织中的表达
免疫印迹检测6个结直肠癌细胞株:SW480、 SW620、HT29、LOVO、RKO和HCT116,及正常结直肠上皮细胞株HCoEpiC中CPNE7表达。结果显示,CPNE7在结直肠癌细胞株中的表达明显高于HCoEpiC(图1A)。检测8个结直肠癌组织及对应癌旁正常组织中CPNE7表达水平,结果显示,CPNE7在结直肠癌组织中的表达远高于癌旁正常组织(图1B)。
2.2 CPNE7在结直肠癌组织芯片中的表达
90例患者共180份样本中,共84例(93.33%)患者出现肿瘤组织中CPNE7表达量高于癌旁组织(P<0.05),见图2。同时,H-score计算结果显示:肿瘤组织中CPNE7高表达率为50.00%,高于癌旁组织的7.78%(P<0.05),见表1。
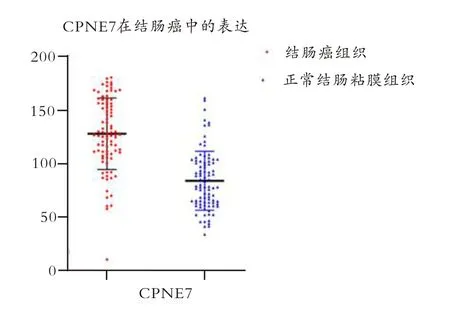

图2 结直肠癌组织芯片中CPNE7的表达
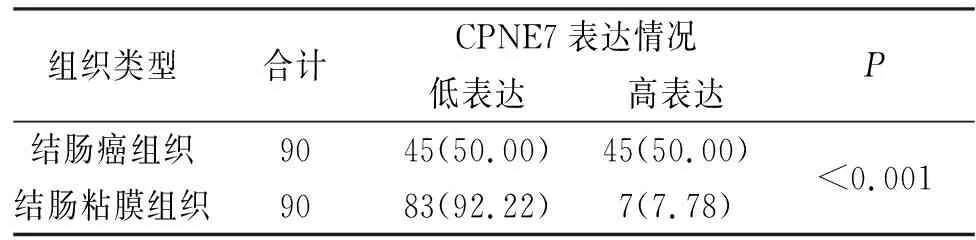
表1 结直肠癌组织芯片中CPNE7的表达[n(%)]
2.3 CPNE7与结直肠癌病理特征及预后的关系
在不同性别、年龄、肿瘤分化程度、肿瘤位置、肿瘤浸润深度上,CPNE7表达水平均无明显差异(P>0.05);但淋巴结转移N1、N2者CPNE7高表达率均高于N0者(P<0.05),TNM分期Ⅲ期者CPNE7高表达率高于I期、Ⅱ期者(P<0.05),见表2。

表2 CPNE7表达与临床病理特征的关系[n(%)]
2.4 CPNE7表达与患者预后的关系
Kaplan-Meier生存曲线分析发现,CPNE7表达水平与患者预后相关(P<0.05),见图3。
3 讨论
根据IARC调查数据显示,2020年,全球癌症死亡病例为996万例,癌症已经成为人类健康的最大威胁之一[2]。近年来随着肿瘤精准医疗和生物医学大数据技术的快速发展,标志着精准医疗时代的到来,从分子生物学机制探讨肿瘤细胞及组织中的基因表达模式,并分析促癌基因产生的促癌效应及对肿瘤细胞的影响,对肿瘤疾病的诊断、治疗及预后评估具有重要的意义。CPNE蛋白为具有特殊生物学特征的DNA结合区,其中CPNE7基因位于人类染色体7p22.1[3],目前国外已有大量前沿文献报道证实,CPNE7对多种肿瘤细胞的增值、迁移和侵袭具有调控作用,临床上通过对调控机制的研究,以寻找特异性靶点,可为肿瘤的靶向治疗提供重要信息[4]。
本研究主要探讨CPNE7在结直肠癌组织中的表达及临床意义,研究结果显示:CPNE7在结直肠癌细胞株中的表达明显高于正常结直肠上皮细胞株,且在结直肠癌组织中的表达显著高于癌旁正常组织,提示CPNE7在结直肠癌组织中呈高表达态势。在基因表达学上,其表达过程是将遗传特征通过生物学效应合成一定的产物,并发挥多种生物学作用[5]。在正常组织及细胞中,基因通过调控机制使其相应蛋白维持在正常水平,并发挥正常的细胞表型,如低增值、低迁移、低侵袭;而在肿瘤组织及细胞中,基因表达模式发生异常,造成肿瘤细胞出现恶性表型,如高增值、高迁移、高侵袭,并通过其表达差异产生促癌效应,促进肿瘤病情的进展[6-7]。从本研究结果来看,CPNE7在结直肠癌组织及细胞中的高表达,是造成结直肠癌细胞出现恶性表型的重要机制之一,提示CPNE7在结直肠癌的发生、发展中发挥了重要的生物学作用。
通过对基因、蛋白及肿瘤标志物的检测以判断肿瘤病情及评估患者预后是当前肿瘤防治体系的重要组成部分[8]。本研究结果显示:淋巴结转移N1、N2者CPNE7高表达率均高于N0者(P<0.05),TNM分期Ⅲ期者CPNE7高表达率高于I期、Ⅱ期者(P<0.05)。Kaplan-Meier生存曲线分析发现,CPNE7表达水平与患者预后相关(P<0.05)。提示CPNE7在结直肠癌组织中的表达水平与淋巴结转移类型、TNM分期及生存预后密切相关。CPNE 家族蛋白在肿瘤病理机制中的生物学作用较为复杂,有研究报道指出CPNE7可促进NF-κB 活性显著增强,而NF-κB在肿瘤细胞的增殖、迁移、侵袭及血管生成中发挥主要作用[9],因此,在间接角度上,CPNE7可通过对NF-κB 活性的调控发挥促肿瘤细胞生长的作用,进而推进肿瘤病情的进展及淋巴结的转移。也有研究报道强调,CPNE7是促乳腺癌转移的重要基因,也为其独立的预后指标[10]。因此,临床上通过对结直肠癌患者CPNE7基因的检测不仅能够为肿瘤疾病的诊断、病情判断及预后评估提供参考,同时能够将其作为重要的治疗靶点,针对性的研发对细胞增殖、侵袭、转移具有抑制作用的靶向化合物,可有效预防肿瘤病情的进展,对改善患者预后具有重要的意义。
综上所述,CPNE7在结直肠癌组织中高表达,与临床病理关系密切且预后不良,为结直肠癌的早期诊断、预后判断和治疗提供了新思路。
