半枫荷组培育苗技术研究
2022-07-15舒婷
舒婷
(福建省林业科技试验中心,福建 漳州 363600)
半枫荷(Semiliquidambar cathayensis)为金缕梅科半枫荷属,为1962 年新发现的我国特有种[1]。半枫荷为常绿高大树种,树干通直,叶形多样,嫩叶为紫色和翠绿色,颇具美感,是优良的园林绿化观赏树种[2];其木材优质,旋包性良好,是制作旋创制品的优良用材;半枫荷的药用价值较高,它的根茎、枝、叶及树皮和花蜜都具有祛除风湿、活血通络的独特功能,可以治疗风湿性关节炎、腰肌劳损、半身不遂、跌打淤积等症状,是一种有效的民间地方特色药,被广泛开发和应用[3-5]。半枫荷对生态环境的要求比较苛刻,主要分布于福建、广东、广西、贵州、湖南、江西等省,自然繁殖率较低,又经常被人们砍伐采掘,野生资源日益稀少,种群繁衍趋于濒危[6]。
半枫荷的繁殖技术主要采用传统的扦插繁殖[7-9],但容易带有病菌并且苗木根系较弱,无法提供大批优质种苗。目前,关于半枫荷组织培养的文章也有一些[10-12],但规模化育苗报道较少。为解决种源不足问题,笔者于2019 年开始对半枫荷进行组培快繁研究并开展规模化生产,在生产过程中发现,随着继代次数的增加,用单一的继代培养基增殖时,组培苗容易出现苗矮小、变异、玻璃化现象等问题,造成有效苗数量少、生根效果差,无法实现短期内组培规模化育苗的要求。针对以上问题,结合生产成本的因素,除了定期更新材料外,采用把基本培养基中NH4NO3的用量减半、KNO3的用量提高1/2、调整激素用量及光照强度的措施来降低半枫荷组培苗玻璃化的现象[13-14],有利于优化组培苗,建立了一套稳定的半枫荷规模化育苗技术体系。
1 材料与方法
1.1 试验材料
试验材料是南平市顺昌林业科技推广中心选育出的半枫荷优良单株“茫荡1 号”。采摘当年春季生长健壮的新萌枝条,截取半木质化茎段并剪去叶片,先用自来水洗去表面污渍,再用肥皂水浸泡20 min 后刷洗干净,最后在流动的自来水下冲洗30 min,备用。
1.2 试验方法
1.2.1 外植体的消毒
在超净工作台上将预处理的外植体剪成带1~2个腋芽、长2~3 cm 的茎段,先用无菌水清洗1 遍后放入无菌玻璃瓶中,每瓶放置20 个;结合笔者早期试验数据,把清洗后的外植体加入75%的酒精浸泡15 s 后用无菌水清洗3 次;0.1%的HgCl2消毒8~10 min 后用无菌水清洗5 次。整个操作过程中要不断摇动容器。接入MS+蔗糖30 g/L 的基本培养基中,培养30 d 后记录污染和死亡情况。
1.2.2 诱导培养基的筛选
选择MS 或WPM+蔗糖30 g/L 为半枫荷诱导的基本培养基,附加质量浓度为1.0 mg/L 的6-BA和0.2 mg/L 的NAA 或IBA,每个处理20 瓶,每瓶1个芽,重复3 次;30 d 后观察统计外植体的诱导萌发率和生长情况。
1.2.3 增殖培养基的筛选
(1)不同质量浓度的6-BA 和NAA 对半枫荷不定芽增殖的影响。将诱导形成的不定芽接种于增殖培养基中,增殖培养基以MS+蔗糖30 g/L 为基础培养基,附加不同质量浓度的6-BA(0.8、1.0、1.2 mg/L)和NAA(0.1、0.2、0.3 mg/L),每个处理20瓶,重复3 次,培养30 d 后观察不定芽的生长增殖情况。
(2)改良MS 和光照强度对半枫荷增殖的影响。把增殖培养基MS 中的NH4NO3用量减半、KNO3用量提高1/2,将诱导形成的不定芽接种到改良增殖培养基中,分别在光照强度(3 000±200)Lx和(5 000±200)Lx 的条件下生长,每个处理20 瓶,重复3 次;30 d 后观察不定芽的生长情况。
1.2.4 生根培养基的筛选
切取生长健壮、苗高约2 cm 且有3 片叶子以上的不定芽,接种到生根培养基中,生根培养以1/2MS为基础培养基,附加蔗糖20 g/L、活性炭0.2 g/L,以及不同质量浓度的IBA(0.5、0.8、1.0 mg/L)和NAA(0、0.2、0.4 mg/L)的组合,每个处理20 瓶,每瓶10个芽,重复3 次;40 d 后,统计苗的生根率和观察根的生长情况。
1.2.5 炼苗与移栽
当半枫荷组培苗根的长度达1 cm 以上、根数3 条以上就可进行炼苗,炼苗7 d 后将生根苗从瓶中取出,根部清洗干净后用800~1 000 倍多菌灵浸泡20 min,再移到不同的基质穴盘中栽培,基质分别为泥炭土、泥炭土∶珍珠岩=3∶1、泥炭土∶黄心土=3∶1,每个处理移栽20 株组培生根苗,重复3 次;移栽后要浇透定根水,40 d 后观察生长情况和统计移栽成活率。
1.2.6 培养条件
培养基中均添加琼脂6.8 g/L,pH 值调至5.8~6.0,培养室温度25~27 ℃,诱导和生根时光照强度2 000~3 000 Lx,光照周期12 h/d。
1.2.7 计算方式
污染率=污染外植体个数/ 接种总外植体个数×100%
死亡率= 死亡外植体个数/接种总外植体个数×100%
诱导成活率=100- 污染率- 死亡率
诱导率= 萌发外植体个数/接种总外植体个数×100%
增殖系数=现有不定芽总个数/原接种不定芽总个数
生根率=40 d 后生根苗个数/接种苗总个数×100%
移栽成活率=移栽后苗的成活个数/移栽苗总个数×100%
1.3 数据处理
采用DPS 软件进行数据处理和分析。
2 结果与分析
2.1 消毒时间对半枫荷外植体灭菌效果的影响
由表1 可知,升汞不同的消毒时间对半枫荷的污染率和死亡率影响明显。当消毒时间在8 min时,半枫荷外植体的污染最严重,达到21.7%,但没有出现死亡现象,说明消毒时间不足,没有起到有效的消毒效果。当消毒时间在9 min 时,污染率明显降低,同时出现死亡现象,说明该时间对半枫荷外植体消毒有一定效果,但也对其产生一定的伤害。当消毒时间在10 min 时污染率有减低,但死亡率明显增加,说明长时间的升汞消毒虽能起到消毒效果,但对半枫荷外植体的伤害很大,造成较高的死亡。结合污染率和死亡率,升汞消毒时间为9 min 时半枫荷外植体成活率最高,达到91.7%,为最佳的消毒处理时间。

表1 消毒时间对半枫荷诱导的影响
2.2 不同的启动培养基对半枫荷外植体萌芽诱导的影响
由表2 可知,基本培养基和激素种类对半枫荷茎段的萌芽诱导效果明显。在6-BA 质量浓度不变的情况下分别添加质量浓度相同的NAA 和IBA,半枫荷在MS 基本培养基中的诱导率分别为90.0%和83.3%,明显高于在WPM基本培养基中的诱导率,说明MS 基本培养基更适合半枫荷茎段的诱导。在6-BA 质量浓度相同的情况下,添加NAA 的启动培养基的萌芽率明显高于添加IBA 的启动培养基,说明NAA 对半枫荷的诱导影响较大。因此,最适合半枫荷茎段的启动培养基为MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L。定芽增殖的影响
由表3 可知,6-BA 和NAA 的用量对半枫荷增殖的影响很明显。当NAA 质量浓度为0.2 mg/L 时,随着6-BA 质量浓度的增加,半枫荷增殖系数不断增加,差异显著;当6-BA 质量浓度为1.0 mg/L 时,苗木生长相对健康,叶色绿,丛芽明显,但开始出现玻璃化,随着6-BA 质量浓度的增加,玻璃化越来越严重;当6-BA 质量浓度为1.5 mg/L 时,虽然增殖系数最高,达3.25,但是丛芽生长不健康,叶片青绿卷曲,严重玻璃化,单株不明显,呈球状,因此不适合用于半枫荷的增殖。综合增殖系数和苗木生长状况,6-BA 质量浓度为1.2 mg/L 较适合。当6-BA 质量浓度为1.2 mg/L 时,随着NAA 质量浓度的增加,半枫荷的增殖系数呈先增加后降低的趋势,说明高浓度的NAA 反而会抑制半枫荷不定芽的增殖。当NAA质量浓度为0.2 mg/L 和0.3 mg/L 时明显优于其他处理,增殖系数最高。综上,半枫荷丛芽增殖时最适合的激素配比是6-BA 1.2 mg/L 和NAA 0.3 mg/L。

表3 不同质量浓度的6-BA 和NAA 对半枫荷增殖的影响

表2 不同启动培养基对半枫荷萌芽率的影响
2.3 半枫荷不定芽的继代增殖
2.3.1 不同质量浓度的6-BA 和NAA 对半枫荷不
2.3.2 基本培养基和光照强度对半枫荷玻璃苗的影响
综合考虑组培苗工厂化生产成本,通过调整基本培养基中的大量元素和培养环境的光照强度来改善或预防半枫荷玻璃化[13-14]。由表4 可知,单独使用改良MS(NH4NO3用量减半、KNO3用量提高1/2)培养基或者把光照强度提高到(5 000±200)Lx 时,虽然苗木有轻微玻璃化,但是生长形态趋于正常,叶片深绿,没有卷曲。在改良MS 和提高光照强度同时处理下,玻璃化明显改善,苗木茎干粗壮,叶片深绿且展开。因此,在半枫荷继代增殖过程中,可将改良MS 基本培养基和提高光照强度到(5 000±200)Lx同时进行。

表4 改良MS 和光照强度对半枫荷玻璃苗的影响
2.4 不同质量浓度的IBA 和NAA 对半枫荷生根的影响
由表5 可知,IBA 用量对半枫荷生根的影响显著高于NAA 对半枫荷生根的影响。当NAA 质量浓度为0.4 mg/L 时,随着IBA 质量浓度的增加,半枫荷生根率呈现先升高再降低的趋势,根的生长状态差异明显,说明高浓度的IBA 不仅抑制半枫荷不定根的诱导,也影响组培苗和根的生长状态。在IBA质量浓度为0.8 mg/L 时生根率最高,达90.0%,并且苗木健壮,根数多,根白、长。当IBA 质量浓度为0.8 mg/L 时,随着NAA 质量浓度的增加,半枫荷的生根率呈现先升高再降低的趋势,说明高浓度的NAA 会抑制半枫荷组培苗不定根的诱导。在NAA 质量浓度为0.4 mg/L 时生根率最高。因此,综合考虑根、苗的生长状态和生根率的因素,半枫荷生根时最适合的激素配比是IBA 0.8 mg/L 和NAA 0.4 mg/L。

表5 不同质量浓度的IBA 和NAA 对半枫荷生根的影响
2.5 不同基质对半枫荷组培苗移栽成活率的影响
由表6 可知,不同基质对半枫荷瓶苗的移栽和生长影响显著。以泥炭土为基质,半枫荷组培瓶苗移栽的成活率高达到85%,并且苗木生长健壮;基质为泥炭土和珍珠岩3∶1 时,移栽成活率明显降低,这可能是保湿保肥效果不好引起的;基质为泥炭土和黄心土3∶1 时,移栽成活率为48.3%,并且苗木生长不健康,茎细、叶黄、苗弱,这可能是疏散、透气效果不好引起的。综合半枫荷移栽成活率和苗木生长情况来看,最适合半枫荷瓶苗移栽的基质是泥炭土。
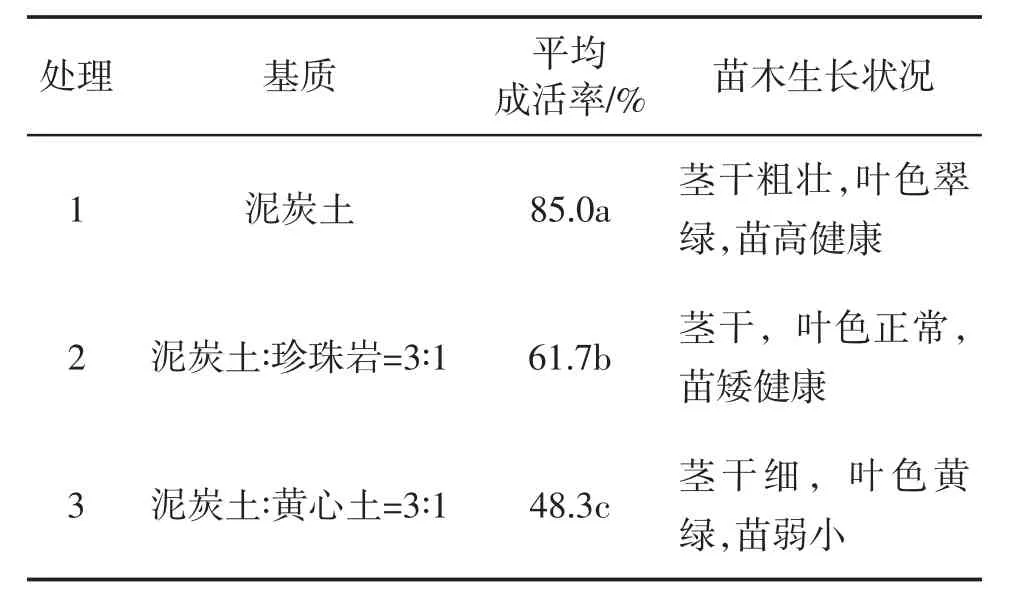
表6 不同基质对半枫荷组培苗移栽成活率的影响
3 结论与讨论
研究结果表明,半枫荷组培在工厂化育苗时,以当年春季生长健壮的新萌枝条茎段为外植体,用75%的酒精消毒15 s 后,再用0.1%的HgCl2消毒9 min,是最佳的消毒处理方式;用MS+6-BA 1.0 mg/L+NAA 0.2 mg/L+蔗糖30 g/L 作为启动培养基,可获得最高的诱导率;用改良MS+6-BA 1.2 mg/L 和NAA 0.3 mg/L 作为继代增殖培养基,并在(5 000±200)Lx 的光照条件下培养,可明显改善玻璃化现象,获得最佳的增殖系数;用1/2MS+IBA 0.8 mg/L+NAA 0.4 mg/L+蔗糖20 g/L+活性炭0.2 g/L 可获得最佳的生根率;直接用泥炭土作为基质,可获得较高移栽成活率,达85%。
在本研究中,半枫荷组培苗在增殖继代过程中容易出现玻璃化现象,在保障较高增殖系数的前提下应控制生产成本,调整元素配比和适当地提高光照强度,能明显改善玻璃化现象,可产出大量生根的半枫荷组培苗,为产业规模化发展提供保障。
