Caulobacter crescentus 蔗糖水解酶受体亚位点分子改造及其在松二糖制备中的应用
2022-07-15王蕾邢晨晨郭志勇宿玲恰吴敬
王蕾,邢晨晨,郭志勇,宿玲恰,吴敬
(江南大学食品科学与技术国家重点实验室,江南大学生物工程学院,江苏 无锡 214122)
松二糖是蜂蜜寡糖的主要成分之一,是由1分子葡萄糖和1 分子果糖以α-1,3 糖苷键连接而成的还原性二糖[1-2]。松二糖是蔗糖的同分异构体,其甜度为蔗糖的50%,甜味和蔗糖相似。由于松二糖不易被人体生物酶利用,因此具有非致龋齿性和低热量的优点。此外,松二糖还可控制脂肪积累[3],适合肥胖症、糖尿病、高脂血症和高血压等患者食用,有望代替蔗糖成为新型功能性甜味剂[4-5]。
目前,松二糖主要由环糊精葡萄糖基转移酶或淀粉蔗糖酶催化制备[5]。已有研究表明,Bacillus stearothermophilus、Bacillus macerans和Bacillus circulans来源的环糊精葡萄糖基转移酶可用于制备松二糖,但产率低于45%,并且含副产物海藻酮糖,同时产物中还存在糖基化的松二糖[6],需要经过糖化酶处理,因此不适合工业化生产。而选用淀粉蔗糖酶制备松二糖产率高,受到青睐[5,7]。
淀粉蔗糖酶是一种多功能酶,可催化转苷反应和水解反应。其中,转苷反应是其主反应,包含分子内转苷反应和聚合反应,分子内转苷反应又称异构反应(图1)。淀粉蔗糖酶能够通过异构反应转化蔗糖制备松二糖[8]。Wang 等[9]使用Neisseria polysaccharea来源的淀粉蔗糖酶制备松二糖,当蔗糖浓度为2.5 mol/L 时,松二糖产率可达56%。宿玲恰等[10]构建了N.polysaccharea来源的淀粉蔗糖酶突变体G396S,并在食品级菌株枯草芽孢杆菌中成功表达,以2 mol/L 的蔗糖为底物时,松二糖产率可达61.7%,产量为410 g/L。尽管采用淀粉蔗糖酶制备松二糖的产率高,但存在副产物麦芽寡糖和海藻酮糖[11-12],不利于后续分离提取。目前,N.polysaccharea来源的淀粉蔗糖酶制备松二糖时,海藻酮糖与松二糖比例最低为0.12或0.21(2%/17%[13]或3%/14%[14]),在反应过程中添加果糖,只能显著降低麦芽寡糖,对海藻酮糖的降低无显著效果[3,11]。
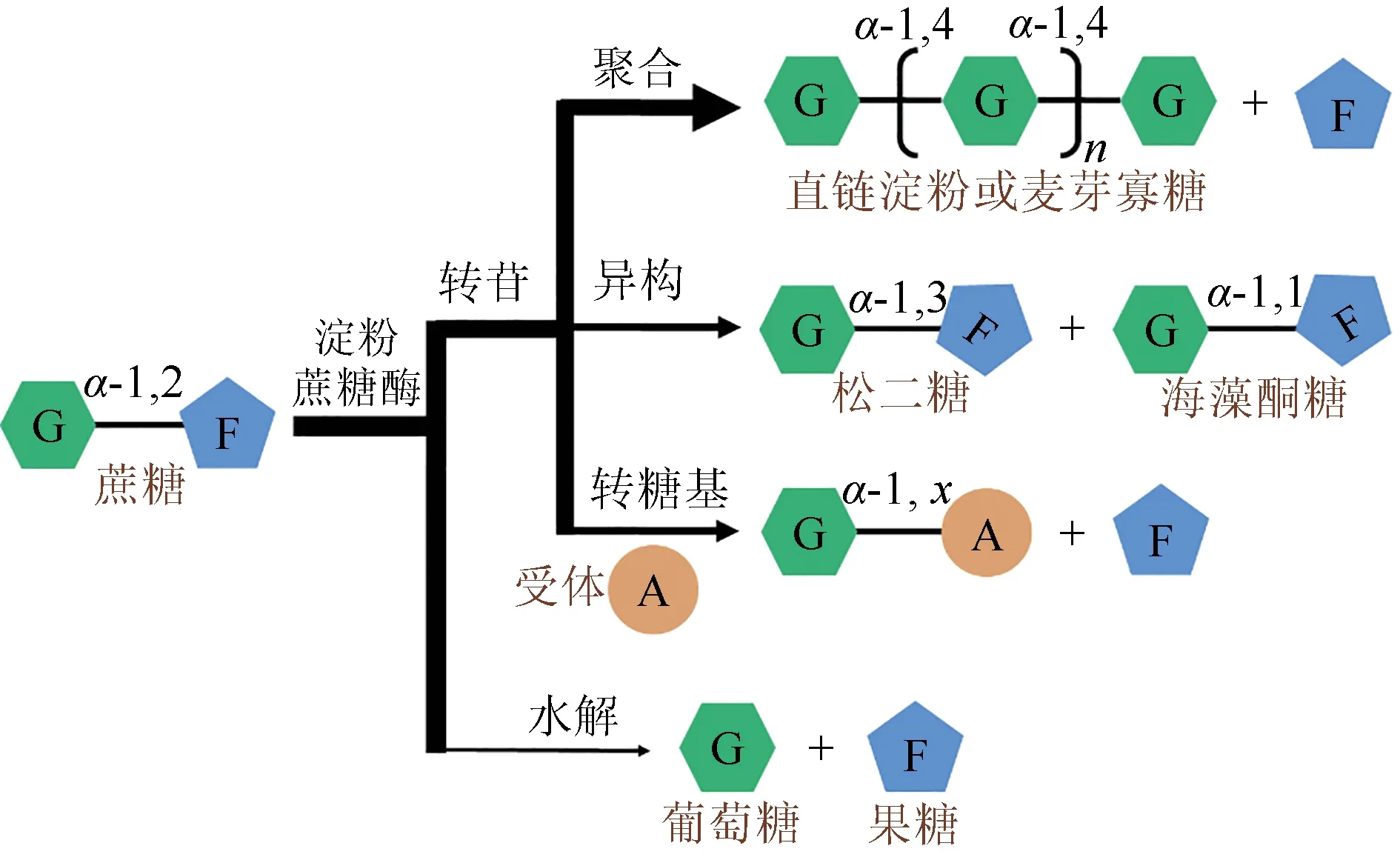
图1 淀粉蔗糖酶催化的反应类型Fig.1 Reactions catalyzed by amylosucrase
蔗糖水解酶和淀粉蔗糖酶同属于糖苷水解酶GH13 家族的第4 亚家族,序列一致性在30%~55%之间[15-16]。与淀粉蔗糖酶催化功能相反,蔗糖水解酶可催化蔗糖水解生成葡萄糖和果糖,转苷反应微弱[17]。本实验室前期通过机器学习、序列结构分析、实验验证以及QM/MM MD 模拟揭示了决定该家族转苷/水解特征的机制,并且获得了Caulobacter crescentus来源的蔗糖水解酶突变体S271A,其具有和淀粉蔗糖酶相似的转苷能力,制备松二糖产率可达55.9%,副产物海藻酮糖产率为9.1%,并且不含副产物麦芽寡糖[18]。因此,本研究以S271A 为出发酶,通过蛋白结构分析和分子改造获得反应特异性提升的突变体,并进一步对其制备松二糖的条件进行优化,提高松二糖的产量和纯度,为工业化制备松二糖奠定了技术基础。本研究还对突变体进行了分子动力学模拟分析,为松二糖高效制备酶学机制提供了理论参考。
1 材料与方法
1.1 实验材料
1.1.1 菌种和质粒
克隆宿主Escherichia coliJM109 和表达宿主E.coliBL21(DE3)购自上海生工生物公司并由本实验室保藏,带有S271A 基因的质粒pET-24a(+)-ccsh S271A由本实验室构建并保藏。
1.1.2 主要试剂及仪器
试剂:DNA 聚合酶2×Phanta Max Master Mix购自南京诺唯赞生物科技有限公司;SDS-PAGE凝胶快速配制试剂盒购自碧云天生物技术有限公司;质粒小提试剂盒、琼脂糖凝胶DNA 回收试剂盒购自天根生化科技(北京)有限公司;限制性内切酶购自宝生物工程(大连)有限公司;卡那霉素购自生工生物工程(上海)股份有限公司;蛋白胨、酵母粉购自英国Oxiod;其他试剂均为国产分析纯,购自国药集团;质粒测序与引物合成由天霖(无锡)生物科技有限公司完成。
仪器:PTC-200 型核酸扩增仪购自美国MJ Research;DYY-6C 型核酸电泳仪购自北京六一电泳仪厂;电热恒温培养箱购自上海医疗器械研究所;凝胶成像系统购自Bio-Rad 公司;UV-1700 紫外可见光分光光度计购自日本Shimadzu 公司;Agilent 1200 高效液相色谱系统购自美国Agilent 公司;超声波细胞粉碎机购自宁波新芝生物科技股份有限公司。
1.2 突变体的构建与表达
1.2.1 突变体的构建
以质粒pET-24a(+)-ccsh S271A 为模板,对第382位点、第211位点、第273位点和第209位点进行突变。根据突变位点设计引物(表1),采用DNA 聚合酶2 × Phanta Max Master Mix 进行一步PCR,将PCR 产物经过Dpn Ⅰ除去模板后转入E.coliJM109,并涂布于含有Kan 抗性的LB 固体平板过夜培养,挑取单菌落至LB 液体培养基中,于37 ℃、200 r/min 培养8 h,提取质粒测序验证,获得带有各突变体S271A/I382G、S271A/I382S、S271A/I382T、S271A/I382Q、S271A/I382K、S271A/I382R、S271A/V211I、S271A/P273A、S271A/P273S 和S271A/P209R基因的质粒。

表1 定点突变引物Tab.1 Primers used for the site-directed mutation
1.2.2 突变体的表达
将含各突变体基因的质粒转入E.coliBL21(DE3)中,并涂布于含有Kan抗性的LB 固体平板过夜培养,挑取单菌落至含有Kan 抗性的液体LB培养基中,在37 ℃、200 r/min摇床中培养8 h。将种子液按照5%的接种量转接至50 mL 含有Kan 抗性的TB 培养基中,于37 ℃、200 r/min 摇床中培养2 h。加入终浓度为0.4 mmol/L 的IPTG,于25 ℃、200 r/min 摇床中培养24 h。发酵结束后,于4 ℃、8000 r/min离心机中收集菌体,用50 mmol/L K2HPO4-KH2PO4(pH 7.0)重悬菌体至OD600为50 后进行高压匀浆破壁,4 ℃、8000 r/min 进行离心后收集上清液,并采用硫酸铵沉淀进行浓缩,在酶液中加入0.3 kg/L 的硫酸铵粉末,并搅拌溶解,在4 ℃冰箱中放置过夜,然后离心弃上清收集沉淀。用10 mmol/L 的pH 7.0 的K2HPO4-KH2PO4缓冲液重悬沉淀直至溶解,然后放入透析袋中于4 ℃冰箱过夜透析,在4 ℃,8000 r/min 的离心机中离心20 min后收集上清用于后续实验。
1.2.3 突变体的纯化
由于重组酶的蛋白末端已经带有His-Tag,所以用镍亲和色谱柱His-TrapTM HP-5 mL 对收集的酶液进行纯化。
结合缓冲液(A 液)成分:25 mmol/L Tris-HCl,500 mmol/L NaCl,调节pH 至7.0。洗脱缓冲液(B 液)成分:300 mmol/L 咪唑,25 mmol/L Tris-HCl,500 mmol/L NaCl,调节pH至7.0。
先用100 mL的A液将镍亲和色谱柱进行平衡,接着将待纯化的粗酶液进行上样。上样结束后,用100 mL 的A 液进行冲洗,冲洗结束后,分别用100 mL 的5% B 液-95% A 液 混 合 液、10% B 液-90% A 液混合液、15% B 液-85% A 液混合液、100% B 液依次进行冲洗,收集洗脱液进行酶活和蛋白含量检测。
1.3 突变体的分析
1.3.1 酶活检测
采用3,5-二硝基水杨酸(DNS)法测定酶活:将1.9 mL 0.3 mol/L 的蔗糖溶液(50 mmol/L K2HPO4-KH2PO4,pH 7.0)在30 ℃预热后,加入0.1 mL 适当稀释的酶液并混匀,30 ℃反应10 min后,加入3 mL DNS 溶液终止反应。然后将反应液在100 ℃水浴中煮沸7 min,迅速放在冰水中进行冷却,最后加入10 mL 蒸馏水定容到15 mL,在540 nm 处测定光密度。检测不同pH 下的酶活时,用不同pH 的K2HPO4-KH2PO4缓 冲液(5.0、6.0、6.5、 7.0、 7.5、 8.0、 8.5、 9.0) 和 不 同pH 的Na2CO3-NaHCO3缓冲液(9.0、10.0、11.0)配制底物。一个酶活单位(U)定义为:在上述条件下每分钟催化产生相当于1 μmol还原糖所需的酶量[10]。
1.3.2 松二糖酶转化工艺
用pH 7.0 缓冲液(50 mmol/L K2HPO4-KH2PO4)配制浓度为2.5 mol/L 的蔗糖母液,按反应体系10 mL加蔗糖母液8.0 mL和酶液,不足部分用缓冲液补齐。突变体分析时,按3.5 mg/mL 加酶(通过粗蛋白含量和蛋白电泳灰度积分计算目的蛋白含量),缓冲液补齐到10 mL,温度30 ℃,pH 7.0,反应48 h。
双突变S271A/I382Q 加酶量对酶转化的影响:蔗糖母液8 mL,酶液按20 U/mL、40 U/mL、60 U/mL、80 U/mL、100 U/mL 分别加酶,加缓冲液补齐到10 mL,温度30 ℃,pH 7.0,反应48 h。
反应温度对酶转化的影响:蔗糖母液8 mL,酶液按60 U/mL 加酶,选择不同反应温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃),加缓冲液补齐到10 mL,pH 7.0,反应48 h。
反应pH 对酶转化的影响:用不同pH 的K2HPO4-KH2PO4缓冲液(5.0、6.0、6.5、7.0、7.5、8.0、8.5、9.0)和不同pH 的Na2CO3-NaHCO3缓冲液(9.0、10.0、11.0)配制蔗糖母液,蔗糖母液8 mL,酶液按60 U/mL 加酶,加相应pH 缓冲液补齐到10 mL,温度30 ℃,反应48 h。
蔗糖浓度对酶转化的影响:用pH 5.0 缓冲液(50 mmol/L K2HPO4-KH2PO4)配制浓度为2.75 mol/L的蔗糖母液,按反应体系10 mL加蔗糖母液(控制终浓度1.0 mol/L、1.5 mol/L、2.0 mol/L、2.5 mol/L)和酶液,加缓冲液补齐到10 mL,温度30 ℃,反应48 h。酶反应结束后,在沸水中煮沸10 min 灭活,用HPLC检测松二糖生成量。
1.3.2 HPLC分析检测产物
将酶转化反应产物以12000 r/min 离心10 min后取上清,用水稀释至适当倍数后与乙腈按照1∶1 的比例进行混合,在4 ℃冰箱放置8 h 后离心取上清,用0.22 μm 的滤头进行过滤。采用HPLC 进行检测分析,检测条件为:Agilent 1200 HPLC 色谱仪,示差折光检测器(RID),色谱柱为Syncronis Amino Column 4.6 mm × 250 mm(5 μm),流动相为80%乙腈(体积分数)和水的混合液,流速0.8 mL/min,柱温35 ℃。松二糖产率公式:

1.4 分子动力学模拟
首先利用SWISS-MODEL 网站[19]对S271A 和S271A/I382Q 突变体的结构进行同源建模。利用GaussianView 软件生成配体松二糖或海藻酮糖结构,并进行QM/MM优化,计算获得配体电荷。然后利用LeDock 软件[20]按照分子对接的标准流程进行分子对接。最后获得S271A和S271A/I382Q与松二糖复合物。使用PROPKA3[21]方法对可解离残基(Asp、Glu 和His)的质子化状态进行分配。基于上一步获得的复合物结构,进行分子动力学模拟。采用Amber ff14SB[22]和GLYCAM_06j[23]力场来分别描述蛋白和碳水化合物。首先将复合物结构沉浸在TIP3P[24]水盒子里,且水盒子边缘距离蛋白表面的最小距离是1.6 nm。然后加入适量的钠离子以平衡系统电荷。体系先在NVT 系综缓慢升温到300 K,接着在NPT 系综平衡2 ns 从而使体系的压力密度稳定,最后进行50 ns MD 模拟。所有MD 模拟均通过Amber 18 GPU 版本进行。积分步长为2 fs,用SHAKE算法[25]来约束所有的共价键。长程静电相互作用通过Particle Mesh Ewald(PME)[26]计算,非键相互作用的截断半径为1.2 nm。轨迹分析通过VMD[27]和AmberTools19的标准模块[28]进行。
3D结构可视化图片的制作软件选用PyMOL软件,数据分析图片选用Origin软件。
2 结果与分析
2.1 突变位点的选择与设计
以与S271A序列一致性为41.21%的Xanthomonas axonopodis蔗糖水解酶(XaSH)为模板(PDB 编号为3CZK)[17],采用SWISS-MODEL 对S271A 进行同源建模[图2(a)],QMEAN 和GMQE 打分结果分别为-2.38(高于-4)和0.76(接近1),表明模拟结构可靠[29-31]。通过LeDock 程序将松二糖对接到S271A 的活性口袋,对其果糖结合区域的位点进行分析[图2(b)]。同时与同家族淀粉蔗糖酶进行多重序列比对[图2(c)]。蛋白结构3CZK确定了XaSH 的-1 和+1 亚位点[17],同时蛋白结构1MW0 确 定 了NpAS 的-1、+1、+2、…、+5 位点[32]。其中,-1 亚位点是底物蔗糖结合时葡萄糖单元的结合位点,也是聚合反应时底物糖单元延长的位点;+1 亚位点是底物蔗糖结合时果糖单元的结合位点,也是聚合反应时葡萄糖的结合位点;+2、…、+5 亚位点是聚合反应时麦芽寡糖的结合位点。通过分析对比,可确定CcSH S271A的-1、+1、+2 等亚位点,在CcSH S271A 中处于+1 亚位点但不保守的氨基酸为I209、V211、P273 和I382。为了探究S271A 与淀粉蔗糖酶的位点差异对松二糖合成的影响,将I209、V211、P273 和I382 分别突变成淀粉蔗糖酶中对应氨基酸,即设计突变体I209R、V211I、P273A 和I382G,同时为了在P273 位点引入可能的氢键设计突变体P273S。此外,在所有淀粉蔗糖酶和蔗糖水解酶中,除了在382 位点处为I 外,其他酶在该位点处均为无侧链的G,这可为+2 亚位点糖单元的结合提供空间以利于生成高聚合度麦芽寡糖或直链淀粉(PDB 编号1MW0)[32]。I382 形成的空间位阻破坏了+2 亚位点糖的结合,这也是具有转苷活性的S271A 不产生高聚合度产物的可能原因。针对这一特征,设计突变体I382S、I382T、I382Q、I382K 和I382R,以在保留空间位阻的同时,引入不同链长的极性氨基酸,可能为+1 亚位点果糖单元的结合提供氢键相互作用。
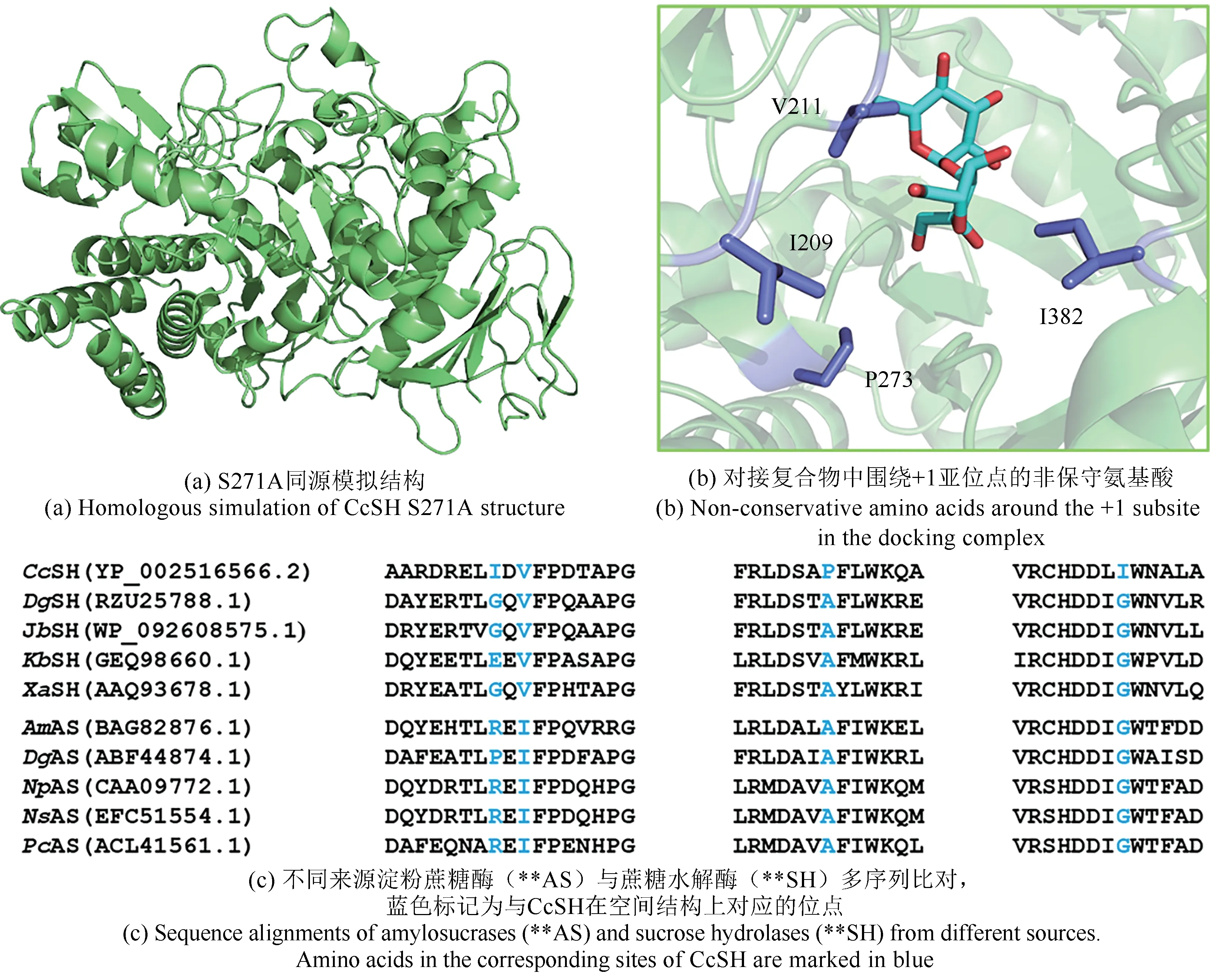
图2 结构模拟与序列比对分析Fig.2 Structure simulations and sequence alignment analysis
2.2 突变体的构建与重组表达
以质粒pET-24a(+)-ccsh S271A 为模板,通过PCR 获得上述10 个突变体基因,并在E.coliBL21(DE3)中重组表达。取样测发酵液菌浓OD600,同时离心收集1 mL 菌体,破壁后取上清测定酶活,结果如图3 所示,所有表达突变体的菌株,除S271A/I382R、S271A/V211I 表达宿主菌浓明显高于S271A 外,其余差别不大。所有突变体发酵液酶活均出现不同程度的下降,其中S271A/I382G、S271A/I382T和S271A/I382Q酶活分别为11.9 U/mL、11.8 U/mL、11.2 U/mL,为单突变体S271A 酶活的80%以上;而其他突变体发酵酶活受到较大影响,特 别 是 S271A/I382K、 S271A/I382R、 S271A/P273S 和S271A/I209R 的酶活下降至单突变体S271A的20%以下。
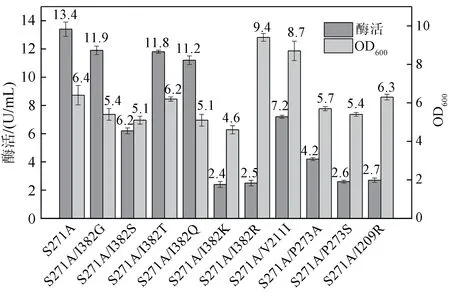
图3 突变体摇瓶发酵情况Fig.3 The shake flask fermentation of E.coli BL21(DE3)mutants
2.3 突变体制备松二糖性能表征
制备松二糖时,以2 mol/L 蔗糖为底物,按目的酶量3.5 mg/mL 加量加入S271A 和各突变体,在pH 7.0、30 ℃条件下反应48 h。结果如图4 所示,仅突变体S271A/I382Q 制备松二糖的产率提高,达到60.2%,松二糖的浓度为408.7 g/L。同时,副产物海藻酮糖的产率比S271A(9.1%)显著降低,仅为2.3%,此时海藻酮糖和松二糖比例为0.04(2.3%/60.2%),显著低于S271A 的0.16(9.1%/55.9%)及N.polysaccharea淀粉蔗糖酶的0.12[13](或0.21[14]),有利于松二糖后续分离及纯化。因此,选择突变体S271A/I382Q 进行后续研究。

图4 突变体制备松二糖的HPLC结果分析Fig.4 HPLC analysis of turanose produced from sucrose by the mutants
2.4 突变体S271A/I382Q的纯化
为了考察双突变体S271A/I382Q的酶学性质以及工业化应用潜力,同时与单突变体S271A酶学性质进行对比,本研究对S271A/I382Q 进行了纯化,经镍柱亲和色谱,达到获得电泳纯(图5),比活为11.5 U/mg(表2),与S271A比活(13.1 U/mg)[18]较为接近。

表2 S271A/I382Q纯化过程参数Tab.2 Parameter for S271A/I382Q purification
2.5 突变体S271A/I382Q的酶学性质
以蔗糖为底物测得S271A/I382Q 的Km为1.5 mmol/L,比S271A 的Km(4.2 mmol/L)[18]显著降低,说明S271A/I382Q 与底物蔗糖的亲和力更好。kcat为14.8 s−1,较单突变体略有降低。kcat/Km为9.8 mmol/(L·s),是S271A 的1.96 倍[18],催化效率显著提高。
为了探究S271A/I382Q 的最适反应温度,在20~50 ℃的条件下测定酶活。如图6(a)所示,S271A/I382Q 的酶活随着温度的升高而先上升再下降,最适温度为45 ℃,和S271A 相同[18]。将其置于30 ℃,每隔24 h 定时取样测定残留酶活。结果显示,S271A/I382Q 的半衰期为384 h[图6(b)],比S271A 的 半 衰 期 长72 h[18],说 明 将S271A 第382 位点突变为谷氨酰胺会提高酶的热稳定性,更有利于工业化应用,S271A/I382Q 稳定性的增加,可能是游离酶或382Q 不与受体位点果糖形成氢键时,382Q的侧链与邻近催化三联体的D380形成氢键(图7),有利于稳定酶的结构。

图7 突变体271A/I382Q中Q382和D380的氢键相互作用Fig.7 Hydrogen bond developed between Q382 and D380 in the mutant S271A/I382Q
为了探究S271A/I382Q的最适pH,在pH 5.0~11.0 条件下测定酶活。如图6(c)所示,S271A/I382Q 的最适pH 为8.0,pH 在6.5~8.5 的范围内,相对酶活均在85%以上,超过该pH 范围时,酶活骤降,但在pH 6.5 以下,较S271A 下降缓慢。为了探究S271A/I382Q 在不同pH 下的稳定性,将上述酶液在pH 5.0~9.0、30 ℃保温48 h后测定酶活。结果表明,S271A/I382Q 在pH 6.0~7.0 范围内较稳定,相对酶活均在90%以上,最稳定pH 为6.0,低于S271A 的最稳定pH 8.0[18],而在偏碱或偏酸的条件下稳定性较差[图6(d)]。
2.6 突变体S271A/I382Q制备松二糖条件优化
为了进一步提高双突变体S271A/I382Q制备松二糖的产率以及探究酶转化条件优化对产物中松二糖纯度的影响,将酶转化条件中的加酶量、反应温度、初始pH 和蔗糖浓度进行优化。首先以2.0 mol/L 蔗糖溶液为底物,在pH 7.0 和30 ℃条件下,反应48 h,考察了不同加酶量(20~100 U/mL)对松二糖制备的影响。结果如图8(a)所示,当S271A/I382Q的加酶量由20 U/mL增加到为40 U/mL时,松二糖的产率从53.1%升高到57.4%,继续增加酶量,松二糖产率逐渐下降,表明过多的酶液并不利于松二糖的制备,最适加酶量为40 U/mL。
为了探究S271A/I382Q制备松二糖时的最优温度,本研究以2.0 mol/L 蔗糖溶液为底物,加入40 U/mL 的S271A/I382Q,在pH 7.0、20~50 ℃条件下进行酶促反应,反应时间为48 h。松二糖产率如图8(b)所示,当温度为30 ℃时,松二糖的产率达到最高,为57.4%,与S271A 制备松二糖的最适温度一致[18]。
在上述加酶量和温度优化的基础上,对反应pH 进行优化。以2.0 mol/L 蔗糖溶液为底物,考察pH 3.0~10.0 对松二糖制备的影响。结果如图8(c)所示,pH 5.0~8.0 有利于松二糖制备,其中当pH 为5.0 时,松二糖产率最高,达到70.3%;当pH 低于5.0 或高于8.0 时松二糖产率显著下降至32%以下。和S271A 制备松二糖相比,最适pH 由8.0 降为5.0,可能由于在催化三联体附近引入了极性氨基酸并与之形成氢键(图7),改变了催化三联体氨基酸的解离平衡[33-34]。

图8 S271A/I382Q催化制备松二糖的条件优化Fig.8 Optimization of reaction conditions for the catalysis of S271A/I382Q to produce turanose
本研究还优化了S271A/I382Q制备松二糖的底物浓度,以1.0~2.5 mol/L 的蔗糖溶液为底物,S271A/I382Q 的加量按照底物浓度设定为20~50 U/mL,并在30 ℃、pH 5.0 的条件下催化反应48 h。结果如图8(d)所示,当底物浓度为2.0 mol/L 时,松二糖产率达到最高,为70.3%,此时产物中松二糖的浓度为480 g/L。
通过上述S271A/I382Q 制备松二糖的工艺优化,确定了最适的酶转化条件。在pH 5.0、温度30 ℃的条件下,以2 mol/L 的蔗糖溶液为底物,添加40 U/mL 的S271A/I382Q,反应48 h,松二糖的产率最高(为70.3%),此时产物中松二糖的浓度为480 g/L,在此条件下制备的产物中未检测出海藻酮糖。该产率高于现有文献报道N.polysaccharea淀粉蔗糖酶(56%)[9]、N.polysaccharea淀粉蔗糖酶突变体G396S(61.7%)[10],以及C.crescentus蔗糖水解酶突变体S271A(66.3%)的松二糖产率[18],同时也高于添加果糖进行转化时的N.polysaccharea淀粉蔗糖酶(61.6%)[3]及其突变体G396S(67.6%)[10]的松二糖产率(松二糖对总底物产率)。更为重要的是,S271A/I382Q经过工艺条件优化,不产副产物海藻酮糖。
2.7 分子动力学模拟分析
从上述酶转化研究可以看出,S271A/I382Q 相对于单突变体S271A 不仅提高了松二糖(α-1,3 键)的产率,而且极大降低了副产物海藻酮糖(α-1,1 键)的生成量(图4),表明S271A/I382Q更倾向于催化α-1,3键合成。S271A/I382Q更倾向于催化α-1,3 键合成,原因可能是对于不同突变体而言,果糖在参与形成糖苷键时的构象的偏好性不同。为了验证该猜测,分别对S271A和S271A/I382Q与松二糖和海藻酮糖进行了分子对接,并在对接的基础上进行了50 ns的MD模拟以检测果糖在受体位点的相互作用情况。蛋白骨架的RMSD值随时间演变的结果如图9(a)、(b)所示,体系均在10 ns后达到平衡。随后对MD模拟的轨迹进行了分析(图10)。

图9 CcSH突变体蛋白骨架原子的均方根偏差(RMSD) 随时间演变过程Fig.9 Time evolution for the root-mean-square deviation(RMSD)of the backbone atoms of CcSH mutants
在单突变体S271A 中,当果糖3号位羟基靠近葡萄糖形成α-1,3糖苷键(松二糖)时,I382与I314构成的疏水簇与糖环中心的平均距离为0.51 nm[图10(a)蓝色散点。注:距离越近,疏水作用越强,平均距离以最近距离氨基酸为准,此处不考虑I382,见图10(b)],因此能够通过疏水堆积稳定果糖在+1 亚位点的结合[图11(a)];当果糖以1号位羟基靠近葡萄糖形成α-1,1 糖苷键(海藻酮糖)时,由于果糖1 号位羟基定位的限制,果糖基偏离+1 亚位点,疏水簇与糖环中心的平均距离为0.57 nm[图10(a)橙色散点、图11(b)],疏水簇的堆积作用较弱,因此S271A生成松二糖的能力较强。
在双突变体S271A/I382Q 中,当果糖以3 号位羟基靠近葡萄糖形成α-1,3 糖苷键(松二糖)时,仅I314 能够提供疏水相互作用,并且I314 与糖环中心的平均距离为0.61 nm[图10(c)蓝色散点、图11(c)],远于S271A 中的0.51 nm,疏水相互作用减弱,但是Q382 可通过侧链氨基与果糖6 号位羟基形成氢键(0.30 nm)[图10(d)紫色散点、图11(c)],弥补疏水作用的减弱,最终也能稳定果糖在+1亚位点的结合。当果糖以1号位羟基靠近葡萄糖形成α-1,1 糖苷键(海藻酮糖)时,同样由于果糖1 号位羟基定位的限制,果糖基偏离+1 亚位点,I314 与糖环中心的平均距离为0.70 nm[图10(c)橙色散点],远于S271A 中的0.57 nm。同时,由于Q382不能和果糖的羟基形成氢键(0.56 nm)[图10(d)绿色散点、图11(d)],导致果糖以该构象与酶结合的能力很差。因此,与S271A 相比,S271A/I382Q 具有生成松二糖的更大优势,而副产物海藻酮糖合成能力甚微。

图10 CcSH突变体与松二糖/海藻酮糖相关距离随时间的演变过程Fig.10 Time evolution of relative distances between CcSH single/double mutants and turanose/trehalulose
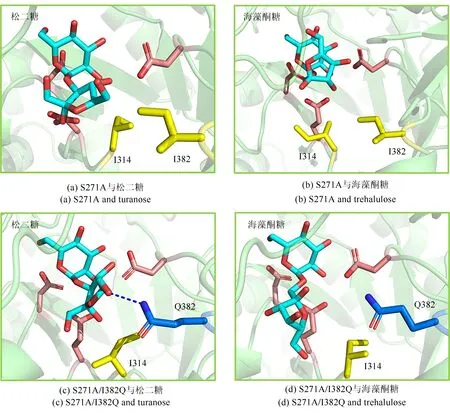
图11 CcSH突变体与松二糖/海藻酮糖复合物的相互作用分析Fig.11 Interaction analysis between CcSH mutants and turanose/trehalulose complex
综合上述分析,S271A/I382Q 中I382Q 的引入在保证松二糖果糖单元稳定结合的情况下,降低了对海藻酮糖果糖单元的结合,因此可以降低副产物海藻酮糖的生成,提高产物松二糖的特异性。
3 结 论
在蛋白结构模拟的基础上,通过对S271A 活性中心理性分析,选取4个可能与副产物形成有关的位点进行突变,其中双突变体S271A/I382Q松二糖产量提高,副产物海藻酮糖显著降低。进一步优化了S271A/I382Q 制备松二糖的工艺。结果表明,以2 mol/L 的蔗糖为底物,加酶量为40 U/mL,在pH 5.0,30 ℃的条件下反应48 h 时,松二糖产率最高为70.3%,浓度为480 g/L,为国内外报道的最高水平,并且无副产物海藻酮糖生成。此外,分子动力学模拟表明,与S271A 相比,S271A/I382Q +1 亚位点与果糖单元的疏水作用降低,但通过氢键相互作用能够稳定果糖参与形成α-1,3糖苷键时的构象,因此提升了生成松二糖的反应特异性。
