嗜酸乳杆菌抗肿瘤作用的研究进展*
2022-07-15李雅婷甘逸夫黄佳敏林丽萍
李雅婷,甘逸夫,黄佳敏,张 豪,林丽萍
南京中医药大学 药学院中药品质与效能国家重点实验室,南京210023
全球恶性肿瘤的发病率逐年上升,2020 年新增癌症约1930 万例,病死约995 万例,预计到2040 年新增癌症将达到2840 万例,将比2020 年增加47%[1]。随着环境污染和生活节奏的加快,癌症已成为居民疾病死亡的主要原因之一。目前,癌症主要通过手术切除病变部位,再配合辅助放疗、化疗、内分泌和免疫调节、靶向抑制等手段进行综合治疗。这样的治疗方法能够延长患者的生存期;但是一些副作用也显现出来:如恶心、呕吐、脱发、黏膜炎、末梢神经及听神经损伤等[2]。此外,由于癌细胞对传统化疗药物的耐药性,癌症患者预后仍然很差。因此寻找创新疗法或替代疗法至关重要。
机体的免疫状况与消化道中的益生菌和共生菌群密切相关。迄今为止,有大量研究调查了肠道微生物群与癌症发生之间的相关性,这表明肠道微生物群在肿瘤新疗法中具有潜在应用价值[3]。
嗜酸乳杆菌属于乳杆菌科乳杆菌属,菌体呈杆状,两端为圆形,大小为(0.6~0.9)μm×(1.5~6.0)μm,以单个、成双或短链排列,不运动,无鞭毛,无芽孢,革兰染色为阳性,主要存在于小肠中,释放乳酸、乙酸和一些对有害菌起作用的抗菌素[4]。嗜酸乳杆菌是公认安全的食品微生物[5],主要作用体现在营养、免疫和治疗方面。嗜酸乳杆菌等益生菌已被证明是一种很有潜力的癌症预防剂,现综述嗜酸乳杆菌对多种肿瘤的抑制作用及其抗肿瘤作用机制。
1 嗜酸乳杆菌对多种肿瘤的抑制作用
1.1 嗜酸乳杆菌对乳腺癌的抑制作用
“粉红杀手”乳腺癌,在过去10 年中病例数量快速增长,成为女性发病率最高的恶性肿瘤之一[6]。其发病机制与多种致癌因子共同作用引起的乳腺上皮细胞增殖失控以及雌酮、雌二醇水平异常有关,嗜酸乳杆菌也显示出在治疗乳腺癌方面的一定作用。Behzadi R[7]等通过多种体外和体内实验评估了不同浓度的嗜酸乳杆菌(ATCC4356)培养上清液对MCF-7 人乳腺癌细胞的抑制活性。结果显示,嗜酸乳杆菌48 h 的上清液在体外、体内(小鼠移植瘤)均对MCF-7 细胞增殖有显著的抑制作用。Maroof H[8]等发现,嗜酸乳杆菌可以促进乳腺癌小鼠模型中淋巴细胞的增殖,减缓肿瘤生长速度。Onur E[9]等发现,乳腺癌小鼠口服蜂胶提取物和嗜酸乳杆菌,以MTT 法检测小鼠脾细胞的增殖情况,使用流式细胞术分析CD8+T 细胞反应,并与正常对照组和肿瘤对照组进行比较评估,结果显示,嗜酸乳杆菌与蜂胶联合使用使乳腺癌细胞体积缩小了63.39%,证明嗜酸乳杆菌和蜂胶的联用具有较好的抗肿瘤效果。
1.2 嗜酸乳杆菌对胃癌的抑制作用
胃癌起源于胃黏膜上皮病变,其发病可由于地域、饮食、幽门螺杆菌、遗传等因素引发。膳食成分的化学预防在近些年来已成为控制胃癌发病率的一种新方法,特别是益生菌作为潜在的饮食癌症预防剂广受关注[10]。幽门螺杆菌(Hp)被认为是胃炎、胃溃疡和胃癌的重要致病因素。关于幽门螺杆菌感染治疗的第5 份共识报告”[11]也表明,在根除Hp 的过程中补充微生物制剂可能会减少抗生素对肠道微生态的不良反应。Al-Yassir F 等[12]研究了De Simone 配方(包含嗜酸乳杆菌在内的有益细菌混合物)对单次或多剂量乙酰水杨酸诱导胃壁损伤的小鼠模型的影响,结果表明De Simone 配方对分裂干细胞和胃的多种分泌细胞谱系具有调节作用,从而对胃糜烂起到保护和治疗作用。Zheng C 等[13]通过临床研究和动物实验发现,嗜酸乳杆菌能够显著降低胃癌患者胃切除术后炎症,促进术后恢复。
1.3 嗜酸乳杆菌对结肠癌的抑制作用
结肠癌常发生于结肠部位,发病率占胃肠道肿瘤的第三位,其病因主要与高脂肪、低纤维素饮食有关[14],严重时可出现黄疸、水肿、肝转移、肺转移等病征。体外实验和临床研究表明,嗜酸乳杆菌具有良好的抗结肠癌活性,其上清液对人克隆结肠腺癌细胞(colon cancer cell-2,Caco-2)有促凋亡和抗增殖作用[15]。Agah S 等[16]将38 只雄性小鼠分为4 组,分别为对照组、偶氮基甲烷(AOM)组、嗜酸乳杆菌组和双歧杆菌益生菌组,评价益生菌对AOM 诱导的小鼠结肠癌的保护作用。结果显示,与双歧杆菌相比,嗜酸乳杆菌组的肿瘤发生率显著下降,证明了嗜酸乳杆菌比双歧杆菌具有更高的抗肿瘤活性。从Zinatizadeh N 等[17]的临床实验中也可以看出,息肉、结肠癌患者和健康受试者的肠道中嗜酸乳杆菌数量存在显著差异,表明嗜酸乳杆菌对有结直肠癌家族史的患者具有预防作用,并建议将嗜酸乳杆菌作为肠息肉患者的营养补充剂。
1.4 嗜酸乳杆菌对宫颈癌的抑制
作为最常见的妇科恶性肿瘤,宫颈癌的发病近年来呈年轻化趋势。而传统抗生素在治疗生殖道感染时,会导致生殖道的微生态失调,预后不良。嗜酸乳杆菌作为生殖道黏膜微生物屏障的一部分,不但能黏附于生殖道上皮细胞,还具有维持生殖道pH 稳定、产生细菌素、阻止致病菌和有害微生物生长等作用[18]。Nami Y 等[19]通过细胞毒性试验和凋亡分析,比较了嗜酸乳杆菌在4 种人癌细胞系(AGS、HeLa、MCF-7 和HT-29)和一种正常细胞系人脐静脉内皮细胞(HUVEC)分泌的生物活性,结果表明,嗜酸乳杆菌36YL 菌株分泌物对HT-29 和HeLa 具有最强的细胞毒性作用。苗丽珍等[20]运用光镜分析嗜酸乳杆菌(BNCC 336974)对人子宫颈鳞癌细胞(SiHa)的黏附指数,结果表明,嗜酸乳杆菌对人子宫颈鳞癌细胞具有较强的黏附能力,从而降低宫颈的癌变概率。放射治疗是宫颈癌的主要治疗方法,最常见的急性副作用是辐射引起的腹泻(RID)。Linn YH 等[21]通过对54 名宫颈癌患者进行随机双盲安慰剂对照实验,结果显示,益生菌组的RID发生率低于安慰剂组,证明补充嗜酸乳杆菌是降低宫颈癌患者RID 发生率的一种方法。
1.5 嗜酸乳杆菌对其它癌症的抑制作用
除了以上几种常见癌症之外,嗜酸乳杆菌还能对发生在口腔、食道、前列腺和肺等其它部位的癌症产生较好的抑制作用。史晓燕等[22]通过体外细胞实验发现,嗜酸乳杆菌上清液对人舌癌细胞(Tca8113)增殖的抑制作用最强,其抑制作用具有密度依赖性和时间依赖性,该上清液细菌密度越高、作用时间越长,Tca8113 细胞的增殖能力就越弱。Barrett 食管(BO)是胃食管交界处的一种复杂疾病,其中正常鳞状上皮转变为柱状上皮并导致食管腺癌(OA)。Namin BM 等[23]通过体外实验,选择两种不同的Barrett 食管细胞系、长杆菌和嗜酸乳杆菌共培养,发现长杆菌和嗜酸乳杆菌共同培养能抑制肿瘤的表达,且治疗作用大于预防作用。因此,联用益生菌预防食管癌是可行的。另有研究[24]表明,嗜酸乳杆菌PTCC 1643 对口腔中的鳞状细胞癌具有抗增殖作用。Gui QF 等[25]研究发现,当Lewis 肺癌小鼠模型用顺铂治疗并灌胃给予嗜酸乳杆菌时,与仅用顺铂和磷酸缓冲液(PBS)治疗的对照组小鼠相比,肿瘤显著缩小,说明嗜酸乳杆菌的抗肿瘤作用可以到达肺部。
2 嗜酸乳杆菌抗肿瘤的作用机制
图1 为嗜酸乳杆菌抗肿瘤的作用机制,由4 个方面运作。
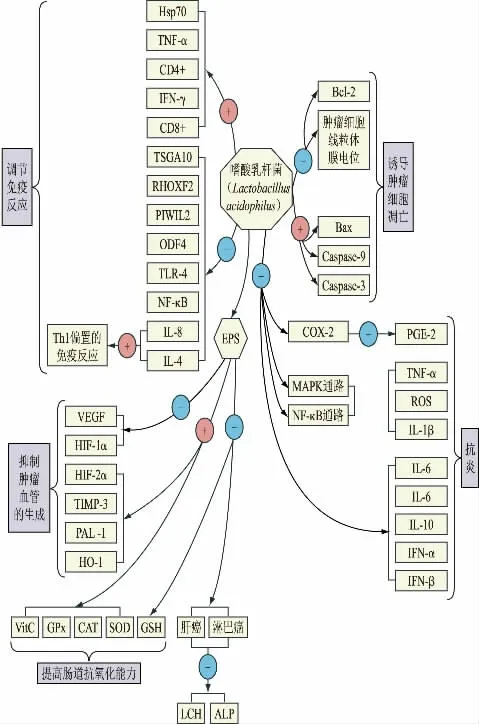
图1 嗜酸乳杆菌的抗肿瘤机制
2.1 诱导肿瘤细胞的凋亡
癌症的发生是多因素综合作用使得正常细胞恶性病变的结果,导致癌症发生的核心因素是基因的失常,抑制了癌症细胞的凋亡。因此,如何促进癌症细胞的凋亡成为抑制癌症的重要研究方向。Soltan DM 等[15]实验发现,嗜酸乳杆菌的上清液和嗜酸乳杆菌提取物均可在体外抑制结肠癌细胞(CaCo-2)的增殖,促进凋亡,并降低其迁移和侵袭能力。Baghbani-Arani F 等[26]通过MTT 法,用流式细胞技术以及qPCR 技术,证实了嗜酸乳杆菌在体外可通过上调含半胱氨酸的天冬氨酸蛋白水解酶caspase-9 和caspase-3 的表达、上调Bax/Bcl-2 比值,诱导内在通路依赖性细胞凋亡,从而促进结肠癌细胞HT-29 的凋亡。另一项研究[27]发现,嗜酸乳杆菌可粘附在HT-29 肿瘤细胞的表面、降低其细胞线粒体膜电位,导致线粒体内膜中的细胞色素c(Cyt c)释放到细胞质中,促进细胞凋亡。Zhang T 等[28]的进一步研究发现,嗜酸乳杆菌CICC6074 的S 层蛋白在体外可诱导人结肠细胞HT-29 的增殖、黏附和凋亡。
2.2 抗炎,减少致癌物的产生
有证据表明,炎症是癌症成熟的驱动因素,炎症与结直肠癌的风险密切相关。肠道微生物群在炎症微环境的形成中起着重要作用,而炎症的发生又会反过来影响肠道微生物群的组成[29]。Li S 等[30]探究了单一和组合益生菌的抗炎作用和机制,发现嗜酸乳杆菌不会降低细胞间粘附分子-1(ICAM-1),但会增强乳双歧杆菌抑制炎症的功效,两者联合使用具有很强的抗炎活性。Wang H 等[31]通过体外实验表明,嗜酸乳杆菌表层蛋白(SlpA)对LPS 诱导的小鼠巨噬细胞样细胞系(RAW264.7)的影响,结合硫酸二恶英钠(DSS)诱导的结肠炎小鼠作为体内模型,发现SlpA 抑制了LPS 诱导的RAW 264.7 细胞中炎症相关基因、白介素(IL-10)、IL-1β、干扰素(IFN-α)和IFN-β 的表达和诱导一氧化氮合酶(iNOS)和环氧化酶2(COX-2)等炎症介质的产生,并推测SlpA 的抗炎作用可能还与Toll 样受体4(TLR-4)、丝裂原活化蛋白激酶(MAPK)和核转录因子κB(NF-κB)以及调控细胞凋亡的NOD2(nucleotide-binding oligomerization domain 2)、NLRP3炎症小体信号失活有关。
2.3 调节免疫反应
免疫反应在机体对抗癌症的过程中起着重要作用,与传统疗法不同,免疫治疗作为一种独特的医疗手段,其作用对象是免疫系统而非直接针对肿瘤。这种新的疗法通过调节体液免疫、细胞免疫来对抗肿瘤,从而控制肿瘤的发生。近年研究表明,嗜酸乳杆菌可以通过增强机体的免疫能力从而预防癌症的发生[32]。癌症-睾丸抗原(CTAs)是一组肿瘤相关抗原,Azam R 等[33]通过体外实验,以MTT 法评估嗜酸乳杆菌和脆乳杆菌在MDA-MB-231 乳腺癌细胞系上的抗肿瘤活性,发现嗜酸乳杆菌可通过下调外周致密纤维4(ODF4)、Piwi 样介导的基因沉默2(PIWIL2)、Rho 同源基因家族成员2(RHOXF2)和睾丸特异蛋白10(TSGA10)四种癌症-睾丸抗原(CTAs)的表达,对乳腺癌细胞系MDA-MB-231 增殖产生抑制作用。据报道,Agah S 等[16]通过小鼠实验,发现口服嗜酸乳杆菌可以刺激免疫细胞的增殖,增加IFN-γ、IL-10 血清水平以及CD4+和CD8+细胞的数量,减少IL-4 的产生,从而达到调节免疫应答的作用,表明嗜酸乳杆菌是一种有效的免疫刺激剂。
2.4 胞外多糖的抗肿瘤活性
嗜酸乳杆菌的胞外多糖(EPS)是嗜酸乳杆菌在生长代谢过程中分泌到细胞壁外的荚膜多糖。研究证实,乳酸菌EPS 有较好的抗肿瘤效果,还可作为碳源调节结肠中的共生菌群的生长,从而发挥维持结肠稳态平衡的作用[34]。Deepak V 等[35]通过细胞实验,在常氧和低氧条件下研究EPS 对HCT15 结肠腺癌细胞系和CaCo2 细胞系中不同基因信使
3 小结与展望
RNA(mRNA)表达的影响,发现嗜酸乳杆菌的胞外多糖下调了血管内皮生长因子(VEGF)和缺氧诱导因子-1α(HIF-1α)的表达,并上调了金属蛋白酶组织抑制物-3(TIMP-3)、HIF-2α 和血红素加氧酶-1(HO-1)的组织抑制剂的表达,上调了纤溶酶原激活物抑制物-1(PAI-1)的水平,表明EPS 可能会抑制肿瘤血管生成。几年后,该团队[36]通过大鼠实验,发现嗜酸乳杆菌的胞外多糖可上调超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)3 种抗氧化酶以及维生素C 的水平,下调谷胱甘肽(GSH)水平,有利于提高肠道抗氧化能力,抑制结肠癌的发生。
癌症的传统治疗方法产生的种种副作用促使人们迫切寻求癌肿的辅助疗法;而肠道微生物未来有望成为辅助治疗癌症的新疗法之一。嗜酸乳杆菌可以通过多种机制影响肿瘤细胞活性,抑制其增殖,诱导其凋亡,对多种癌症具有预防和治疗作用。然而,在癌症患者中使用益生菌有利于治疗尚未建立权威指南,对于所需的最低微生物数量也没有达成共识。另外关于嗜酸乳杆菌的联合用药和胞外多糖方面的研究较少,特别是胞外多糖抗癌机制方面研究比较薄弱。因此,迫切需要加强对嗜酸乳杆菌的抗癌机制研究,并加大对嗜酸乳杆菌联合用药方面的研究力度,以对其抗癌机制形成一个全面、系统的理论,更好的指导临床用药。