二氢杨梅素对异丙肾上腺素诱导小鼠心肌纤维化的影响及机制研究
2022-07-15张月月许晓乐
张月月,许晓乐
1 南通大学附属第三医院 药学部,南通 226001;2 南通大学药学院 药理系,南通226001
心肌纤维化是与心脏损伤和疾病相关的常见病理变化。尽管在某些情况下,胶原和其他细胞外基质蛋白的沉积可能具有一定的保护作用;但延长的纤维化通常会对心脏功能产生负面影响,并导致有害的后果。抑制心脏纤维化可以改善心血管疾病、尤其是心衰患者的预后。二氢杨梅素(DMY)是藤茶中含量最丰富的天然黄酮类化合物,具有多种有效的生物和药理活性。在心血管方面,DMY 能抑制动脉粥样硬化斑块形成[1],改善糖尿病小鼠心肌和血管内皮功能[2,3],减轻阿霉素诱导的心脏毒性[4],改善心肌缺血/再灌注损伤[5],减轻主动脉缩窄引起的心肌肥厚[6]等。DMY 对心肌纤维化作用及机制研究尚未见报道。本研究首次采用皮下注射异丙肾上腺素建立小鼠心肌纤维化模型,观察DMY 对心肌纤维的防治作用及初步探讨其作用机制,为DMY 在心血管疾病方面的开发和临床应用提供实验和理论依据。
1 材料与方法
1.1 材料
1.1.1 动物 健康雄性C57BL/6 小鼠,22-25 克,购买于南通大学实验动物中心,许可证号是:SYXK(苏)2017-0046。
1.1.2 药品及试剂 DMY 购自西安天丰生物科技有限公司,含量为98%,批号NF-20 151110;美托洛尔(Met)购于Selleck 公司;异丙肾上腺素(ISO)购于Sigma-Aldrich 公司;乳酸脱氢酶(LDH)、肌酸激酶(CK)、羟脯氨酸(HYP)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、丙二醛(MDA)试剂盒均购于南京建成生物公司;肿瘤坏死因子α(TNFα)、白介素-6(IL-6)ELISA 试剂盒、组织总蛋白和核蛋白提取试剂盒、BCA 蛋白定量试剂盒均购于江苏海门碧云天生物技术研究所;总RNA 提取试剂盒购于北京天根生物技术公司;组蛋白H2A(Histone H2A)抗体(#2578)和核因子红细胞素相关因子2(Nrf2)抗体(#12721)均购自美国Cell signaling 公司;转化生长因子-β1(TGF-β1)抗体(21898-1-AP)、胶原蛋白Ⅰ(Collagen Ⅰ)抗体(67288-1-Ig)、胶原蛋白Ⅲ(Collagen Ⅲ)抗体(22734-1-AP)、平滑肌肌动蛋白α(α-SMA)抗体(55135-1-AP)均购自中国ProteinTech 公司;核转录因子κB(NF-κB p65)抗体(ab7970),抗体p-Smad2(ab53100)、p-Smad3(ab52903)、Smad2(ab40855)Smad3(ab40854)均购自美国Abcam 公司;抗体GAPDH(kc5G4)购自中国Kangchen 公司;其它试剂均为国产分析纯。
1.1.3 仪器 全套BIO-RAD 电泳及转膜系统(美国Bio-Rad L 公司);Synergy H1 全功能微孔板检测仪(美国Bio-TEK 公司);实时定量PCR 系统(Thermo Fisher 公司);Odyssey 双色红外激光成像系统(LI-COR 公司)。
1.2 方法
1.2.1 动物模型建立 小鼠背部皮下注射ISO,第1天剂量为5 mg·kg-1·d-1,之后以2.5 mg·kg-1·d-1剂量维持30 天,自由进食、给水;正常对照组小鼠皮下注射相同体积的生理盐水。小鼠随机分为5 组,即正常对照组、模型组、DMY 高(DMYH,200 mg·kg-1·d-1)、低剂量组(DMYL,100 mg·kg-1·d-1)、阳性对照药美托洛尔组(50 mg·kg-1·d-1);每组10 只。各组小鼠均每日灌胃给药1 次,连续给药30 天。药物混悬于0.5%羧甲基纤维素钠溶液中。正常对照组和模型组给予相同体积的溶媒。
建模结束,取鼠眼眶血与鼠心脏。
1.2.2 实验取材 造模结束前,实验动物禁食12 h,给以充足的水。取材前,小鼠称重。眼眶取血,将鼠心脏放入冷生理盐水中洗涤,心脏用滤纸吸干后称重,计算心重指数(CWI)。取部分左心室组织置入4%的多聚甲醛中固定待切片染色,其余部分液氮速冻。
CWI(mg·g-1)=全心重/体重
1.2.3 血清中LDH 和CK 含量检测 血清中LDH活性测定采用丙酮酸法,CK 活性测定采用肌酸显色法,按照试剂盒说明书配制试剂及操作,分别在波长440 nm 和660 nm 处测定血清LDH 和CK 活性。
1.2.4 血清中TNF-α、IL-6 含量检测 按照试剂盒说明书用ELISA 法检测血清中TNF-α、IL-6 含量。
1.2.5 Masson 染色 小鼠心脏样本在10%甲醛溶液中固定、石蜡包埋、切片心肌组织进行Masson 染色,具体方法参照本研究以往的报道[7]。用Image J软件对图像进行分析,计算心肌胶原容积分数(CVF)。CVF 为胶原阳性蓝色的面积占组织总面积的比值。
1.2.6 心肌组织HYP、MDA、SOD 及GSH-Px 测定 取适量心肌组织,准确称重。按照重量体积比1∶9 加入9 倍体积生理盐水,剪碎组织,冰浴中制备10%组织匀浆,3000 r·min-1离心10 min,取上清液。心肌组织HYP、MDA、SOD、GSH-Px 测定分别按照相关检测试剂盒的说明书操作。
1.2.7 Western blot 检测 组织总蛋白和核蛋白提取,以及BCA 蛋白定量按各自试剂盒说明书进行。将蛋白样品配平后加上样缓冲液,95 ℃、5 min 灭活,备用。按需配制凝胶,加样后,80 V 电泳至Marker 分离后换100 V 电泳。转膜后,将膜放入封闭液中,4 ℃过夜。漂洗后,一抗4 ℃孵育过夜;二抗室温避光孵育2 h。漂洗后,以红外激光成像扫描仪扫膜显影,并用图像分析系统进行灰度分析。
1.2.8 实时定量荧光PCR 检测 小鼠左心室匀浆后,参照RNA 提取试剂盒说明书提取总RNA,并进行逆转录,置于实时定量PCR 仪中进行PCR 检测,具体方法参照本研究以往的报道[7]。以18 s 作为内参基因,实验结果以2-ΔΔCT法计算基因的相对表达量。
引物序列如下:TNF -α:5’ -CGTCAGCCGATTTGCTATCT-3’(Forward)和5’-CGGACTCCGCAAAGTCTAAG -3’(Reverse);IL -6:5’ -AGTTGCCTTCTTGGGACTGA-3’(Forward)和5’-AGTTGCCTTCTTGGGACTGA -3’(Reverse);18s:5’ -CGCGGTTCTATTTTGTTGGT-3’(Forward)和5’-AGTCGGCATCGTTTATGGTC-3’(Reverse)。
1.3 数据统计分析
2 结果
2.1 DMY 对小鼠血清LDH 和CK 的影响
与正常对照组相比,模型组小鼠血清LDH 和CK 含量均显著增加(见图1A 和图1B);与模型组相比,给予DMY 高、低剂量及美托洛尔均能显著降低小鼠血清LDH 和CK 含量,表明DMY 能减轻异丙肾上腺素引起的心肌损伤。
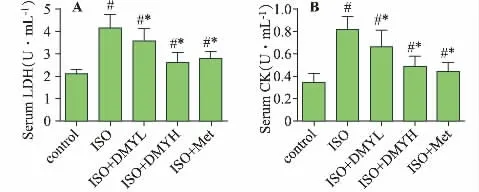
图1 DMY 对小鼠血清LDH 和CK 的影响
2.2 DMY 对小鼠体重和心重指数的影响
实验结束时,各组小鼠体重未出现显著性差异(见图2A)。与正常对照组相比,模型组小鼠心脏变大,心重指数(CWI)显著增加。与模型组相比,给予DMY 高剂量和美托洛尔能显著降低CWI(见图2B)。

图2 DMY 对小鼠心重指数的影响
2.3 DMY 对小鼠心肌纤维化的影响
Masson 结果显示,正常对照组心肌间质纤维组织较少,与正常对照组相比,模型组心肌间质可见较多纤维组织(见图3A)。胶原容积分数CVF 计算结果显示,模型组较正常对照组显著增加(见图3B)。与模型组相比,给予DMY 高、低剂量及美托洛尔能减轻心肌间质纤维组织,显著减少CVF(见图3A 和图3B)。与正常对照组相比,模型组小鼠心肌组织中羟脯氨酸含量显著增加,而给予DMY 高、低剂量和美托洛尔能显著降低小鼠心肌组织中羟脯氨酸的含量(见图3C)。与正常对照组相比,模型组小鼠心肌组织中Collagen Ⅰ、Collagen Ⅲ和α-SMA 蛋白表达显著增高;与模型组相比,给予DMY 高、低剂量和美托洛尔均显著降低小鼠心肌组织中CollagenⅠ、Collagen Ⅲ和α-SMA 蛋白表达(见图3D-F)。

图3 DMY 对小鼠心肌纤维化的影响
2.4 DMY 对小鼠心肌组织中TGF-β1/Smad 信号通路相关蛋白表达的影响
与正常对照组相比,模型组TGF-β1 蛋白表达显著增高,同时TGF-β1 下游信号通路中Smad2 和Smad3 的磷酸化表达显著增高;与模型组相比,给予DMY 高、低剂量和美托洛尔均显著降低小鼠心肌组织中TGF-β1 蛋白表达以及Smad2 和Smad3 的磷酸化表达(见图4)。
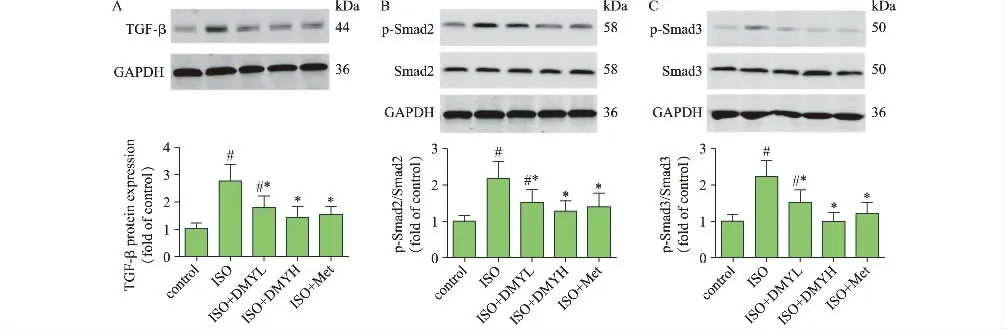
图4 DMY 对小鼠心肌组织中TGF-β1/Smad 信号通路相关蛋白表达的影响
2.5 DMY 对小鼠心肌组织中氧化应激的影响
与正常对照组相比,模型组小鼠心肌组织中MDA 含量显著增高,抗氧化物酶SOD 和GSH-Px活性显著降低。与模型组相比,给予DMY 高、低剂量和美托洛尔均显著减少MDA 含量,增强抗氧化物酶SOD 和GSH-Px 活性。Nrf2 是抗氧化信号通路关键因子,结果显示,与正常组相比,模型组小鼠肝脏Nrf2 入核显著减少,而给予DMY 高、低剂量和美托洛尔均显著增加Nrf2 的入核(见图5)。

图5 DMY 对小鼠心肌组织中氧化应激的影响
2.6 DMY 对小鼠心肌组织中炎症反应的影响
与正常对照组相比,模型组小鼠血清中TNFα、IL-6 含量显著增加,同时心肌组织中TNF-α、IL-6 mRNA 表达显著提高;与模型组相比,给予DMY高、低剂量和美托洛尔均显著减少血清中TNF-α、IL-6 含量和心肌组织中TNF-α、IL-6 mRNA 表达。与正常对照组相比,模型组小鼠心肌组织中炎症转录因子p65-NF-κB 入核显著增加;与模型组相比,给予DMY 高、低剂量和美托洛尔均显著减少p65-NF-κB 入核(见图6)。

图6 DMY 对小鼠心肌组织中炎症反应的影响
3 讨论
心脏纤维化是几乎所有类型心脏病终末期的特征。心肌细胞外基质的积累导致心律失常和心功能受损的风险增加,最终发展为心力衰竭。因此,寻找和开发减轻心肌纤维化的药物对防治心肌纤维化、降低死亡率具有重要意义[8]。
心脏病的临床前模型是揭示心脏纤维化发展过程中涉及的复杂发病机制的重要工具,进而可以确定新的治疗靶点和促进抗纤维化药物的发现。许多临床前模型已被用于研究心脏纤维化,一般来说,临床前模型可以根据诱导方式大致分为手术诱导、化学诱导和遗传模型三大类。每种模型都有其自身的优势和局限性。ISO 皮下注射诱导的心肌纤维化模型优势在于方法简单且无创接近自然病理进程。ISO 作用于β1-肾上腺素受体以增加心脏收缩力和速率,激活肾素血管紧张素醛固酮系统,促进了心脏肥大和心肌纤维化的发生发展[9],该模型已用于筛选大量植物药产品及其活性成分[10]。根据文献报道[11],本研究采用给小鼠皮下注射ISO 30 d的方法建立小鼠心肌纤维化模型。ISO 模型组小鼠血清LDH 和CK 含量均显著增加,说明ISO 导致了心肌损伤;模型组小鼠心脏变大,CWI 显著增加,说明长期注射ISO 导致心肌肥大;模型组小鼠心肌间质纤维组织显著增多,反映结缔组织疾病的胶原代谢情况的羟脯氨酸含量显著增加,提示成功复制了ISO 致心肌纤维化模型,该方法简便、经济、可靠。在小鼠心肌纤维化模型制备成功的基础上,观察了DMY 对ISO 诱导的心肌纤维化的作用。结果显示,DMY 能降低血清LDH 和CK 含量,减轻心肌损伤;降低小鼠CWI 和心肌中羟脯氨酸含量;病理染色结果显示,DMY 可以减轻小鼠心肌纤维化程度,降低心肌组织中胶原沉积,具有防治心肌纤维化的作用。
实验研究已证实ISO 能通过多种途径增加TGF-β1 这一关键的致心肌纤维化细胞因子的表达和其在心肌中的含量[9,10]。TGF-β1 能通过自分泌和旁分泌方式刺激心肌成纤维细胞增殖,并使心肌成纤维细胞向α-SMA 高表达的肌成纤维细胞转化,从而使Collagen Ⅰ和Collagen Ⅲ等胶原蛋白在心肌中大量生成并沉积,许多促纤维化因子均通过它们起到作用。此外,TGF-β1 还通过信号转导途径影响其他细胞因子,形成细胞因子网络,使其致纤维化效应增强。因此,TGF-β1 过度表达在纤维化机制中起到关键作用,TGF-β1 也多作为治疗纤维化病变的靶标[12]。本实验结果显示,DMY 能抑制ISO 导致的小鼠心肌中TGF-β1 蛋白表达及α-SMA、CollagenⅠ和Collagen Ⅲ蛋白表达。研究表明,Smad2/3蛋白复合物是纤维化过程中TGF-β1 的经典的下游靶标。过度的TGF-β1/Smad2/3 信号或心脏成纤维细胞中TGF-β1 刺激的长期效应,被认为是心脏纤维化的生理、病理基础[12]。以往实验已证明,抑制Smad2/3 可抑制心脏成纤维细胞中的纤维化基因程序和细胞外基质重塑[12]。考虑到这一点,Smad 蛋白亦是减少纤维化的重要靶点。实验结果显示,DMY能降低注射ISO 导致的小鼠心肌组织中Smad2 和Smad3 的磷酸化表达。以上结果表明,对TGF-β1/Smad2/3 信号通路的抑制机制参与了DMY 减弱心肌纤维化的作用。
氧化应激参与心肌梗死后左心室重构和心力衰竭的发生和发展。这些发现表明,氧化损伤和纤维化相互作用,并在恶化的心脏重塑过程中加速结构改变和心室功能障碍。抗氧化剂被证明能改善心脏功能并产生抗纤维化作用[13]。大量实验已证明,ISO 通过诱导心脏组织中的氧化应激而引起毒理学变化,从而导致抗氧化物酶的消耗,促进心肌纤维化的发生[9,10,13]。
本实验结果表明,与正常对照组相比,ISO 诱导的小鼠心肌组织中脂质过氧化损伤的生物标记物MDA 含量增强,而抗氧化物酶SOD 和GSH-Px 活性显著降低。而给与DMY 能降低心肌MDA 含量,增强抗氧化物酶SOD 和GSH-Px 活性。Nrf2 通路是抗氧化系统的中心,在心脏病,尤其是心脏纤维化的治疗中具有越来越重要的意义。Nrf2 是一种碱性亮氨酸拉链蛋白,调节抗氧化蛋白的表达,防止损伤和炎症引起的氧化损伤[14]。Nrf2 是一个复杂调节网络的核心,在代谢、炎症、自噬、蛋白质保留、线粒体生理学和免疫反应的调节中发挥着许多重要作用[14]。当遇到应激条件时,如氧化应激,Nrf2 被人体的防御机制激活并进入细胞核,增加抗氧化相关基因、血红素加氧酶-1、SOD、GSH-Px 和硫氧还蛋白等的转录。DMY 对Nrf2 的作用已在不少病理模型上被证实。比如Tian X 等[15]报道DMY 可通过调节Nrf2 信号通路减轻脓毒症急性肾损伤。Qiu P 等[16]报道DMY 通过促进Nrf2 核易位对乙醇诱导的肝损伤具有保护作用。本实验结果表明,给予ISO 作用的小鼠DMY 能显著增加Nrf2 的入核。这些结果提示,DMY 能增强Nrf2 的核转录,由此推测增加了抗氧化酶SOD 和GSH-Px 的活性,发挥抗氧化作用清除ROS,有助于减轻心肌纤维化。
众所周知,炎症反应在心脏纤维化中起着重要作用。炎症和氧化应激也存在互相影响。炎症细胞因子、趋化因子和生长因子通过直接作用于成纤维细胞、刺激成纤维巨噬细胞和淋巴细胞的募集和激活,以及触发血管细胞和心肌细胞中的成纤维程序,参与了心脏纤维化的发病机制。此外,长期慢性炎症可能导致心肌细胞坏死,引发修复性纤维化。促炎细胞因子TNF-α、IL-6 的水平在许多与纤维化相关的心肌病理条件下显著升高。TNF-α、IL-6 致纤维化作用可能涉及对成纤维细胞的直接或间接的作用,与巨噬细胞的募集、基质细胞蛋白的诱导和具有显著成纤维细胞激活特性的生长因子、如TGF-β1 的上调有关[17]。
本实验结果显示,DMY 能减少ISO 作用的小鼠血清中TNF-α、IL-6 含量和心肌组织中TNF-α 和IL-6 mRNA 表达。转录因子NF-κB 控制各种炎症细胞因子的诱导。在正常情况下,NF-κB p65 亚单位与其抑制对应物Iκ-Bα和其他IκB 蛋白结合,形成存在于细胞质中的非活性复合物。当激活后,Iκ-Bα 被磷酸化,导致p65-NF-κB 的激活和移位进入细胞核,在那里它介导炎症基因如TNF-α、IL-6 的表达[18]。Zhao Y 等[19]报道DMY 可通过抑制NF-κB介导的炎症和TGF-β1 调节的PI3K/Akt 信号通路逆转硫代乙酰胺诱导的肝纤维化。Zhou MQ 等[20]报道二氢杨梅素通过NF-κB 途径保护脂多糖诱导的心肌细胞损伤。本实验结果表明,在心肌纤维化模型上DMY 可显著减少p65-NF-κB 入核,减轻炎症反应,亦有助于减轻心肌纤维化。
综上所述,本研究证明,DMY 能减轻ISO 诱导的小鼠纤维化。DMY 可通过增强Nrf2 抗氧化信号通路减轻心肌氧化应激,抑制转录因子p65-NF-κB活化,减轻心肌炎症反应,有助于干预TGF-β1/Smad2/3 信号通路的活化,减轻心肌纤维化。这些结果表明,DMY 可能是预防和治疗心肌纤维化的有前途的候选药物。