提高血钾浓度通过减轻氧化应激改善心肺复苏大鼠脑缺血再灌注损伤
2022-07-15杨叶桂李诺石佳欣黄京菊方卫覃斯娜谢露陈蒙华
杨叶桂 李诺 石佳欣 黄京菊 方卫 覃斯娜 谢露 陈蒙华*
发生心跳骤停(Cardiac Arrest,CA)后恢复自主循环(Return of Spontaneous Circulation,ROSC)的患者仍有一定几率发生迟发性脑损伤,此现象与脑的缺血再灌注损伤(Ischemia Reperfusion Injury,IRI)有关。大量活性氧(reactive oxygen species,ROS)的生成导致脑组织氧化应激损伤是缺血再灌注机制之一。降低氧化应激损伤成为减轻心肺复苏(Cardiopulmonary Resuscitation,CPR)患者迟发性脑损伤的有效手段。
既往研究显示:相比电刺激诱导CA 的动物模型而言,使用高血钾诱导CA 的动物控制性高血钾能够耐受更长时长的脑缺血,且复苏后脑损伤表象甚微[1,2]。我们推测后者血液中的较高的血钾水平可能发挥减轻脑组织IRI 的作用,因为在体外实验还证实了细胞外高钾环境能够抑制细胞凋亡的发生[3]。
ROS 含量在短时间内剧增是引起氧化应激损伤的原因。而ROS 水平是体内活性氧“生成”和“清除”两种机制共同作用下的结果。假如提高CA 动物模型血钾能够发挥脑保护作用,其潜在机制是降低ROS 的生成水平还是提升ROS 的清除能力尚未可知。
本研究将基于ROS 代谢原理,探讨控制性高血钾降低CA 动物模型脑损伤的潜在机制。
1 材料与方法
1.1 动物随机从广西医科大学实验动物中心选取7-8 周,体重为210-240 g,健康成年雄性Sprague⁃Dawley(SD)大鼠,置在SPF 级环境进行饲养,室内温度26℃,术前禁食12 h,允许自由饮水和活动。本研究方案经广西医科大学动物伦理委员会批准,动物许可证号:SYXK 桂2014-0003。
1.2 动物模型动物模型的准备:腹腔注射2%戊巴比妥钠注射液(30 mg/kg)麻醉大鼠,分别分离左侧股静脉、股动脉,并穿刺置管,分别用于药物注射及动脉压监测,记录标准Ⅱ肢体导联心电。
动物模型建立:根据Chen 等[4]人报道的方法,经食道电刺激诱导大鼠室颤,建立CA/CPR 模型,将CA 大鼠随机为生理盐水组(NS 组,n=16),氯化钾组(KCL 组,n=16)。CA 6 min 时,分别经静脉注射3.2 ml/kg 的生理盐水、2.5%氯化钾(60 ug/g),同时行常规CPR、机械通气。CPR 启动后未ROSC,则在CPR 1 min、3 min 静脉注射肾上腺素(0.02 mg/kg)。CRP 10 min 仍未ROSC 则定义为复苏失败。ROSC 后维持血流动力学稳定1 h,后撤机、拔管,置于笼中单独饲养。另随机选取12 只大鼠作为假手术组(SH 组,n=12),仅行麻醉及穿刺置管。建模期间,使用加热灯维持大鼠体温恒定(直肠温度37.0±0.3℃)。
1.3 评判标准(1)CA 的标准:心电图显示室颤或无脉电活动,平均动脉压<20 mmHg(1 mmHg =0.133 kPa)。(2)ROSC 的标准:心电呈室上性节律(窦性、房性、交界性心律),平均动脉压≥50 mmHg持续5 min 以上。
1.4 检测指标记录ROSC 后30 min 平均动脉压(MAP),ROSC 后24 h 神经功能评分(NDS),ROS、丙二醛(MDA)、超氧化物歧化酶(SOD)。(1)NDSROSC 后24 h 进行NDS 评分,总分0-80 分,分数越低提示神经损伤越重。(2)ROS 荧光强度、MDA 水平、SOD 活性的检测ROSC 后24 h,随机抽取7 只大鼠/组,麻醉后立即断头取脑,冰冻标本后,分离左右大脑用于后续检测。ROS 荧光强度:作右侧脑组织视交叉处冠状面切片,用二氢乙啶(10 mmol/L)避光孵育30 min,用激光共聚焦显微镜测定海马区荧光强度。MDA 水平、SOD 活性:取左侧海马组织100 mg 进行匀浆,用多功能酶标仪测定MDA 的吸光度值(波长532 nm)及SOD 吸光度值(波长550 nm),按测定盒(南京建成生物工程研究所)提供公式计算MDA 含量和SOD 活力。
1.5 统计学方法采用SPSS 22 统计软件进行分析。计量资料采用(±s)表示,服从正态分布、方差齐性的计量资料使用ANOVA 单因素方差分析;方差不齐使用Dunnett's 两两比较,P<0.05 为差异有统计学意义。
2 结 果
2.1 各组大鼠的基线特征见表1。
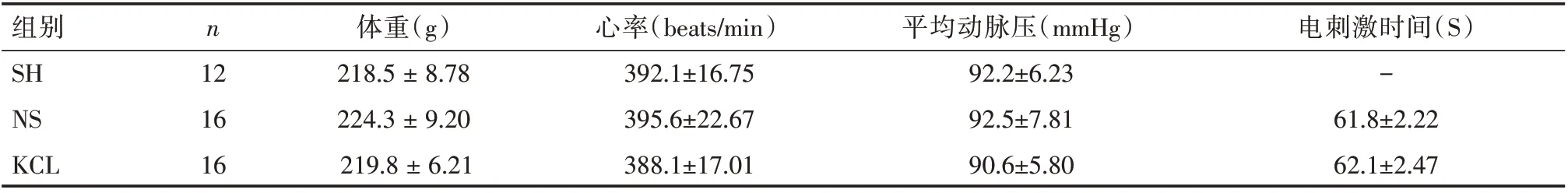
表1 各组大鼠基线特征
2.2 各组大鼠复苏效果比较见表2。
2.3 ROSC 后30min 的MAP 比较见图1。
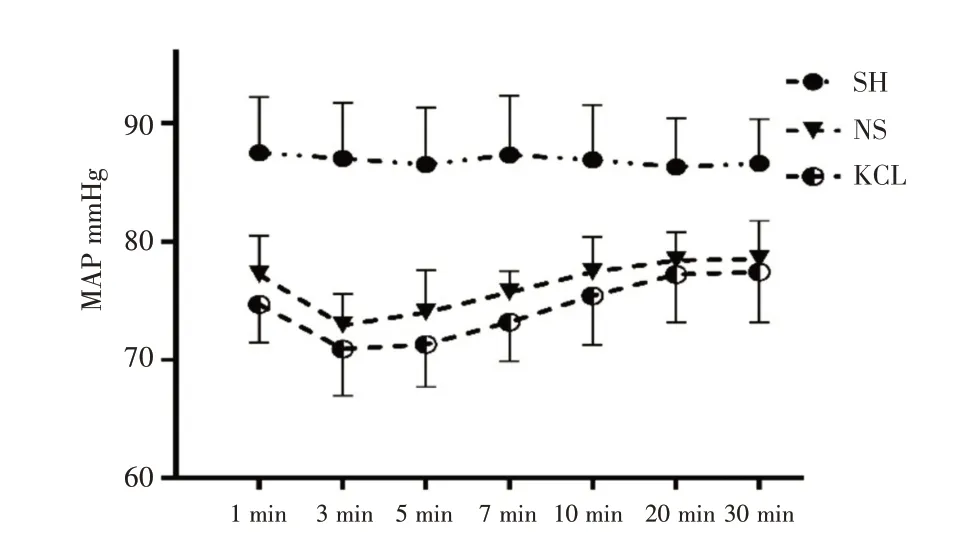
图1 ROSC 后1-30 min 的MAP 比较
2.4 海马ROS、MDA水平、SOD活性比较见表2。

表2 各组大鼠复苏效果的比较

表2 各组大鼠复苏效果的比较
3 讨 论
在本研究中结果显示KCL 组大鼠ROSC 后24 h NDS 明显改善,ROS 及MDA 水平,ROSC 后1-30 min MAP 无统计学差异,结果表明提高血钾可能通过抑制ROS 生成,减轻氧化应激,改善脑IRI,使用该剂量氯化钾是安全的。
ROS 是电子与氧结合生成的单电子还原产物。缺血缺氧时线粒体出现呼吸链功能障碍,导致电子泄露,恢复再灌注时大量泄露电子与富含氧血液中的氧气结合,产生大量ROS。过量的ROS 增加降解细胞内的脂质结构,从而造成氧化应激损伤,导致线粒体去极化、膜电位丧失,加重线粒体功能障碍,导致线粒体释放更多的ROS[5]。MDA 是过量ROS 氧化磷脂的多聚不饱和脂肪酸的产物,其含量高低反映氧化损伤程度。SOD 是生物体内清除自由基的重要的抗氧化酶。本研究发现,CPR 时提高血钾浓度可减少ROS 及MDA 水平,减轻大脑神经损伤,但SOD 未见明显改变,因此,推测提高血钾可能通过减轻ROS 的生成,抑制氧化应激,改善脑IRI。
细胞内钾离子外排和细胞收缩是细胞凋亡的特征,细胞质钾离子在启动细胞凋亡中起调节作用。研究发现提高细胞外钾离子浓度可改善线粒体功能,减轻缺血缺氧损伤[3,6]。Crestanello JA等[7]发现,使用线粒体钾离子通道开放剂可增加钾离子内流,可抑制ROS 的生成,维持线粒体的稳定性,延缓或减轻细胞凋亡。另有研究报道,细胞内外钾离子浓度可影响caspase 的激活和由化学应激诱导的凋亡的启动,细胞内钾离子升高至135 mM 可以完全抑制CD95 介导的凋亡,低于95 mM则无明显改善,介于95 mM 至135 mM 时,其保护效应与钾离子浓度呈浓度依赖性[8]。那么,CPR 时继续增加氯化钾剂量是否可以增强其保护作用?众所周知,CA/CPR 后的心脏经历了缺血及IRI 的双重打击,对高血钾的耐受性会降低。本研究中,氯化钾组大鼠ROSC 后的MAP 与NS 组比较,虽无统计学差异,但ROSC 后10 min 内的MAP 呈现一定的下降趋势,继续增加剂量则可能增加其对心肌的负性作用,削弱其保护作用。因此,适度提高细胞外钾离子浓度可改善脑IRI,但需警惕过高血钾对心肌的抑制作用。
综上,CPR 时升高血钾通过减少ROS 生成,降低MDA水平,减轻氧化应激,改善CPR后的脑IRI。
4 结 论
心肺复苏早期升高血钾浓度可抑制ROS 生成,减少氧化应激改善脑IRI。
