强心方对慢性心力衰竭大鼠心肌线粒体能量代谢与自噬的影响
2022-07-14罗远林徐燕梅谭志强周学锋刘焕云
罗远林, 徐燕梅, 谭志强, 周学锋, 刘焕云
(1.乐山市人民医院,四川乐山 614000;2.乐山职业技术学院医学系,四川乐山 614000;3.重庆两江新区第一人民医院心血管内科,重庆 401121)
慢性心力衰竭(chronic heart failure)(简称慢性心衰)是心脏多种疾病发展至终末期的临床综合征,其发病机理与心肌长期缺血导致的心脏结构改变有关[1-2]。慢性心衰治疗多以药物为主,其中,中医药发挥日益重要的作用。中医古代文献无慢性心衰病名记载,根据症状可将其归属于“心痹”“心悸”“喘证”“水肿”等范畴,其主要病机以心阳气虚为本,瘀血、水饮、痰浊为标,属本虚标实之证[3]。对于慢性心衰患者,在西药规范化治疗基础上加用温阳活血利水方药(强心颗粒)能够减轻慢性心衰患者的临床症状,可增强心肌收缩力,增加心输出量,明显改善心功能等[4]。已有实验研究证实,采用温阳活血利水法对慢性心衰大鼠具有良好的治疗作用,并有助于改善慢性心衰大鼠的预后[5]。本研究采用的强心方是参考强心颗粒组方进行加减的经验方,具有活血、补气及利水功效。本研究通过构建慢性心衰大鼠,观察强心方的治疗机制,以期为其临床应用治疗慢性心衰提供依据,现将研究结果报道如下。
1 材料与方法
1.1 实验动物72只SPF级Wistar雄性大鼠,体质量200 ~250 g,由基尔顿生物科技(上海)有限公司提供,动物质量许可证号:SYXK(上)2019-0006,在通风且干净的环境中对大鼠进行饲养,5只大鼠1个笼子,温度为23 ℃左右,湿度要求为50%左右,黑夜白昼交替循环,自由进食标准颗粒饲料,饮干净饮用水。所有实验动物于开始实验前,适应环境饲养1周。动物实验的实施严格遵照《实验动物护理和使用指南》,动物实验地点为重庆大学动物实验中心。
1.2 试剂与仪器单磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)酶联免疫吸附分析(ELISA)试剂盒(上海酶联生物科技有限公司);二喹啉甲酸(BCA)蛋白定量试剂盒(天津金克隆生物技术有效公司);考马斯亮蓝染色试剂盒(上海纪宁生物科技有限公司);过氧化物酶体增殖物激活受体(PPAR)-γ 抗体(武汉益普生物科技有限公司);微管相关蛋白轻链3Ⅱ(LC3-Ⅱ)抗体(美国Abcam 公司); p38 丝裂原活化蛋白激酶(p38MAPK)、磷酸化p38MAPK(p-p38MAPK)抗体[微蒙(上海)生物科技有限公司];GAPDH 抗体(云南圣克鲁斯生物科技有限公司);异硫氰酸荧光素(FITC)标记荧光二抗(武汉博士德生物工程有限公司);苏木素-伊红(HE)染色试剂盒[康迪斯化工(湖北)有限公司];免疫荧光染色试剂盒-抗兔FITC(上海碧云天生物技术有限公司)。L535R低速离心机(湖南湘仪实验室仪器开发有限公司);S80彩色多普勒超声诊断仪[大为医疗(江苏)有限公司];UG-1 荧光显微镜[赛默飞世尔科技(中国)有限公司];Leica TCS SP8激光扫描共聚焦显微镜(成都生物所公共实验技术中心提供)。
1.3 药物及制备强心方的组成为黄芪9 g、炒白术9 g、干姜6 g、水蛭6 g、茯苓12 g、车前子9 g、枳实9 g、葶苈子6 g、炙甘草12 g。将上述所有中药材加10 倍量水煎煮60 min,过滤,药渣再加8 倍量水煎煮60 min,过滤,减压浓缩至相对密度1.25 ~1.30 的稠膏,加适量糊精混合均匀,制成颗粒,60 ℃烘干,整粒,分装。规格为每袋9 g,每袋相当于原生药材17.31 g,由我院药剂科制备并提供。卡托普利片(广州迈特兴华制药公司产品,批号:国药准字H44023128)。
1.4 造模建模前对72只大鼠均采用S80彩色多普勒超声诊断仪进行心脏检查,以确保心功能正常。抽取60只大鼠用1%戊巴比妥钠麻醉后,连接小动物呼吸机,在3 ~4 肋骨间分离皮肤后剪开心包后用5 号丝线结扎左侧心耳及动脉圆锥正下方2 mm处,后缝合皮肤。待大鼠自主呼吸后撤掉呼吸机。连续3 d 注射40 万U 的青霉素。剩余12只大鼠仅切口穿线不结扎。4周后,行心脏彩超,若左心室射血分数(LVEF)<45%,则判断为建模成功[6]。因感染导致死亡大鼠5只,共有55只大鼠建模成功。仅切口穿线不结扎的大鼠无死亡。
1.5 分组与干预方法将55只造模成功的大鼠按照体质量随机分为模型组,卡托普利组,强心方低、中、高剂量组,每组11只。将其余12只仅切口穿线不结扎的大鼠设为假手术组。大鼠给药剂量按成人与大鼠体表面积法[7]进行换算,为7.92 g·kg-1·d-1(设为中剂量),高、低剂量分别为中剂量的2 倍和1/2 倍,即15.84、3.96 g·kg-1·d-1。建模第1天,强心方低、中、高剂量组大鼠分别灌胃3.96、7.92、15.84(生药)g·kg-1·d-1的强心方混悬液,卡托普利组大鼠灌胃10 g/mL 的卡托普利。假手术组和模型组分别灌胃等体积生理盐水溶液。每日1次,连续4周。
1.6 观察指标与方法
1.6.1 ELISA法检测血清AMP、ADP、ATP含量干预4周后,麻醉大鼠,胸部主动脉采血,3500r/min(离心半径10 cm)离心10 min,取上清液,按照ELISA 试剂盒说明书操作,应用酶标仪在400 nm波长处检测光密度(OD)值,根据标准曲线和OD值计算血清ATP、ADP、AMP水平。
1.6.2 考马斯亮蓝染色法检测心肌组织Na+-K+ATP酶及Ca2+-Mg2+ATP酶的活性 干预4周后,麻醉大鼠,取左侧心室心肌组织100 mg,制备组织匀浆,将低速离心机调整为3500 r/min(离心半径10 cm),运转10 min 后,保留上清液。按照考马斯亮蓝蛋白测定试剂盒说明书,经蛋白浓度测定,酶促反应,定磷及ATPase 活力计算等步骤检测心肌组织Na+-K+ATP酶、Ca2+-Mg2+ATP酶活性的变化。
1.6.3 HE染色法观察心肌组织形态 心脏组织甲醛固定后,进行石蜡包埋,切片5 μm。脱蜡,苏木素染色10 min 后以小流量自来水冲洗,1%的盐酸乙醇褪色变红后停止操作,再次1%伊红复染,脱水。封片。最后光学显微镜下观察心肌组织形态。
1.6.4 免疫荧光法检测心肌组织自噬蛋白LC3-Ⅱ表达 取心室肌组织部分PBS 清洗,4%多聚甲醛固定,脱水,石蜡包埋,切片,烤片。在切片组织上滴加正常山羊血清,室温封闭60 min。吸水纸吸掉封闭液,再在每张切片组织上滴加足够量的LC3-Ⅱ抗体(1∶200)并放入湿盒,4 ℃孵育过夜。阴性对照用PBS 液代替一抗。取出湿盒,室温复温30 min,PBS浸洗切片3次,每次3 min。吸水纸吸干切片组织上多余液体后滴加稀释好的FITC 荧光二抗(1∶800),湿盒中37 ℃孵育60 min。PBS 清洗3 次,每次3 min。滴加DAPI 避光孵育15 min。PBS 清洗4 次,每次5 min。用含有抗荧光淬灭剂的封片液封片,然后在激光扫描共聚焦显微镜下观察采集图像。在高倍镜(×200)下,每张组织切片选取3个视野,每一个视野计数100个细胞,按LC3-Ⅱ阳性细胞所占百分比进行评分,无阳性表达计0 分,阳性细胞数<30%计1 分,阳性细胞数≥30%计2分。
1.6.5 蛋白免疫印迹法检测心肌组织中p38MAPK、p-p38MAPK、PPAR-γ蛋白表达 取心肌组织,裂解提取蛋白,BCA 法进行蛋白定量;加入5×十二烷基硫酸钠(SDS)上样缓冲液,煮沸使蛋白变性;加样,进行SDS-聚丙烯酰胺凝胶电泳(PAGE)分离蛋白后,电转移至PVDF 膜;用5%脱脂奶粉室温封闭1 h;加入一抗稀释液p38MAPK(1∶500)、p-p38MAPK(1∶500)、PPAR-γ(1∶500),内参为GAPDH(1∶2000),室温孵1 h后5 ℃孵育过夜;加入HRP 标记的IgG 稀释液(1∶5000),室温孵育1 h;加入电化学发光试剂(ECL)显影,凝胶成像系统进行图像采集和分析,结果以目的蛋白条带与GAPDH 蛋白条带的灰度比值作为目的蛋白的相对表达水平。
1.7 统计方法采用SPSS 23.00 统计软件进行数据分析,实验数据结果以均数± 标准差(x±s)表示,多组比较采用单因素方差异分析,组间两两比较采用LSD-t检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清中ATP、ADP、AMP含量比较表1结果显示:与假手术组比较,模型组大鼠血清ATP 含量降低,ADP、AMP 含量升高(P<0.05);与模型组比较,强心方低、中、高剂量组与卡托普利组大鼠血清ATP 含量升高,ADP、AMP 含量降低(P<0.05),其中,强心方低、中、高剂量组上述指标组间比较,差异有统计学意义(P<0.05),强心方高剂量组上述指标与卡托普利组比较,差异均无统计学意义(P>0.05)。
表1 各组大鼠血清中三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)含量比较Table 1 Comparison of ATP,ADP and AMP levels in serum among various groups of rats (±s,μg·mL-1)
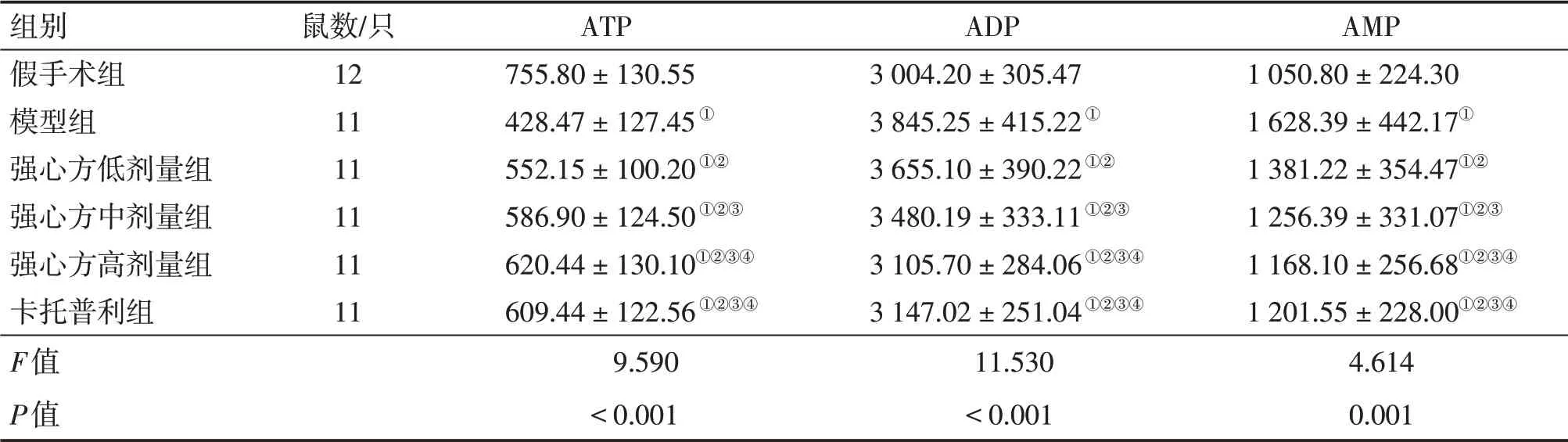
表1 各组大鼠血清中三磷酸腺苷(ATP)、二磷酸腺苷(ADP)、单磷酸腺苷(AMP)含量比较Table 1 Comparison of ATP,ADP and AMP levels in serum among various groups of rats (±s,μg·mL-1)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与强心方低剂量组比较;④P<0.05,与强心方中剂量组比较
组别假手术组模型组强心方低剂量组强心方中剂量组强心方高剂量组卡托普利组F值P值鼠数/只121111111111 ATP 755.80±130.55428.47±127.45①552.15±100.20①②586.90±124.50①②③620.44±130.10①②③④609.44±122.56①②③④9.590<0.001 ADP 3004.20±305.473845.25±415.22①3655.10±390.22①②3480.19±333.11①②③3105.70±284.06①②③④3147.02±251.04①②③④11.530<0.001 AMP 1050.80±224.301628.39±442.17①1381.22±354.47①②1256.39±331.07①②③1168.10±256.68①②③④1201.55±228.00①②③④4.6140.001
2.2 各组大鼠心肌组织线粒体酶活性比较表2结果显示:与假手术组比较,模型组大鼠心肌组织匀浆中Na+-K+ATP酶、Ca2+-Mg2+ATP酶活性降低(P<0.05);与模型组比较,强心方低、中、高剂量组与卡托普利组Na+-K+ATP酶、Ca2+-Mg2+ATP酶活性升高(P<0.05),其中,强心方低、中、高剂量组上述指标组间比较,差异有统计学意义(P<0.05),强心方高剂量组上述指标与卡托普利组比较,差异均无统计学意义(P>0.05)。
表2 各组大鼠心肌组织线粒体酶活性比较Table 2 Comparison of mitochondrial enzyme activities in myocardial tissues among various groups of rats(±s,μmol·mg-1·h-1)
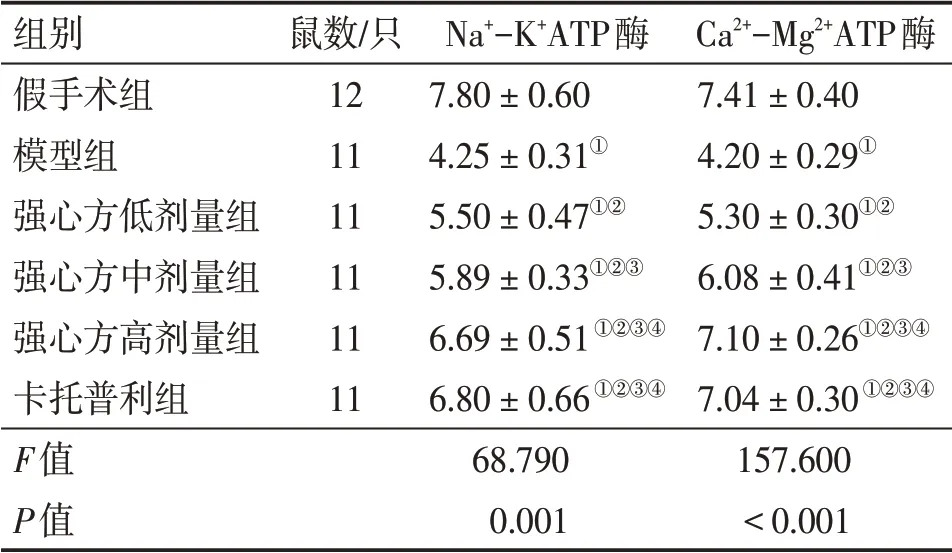
表2 各组大鼠心肌组织线粒体酶活性比较Table 2 Comparison of mitochondrial enzyme activities in myocardial tissues among various groups of rats(±s,μmol·mg-1·h-1)
①P<0.05,与假手术组比较;②P<0.05,与模型组比较;③P<0.05,与强心方低剂量组比较;④P<0.05,与强心方中剂量组比较
组别假手术组模型组强心方低剂量组强心方中剂量组强心方高剂量组卡托普利组F值P值鼠数/只121111111111 Na+-K+ATP酶7.80±0.604.25±0.31①5.50±0.47①②5.89±0.33①②③6.69±0.51①②③④6.80±0.66①②③④68.7900.001 Ca2+-Mg2+ATP酶7.41±0.404.20±0.29①5.30±0.30①②6.08±0.41①②③7.10±0.26①②③④7.04±0.30①②③④157.600<0.001
2.3 各组大鼠心肌组织病理形态比较图1结果显示:假手术组大鼠心肌组织形态规则,细胞核分布均匀,未见变性坏死;模型组大鼠心肌组织细胞变形,结构紊乱,部分纤维组织断裂,伴大量炎症细胞浸润;强心方低、中、高剂量组及卡托普利组大鼠心肌纤维排列逐渐规则,心肌细胞水肿及坏死减少,逐渐恢复正常,炎症细胞浸润减少,其中以强心方高剂量组改善最显著,改善程度与假手术组相近。
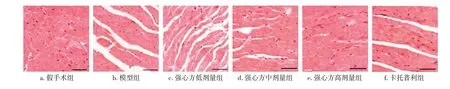
图1 各组大鼠心肌组织病理形态比较(HE染色,×200)Figure 1 Comparison of the histopathological morphology of myocardium among various groups of rats(HE staining,×200)
2.4 各组大鼠心肌组织自噬蛋白LC3-Ⅱ表达比较图2、图3结果显示:假手术组大鼠心肌组织自噬蛋白LC3-Ⅱ阳性表达率为(10.15±0.33)%、模型组为(49.66±7.55)%,强心方低、中、高剂量组分别为(30.49±4.11)%、(26.28±3.52)%、(22.30±2.80)%,卡托普利组为(23.06 ± 3.11)%。多组间比较存在差异(F=112.800,P<0.05)。进一步两两比较:模型组LC3-Ⅱ阳性表达率高于假手术组(P<0.05);与模型组比较,强心方低、中、高剂量组与卡托普利组中LC3-Ⅱ阳性表达率均降低(P<0.05),其中,强心方低、中、高剂量组LC3-Ⅱ阳性表达率比较,差异有统计学意义(P<0.05),强心方高剂量组LC3-Ⅱ阳性表达率与卡托普利组比较,差异无统计学意义(P>0.05)。
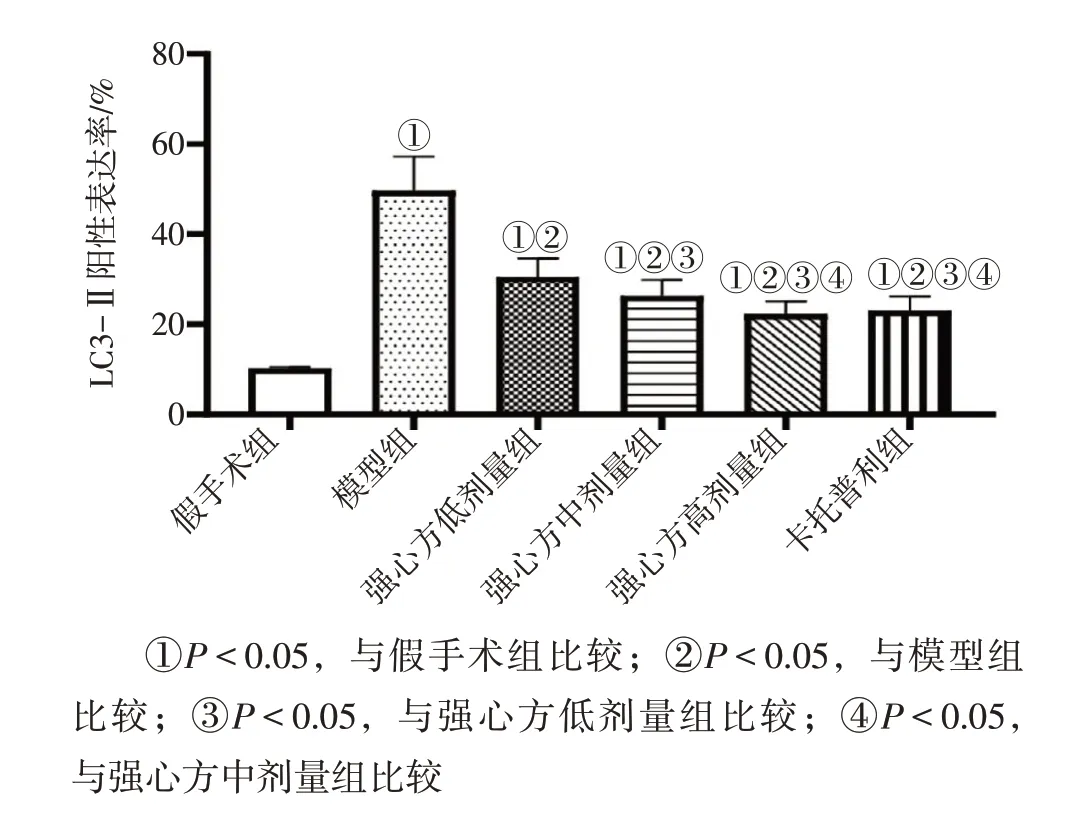
图2 各组大鼠心肌组织自噬蛋白LC3-Ⅱ阳性表达率比较Figure 2 Comparison of the positive expression rate of autophagy protein LC3-Ⅱin myocardial tissues among various groups of rats
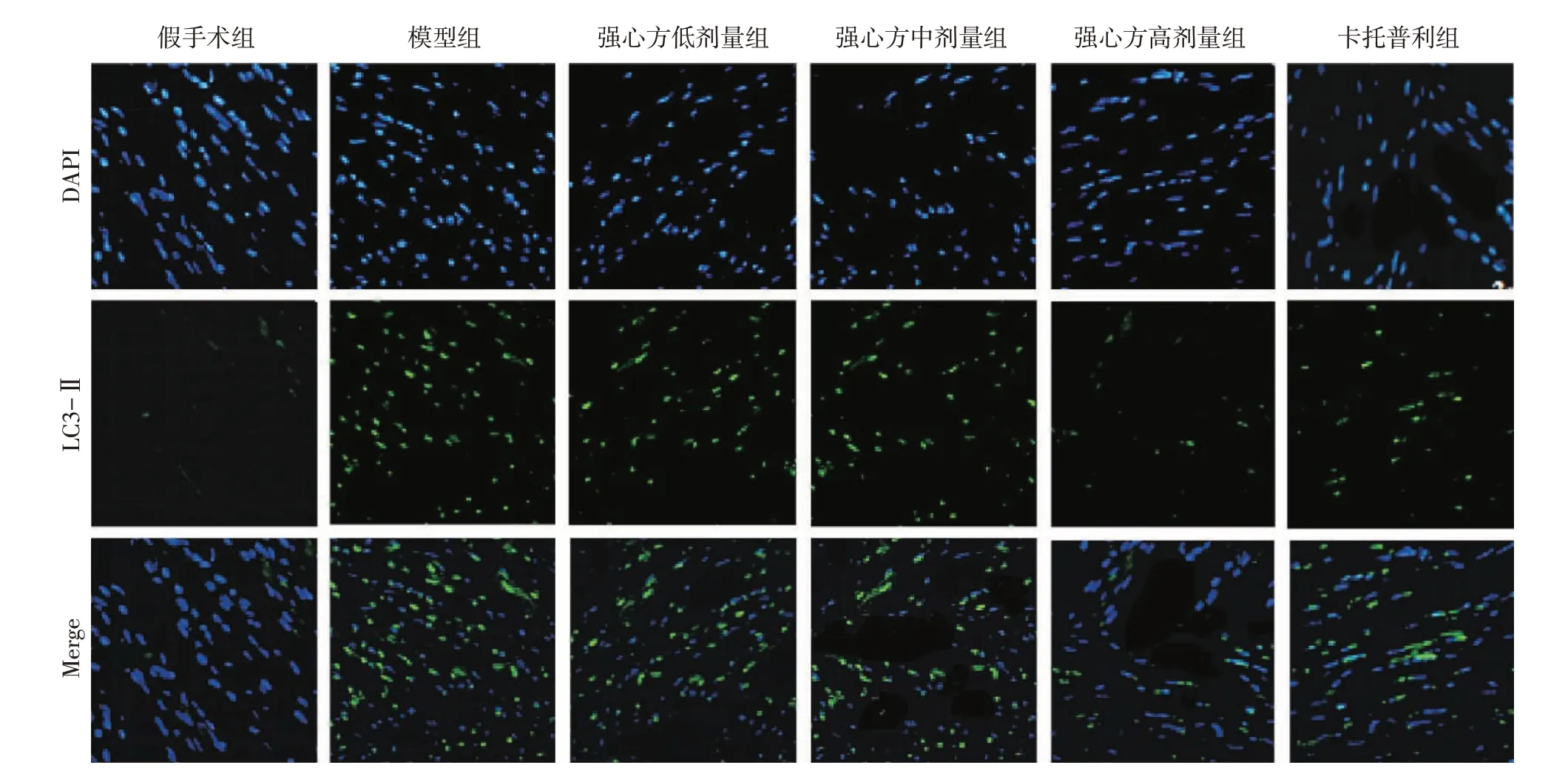
图3 各组大鼠心肌组织自噬蛋白LC3-Ⅱ阳性表达情况比较(免疫荧光法,×200)Figure 3 Comparison of myocardial tissue positive expression of autophagy protein LC3-Ⅱamong various groups of rats(immunofluorescence method,×200)
2.5 各组大鼠心肌组织中p38MAPK、p-p38MAPK、PPAR-γ 蛋白表达比较表3、图4结果显示:与假手术组比较, 模型组大鼠心肌组织中p38MAPK、p-p38MAPK 蛋白表达水平升高,PPAR-γ 蛋白表达水平降低(P<0.05);与模型组比较,强心方低、中、高剂量组与卡托普利组大鼠心肌组织中p38MAPK、p-p38MAPK 蛋白表达水平降低,PPAR-γ 蛋白表达水平升高(P<0.05),其中,强心方低、中、高剂量组上述指标组间比较,差异有统计学意义(P<0.05),强心方高剂量组上述指标与卡托普利组比较,差异均无统计学意义(P>0.05)。
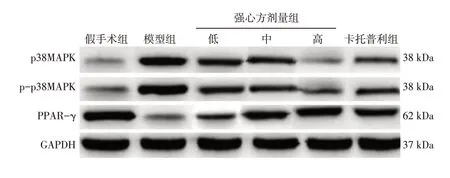
图4 各组大鼠心肌组织中p38MAPK、p-p38MAPK、PPAR-γ蛋白电泳条带图Figure 4 Electrophoretic strip images of p38MAPK,p-p38MAPK and PPAR-γ proteins in myocardial tissues in various groups of rats
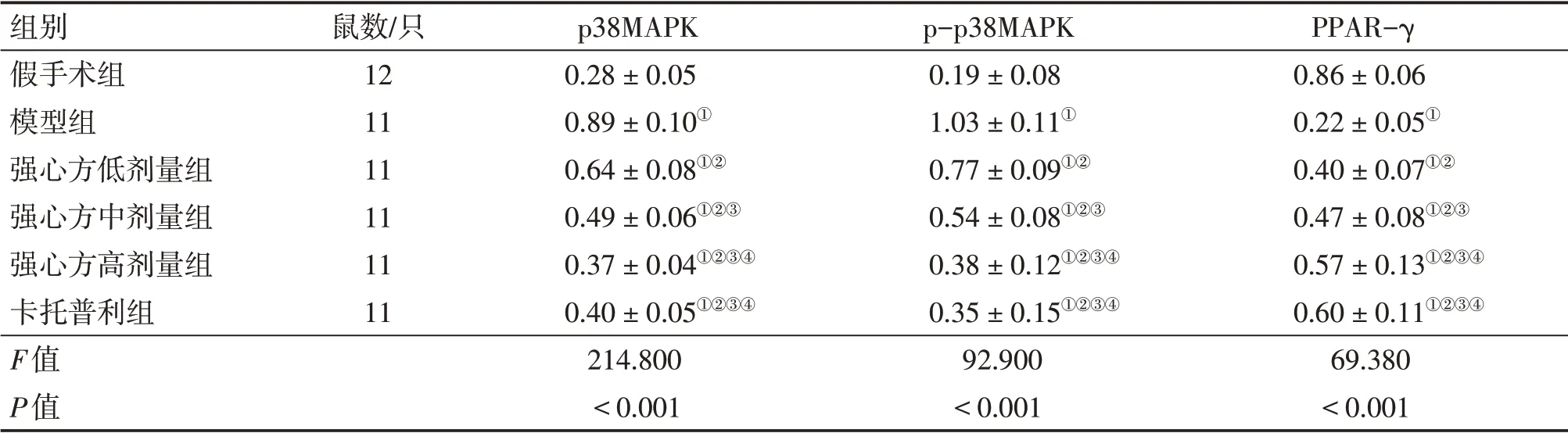
表3 各组大鼠心肌组织中p38MAPK、p-p38MAPK、PPAR-γ蛋白表达水平比较Table 3 Comparison of protein expression levels of p38MAPK,p-p38MAPK and PPAR-γ in myocardialtissues among various groups of rats
3 讨论
多种原因诱发的心衰均与心肌细胞线粒体自噬及能量异常代谢有关[8]。线粒体与中医学“气”的功能相似。心衰发生发展过程中伴随心肌线粒体损伤,多认为与心气虚有关[9]。气为血之帅,心气虚致血液、水液运行不畅,导致血瘀、水停心下,引发短气不足以息、水肿、心悸等一系列症状。另外,疾病发生发展的根本原因是人体机能的太过与不及,自噬参与多种疾病的病理过程,如心血管疾病的发生发展。自噬相当于机体正气与邪气调控,中医认为,邪气侵袭人体而致病,必然是正气虚弱,所谓“邪之所凑,其气必虚”。当自噬相关基因低表达时,则可导致心血管疾病的发生[10]。改善心肌细胞自噬及线粒体能量代谢能力异常,可缓解心衰。
线粒体形态功能损伤是慢性心衰心功能降低及心肌细胞凋亡的主要因素之一。线粒体通透性改变进而上调大分子物质穿过内膜导致线粒体肿胀及膜电位改变,进一步影响心肌细胞能量代谢。心衰时心肌组织代谢异常,ATP 酶活力降低(主要包括Na+-K+ATP 酶及Ca2+-Mg2+ATP 酶活力的降低),导致心肌细胞内钠离子水平升高、细胞内外钙镁离子分布失衡而造成钙超载[11-12]。心肌细胞内钙超载会上调磷脂酶活性,诱导线粒体损伤,引起细胞自噬,加重心衰病理损伤[13]。有研究[14]表明,心肌组织Na+-K+ATP酶及Ca2+-Mg2+ATP酶降低提示细胞心肌细胞能量代谢障碍,因此,通过改善心肌细胞线粒体能量代谢状态能够控制疾病发展。本研究结果显示,强心方各剂量组与卡托普利组血清ATP 含量和心肌组织Na+-K+ATP 酶活性、Ca2+-Mg2+ATP 酶活性高于模型组,血清ADP、AMP含量低于模型组(P<0.05),其中,高剂量组与卡托普利组差异无统计学意义(P>0.05),表明强心方能够增强慢性心衰大鼠心肌线粒体能量代谢而发挥心脏保护作用。
有研究[15]表明,心衰大鼠模型自噬蛋白LC3-Ⅱ表达上调,7 d 后大鼠心肌细胞自噬功能被激活,提示心肌细胞自噬参与了心衰病理损伤过程。还有研究[16]证实,对心衰大鼠采用姜油酮有效治疗后心肌自噬蛋白LC3-Ⅱ表达降低,亦表明降低心肌自噬蛋白LC3-Ⅱ表达可减少心肌损伤。本研究结果显示,强心方各剂量组LC3-Ⅱ阳性表达率低于模型组(P<0.05),与卡托普利组比较无显著性差异(P>0.05),表明强心方可通过减少心肌细胞线粒体自噬而发挥心肌细胞保护作用。
p38MAPK 是MAPK 的下游因子,广泛分布于人体细胞中,在缺氧及炎性反应时表达升高[17]。心衰时心肌p-p38MAPK 可将细胞外信息传递至细胞核,通过转录因子调节多种靶基因共同加重心肌线粒体结构改变及代谢异常等[18]。PPAR-γ 是PPAR 的家族成员之一,具有多种生物调节功能,如抑制炎症及抗肿瘤等[19]。PPAR-γ 在心肌代谢异常疾病中呈低表达,是改善心脏病变的重要靶标。有研究表明,通过激活心衰大鼠PPAR-γ表达后能够增强心肌细胞能量代谢,从而改善心脏重构[20]。本研究结果显示,强心方各剂量组心肌组织p38MAPK、p-p38MAPK 蛋白表达水平低于模型组,PPAR-γ蛋白表达水平高于模型组(P<0.05),与卡托普利组比较无显著性差异(P>0.05),表明强心方可通过抑制心衰大鼠心肌组织中p38MAPK活化、促进PPAR-γ表达发挥心肌保护作用。
综上所述,强心方能够通过提高慢性心衰大鼠心肌线粒体能量代谢,降低心肌细胞自噬,抑制心肌p38MAPK 活化、促进PPAR-γ 蛋白表达,进而减轻病变。
