C57bl/6n小鼠CLP模型的建立和评价
2022-07-14文康姚一帆吴春艳李霞贾彩云
文康 姚一帆 吴春艳 李霞 贾彩云
1 河南大学 临床医学院,河南 开封 475004;2抗体药物开发技术国家地方联合工程实验室,河南 开封475004
脓毒症(sepsis)被定义为由于宿主对感染反应失调引起的威胁生命的多器官功能障碍[1]。目前尚无临床应用的特效治疗药物,脓毒症的发病率仍在上升[2]。即使经过治疗,脓毒症患者也会长期面临严重功能性残疾、心理和认知障碍问题[3-4]。因此,通过建立动物模型来进一步研究脓毒症的致病机制并发现新的标志物,使用生物标志物来识别可能受益于更个性化关注的特定个体[5],从而采取精确治疗措施,对预后是非常重要的。
为了解临床脓毒症的发病机制和发展有效的治疗模式,有必要使用有效的实验模型。目前已有多种动物模型用于脓毒症的研究,常用的模型有静脉内毒素激发模型、活体生物腹腔注射模型、四肢脓肿模型[6-7],以及通过盲肠结扎和穿刺(cecal ligation and puncture,CLP)诱导实验性微生物腹膜炎模型。本研究描述小鼠盲肠结扎穿刺(CLP)模型,该过程已被证明与人类临床脓毒症的性质和过程非常相似。为验证其与临床脓毒症的一致性,本研究通过术后小鼠的体质量变化、生存率、血常规、血生化检测、血清炎性因子检测、血液及腹腔液细菌培养、组织病理改变等指标对模型进行评价。
1 材料与方法
1.1 实验材料
1.1.1 实验动物
6周龄雄性C57bl/6n小鼠,购自北京维通利华实验动物技术有限公司,于普通洁净级动物房饲养。动物实验方案由河南大学伦理委员会批准。
1.1.2 试剂盒器材
戊巴比妥钠(北京华业寰宇化工有限公司);胰蛋白胨(OXOID),琼脂(OXOID),化学试剂助剂(河南热联科技有限公司)。EDTAK2抗疑管(美国BD 公司);生化培养箱(Blue Pard);全自动血液细胞分析仪(MINFDRAY 公司,BC-5000Vet);血生化仪(IDEXX Vet Lab Station);ELLISA 试剂盒(郑州腾飞尔生物科技有限公司);全自动包埋机(Thermo,美国);冻台(Thermo,美国);石蜡切片机(Leica Biosystems Nussloch Gmb H,美国);无菌缝合线,缝合针,结扎线(宁波医用缝针有限公司)。
1.2 实验方法
1.2.1 CLP模型的建立
于接到小鼠当天、术前每3 d、术后每12 h,称小鼠体质量并记录。30只小鼠,随机分为10只、20只两组,分别作为Control(假手术组)和CLP 组。术前用0.02 g/m L 的戊巴比妥钠(0.05 m L/只)腹腔注射麻醉。手术时小鼠仰卧位固定在手术台上,腹部备皮,络合碘消毒;在剑突下1 cm 中线处沿腹中线作长1~2 cm 纵切口,剪开腹膜暴露腹腔,用镊子从左后侧腹腔拉出盲肠,辨别肠系膜血管走向,用3-0号线于盲端1/2处结扎,注意避免损伤肠系膜血管;用8号针头在结扎点远端中部不同位点贯穿肠壁穿孔2次;轻压肠管,挤出适量肠内容物,将肠管还纳腹腔,逐层缝合关腹,消毒切口;于小鼠背部注射0.5 m L无菌生理盐水补液。Control组需要相同操作暴露盲肠,但不进行盲肠结扎和穿孔术。
1.2.2 血、腹腔载菌量检测和腹腔巨噬细胞计数
于术后12 h、24 h,将小鼠进行眼球放血采血。用5 m L注射器抽取无菌生理盐水灌洗小鼠腹腔,收集腹腔灌洗液,3 000 r/min离心5 min,加1 m L PBS重悬。分别将100μL 采集的血液和腹腔重悬液均匀涂布在培养平板上,37 ℃恒温培养箱培养过夜,次日观察菌落分布和数量并拍照。另取腹腔重悬液10μL,计数板计数腹腔巨噬细胞数量。
1.2.3 ELLIA 法血清IL-6、TNF-α检测
按操作说明书制备标准品和试剂。洗涤缓冲液300μL/孔,洗板3次。空白孔每孔加入100μL 标准/样品稀释液(R1)。每孔加入100μL 不同浓度(2 000,1 000,500,250,125,62.5,31.2 pg/m L)的标准品和血清(×10,×100稀释),37 ℃孵育2 h,洗涤3次。空白孔中加入生物素偶联抗体稀释液(R2)100μL/孔,其他孔中加入100μL/孔生物偶联抗体工作溶液,37 ℃孵育1 h,洗涤3次。在空白孔中加入链霉亲和素稀释液(R3),其他孔加入链霉亲和素工作溶液100μL/孔,37℃孵育30 min,洗涤3次。添加底物TMB(四甲基联苯胺)100μL/孔,37 ℃避光孵育15~20 min。加终止溶液50μL/孔,5 min内酶标仪450 nm 波长测光密度值。EXCEL生成标准曲线,计算IL-6和TNF-α浓度。实验用不同批次小鼠重复3次。
1.2.4 血常规及生化指标测定
分别于术后12 h、24 h眼球放血采血,室温静置2 h,7 000 r/min离心5 min;取血清,-80 ℃保存备用。血细胞仪进行血细胞数检测;血生化仪检测血谷丙转氨酶(ALT)、谷草转氨酶(AST)和肌酸激酶(CK)水平。
1.2.5 组织病理检测
CLP术后48 h,颈椎脱臼法处死小鼠,取出小鼠肝、肾、肺和脾等脏器,PBS 洗涤,滤纸吸干表面水分,于4%(m/m)多聚甲醛溶液固定;经组织脱水、石蜡包埋,组织切片;片厚3μm,HE 染色,在光学显微镜下观察组织病理变化情况并拍照。
1.3 统计学分析
采用SPSS 25.0软件进行数据分析,组间比较采用两独立样本t检验,两组生存曲线比较用Log-rank(Mantel.Cox)检验,P<0.05有统计学意义。
2 结果
2.1 C57bl/6n小鼠CLP模型建立及一般状态观察
CLP术后小鼠精神不佳,行动迟缓,饮食行为减少,背毛稀疏竖立。死亡小鼠解剖后可见腹腔充满浑浊恶臭的渗出液,肠管多处粘连,结扎盲肠远端坏死,多脏器淤血肿胀(如图1A所示)。肝脏肿大,颜色变暗(如图1B所示);脾脏体积增大,尚有局部发黑现象(如图1C所示)。
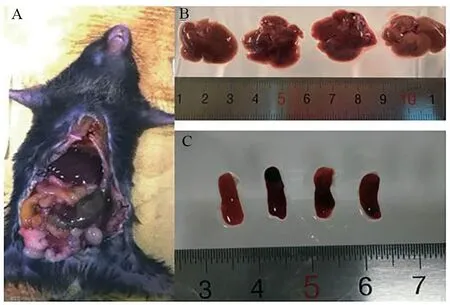
图1 死亡小鼠解剖情况
2.2 手术后小鼠体质量变化
如图2A 所示,CLP组小鼠术后12 h体质量开始下降,随着时间延长下降明显;Control组小鼠体质量变化平稳。截至术后108 h,CLP组与Control组小鼠体质量比较差异显著(图2B,P<0.05)。

图2 CLP术后小鼠体质量变化情况
2.3 CLP术后小鼠生存曲线
CLP组小鼠术后12 h开始出现死亡,60%的小鼠于术后72 h内死亡。观察时长为1周,至观察结束,共有12只死亡。如图3所示,术后12,24,36,48,72 h 各个时间段的生存率分别为90%,65%,50%,45%,40%;截至观察结束时间,只有30%左右的动物生存。Control组小鼠术后状态平稳,生存率为100%(图3,P<0.05)。

图3 CLP术后小鼠的生存曲线
2.4 CLP手术后小鼠腹腔与血液载菌量、腹腔巨噬细胞的计数
分别取术后12 h、24 h小鼠的血液和腹腔灌洗液涂板,37℃过夜培养,检测结果如图4所示:CLP组小鼠的腹腔灌洗液和血液中均检测到细菌,Control组小鼠腹腔灌洗液和血液中未检测到细菌。腹腔巨噬细胞计数结果如表1所示,CLP组小鼠腹腔巨噬细胞数量明显升高,差异具有显著性(P<0.001)。

表1 CLP术后小鼠腹腔巨噬细胞计数检测结果
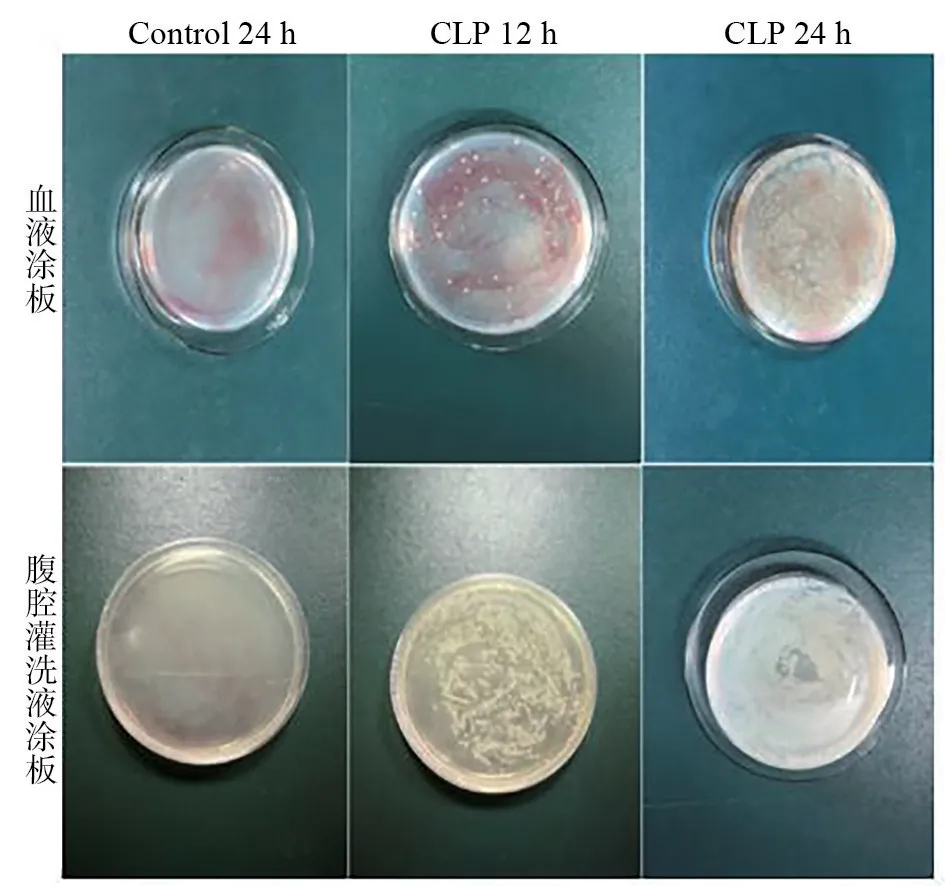
图4 CLP术后血液和腹腔灌洗液载菌量
2.5 ELLIA法血清IL-6和TNF-α检测结果
分别取12 h、24 h血清,按ELLISA 试剂盒说明书操作步骤进行检测,绘制标准曲线,计算血清IL-6值和血清TNF-α值,结果如图5所示:在12 h、24 h血清中,CLP组的IL-6水平分别为Control组的61倍、37倍(P<0.05),CLP组的TNF-α水平分别是Control组的4.69倍、7.9倍(P<0.05)。

图5 CLP术后小鼠血清炎性介质IL-6(A)和TNF-α(B)表达
2.6 CLP手术后血细胞计数与血生化检查结果
LP 术后24 h 小鼠血常规检测结果如表2 所示:白细胞总数(WBC)、淋巴细胞数(LYM)显著下降,中性粒细胞(NEU)百分比和单核细胞(MON)百分比明显升高。

表2 CLP术后小鼠24 h血常规结果
CLP术后12 h、24 h小鼠血生化检测结果如表3所示:丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和肌酸激酶(CK)均明显升高,而且随时间的延长升高更加明显。

表3 CLP术后小鼠12 h和24 h血生化结果
2.7 CLP手术后组织病理检查
CLP术后48 h,小鼠肝、肾、肺、脾组织病理学变化如图6所示:小鼠肝脏组织内可见肝细胞有点状核固缩;肾脏近曲小管上皮细胞结构完整性受损;肺组织充血水肿;脾脏被膜呈破浪状改变,小梁走向扭曲,淋巴小结结构改变。

图6 CLP术后48 h小鼠肝、肾、肺、脾组织病理学变化(×200)
3 讨论
资料[8-10]显示,肿瘤、大面积烧伤、极低出生体质量新生儿、肝硬化、糖尿病和肺结核等疾病都可以合并感染引起脓毒症。由于脓毒症表现形式多样,发病机制和疾病进展的复杂性,相关的治疗研究进展缓慢。理想情况下,动物模型应该模拟人类脓毒症的速度和严重程度,以帮助了解药物研究的进展和临床治疗的发展。
本研究应用盲肠结扎穿刺术建立脓毒症模型,发现CLP术后小鼠出现寒颤、体质量下降、毛发稀疏等脓毒症的恶病质状态。此外,CLP术后小鼠的生存率明显下降,72 h生存率约为40%。死亡小鼠解剖后可见腹腔充满浑浊恶臭的渗出液,消化道多处坏死粘连,多脏器淤血肿胀等器官损伤特征。魏西军[11]也报道了建模术后大鼠腹腔多脏器呈炎症性特征性改变。同时,细胞内的酶会释放到体液中,CLP术后12 h和24 h的血常规结果显示:ALT、AST、CK 的血清水平呈时间依赖性的升高。
血培养是诊断血流感染的金标准[12]。相对于Control组的阴性结果,CLP术后血液和腹腔灌洗液涂板培养结果显示均有细菌生长,说明脓毒症是由经历血液循环的病原微生物引起,并引起过度的全身炎症反应。为证明系统性炎症反应在脓毒症发生发展中的作用,本研究对CLP术后小鼠血清炎性因子IL-6和TNF-α的水平进行了检测,结果显示:CLP术后小鼠血清中有大量炎性因子,而且各因子的血清水平随时间存在动态变化。为了进一步验证脓毒症发生后机体各脏器生理功能受损的物质基础,对手术后48 h内的肝、肾、肺和脾等器官进行了病理学检测,HE染色结果显示:CLP术后肝脏的肝细胞有点状核固缩现象;肺脏出现充血水肿;肾脏近曲小管上皮细胞膜损伤严重;脾被膜破浪样改变,小梁紊乱,脾淋巴结变形。说明脓毒症是机体重要器官损伤,淋巴器官功能受损,不能行使正常的免疫防御功能。
综上所述,CLP小鼠脓毒症模型建造成功,稳定可重复,可以作为研究人类脓毒症发病机制、寻找检测和治疗的新靶点,以及验证药物疗效的理想模型。
