光质在血橙果皮花色苷合成中的调控作用
2022-07-14杨海健周心智王武杨蕾洪林彭芳芳张云贵
杨海健 周心智 王武 杨蕾 洪林 彭芳芳 张云贵








摘要:【目的】探明光質在血橙果皮花色苷合成中的调控作用,为精确解答生产中血橙果面花色苷着色规律和研发血橙提质增效方法提供科学依据。【方法】对血橙果实进行遮光处理,采用可见光(390~780 nm)、紫外+可见光(300~780 nm)、长波紫外线(365 nm)和中波紫外线(311 nm)在果实转色期间照射,以不作照射的遮光果实为对照,动态测定各处理血橙果皮中总花色苷和可溶性糖含量,使用实时荧光定量PCR测定果皮中7个花色苷合成相关基因的动态表达情况。【结果】血橙转色期间,遮光条件下经对照、可见光和长波紫外线照射的果实,其果面均无花色苷着色;紫外+可见光和中波紫外线照射果实,其果面在照射46 d时均呈现花色苷着色,果皮花色苷含量分别为1.78和1.75 mg/kg,照射61 d时,果皮花色苷含量分别为8.78和6.15 mg/kg。试验期间,对照和各补光处理的血橙果皮中果糖和葡萄糖含量持续累积,尤其在紫外+可见光、长波紫外线和中波紫外线光质照射下,果皮果糖和葡萄糖含量明显高于可见光处理。转色期间,血橙果皮中7个花色苷合成相关基因(4CL、CHS、DFR、ANS、UFGT、GST和Ruby)在不同补光条件下的表达量均呈增长趋势,尤其在紫外+可见光和中波紫外线照射果实中,上述7个基因在各采样期的表达均明显高于同期其他处理,补光61 d时果皮中7个基因的表达量分别比同期其余处理至少高2.42和2.76倍、26.46和23.91倍、46.68和44.24倍、10.94和9.70倍、2.09和2.09倍、42.84和36.28倍、5.58和4.99倍。【结论】中波紫外线是诱导血橙果皮花色苷合成的真正光质,血橙转色过程中,其激发果皮中花色苷合成相关基因的大量表达,促进果糖、葡萄糖的快速积累,最终促成花色苷在果皮中的快速合成。
关键词: 光质;花色苷;血橙;果皮;中波紫外线(UVB)
中图分类号: S666.4 文献标志码: A 文章编号:2095-1191(2022)04-1102-10
Regulatory function of light quality on anthocyanin
synthesis in blood orange peel
YANG Hai-jian, ZHOU Xin-zhi, WANG Wu, YANG Lei, HONG Lin,
PENG Fang-fang, ZHANG Yun-gui*
(Chongqing Academy of Agricultural Sciences/Jiangjin Citrus Experiment Station,Chongqing 401329, China)
Abstract:【Objective】To explore the role of light quality in the regulation of anthocyanin biosynthesis in blood orangepeel, so as to provide scientific basis for uncovering the coloring regularity of anthocyanin in blood orange peel and developing the method of improving the blood orange fruit quality and production efficiency. 【Method】Blood orange was treated with shading treatment. Visible light(VL, 390-780 nm), partial UV and visible light(UV+VL,300-780 nm), long-wave ultraviolet(UVA,365 nm)and medium wave ultraviolet(UVB,311 nm) were used to irradiate the fruit during color-changing period. The fruits shaded without light irradiating treatment were used as the control group. The content of total anthocyanin and soluble sugar in blood orange peel of different treatment groups were determined dynamically, and the dynamic expressions of 7 genes related to anthocyanin synthesis were detected by real-time fluorescence quantitative PCR (qRT-PCR). 【Result】In the color-changing period, the shaded blood orange peel, the control and the groups irradia-ted by VL or UVA did not showed purplish-red colorof anthocyanin under shading condition.After 46 days irradiation with UV+VL and UVB supplementary light, the fruit peel of two experimental groups showed the color of anthocyanin, and the contents of anthocyanin in the peel were 1.78 and 1.75 mg/kg, respectively. After 61 days irradiation, the contents of anthocyanin in peel were increased to 8.78 and 6.15 mg/kg, respectively. During the experiment, the fructose and glucose contents in the peel of blood orange were continuously accumulated, especially under the irradiation of UV+VL, UVA and UVB. The fructose and glucose contents of these three treatment groups were obviously higher than those of other treatment groups. The expressions of 7 genes(4CL,CHS,DFR,ANS,UFGT,GST and Ruby) involved in anthocyanin biosynthesis showed an increasing trend in all the treatment groups. Under UV+VL and UVB irradiation treatments, the expressions of these 7 genes in the peel were significantly higher than those of other treatment groups at each sampling stage. After 61 days of UV+VL and UVB supplementary irradiation, the expression of 4CL, CHS, DFR, ANS, UFGT, GST and Ruby in the peel were at least 2.42 and 2.76 times, 26.46 and 23.91 times, 46.68 and 44.24 times, 10.94 and 9.70 times, 2.09 and 2.09 times, 42.84 and 36.28 times, 5.58 and 4.99 times higher than other treatment groups, respectively. 【Conclusion】UVB is the light that can induce anthocyanin synthesis in blood orange peel. UVB enhances the expression of most genesrelated toanthocyanin biosynthetic, promotes the rapid accumulation of fructose and glucose, and finally induces the biosynthesis and accumulation of anthocyanins in the peel during blood orange ripening.
Key words: light quality; anthocyanin; blood orange; peel; medium wave ultraviolet(UVB)
Foundation items: National Modern Citrus Industry Technology System Construction Project (SARS-27); Chong-qing Natural Science Foundation General Project(cstc2019jcyj-msxmX0476);Chongqing Scienterprise Union Germplasm Resources Collection and Utilizationand Variety Test Project (cqnyncw-kqlhtxm);Chongqing Basic Scientific Research Project (NKY-2021AC004)
0 引言
【研究意义】血橙(Citrus sinensis L. Osbeck)是现有甜橙品种中唯一含有花色苷的类型(陈嘉景等,2016),其成熟果实的果皮和果肉因含有花色苷而呈紫红色。果实外观着色是评价其商品价值的重要指标(Cebadera-Miranda et al.,2019),血橙果面花色苷含量的多少很大程度上代表着其外观品质的优劣。生产上一直存在血橙果面无花色苷着色或着色浅、不均匀的问题。因此,研究光质在血橙果皮花色苷合成中所起的调控作用,对提升血橙外观品质具有重要意义。【前人研究进展】花色苷属黄酮类化合物,是植物中重要的次生代谢物(Duan et al.,2019),其作为具有调理人体健康作用的功能性物质被重点研究(Overall et al.,2017;Qin et al.,2018),并作为食品添加剂被广泛应用于食品工业。植物花色苷的积累和分配受遗传和环境条件的共同调节,而光是影响果实花色苷合成积累的首要环境因素(王华等,2015;张彦杰,2015;单建伟等,2019;Zhang et al.,2019)。杨海健等(2019)研究认为,血橙成熟时,果皮和果肉均合成花色苷,但光照只对果皮中的花色苷合成积累起到明显的调控作用,与果肉中花色苷的合成无直接联系。光照对花色苷合成的影响在不同植物间的表现差别较大,其中,光质发挥着重要作用,不同光质对花色苷的影响因植物种类而异,甚至對不同基因型的同一植物的花色苷合成影响也不尽相同(孟霖,2015)。前人已将植物花色苷的代谢途径研究得较清晰,PAL(苯丙氨酸裂解酶)、C4H(肉桂酸羟化酶)、4CL(香豆酞CoA连接酶)、CHS(查尔酮合成酶)、CHI(查尔酮异构酶)、F3H(黄烷酮-3-羟化酶)、DFR(二氢黄酮醇-4-还原酶)、ANS(花青素合成酶)、UFGT(类黄酮糖苷转移酶)、GST(谷胱甘肽转移酶) 等是植物花色苷合成通路中的关键酶,合成这些关键酶的基因组成了合成花色苷的主要结构基因(魏海蓉,2015;Butelli et al.,2017),转录因子Ruby和MYBF1是血橙花色苷合成途径中的重要调节基因(Huang et al.,2018,2019)。目前关于血橙花色苷的研究主要集中在采后加工领域(Carmona et al.,2017)和基因调控方面(Butelli et al.,2017;Huang et al.,2019),较少报道外界环境因子与血橙果面着色的关系。已有相关研究证实光照能调控血橙果皮花色苷合成积累(杨海健等,2019),在此基础上,有必要进一步探究光质在其中发挥的调控作用。【本研究切入点】目前,血橙花色苷合成受环境因子的调控研究较少,尤其是光质对血橙果面花色苷的合成调控未见报道。【拟解决的关键问题】以进入转色期的血橙果实为研究对象,通过遮光,并采用不同光质的光源照射,动态监测果皮花色苷、可溶性糖含量变化及与花色苷合成相关性较高的基因表达变化,探明光质对血橙果面花色苷积累的调控作用,为丰富、完善光对血橙花色苷合成的调控理论及提高血橙果品质量的方法研究提供科学依据。
1 材料与方法
1. 1 试验地概况
试验地位于重庆市农业科学院江津先锋区试园,平地果园,海拔210 m左右;紫色土,土壤pH 5.0~6.0,土层厚度50 cm以上,年平均气温18.4 ℃,年平均日照时数1141.0 h。
1. 2 试验设计
选择20株塔罗科血橙为试验树,采用遮阳网对血橙果实进行遮光处理。于2020年11月15日,分别利用可见光(390~780 nm)、紫外+可见光(300~780 nm)、长波紫外光(365 nm)及中波紫外光(311 nm)4种不同光质的光源照射血橙遮光果实,每照射处理设3个重复,以不作照射处理的遮光果实为对照(CK)。2020年4月20日为血橙谢花末期,采样日期为2020年12月1日(花后224 d)—2020年1月15日(花后269 d),每隔15 d采样1次,每处理3个重复,每重复5个果实,当天带回试验室立即削取整个果实的果皮表层于液氮中速冻,-80 ℃保存备用。
1. 3 测定项目及方法
1. 3. 1 总花色苷含量测定 采用pH示差法分别对试验中所有血橙果皮样品的总花色苷含量进行测定。
1. 3. 2 果皮色泽测定 采用便携式色差计(KONICA MINOLTA)对最后一次采样的果实果面进行色泽测定,每处理设3个生物学重复,每个重复测定3个果实,每个果实沿赤道均匀采集4个点进行测定。
1. 3. 3 可溶性糖测定 采用高效液相色谱(HPLC)法测定各处理果皮样品中果糖、葡萄糖和蔗糖含量。液相色谱条件:LC-100液相色谱仪,Dikma Polyamino HILIC(250 mm×4.6 mm,5 μm),Shodex RI-201H视差检测器;流动相60%乙腈水溶液;进样量10 μL,流速1 mL/min,柱温30 ℃,示差检测器温度40 ℃。
1. 3. 4 RNA提取、cDNA制备及定量检测 RNA提取采用大量法,以RNA为模板,合成cDNA,其中反转录试剂盒采用PrimeScript™ RT reagent Kit with gDNA Eraser(Perfect Real Time),具体提取步骤参照杨海健等(2021)的方法。选用课题组相关研究中筛选出的7个血橙果皮中与光照调控相关性较高的花色苷合成相关基因(DFR、UFGT、CHS、Ruby、GST、ANS、4CL),内参基因选用EF-1α(Accession No.XM_015533332) 。内参EF-1α、DFR、UFGT和CHS基因引物序列参考Crifò等(2012)的研究结果,Ruby、GST、ANS和4CL基因引物序列参考Carmona等(2017)的研究结果,引物序列见表1。实时荧光定量PCR(qRT-PCR)反应采用试剂盒TB Green® Premix Ex TaqTM II(Tli RNaseH Plus)。反应仪器BIO-RAD CFX96TM Real-Time Systerm,反应体系见表2。扩增程序:95 ℃ 1 min,95 ℃ 15 s,58 ℃ 30 s,40个循环,模板重复3次。使用2−ΔΔCT法计算基因相对表达量。
1. 4 统计分析
采用Excel 2010进行数据整理分析及制图。利用SAS 8.0的SAS ANOVE多重分析比较法进行差异显著性分析。
2 结果与分析
2. 1 不同光质处理对血橙果皮外观着色变化影响
试验结果(图1)表明,处于遮光条件下的CK,以及经可见光和长波紫外线光源分别补光的血橙在转色发育直至成熟的过程中,其果面始终无紫红色着色;而经紫外+可见光和中波紫外线光源照射的血橙果实,其果皮在花后254 d(照射46 d)时出现了肉眼可见的紫红色着色,随后着色程度逐渐加深,到花后269 d(照射61 d)时,果皮紫红色已非常明显。从补光效果看,经可见光照射的血橙果面在转色过程中未出现花色苷着色,而经紫外+可见光照射的血橙果面则出现花色苷着色,说明调控血橙果面花色苷合成的光质在紫外+可见光范围内,属于紫外光;同为紫外光的长波紫外线和中波紫外线照射表现出不同的2种效果,长波照射后果面无花色苷着色,而中波呈现花色苷着色,说明不是所有紫外光都能诱导血橙果皮在转色期间产生花色苷着色,初步推断紫外光中中波紫外线是发挥作用的核心光质。
2. 2 不同光质处理下血橙果皮的色泽分析
对花后269 d(照射61 d)的各处理血橙果面进行色差分析,结果如表3所示。不同照射处理的血橙果皮按a值高低分为两组,其中CK、可见光和长波紫外线光源照射处理属于a值较低的一组;紫外+可见光和中波紫外线光源照射处理属于a值较高的一组;两组組内各处理间均无显著差异(P>0.05,下同),而紫外+可见光和中波紫外线补光处理均与a值较低的3个处理差异显著(P<0.05,下同)。说明紫外+可见光和中波紫外线补光较其他处理更有利于血橙果面转红。不同照射处理按b值也分为2组,其中b值较高的一组处理为CK、可见光和长波紫外线照射,恰好与a值较低的一组重合,其代表黄色的b值在本组内各处理间无显著差异;而b值较低的一组为经紫外+可见光补光和中波紫外线补光,两者间b值差异不显著,但与b值较高的3个处理间均具有显著差异。说明血橙经CK、可见光和长波紫外线照射处理后,其果面转红程度低。亮度L值则表现为CK、可见光和长波紫外线光源照射的血橙果面亮度较高,而经紫外+可见光和中波紫外线光源照射的血橙果面亮度较低。色差分析结果与血橙果面着色结果相呼应,进一步证实紫外光中中波紫外线光质在调控血橙果面花色苷着色中的核心作用。
2. 3 不同光质处理下血橙果皮总花色苷含量变化
总花色苷含量分析结果(图2)显示,无论是CK还是经可见光和长波紫外线光源补光的血橙果实,在整个转色成熟过程中均未在其果皮中检测到明显的花色苷含量,而经紫外+可见光和中波紫外线光源照射处理的血橙果实,在花后254 d(照射46 d)时,在其果皮样品中检测出1.78和1.75 mg/kg的花色苷含量,到花后269 d(照射61 d)时,2个处理果皮中的花色苷含量已分别达8.78和6.15 mg/kg。该花色苷含量的测定数据与血橙外观着色表现(图1)一致,再次验证了紫外光中的中波紫外线能在血橙转色期间促进血橙果皮花色苷的合成。
2. 4 不同光质处理下血橙果皮可溶性糖含量变化
如图3所示,血橙果实转色成熟期间,在本研究5个处理血橙果皮样品中,果糖和葡萄糖含量均整体呈上升趋势。试验开展61 d(花后269 d)时,CK、可见光、紫外+可见光、长波紫外线和中波紫外线补光处理的血橙果皮中果糖含量分别增加5.29、5.90、10.69、9.79 和9.86 mg/g,葡萄糖含量分别增加3.51、3.98、8.12、7.18和11.24 mg/g;紫外+可见光、长波紫外线和中波紫外线补光照射的果皮中果糖增加量比CK和可见光补光处理增加近1倍,葡萄糖增加2倍以上。此外,5种处理的血橙果皮中,均在花后239~254 d出现一个果糖快速积累期。在此期间,5种处理血橙果皮样品中蔗糖含量整体呈下降趋势;试验开展61 d时,上述5个处理果皮样品中,蔗糖含量分别下降2.16、5.38、4.04、3.60和4.06 mg/g。
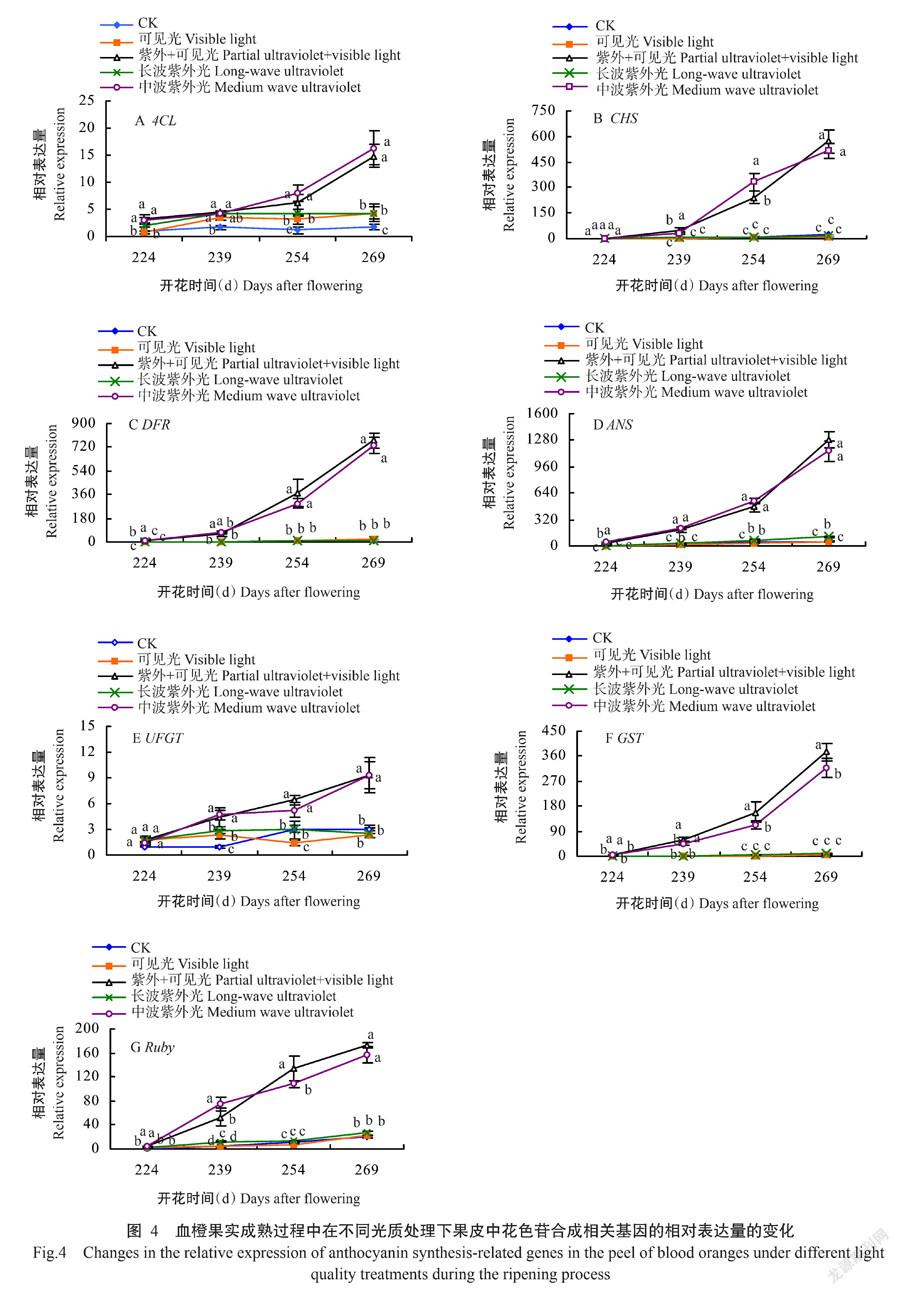
2. 5 不同光质处理下血橙果皮花色苷合成相关基因表达量的测定
如图4所示,血橙转色发育过程中,7个受光照影响较大的基因(4CL、CHS、DFR、ANS、UFGT、GST和Ruby)在5个处理果皮中表达量均呈增长趋势;经紫外+可见光和中波紫外线照射时,血橙果皮中上述7个基因在各采样期的表达量均明显高于同期其余处理。随着照射时间的积累,果皮中7个基因的表达量高于其余处理的趋势越来越明显,在花后254~269 d期间时,7个基因表达量的增长率达最高。花后269 d(照射61 d)时,经紫外+可见光和中波紫外线光源照射的血橙果皮中4CL基因表达量分别比同期其余处理高2.42~7.99和2.76~8.88倍,CHS高26.46~62.62和23.91~56.71倍,DFR高46.68~54.41和44.24~51.58倍,ANS高10.94~26.25和9.70~23.41倍,UFGT高2.09~2.84和2.09~2.84倍,GST高42.84~81.43和36.28~69.09倍,Ruby高5.58~7.43和4.99~6.68倍。其中,与4CL、UFGT和Ruby相比,CHS、DFR、ANS和GST等4个基因在中波紫外线照射条件下出现更高水平的表达。因此,基因表达量的测定结果说明,与CK、可见光和长波紫外线补光处理相比,紫外+可见光和中波紫外线补光促进了血橙在转色期间其果皮中花色苷合成相关基因的表达。
3 讨论
太阳光质按波段分为可见光(400~760 nm)、紫外光(<400 nm)和红外光(>760 nm)(孟霖,2015),3个波段中对植物色素的合成起到正调控作用的多见于可见光(陈强等,2009;Li and Kubota,2009)和紫外光(Zhou et al.,2007)波段。其中,紫外光又分为长波紫外线(320~400 nm)、中波紫外线(280~320 nm)和短波紫外线(<280 nm)3个波段,由于臭氧(O3)对200~320 nm波段具有极强的吸收作用,使得对植物有致死作用的短波紫外线极少到达地球表面(王亚吉,2011)。基于此,该研究在试验中采用由可见光到中波紫外线光波段的光源进行补光,结果表明,只在经紫外+可见光混合光质和中波紫外线补光的血橙果面上观察到花色苷着色,并在果皮色泽和花色苷含量测定上得到进一步印证;而经可见光和长波紫外线光源照射却未显现这一结果,充分说明紫外光中的中波紫外线是在血橙成熟过程中调控其果皮花色苷合成的重要光质。
光质是光对植物花色苷的生物合成产生影响的一个重要方面,但不同植物花色苷的积累对接受的光谱成分敏感度不同,果实类对短波长光质敏感,蓝光可显著提高草莓(Kadomura-Ishikawa et al.,2013)、葡萄果皮(Rodyoung et al.,2016)和梨果皮(Tao et al.,2018)的花色苷含量;拟南芥对长波长的光质较敏感,蓝光、红光甚至远红光均能诱导花色苷的大量积累(Liu et al.,2015);而苹果花色苷合成则对中波紫外线敏感,甚至某些种类果实对紫外光的敏感程度要依品种而异,湖景蜜露桃果皮的花色苷受长波和中波紫外线诱导,而玉露桃仅受中波紫外线诱导(Zhao et al.,2017)。本研究中,血橙果皮花色苷仅由中波紫外线诱导合成,推测其果皮是通过中波紫外线的光受体 UVR8(UV resistance locus 8,UVR8)感受光信号。另外,本研究还发现,中波紫外线照射只能诱导遮光血橙的受光一面产生花色苷,背光一面的果皮中无花色苷着色,说明花色苷合成后无法在果皮表层细胞间运输。
花色苷结构基因的表达是其生物合成的直接原因,很多植物果实花色苷的结构基因表达受光的调控,从而影响花色苷的积累,如葡萄(Azuma et al.,2012)、梨(Sun et al.,2014)和海棠(Lu et al.,2017)等。结构基因启动子序列的光响应顺式作用元件(Light regulatory unit,LRU)是花色苷合成途径中基因响应光照表达的必要条件(洪艳等,2021),而与该类顺式作用原件结合的转录因子在光响应呈色的调控中发挥着重要作用。MYB属于这类转录因子,并参与植物次生代谢过程,其中作为MYB的一大类,R2R3-MYB是调控类黄酮途径的重要转录因子,广泛参与调控花色苷的生物合成。Ruby是血橙中的R2R3-MYB型转录因子,参与调控血橙花色苷的生物合成。本研究中果皮花色苷合成相关基因表达结果显示了中波紫外线照射能明显上调6个结构基因(4CL、CHS、DFR、ANS、UFGT和GST)及Ruby转录因子的表达,最终促进了血橙果皮花色苷的合成积累。
中波紫外线对血橙果皮花色苷的调控作用并没有在照射后立刻显现,而是在照射46 d时才检测到花色苷的积累,这个时间点处于花后254 d,此时果实已彻底由绿转黄,且血橙果皮的可溶性糖含量也已处于较高位置,此时果实处于接近成熟。因此,推断中波紫外线光诱导血橙果皮合成花色苷的前提是果实已处于果面完全转黄后的成熟期间。本研究中试验地血橙成熟期的日常温度为2~10 ℃,遮光后的血橙果实在无光条件下或在非中波紫外线波段光照条件下其果皮均无法合成花色苷,该结果说明了单纯的低温无法诱导血橙果皮花色苷合成积累,与苹果和梨果皮中花色苷积累可由低温诱导(Steyn et al.,2009;Xie et al.,2012)不同。另外,血橙果肉中积累花色苷通常被认为是低温的诱导(Huang et al.,2019),说明血橙果实在果皮和果肉上存在两种不同的花色苷合成机制。
血橙在成熟转色期间,即便是在弱光条件下,随着果实的逐渐成熟,果皮中果糖和葡萄糖也在不断积累,且二者含量接近1∶1,果皮中蔗糖含量则随着果实不断成熟而下降,与王贵元(2007)在自然光照下测定成熟期间红肉脐橙果皮果糖、葡萄糖和蔗糖积累的规律相一致。经4种光质照射的血橙,其果皮中果糖、葡萄糖和蔗糖的积累也符合这一规律,只是受紫外+可见光、长波紫外线和中波紫外线光源照射后,血橙果皮中积累的果糖和葡萄糖比遮光处理和可见光照射处理積累的更多。因此,推测紫外光能促进血橙果皮中果糖和葡萄糖的积累。有研究认为糖的积累是促进植物花色苷积累的重要原因(喻最新等,2020;樊小雪等,2021),依据本研究结果,经中波紫外线照射,血橙果皮确实产生了果糖和葡萄糖的快速积累,并成功合成了花色苷,证实糖与花色苷合成存在密切关系。而此时蔗糖含量的降低,可能是在血橙成熟过程中,蔗糖通过不断转化成果糖和葡萄糖使二者含量升高,导致自身含量降低。故推测果糖和葡萄糖是血橙果皮花色苷糖苷的直接合成组分,而不是蔗糖;经长波紫外线照射时,血橙果皮中同样快速积累了果糖和葡萄糖,但没有花色苷合成,说明糖是植物花色苷合成的必要条件,却不能直接诱导花色苷合成的开启。
本研究结果能很好地解释生产中处于树冠不同部位血橙果实的着色规律:由于空气中存在大量散射状态的中波紫外线,无论血橙果实在任何朝向,其裸露在外的果面均有花色苷合成;血橙果实裸露在外的面积越大,其果面接受中波紫外线的面积也就越大,最终花色苷着色面积也越大;被叶片遮挡无法接受中波紫外线的果面则无花色苷合成;利用缺少中波紫外线的普通光源补光无法改善血橙果面花色苷着色。根据上述结果可研发改进针对促进血橙着色的修剪技术,使血橙在果实转色成熟期间尽可能的接触到大气中中波紫外线,也可研发能自主发射中波紫外线的设备或能将大气中的中波紫外线集中转移到血橙果面的方法。
4 结论
紫外线中的中波紫外线是诱导血橙果皮花色苷合成的真正光质。血橙转色过程中,中波紫外线光激发果皮中花色苷合成相关基因的大量表达,促进果糖、葡萄糖的快速积累,最终促成花色苷在果皮中的快速合成。
参考文献:
陈嘉景,彭昭欣,石梅艳,徐娟. 2016. 柑橘中类黄酮的组成与代谢研究进展[J]. 园艺学报,43(2):384-400. [Chen J J,Peng Z X,Shi M Y,Xu J. 2016. Advances in on flavonoid composition and metabolism in citrus[J]. Acta Horticulturae Sinica,43(2):384-400.] doi:10.16420/j.issn. 0513-353x.2015-0689.
陈强,刘世琦,张自坤,崔慧茹,郝树芹,刘忠良. 2009. 不同LED光源对番茄果实转色期品质的影响[J]. 农业工程学报,25(5):156-161. [Chen Q,Liu S Q,Zhang Z K,Cui H R,Hao S Q,Liu Z L. 2009. Effect of different light emitting diode sources on tomato fruit quality during color-changed period[J]. Transactions of the CSAE,25(5):156-161.] doi:10.3969/j.issn.1002-6819.2009.05.30.
樊小雪,凌丹丹,徐刚,高文瑞,孙艳军,韩冰. 2021. 不同LED光照对番茄果实品质和糖类物质含量的影响[J]. 江苏农业学报,37(4):944-948. [Fan X X,Ling D D,Xu G,Gao W R,Sun Y J,Han B. 2021. Effects of different LED light intensities on tomato fruit quality and carbohydrate content[J]. Jiangsu Journal of Agriculture Sciences,37(4):944-948.]
洪艳,武宇薇,宋想,李梦灵,戴思兰. 2021. 光照调控园艺作物花青素苷生物合成的分子机制[J]. 园艺学报,48(10):1983-2000. [Hong Y,Wu Y W,Song X,Li M L,Dai S L. 2021. Molecular mechanism of light-induced anthocyanin biosynthesis in horticultural crops[J]. Acta Horticulturae Sinica,48(10):1983-2000.] doi:10.16420/j.issn. 0513-353x.2021-0497.
孟霖. 2015. 光质对烤烟叶片代谢物质积累及烟苗发育的影响[D]. 北京:中国农业科学院. [Meng L. 2015. The effects of light quality on development of tobacco seedlings and accumulation of metabolites in flue-cured tobacco leaves[D]. Beijing:Chinese Academy of Agricultural Sciences.] doi:10.7666/d.Y2787365.
单建伟,刘晓津,索海翠,安康,罗焕明,王丽,李小波. 2019. 植物花色苷的研究进展[J]. 南方农业学报,50(2):278-285. [Shan J W,Liu X J,Suo H C,An K,Luo H M,Wang L,Li X B. 2019. Plant anthocyanins:A review[J]. Journal of Southern Agriculture,50(2):278-285.] doi:10.3969/ j.issn.2095-1191.2019.02.09.
王贵元,吴强盛,孙俊雄. 2007. 红肉脐橙果实发育过程中主要糖含量的变化[J]. 长江大学学报(自科版)农学卷,4(1):12-13. [Wang G Y,Wu Q S,Sun J X. 2007. Changes of sugar concentration during the development of Cara Cara navel orange[J]. Journal of Yangtze University(Na-tural Science Edition) Agricultural Science Volumn,4(1):12-13.] doi:10.3969/j.issn.1673-1409.2007.01.004.
王華,李茂福,杨媛,金万梅. 2015. 果实花青素生物合成分子机制研究进展[J]. 植物生理学报,51(1):29-43. [Wang H,Li M F,Yang Y,Jin W M. 2015. Recent advances on the molecular of anthocyanin synthesis in fruits[J]. Plant Physiology Communications,51(1):29-43.] doi:10.13592/ j.cnki.ppj.2014.0321.
王亚吉. 2011. 太阳辐射光谱的测量与应用研究[D]. 南京:南京信息工程大学. [Wang Y J. 2011. Measurement and application of solar radiation spectra[D]. Nanjing:Nanjing University of Information Science & Technology.] doi:10.7666/d.y1891560.
魏海蓉. 2015. 甜樱桃果实花青苷形成的生理生化与转录组分析[D]. 泰安:山东农业大学. [Wei H R. 2015. Transcriptome profiling and physio-chemical analysis reveals the biosynthesis of anthocyanin in sweet cherry fruit[D]. Tai’an:Shandong Agricultural University.] doi:10.7666/d.Y2786226.
杨海健,张云贵,周心智,洪林,杨蕾,彭芳芳,王武. 2021. 不同PE材料遮光下血橙转色期果皮花色苷合成及其相关基因的表达分析[J]. 浙江農业学报,33(10):1861-1869. [Yang H J,Zhang Y G,Zhou X Z,Hong L,Yang L,Peng F F,Wang W. 2021. Analysis of anthocyanin synthesis and related gene expression in blood orange peel under different PE materials shading during fruit coloring[J]. Acta Agriculturae Zhejiangensis,33(10):1861-1869.] doi:10.3969/j.issn.1004-1524.2021.10.09
杨海健,周心智,张云贵,杨蕾,丁志祥. 2019. 光照对血橙果实内外着色调控的影响[J]. 南方农业学报,50(9):2015-2021. [Yang H J,Zhou X Z,Zhang Y G,Yang L,Ding Z X. 2019. Effects of light on the regulation of coloration in blood orange peel and pulp[J]. Journal of Southern Agriculture,50(9):2015-2021.] doi:10.3969/j.issn.2095-1191. 2019.09.17.
喻最新,王日葵,贺明阳,洪敏,袁小淞,王晶,冯雨,吴志刚. 2020. ‘塔罗科’血橙成熟过程中花色苷积累及其与糖酸含量相关性[J]. 食品科学,41(15):105-114. [Yu Z X,Wang R K,He M Y,Hong M,Yuan X S,Wang J,Feng Y,Wu Z G. 2020. Correlation between anthocyanin accumulation and sugar and acid contents in ‘Tarocco’ blood oranges during ripening[J]. Food Science,41(15):105-114.] doi:10.7506/spkx1002-6630-20190620-227.
张彦杰. 2015. 紫白菜与紫茄花色苷生物合成及光调控的分子机理研究[D]. 重庆:重庆大学. [Zhang Y J. 2015. Molecular analysis of light-regulated anthocyanin biosynthesis in purple Chinese cabbage and purple eggplant[D]. Chongqing:Chongqing University.]
Azuma A,Yakushiji H,Koshita Y,Kobayashi S. 2012. Flavonoid biosynthesis-related genes in grape skin are differentially regulated by temperature and light conditions[J]. Planta,236(4):1067-1080. doi:10.1007/s00425-012-1650-x.
Butelli E,Garcia-lor A,Licciardello C,Casas G L,Hill L,Recupero G R,Keremane M L,Ramadugu C,Krueger R,Xu Q. 2017. Changes in anthocyanin production during domestication of citrus[J]. Plant Physiology,173(4):2225-2242. doi:10.1104/pp.16.01701.
Carmona L,Alquézar B,Marques V V,Peña L. 2017. Anthocyanin biosynthesis and accumulation in blood oranges during postharvest storage at different low temperatures[J]. Food Chemistry,237:7-14. doi:10.1016/j.foodchem. 2017.05.076.
Crifò T,Petrone G,Cicero L L,Piero A L. 2012. Short cold storage enhances the anthocyanin contents and level of transcripts related to their biosynthesis in blood oranges[J]. Journal of Agricultural and Food Chemistry. 60(1):476-481. doi:10.1021/jf203891e.
Cebadera-Miranda L,Domíngguez L,Dias M I,Barros L,Ferreira I C F R,Igual M,Martínez-Navarrete N,Fernández-Ruiz V,Morals P,Cámara M. 2019. Sanguinello and Tarocco(Citrus sinensis[L.] Osbeck):Bioactive compounds and colour appearance of blood oranges[J]. Food Chemistry,270:395-402. doi:10.1016/j.foodchem.2018. 07.094.
Duan B B,Song C Z,Zhao Y M,Jiang Y,Shi P B,Meng J F,Zhang Z W. 2019. Dynamic changes in anthocyanin biosynthesis regulation of Cabernet Sauvignon(Vitis vinifera L.) grown during the rainy season under rain-shelter cultivation[J]. Food Chemistry,283:404-413. doi:10.1016/j.foodchem.2018.12.131.
Huang D,Wang X,Tang Z Z,Yuan Y,Xu Y T,He J X,Jiang X L,Peng S A,Li L,Butelli E,Deng X X,Xu Q. 2018. Subfunctionalization of the Ruby2-Ruby1 gene cluster during the domestication of citrus[J]. Nature Plants, 4:930-941. doi:10.1038/s41477-018-0287-6.
Huang D, Yuan Y, Tang Z Z,Huang Y, Kang C Y, Deng X X,Xu Q. 2019. Retrotransposon promoter of Ruby1 controls both light- and cold-induced accumulation of anthocyanins in blood orange[J]. Plant,Cell & Environment,42(11):3092-3104. doi:10.1111/pce.13609.
Kadomura-Ishikawa Y,Miyawaki K,Noji S,Takahashi A. 2013. Phototropin 2 is involved in blue light-induced anthocyanin accumulation in Fragaria×ananassa fruits[J]. Journal of Plant Research,126(6):847-857. doi:10.1007/s10265-013-0582-2.
Li Q,Kubota C. 2009. Effects of supplemental light quality on growth and phytochemicals of baby leaf lettuce[J]. Environmental and Experimental Botany,67(1):59-64. doi:10.1016/j.envexpbot.2009.06.011.
Liu Z J,Zhang Y Q,Wang J F,Li P,Zhao C Z,Chen Y D,Bi Y R. 2015. Phytochrome-interacting factors PIF4 and PIF5 negatively regulate anthocyanin biosynthesis under red light in Arabidopsis seedlings[J]. Plant Science,238:64-72. doi:10.1016/j.plantsci.2015.06.001.
Lu Y F,Bu Y F,Hao S X,Wang Y R,Zhang J,Tian J,Yao Y C. 2017. MYBs affect the variation in the ratio of anthocyanin and flavanol in fruit peel and flesh in response to shade[J]. Journal of Photochemistry and Photobiology B:Biology,168:40-49. doi:10.1016/j.jphotobiol.2017.01.017.
Overall J,Bonney S A,Wilson M,Beermann A,Grace M H ,Esposito D,Lila M A,Komarnytsky S. 2017. Metabolic effects of berries with structurally diverse anthocyanins[J]. International Journal of Molecular Sciences,18(2):422. doi:10.3390/ijms18020422.
Qin Y,Zhai Q Q,Li Y,Cao M,Xu Y,Zhao K L,Wang T. 2018. Cyanidin-3-O-glucoside ameliorates diabetic nephropathy through regulation of glutathione pool[J]. Biomedicine & Pharmacotherapy,103(2):1223-1230. doi:10.1016/j.biopha.2018.04.137.
Rodyoung A,Masuda Y,Tomiyama H,Saito T,Okawa K,Ohara H,Kondo S. 2016. Effects of light emitting diode irradiation at night on abscisic acid metabolism and anthocyanin synthesis in grapes in different growing seasons[J]. Plant Growth Regulation,79:39-46. doi:10.1007/s10725-015-0107-1.
Steyn W J,Wand S J,Jacobs G,Rosecrance R,Roberts S. 2009. Evidence for a photoprotective function of low-temperature-induced anthocyanin accumulation in apple and pear peel[J]. Physiologia Plantarum,136(4):461-472. doi:10.1111/j.1399-3054.2009.01246.x.
Sun Y W,Qian M J,Wu R Y,Niu Q F,Teng Y W,Zhang D. 2014. Postharvest pigmentation in red Chinese sand pears(Pyrus pyrifolia Nakai)in response to optimum light and temperature[J]. Postharvest Biology and Technology,91:64-71. doi:10.1016/j.postharvbio.2013.12.015.
Tao R Y,Bai S L,Ni J B,Yang Q S,ZhaoY,Teng Y W. 2018. The blue light signal transduction pathway is involved in anthocyanin accumulation in ‘Red Zaosu’ pear[J]. Planta,248:37-48. doi:10.1007/s00425-018-2877-y.
Xie X B,Li S,Zhang R F,Zhao J,Chen Y C,Zhao Q,Yao Y X,You C X,Zhang X S,Hao Y J. 2012. The bHLH transcription factor MdbHLH3 promotes anthocyanin accumulation and fruit colouration in response to low temperature in apples[J]. Plant,Cell & Environment,35:1884-1897. doi:10.1111/j.1365-3040.2012.02523.x.
Zhang Y J ,Li Y ,Li W P,Hu Z L,Yu X H,Tu Y,Zhang M,Huang J Y,Chen G P. 2019. Metabolic and molecular analysis of nonuniform anthocyanin pigmentation in tomato fruit under high light[J]. Horticulture Research,6(1). doi:10.1038/s41438-019-0138-2.
Zhao Y,Dong W Q,Wang K,Zhang B ,Allan A C,Lin-Wang K,Chen K S,Xu C J. 2017. Differential sensitivity of fruit pigmentation to ultraviolet light between two peach cultivars[J]. Frontiers in Plant Science,8:1552. doi:10.3389/fpls.2017.01552.
Zhou B,Li Y H,Xu Z R,Yan H F,Homma S,Kawabata S. 2007. Ultraviolet A-specific induction of anthocyanin biosynthesis in the swollen hypocotyls of turnip(Brassica rapa) [J]. Journal of Experimental Botany,58(7):1771-1781. doi:10.1093/jxb/erm036.
收稿日期:2021-09-26
基金项目:国家现代柑橘产业技术体系建设专项(SARS-27);重庆市自然科学基金面上项目(cstc2019jcyj-msxmX0476);重庆市科企联合体种质资源收集利用与品种试验项目(cqnyncw-kqlhtxm);重庆市基础科研项目(NKY-2021AC004)
通讯作者:张云贵(1965-),https://orcid.org/0000-0002-2530-5316,研究员,主要从事果树栽培研究工作,E-mail:zhangyg66@ gmail.com
第一作者:杨海健(1985-),https://orcid.org/0000-0002-3716-1698,副研究員,主要从事果树栽培育种研究工作,E-mail:yanghaijian126@126.com
