不同LED光源对温室黄瓜幼苗生长和生理特性的影响
2017-02-15刘丹��刘晓英焦学磊朱家春徐志刚
刘丹��+刘晓英+焦学磊+朱家春+徐志刚��唐灿明��


摘要:发光二极管(light-emitting diodes,LEDs)是新型的高效節能光源,具有体积小、能耗低、低发热且与植物生长的光谱范围相吻合等优点,已用于设施栽培补充光源。研究了不同比例LED光源对黄瓜品种露丰幼苗生长的影响,采用荧光灯(FL)、单色红光(R)LEDs,红蓝组合光(R ∶[KG-*3]B=7 ∶[KG-*3]3、1 ∶[KG-*3]1、3 ∶[KG-*3]7)LEDs以及单色蓝光(B)LEDs共6个不同的光源处理30 d。结果表明,红光处理下的黄瓜幼苗株高和可溶性糖、淀粉含量最大;红蓝7 ∶[KG-*3]3 LEDs处理下的鲜质量、干质量、叶面积最大;红蓝1 ∶[KG-*3]1 LEDs处理下的蔗糖含量最高;红蓝3 ∶[KG-*3]7 LEDs处理的叶绿素含量、可溶性蛋白含量最高,红蓝3 ∶[KG-*3]7 LEDs处理的根系活力显著高于其余LED光处理;蓝光处理下的游离氨基酸含量最高。红蓝7 ∶[KG-*3]3 LEDs处理下的鲜质量、干质量、叶面积、叶绿素含量、可溶性蛋白和游离氨基酸的含量均显著高于荧光灯处理,可作为日光温室中黄瓜生产的补充光源。
关键词:发光二极管;黄瓜;光质;幼苗;生长指标;生理指标
中图分类号: S642.201文献标志码:
文章编号:1002-1302(2016)08-0238-04
我国利用日光温室进行蔬菜反季节栽培已推广十余年[1]。近年来,随着设施栽培技术的发展,黄瓜的反季节生产技术逐步建立,已经能达到全年的生产与供应,采用日光温室进行黄瓜反季节栽培能够显著增产、增收、提高黄瓜品质[2]。光质、光强和光周期对植物生长发育有重要调控作用[3]。黄瓜设施栽培中存在的问题是遇到长期阴雨天气或冬季温室盖草帘后,常发生光照不足或无光照的问题,由于光合作用不能正常进行,黄瓜的生长、产量和品质均受到影响,因此需要筛选高效的人工光源对设施内黄瓜进行补充光照。
发光二极管(light-emitting diodes,LEDs)是一种新型的人工光源,具有体积小、重量轻、寿命长、光效率高、能耗小等优点[4-7]。LED可提供与植物生长所需的光谱范围相吻合的波长[8-9]。通过将红、蓝等单色LED光组合,可以形成对植物光合作用形态建成有效的光谱,可提高植物的光能利用率,有利于植物的生长发育。
LED光源在萝卜[10]、莴苣[11]、生菜[12]和番茄[13]等植物设施栽培中的效果已有报道,能够显著促进设施内植物的生长。LED光源对黄瓜生长的影响已有研究,但结果不同:唐大为等发现黄瓜幼苗在红蓝7 ∶[KG-*3]3 LEDs下生长最佳[14];苏娜娜等发现LED红光下黄瓜幼苗生长最好[15];段奇珍等发现白光有利于壮苗,增加红蓝光有利于同化物向地下部分运输[16];谢景等发现红蓝6 ∶[KG-*3]3 LEDs下黄瓜幼苗生长最好[17]。因此,适合黄瓜幼苗生长的LED光源还需要进一步研究。本试验研究了不同比例红、蓝LED光对温室内黄瓜幼苗生长的影响,筛选适合黄瓜设施栽培中使用的LED光源,为设施中黄瓜幼苗补光提供试验依据。
1材料与方法
1.1材料
本研究所使用的黄瓜品种为露丰,该品种为春秋露地专用品种。
1.2处理
将黄瓜种子用蒸馏水冲洗2~3遍,37 ℃浸种1 d。露白后移栽到装有栽培基质的育苗钵中,育苗钵为底面直径 8 cm、高15 cm的圆柱形苗钵,栽培基质为蛭石 ∶[KG-*3]营养土=3 ∶[KG-*3]1,混合后高温灭菌。
栽培条件是:温度28~30 ℃,相对湿度40%~60%,光—暗周期12 h—12 h。光源为单色红光(R)LEDs,红蓝组合光(R ∶[KG-*3]B=7 ∶[KG-*3]3、1 ∶[KG-*3]1、3 ∶[KG-*3]7)LEDs以及单色蓝光(B)LEDs,育苗所用的植物生长架共3层,高2 m,每层高度 50 cm,每层配备10支LED灯,为东莞勤上光电股份有限公司生产的PT1 D2288条形植物照明灯,长1 m,内含72颗LED灯珠。红光峰值波长为610~625 nm,额定功率12 W;蓝光峰值波长为445~455 nm,额定功率为18 W。光照度为300 μmol/(m2·s)。育苗钵与光源的距离为30 cm左右。播种之后每3 d浇1次水,待幼苗2片子叶展开后,每2 d浇1次水,每周施用2次改良霍格兰培养液[18]1/10稀释液 50 mL。培养时间为 30 d,重复3次。对照组光源为荧光灯,其余条件与试验组相同。
1.3测定方法
1.3.1生长指标测定随机选取不同光处理的植株进行生长分析。干质量测定是将植株放置于80 ℃烘箱中烘干至恒质量,再用电子天平称质量。株高的测定是测量植株茎基部到最顶端的长度。根长是从茎基部到根尖的长度,茎粗的测定部位是根基部的节间距。叶面积采用拍照分析法,将叶片平铺在网格纸上,其中网格纸的每个网格面积为1 cm2,然后用数码相机拍照,应用Photoshop CS 3.0软件对照片像素进行计算,以网格为参照勾勒叶片轮廓来测量叶片的实际面积。
1.3.2叶片叶绿素的测定方法称取0.05 g叶片放入试管,然后加入10 mL 80%叶绿素提取液(丙酮 式中:m为叶片质量,g;V为提取液体积,mL。
1.3.3根系活力的测定方法采用四氮唑法(TTC法)测定根系活力。称取0.1 g的侧根,放入试管中,加入5 mL磷酸缓冲液(PBS,pH值7.8)和5 mL四氮唑,混匀后37 ℃保温 4~5 h,然后加入2 mL 1 mol/L的H2SO4终止反应。倒掉反应液,用蒸馏水冲洗3次,加入10 mL无水乙醇后试管加塞,95 ℃ 保温30 min。然后用紫外分光光度计测定在490 nm波长下的光密度值[20]。
1.3.4糖含量的测定方法将叶片研磨至粉末状,称取 0.5 g 加5 mL磷酸缓沖液(PBS,pH值7.8)搅拌均匀,于 85 ℃ 保温30~50 min,冷却后4 000 r/min离心20 min,将上清液倒入刻度试管中,离心10 min,重复2次,合并上清液定容至刻度试管待用,保留残渣。可溶性糖测定用蒽酮法。游离氨基酸含量采用水合茚三酮法。蔗糖含量采用间苯二酚法[19,21-22]。
1.3.5淀粉含量的测定方法淀粉含量测定采用蒽酮法[19]。将糖提取的残渣于80 ℃烘箱中烘干,加1 mL蒸馏水,在沸水中糊化30 min不断搅拌,取出混匀。冷却后加 1 mL 9.2 mol/L高氯酸和2 mL蒸馏水,不断搅拌10 min,8 000 r 离心6 min,取上清液倒入刻度试管中。加1 mL 4.6 mol/L 高氯酸和3 mL蒸馏水,不断搅拌10 min,合并上清液,反复冲洗沉淀转移上清液,冷却后定容。
1.4数据整理与分析
数据整理分析采用Microsoft Excel 2003和SPASS 16.0,进行一维方差分析(ANOVA),采用Tukeys和Duncans法分析差异显著性(α=0.05)。
2结果与分析
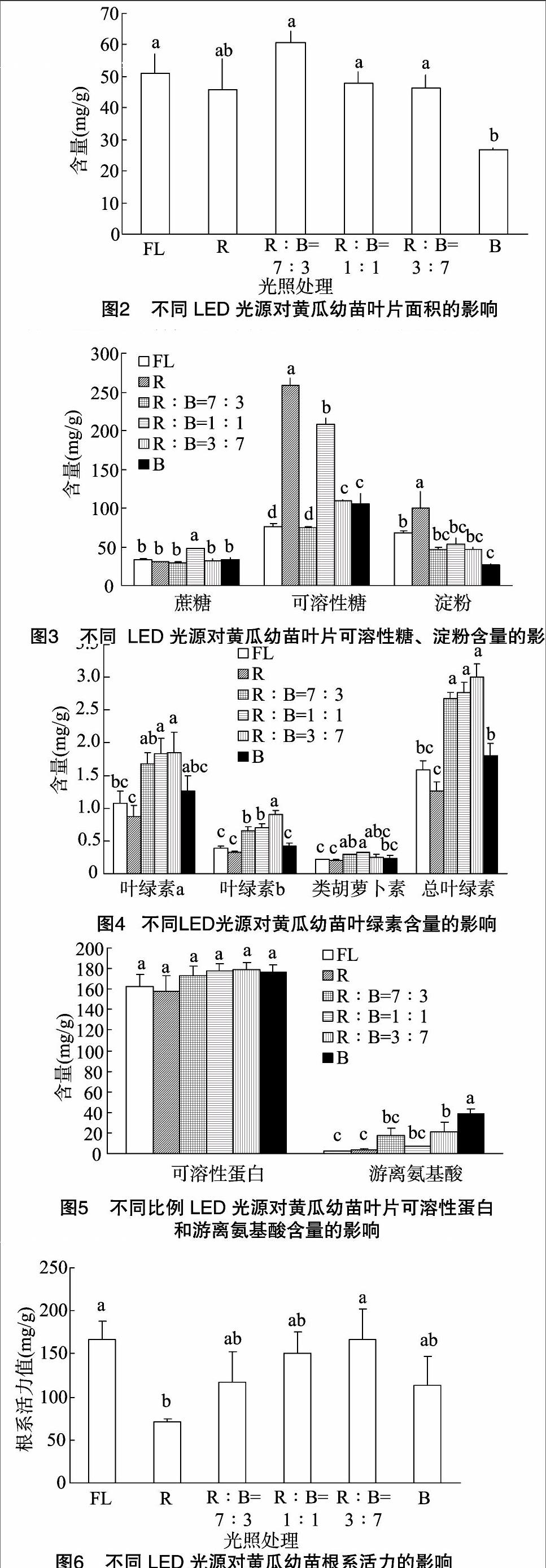
2.1LED光源对黄瓜幼苗生长的影响
3讨论
LED光源对黄瓜生长的影响已有研究,但结果不同。苏娜娜等发现光照度50 μmol/(m2·s)下红光可作为设施内黄瓜生长的补充光源;段奇珍等采用30 μmol/(m2·s)光照度,发现白光下黄瓜生长最佳;谢景等发现光照度为 100 μmol/(m2·s) 下,红蓝6 ∶[KG-*3]3 LEDs下黄瓜幼苗生长最佳,本研究结果与之不同。本研究采用了300 μmol/(m2·s)光照度,与唐大为等在光照度为150 μmol/(m2·s)下发现的红蓝7 ∶[KG-*3]3 LEDs最适合用于黄瓜幼苗生长补光的研究结果相一致。红蓝组合光的光谱与植物光合作用光谱范围相吻合,但在光照度低于100 μmol/(m2·s)时,组合光对黄瓜幼苗生长的促进作用不显著,原因可能是植物的净光合速率在光补偿点和光饱和点之间会随着光照度的增加而增加,通过总结不同的研究结果发现光照度不同导致了适合黄瓜幼苗生长光质的不同,光照度低于100 μmol/(m2·s)时,单色红光、单色白光有利于黄瓜幼苗生长。
单色红光下黄瓜幼苗叶片可溶性糖和淀粉的含量最大,这与Kowallik报道的光质可以调控高等植物碳水化合物的代谢、碳水化合物的含量在红光下较高的结果[23]相一致。唐大为等发现红光下黄瓜幼苗可溶性糖含量最高[14],本研究结果与之相一致。这是因为红光能够抑制光合产物向叶片外转运,造成淀粉的积累[24]。本研究结果表明红蓝1 下黄瓜幼苗叶片的蔗糖含量最大,其余各处理间与对照相比无显著差异,表明红蓝1 ∶[KG-*3]1 LEDs不利于黄瓜幼苗叶片蔗糖向外运输。
组合光下的植株生长较好,因为红蓝组合光的光谱能量分布和植物叶绿素吸收光谱一致[25]。LED组合光对香蕉、草莓以及百合生长的研究表明,组合光能显著改善植物的生长状态,增加光合产物积累,有利于植物生长[26-28]。本研究发现LED红蓝组合光处理下黄瓜幼苗叶片中叶绿素的含量显著高于荧光灯对照和单色红光、蓝光处理。这可能是因为组合光产生了与植物光合作用相吻合的光谱,促进了植物的光合作用,促进了叶绿体中叶绿素a、叶绿素b、类胡萝卜素的合成,这与Tanaka等的研究结果[29]一致。本研究发现在光照度为300 μmol/(m2·s)下红蓝3 ∶[KG-*3]7 LEDs的总叶绿素含量最高,但与红蓝7 ∶[KG-*3]3、1 ∶[KG-*3]1 LEDs相比无显著差异,红蓝 7 ∶[KG-*3]3 LEDs能够促进黄瓜幼苗干质量和鲜质量的增加,因此在设施内利用红蓝7 ∶[KG-*3]3 LEDs组合光对黄瓜幼苗进行补光处理,能显著提高黄瓜幼苗的叶绿素含量,促进黄瓜幼苗的光合作用,增加有机物的合成和积累。
本研究单色红光下的可溶性蛋白含量最小;组合光中,随着蓝光比例的增加,叶片中可溶性蛋白的含量也随之增加,这与唐大为等发现的黄瓜幼苗叶片可溶性糖含量在LED红光下含量最低的结果[14]一致;与苏娜娜等发现的LED红光下叶片可溶性蛋白含量最高的研究结果[15]不同,可能是光照度不同产生的差异。本研究发现单色红光、蓝光下的叶片可溶性蛋白含量较LED组合光低,说明单色LED光不利于黄瓜幼苗叶片中可溶性蛋白的积累。黄瓜幼苗叶片中的游离氨基酸含量蓝光下显著高于对照及其他LED光处理,原因可能是蓝光可显著促进线粒体的暗呼吸,暗呼吸过程中产生的有机酸为氨基酸的合成提供了碳架,从而促进了蛋白质的合成[30]。本研究发现蓝光下黄瓜幼苗叶片淀粉含量显著低于对照,蔗糖含量和可溶性糖含量显著低于红蓝1 ∶[KG-*3]1 LEDs,可能是因为淀粉等有机物的合成和积累的量较小导致了叶片面积偏小。
4结论
本研究结果表明,光照度为300 μmol/(m2·s)下,黄瓜幼苗的干物质积累量、叶片面积、可溶性糖在红蓝7 ∶[KG-*3]3 LEDs光处理下最高,叶绿素含量显著高于对照和单色LED光处理,因此,可在设施内采用该比例的LED光源对黄瓜幼苗进行补光处理,可促进植物生长。
参考文献:
[1]王新华,陈火英. 大棚蔬菜反季节栽培的意义与改进[J]. 上海农业科技,2011(3):65,60.
[2]杨创源. 黄瓜反季节大棚高产高效栽培技术[J]. 福建农业科技,2008(6):30-31.
[3]Reuveni M,Evenor D. On the effect of light on shoot regeneration in [JP3]petunia[J]. Plant Cell Tissue and Organ Culture,2007,89(1):49-54.
[4]Kevin W. Photo-Manipulation-Boxes:an instrument for the study of plant photobiology[J]. Plant Photobio,2000,26:3-15.
[5]Brown C S,Schuerger A C,Sager J C. Growth and photomorphogenesis of pepper plants under red light-emitting diodes with supplemental blue or far-red lighting[J]. Journal of the American Society for Horticultural Science,1995,120(5):808-813.
[6]Bula R J,Morrow R C,Tibbitts T W,et al. Light-emitting diodes as a radiation source for plants[J]. HortScience,1991,26(2):203-205.
[7]楊其长,张成波. 植物工厂概论[M]. 北京:中国农业科学技术出版社,2005.
[8]刘江,范广涵,刘承宜. 用于细胞及组织培养的低强度LED生物光源[J]. 激光杂志,2003,24(4):78-80.
[9]贺冬仙,杨其长,马承伟,等. 植物生产中人工光环境调控[C]. 第五次全国高等学校农业工程类学科专业教学改革暨国际学术研讨会,2002.[ZK)]
[10]吴家森,胡君艳,周启忠,等. LED灯补光对萝卜生长及光合特性的影响[J]. 北方园艺,2009(10):30-33.
[11]闻婧,鲍顺淑,杨其长,等. LED光源R/B对叶用莴苣生理性状及品质的影响[J]. 中国农业气象,2009,30(3):413-416.
[12]陈文昊,徐志刚,刘晓英,等. LED光源对不同品种生菜生长和品质的影响[J]. 西北植物学报,2011,31(7):1434-1440.
[13]蒲高斌,刘世琦,刘磊,等. 不同光质对番茄幼苗生长和生理特性的影响[J]. 园艺学报,2005,32(3):420-425.
[14]唐大为,张国斌,张帆,等. LED光源不同光质对黄瓜幼苗生长及生理生化特性的影响[J]. 甘肃农业大学学报,2011,46(1):44-48.
[15]苏娜娜,邬奇,崔瑾. LED光质补光对黄瓜幼苗生长和光合特性的影响[J]. 中国蔬菜,2012(24):48-54.
[16]段奇珍,曲梅,高丽红. 不同LED光源对黄瓜幼苗质量的影响[J]. 北方园艺,2010(15):125-128.
[17]谢景,刘厚诚,宋世威,等. 不同光质LED灯对黄瓜幼苗生长的影响[J]. 长江蔬菜,2012(6):23-25.
[18]连兆煌. 无土栽培原理与技术[M]. 北京:中国农业出版社,1994:57.
[19]Lichtenthaler H K,Wellburn A R. Determinations of total carotenoids and chlorophylls a and b of leaf extracts in different solvents[J]. Biochemical Society Transactions,1983,11:591-592.
[20]张以顺,黄霞,陈云凤. 植物生理学实验教程[M]. 北京:高等教育出版社,2009.
[21]Takahashi K,Fujino K,Kikuta Y,et al. Involvement of the accumulation of sucrose and the synthesis of cell wall polysaccharides in the expansion of potato cells in response to jasmonic acid[J]. Plant Science,1995,111:11-18.
[22]Martin A B,Cuadrado Y,Guerra H. Differences in the contents of total sugars,reducing sugars,starch and sucrose in embryogenic and nonembrogenic calli from Medicago arborea L.[J]. Plant Science,2000,154:143-151.
