陆川猪CSRP3基因克隆及其组织表达差异分析
2022-07-14陈云潘鹏丞陈钊姜长津关志惠陈宝剑梁晶谢炳坤覃兆鲜
陈云 潘鹏丞 陈钊 姜长津 关志惠 陈宝剑 梁晶 谢炳坤 覃兆鲜










摘要:【目的】克隆陸川猪的富含半胱氨酸和甘氨酸蛋白3(CSRP3)基因,并对其进行生物信息学和组织表达谱分析,为研究CSRP3基因在陆川猪肌肉生长过程中的作用机制打下基础。【方法】根据NCBI已公布的野猪CSRP3基因序列设计特异性定量引物和克隆引物,运用RT-PCR克隆CSRP3基因并进行生物信息学在线分析,采用实时荧光定量PCR检测CSRP3基因在陆川猪各组织中的表达差异。【结果】陆川猪CSRP3基因编码区(CDS)全长854 bp,编码194个氨基酸残基,与NCBI已公布的野猪CSRP3基因CDS序列相比存在5处同义碱基突变,且陆川猪与野猪氨基酸序列相似性达100.0%;陆川猪CSRP3基因的编码蛋白分子量为20935.82 Da,分子式为C964H1404N262O274S19,理论等电点(pI)为8.89,不稳定系数为39.11,表明其是偏碱性的稳定蛋白;CSRP3蛋白二级结构主要由无规则卷曲构成,三级结构可能有一种模型;陆川猪CSRP3蛋白除有多个磷酸化位点之外,无跨膜结构和信号肽;陆川猪CSRP3基因在心脏中表达量最高,背最长肌次之,在肝脏中的表达量最低。【结论】CSRP3基因在陆川猪心脏中表达量最高,背最长肌次之且明显高于其他组织,说明该基因可能对肌肉生长有一定影响。
关键词: 陆川猪;CSRP3基因;基因克隆;生物信息学分析
中图分类号: S828.89 文献标志码: A 文章编号:2095-1191(2022)04-0977-08
Cloning and differential expression analysis of CSRP3 gene
in Luchuan pig
CHEN Yun1, PAN Peng-cheng2, CHEN Zhao2, JIANG Chang-jin1, GUAN Zhi-hui2,
CHEN Bao-jian2, LIANG Jing1, XIE Bing-kun2, QIN Zhao-xian2*
(1College of Animal Science and Technology, Guangxi University, Nanning, Guangxi 530004, China; 2 The Animal Husbandry Research Institute of Guangxi/Guangxi Key Laboratory of Livestock Genetic Improvement,
Nanning, Guangxi 530001, China)
Abstract:【Objective】The cysteine and glycine rich protein 3(CSRP3)of Luchuan pig was cloned and the bioinformatics and tissue expression profile were analyzed, so as to lay foundation for studying the role of CSRP3 gene in muscle growth of Luchuan pigs. 【Method】According to the sequence of wild boar CSRP3 gene published on NCBI,specific quantitative primers and cloning primers were designed,CSRP3 gene was cloned by RT-PCR,and bioformatics analysis was conducted online. Finally,the expression difference of CSRP3 gene in various tissues of Luchuan pig was detected by qPT-PCR. 【Result】The CDS region of Luchuan pig CSRP3 gene was 854 bp in length, encoding 194 amino acids. Compared with the wild boar CSRP3 gene CDS region published on NCBI,there were 5 synonymous base mutations. The amino acid sequence was the same and its similarity was 100.0% between Luchuan pig and wild boar. Molecular weight of the protein encoded by the CSRP3 gene of Luchuan pig was 20935.82 Da, and its molecular formula was C964H1404N262O274S19, the theoretical isoelectric point was 8.89 and the instability coefficient was 39.11,which indicated that it was a stable protein with alkalinity. The secondary structure of CSRP3 gene was mainly composed of random coils and there might be a model of tertiary structure. Luchuan pig CSRP3 protein had no transmembrane structure and signal peptide except for multiple phosphorylation sites. Luchuan pig CSRP3 gene had the highest expression in the heart,followed by muscle tissue. The expression in the liver was the lowest. 【Conclusion】The expression of CSRP3 gene is highest in the heart of Luchuan pigs,followed by muscle. And the expression in heart and muscle are significantly higher than that in other tissues,indicating that this gene may have a certain effect on muscle growth.
Key words: Luchuan pig; CSRP3 gene; gene cloning; bioinformatics analysis
Foundation items: Guangxi Science and Technology Plan Project(Guike AB21196060); Central Government Guided Local Scientific and Technological Development Special Funds(Guike ZY20198019,Guike ZY21195052)
0 引言
【研究意义】陆川猪是我国地方优良猪种,具有抗逆性强、耐粗饲、繁殖能力强及肉质好等特点,其原产地位于广西陆川县(关意寅,2020)。陆川猪为我国优质的脂肪型猪种,肌间脂肪含量高,肉香味美,而深受广大消费者喜爱。但与市场主流商品猪种相比,其胴体瘦肉率较低,市场竞争力不足,具有较大的遗传改良空间。富含半胱氨酸和甘氨酸蛋白3(Cysteine and giy-cine rich protein 3,CSRP3)是富含半胱氨酸的蛋白家族成员,是进化上的保守蛋白,主要参与肌细胞增殖和分化的过程(Louis et al.,1997);其通过与LC3蛋白的相互作用促进形成自噬体,从而参与调节肌肉萎缩(Cui et al.,2020)。因此,克隆陆川猪CSRP3基因并进行组织表达差异分析,可对陆川猪的育种改良提供重要参考。【前人研究进展】目前,已有许多国内学者对陆川猪肉质性状相关基因进行研究。谢婉等(2018)研究表明,GPR1基因对陆川猪脂肪沉积有一定影响;邓章超等(2019)成功克隆了DGAT2基因编码区(CDS)序列,认为DGAT2 基因可能会影响陆川猪脂肪沉积;焦迪等(2019)研究认为,IGFBP5基因可能是影响陆川猪瘦肉率的原因之一,为进一步研究陆川猪的瘦肉率和胴体性状提供了新的遗传标记;潘鹏丞等(2020)对PDK4基因进行研究,结果表明其在皮下脂肪中表达量显著高于在其他组织中的表达量,为研究陆川猪脂肪沉积机制提供了参考。关于CSRP3基因的研究方面,Xu等(2010)研究表明,在猪胚胎骨骼肌发育过程中CSRP3基因mRNA表达量上调,表明其在肌肉生长发育过程中具有重要作用,可作为影响猪肉品质的候选基因;He等(2014)研究表明,CSRP3基因的一些组合基因型与秦川牛的生长和胴体性状显著或极显著相关,说明CSRP3基因作为标记基因在提高牛生长性能和胴体性状方面具有较高潜力;Sun等(2014)研究发现,富含肌肉的miRNAs靶向CSRP3基因来参与骨骼和肌肉系统的发育过程;Han等(2019)研究表明,鸡敲除CSRP3基因后,卫星细胞分化受到抑制,表明CSRP3可能在促进鸡卫星细胞分化过程中起重要作用,影响鸡骨骼肌生长发育(Li et al.,2020),可作为影响鸡骨骼肌生长发育的候选基因(单艳菊等,2020)。此外,有学者通过敲除斑马鱼和小鼠的CSRP3基因,发现CSRP3基因有调节骨骼肌葡萄糖稳态和维持骨骼肌机械稳定性的作用(Hernandez-Carretero et al.,2018;Chang et al.,2019)。【本研究切入点】CSRP3参与细胞分化和肌肉生长等过程,并与家畜的生长性状和胴体性状密切相关,但目前国内鲜有学者对陆川猪CSRP3基因进行研究和报道。【拟解决的关键问题】克隆陆川猪CSRP3基因,使用在线软件对CSRP3蛋白进行分析,并对比陆川猪不同组织中CSRP3基因的表达差异,为进一步研究CSRP3基因在陆川猪生长发育过程中的作用机制打下基础。
1 材料与方法
1. 1 试验材料
试验材料为3头8月龄陆川猪的心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和脂肪组织样本,由广西畜牧研究所提供。主要试剂:TRIzol试剂、反转录试剂盒、定量试剂盒、pMD18-T、Premix Taq DNA聚合酶购自TaKaRa公司;酵母浸出物和胰蛋白胨购自Oxoid公司;胶回收试剂盒购自杭州博日科技有限公司;琼脂糖购自Biowest公司;DL2000 DNA Marker购自广州东盛生物科技有限公司;大肠杆菌Trans 5α感受态细胞购自北京全式金生物技术有限公司。
1. 2 试验方法
1. 2. 1 引物设计与合成 参考NCBI的野猪CSRP3基因序列(NM_001172368.1),使用Oligo 7.0设计陆川猪CSRP3基因的定量引物(CSRP3-Fa和CSRP3-Ra)及克隆引物(CSRP3-Fb和CSRP3-Rb)(表1),以18S RNA作为内参基因,委托生工生物工程(上海)股份有限公司合成所有引物。
1. 2. 2 RNA提取和cDNA合成 采用TRIzol法分别提取陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和脂肪的RNA,以紫外分光光度計检测所提RNA的纯度和浓度,按照试剂盒说明反转录合成cDNA。
1. 2. 3 PCR扩增 以CSRP3-Fb和CSRP3-Rb为引物、陆川猪背最长肌cDNA为模板进行PCR扩增。反应体系10.0 µL:cDNA模板1.0 µL,CSRP3-Fb/CSRP3-Rb各0.3 µL,无酶无菌水3.4 µL,Premix Taq DNA聚合酶5.0 µL。扩增程序:94 ℃ 30 s,55 ℃ 30 s,72 ℃ 55 s,进行35个循环,4 ℃终止扩增。
1. 2. 4 胶回收连接及测序 PCR产物使用1.0%琼脂糖凝胶电泳进行验证,并回收目的条带,回收产物运用快速连接法与pMD18-T载体连接。连接体系10 µL:pMD18-T载体1 µL,Insert DNA 4 µL,Solution I 5 µL。16 ℃反应30 min,将连接产物转化至Trans 5α感受态细胞,37 ℃培养1 h,吸取60 µL转化产物均匀涂布在含有氨苄抗性的平板上,37 ℃培养10 h,挑单克隆阳性菌接种于3 mL含有氨苄青霉素抗性的LB液体培养基中培养至菌液浑浊,然后用菌液进行PCR验证,将阳性PCR扩增产物送至生工生物工程(上海)股份有限公司测序。
1. 2. 5 实时荧光定量PCR 以cDNA为模板,18S RNA为内参基因进行实时荧光定量PCR。反应体系20.0 µL:cDNA模板4.0 µL,CSRP3-Fa/CSRP3-Ra各0.6 µL,无酶无菌水4.8 µL,SYBR Green MasterMix 10.0 µL。扩增程序:95 ℃ 15 min;95 ℃ 10 s,60 ℃ 32 s,进行40个循环。每个样本3次技术重复,采用2-ΔΔCt法计算CSRP3基因在陆川猪各个组织中的相对表达量。
1. 3 生物信息学分析
使用软件MegALign检测对比陆川猪与其他物种CSRP3基因编码的氨基酸序列的相似性,并依据相似性构建系统发育进化树。运用ProtParam分析预测CSRP3蛋白理化性质、SOPMA预测分析CSRP3蛋白高级结构、SWISS-MODEL和ProtScale预测分析CSRP3蛋白亲/疏水性和跨膜结构、MHMM Server 2.0预测分析CSRP3蛋白信号肽、SignalP 4.1N预测分析CSRP3蛋白糖基化位点、NetNGlyc1.0和NetPhos 3.1 Server预测分析CSRP3蛋白磷酸化位点和激酶位点、WoLF PSORT预测分析CSRP3蛋白的亚细胞定位、CD-search预测分析CSRP3蛋白保守结构域。
2 结果与分析
2. 1 基因克隆结果
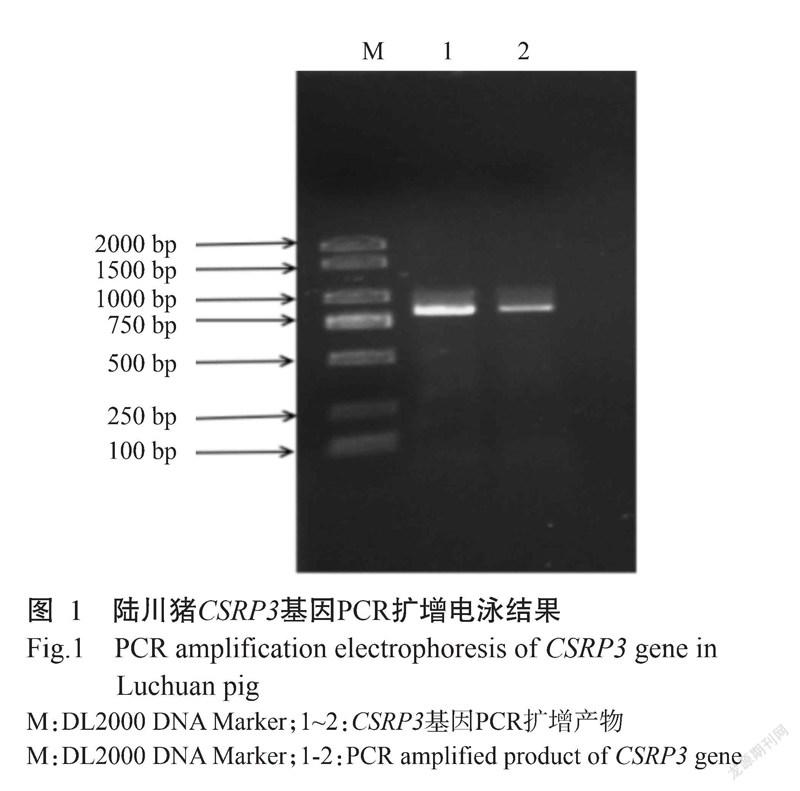
获得PCR扩增产物后,采用1.0%琼脂糖凝胶电泳对PCR产物进行验证,结果在750 bp附近观察到与预期结果相符的明亮单一条带(图1)。
2. 2 生物信息学分析结果
2. 2. 1 测序结果分析 通过克隆获得CSRP3基因CDS序列(854 bp),共编码194个氨基酸残基,与野猪CSRP3基因CDS序列(NM_001172368.1)进行对比,发现共有5处同义碱基突变(图2)。利用MegAlign 软件对所得CDS序列与NCBI已公布的野猪(NM_001172368.1)、牛(NM_001024689.3)、人类(NM_003476.5)、小鼠(NM_001198841.1)、大鼠(NM_057144.2)和原鸡(NM_001199486.1)的CSRP3基因的DS序列进行同源比对(图3),其相似性分别为100.0%、98.5%、98.5%、97.4%、97.4%和88.7%。同时,构建的CSRP3基因系统发育进化树(图4)显示,陆川猪与野猪的亲缘关系最近,与原鸡的亲缘关系最远。
2. 2. 2 蛋白理化性质 经ProtParam分析预测显示,CSRP3蛋白分子量为20935.82 Da,分子式为C904H1404N262O274S19,理论等电点(pI)为8.89,偏碱性,N端氨基酸残基为酪氨酸,在194个编码蛋白中,甘氨酸(Gly)含量最多,为13.4%,CSRP3蛋白在体外的半衰期为30 h,不稳定系数为39.11,属于稳定蛋白。
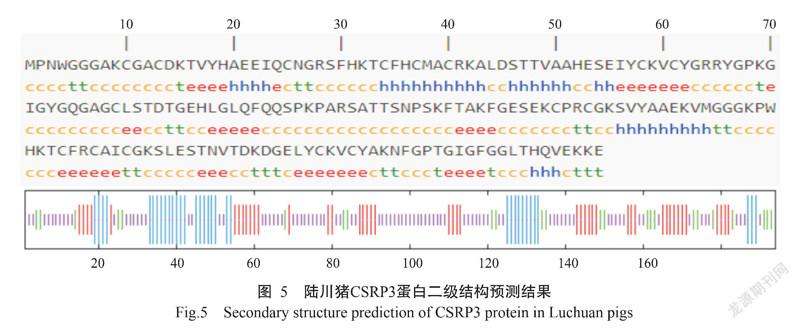
2. 2. 3 蛋白三级结构 使用SOPMA预测分析CSRP3蛋白二级结构,结果显示陆川猪CSRP3蛋白二级结构中无规则卷曲占比最高(47.42%),延伸链、α-螺旋和β-转角占比分别为22.68%、17.53%和12.37%(图5);进一步预测分析蛋白三级结构,发现陆川猪CSRP3蛋白三级结构可能有1种模型(图6)。
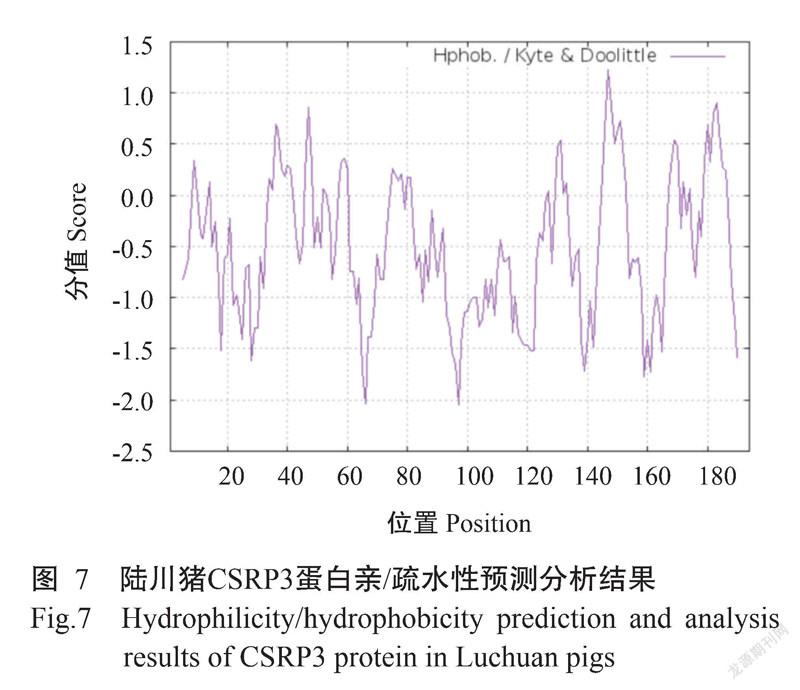
2. 2. 4 蛋白亲/疏水性 ProtScale预测分析显示,陆川猪CSRP3蛋白疏水分值最大为1.222,疏水分值最小为-2.044,分别位于第147位氨基酸和第97位氨基酸。结合图7结果分析,陆川猪CSRP3蛋白具有亲水性。
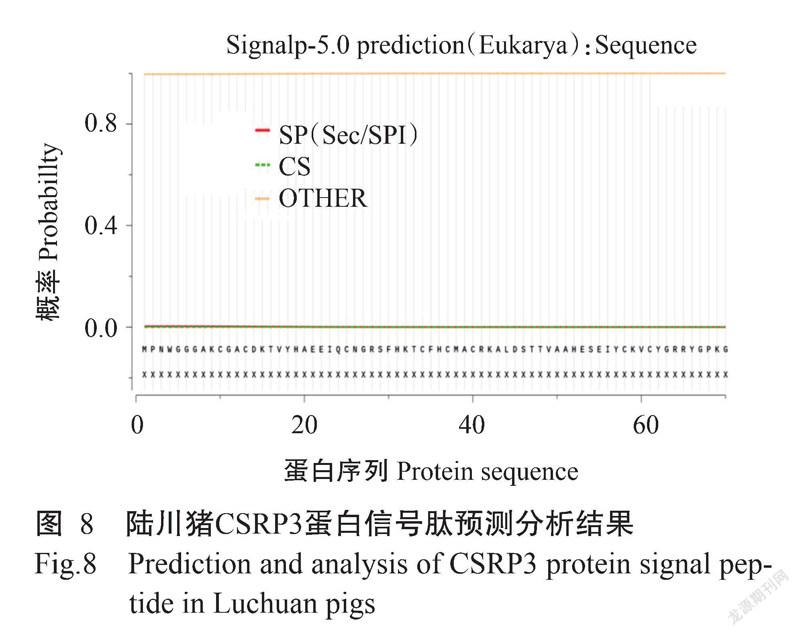
2. 2. 5 蛋白跨膜结构和信号肽 通过SignalP 4.1对陆川猪CSRP3蛋白信号肽和跨膜结构进行预测,结果显示CSRP3蛋白无信号肽存在(图8),也不存在跨膜结构(图9)。
2. 2. 6 蛋白磷酸化位點和糖基化位点 经NetPhos 3.1 Server对CSRP3蛋白磷酸化位点进行预测分析,结果显示陆川猪CSRP3蛋白可能存在20个磷酸化位点(图10),且该蛋白上存在25个蛋白激酶结合位点(PKC、UNSP、GSK13、CKⅡ、P38MAPK、CDC2、INSR和PKG等)。经NetNGlyc 1.0预测分析,结果显示陆川猪CSRP3蛋白在106和158氨基酸序列处各有1个糖基化位点(图11)。
2. 2. 7 亚细胞定位和蛋白保守结构域 经WoLF PSORT对陆川猪CSRP3蛋白进行亚细胞定位分析显示,CSRP3蛋白在细胞核、线粒体和细胞质占比分别为69.6%、17.4%和13.0%。使用CD-search预测分析陆川猪CSRP3蛋白保守结构域,结果显示陆川猪CSRP3蛋白存在2个LIM结构域(图12)。
2. 3 CSRP3基因组织表达差异分析
以陆川猪心脏、肝脏、脾脏、肺脏、肾脏、背最长肌和脂肪cDNA为模板,18S RNA为内参基因,运用实时荧光定量PCR技术检测CSRP3基因在陆川猪不同组织中的表达情况,结果(图13)显示,CSRP3基因在陆川猪心脏中的表达量最高,背最长肌次之,在其他组织中的表达量明显低于心脏和背最长肌,在肝脏中表达量最低。
3 讨论
富含半胱氨酸蛋白基因家族包括CSRP1、CSRP2、CSRP3和TLP基因。其中,CSRP3基因通过编码CSRP3蛋白,主要在横纹肌中发挥作用(Liu et al.,2016),参与肌细胞调控和结构蛋白调控(Flick and Konieczny,2000)。Xu等(2010)检测通城猪和长白猪胚胎3个不同发育阶段骨骼肌CSRP3基因mRNA的表达水平,结果显示CSRP3基因表达量总体呈上升趋势。Han等(2019)研究发现,敲除鸡CSRP3基因后,TGF-β信号通路中的Smad3磷酸化升高,抑制了鸡卫星细胞分化。Li等(2020)通过GO富集分析和KEGG通路分析筛选256个鸡发育阶段与肌肉发育、细胞数量和能量代谢相关的常见调控基因,其中CSRP3基因在3~18周表达量显著上调。由此可见,CSRP3在肌细胞分化和肌肉生长发育过程中发挥重要作用,但目前关于陆川猪CSRP3基因的研究鲜有报道。
本研究成功克隆获得陆川猪CSRP3基因CDS序列,其全长为854 bp,编码194个氨基酸残基,与NCBI上公布的野猪CSRP3基因CDS序列存在5处同义突变。该结果与单艳菊等(2020)的研究结果相似,同义突变虽不改变编码的氨基酸,但可影响基因的转录速度,从而影响蛋白功能,这可能造成陆川猪与野猪CSRP3基因功能的差异,而陆川猪CSRP3基因5处同义突变会对机体产生何种影响尚需深入研究。通过与NCBI上已公布的各物种CSRP3基因CDS序列进行同源比对分析,发现陆川猪与野猪的CSRP3基因氨基酸序列相似性高达100.0%,与哺乳动物(牛、人类、小鼠和大鼠)氨基酸序列相似性均在97.4%以上,表明CSRP3基因在不同物种间具有高度保守性;而与非哺乳动物(原鸡)的氨基酸序列相似性只有88.7%,与白佳灵等(2020)的研究一定相似性。本研究中,经预测分析发现,陆川猪CSRP3基因的编码蛋白分子量为20935.82 Da,理论等电点为8.89,不稳定系数为39.11,表明其为偏碱性的稳定蛋白;CSRP3蛋白无跨膜结构,也无信号肽,表明不具备分泌功能,二级结构主要由无规则卷曲构成,三级结构可能有一种模型。此外,陆川猪CSRP3蛋白有多个磷酸化位点。蛋白磷酸化有可能改变蛋白结构,激活蛋白活力,从而影响猪肉品质(Li et al.,2019;Zou et al.,2020),CSRP3蛋白的多个磷酸化位点可能对陆川猪肉质产生一定影响。本研究发现,CSRP3蛋白在细胞核、线粒体和细胞质占比分别为69.6%、17.4%和13.0%,与白佳灵等(2020)的研究存在差异,可能是因物种不同导致产生差异。在细胞核中,CSRP3蛋白通过促进bHLH因子与调控元件的结合,调控肌肉生长发育相关基因(Kong et al.,1997),在细胞质中,CSRP3作为支架蛋白,与许多结构蛋白相互作用,从而维持肌细胞的肌动蛋白基础的细胞结构(Arber and Caroni,1996);因此,CSRP3蛋白可能有维持陆川猪肌细胞稳定及调控肌肉生长发育的作用。
实时荧光定量PCR检测结果显示,CSRP3基因在所检测的陆川猪各组织中均有表达,且CSRP3基因除在心脏中高表达之外,在肌肉中的表达量也显著高于在其他组织中的表达量,与Arber等(1994)对CSRP3基因编码肌肉LIM 蛋白(MLP)在骨骼肌和心肌中特异性表达的研究结果一致,说明CSRP3基因主要在陆川猪心肌和骨骼肌中发挥作用(Liu et al.,2016)。综上所述,CSRP3基因参与肌细胞调控和肌肉生长发育过程,在肌肉发育和肌细胞的结构维护中起核心作用(Rashid et al.,2015),研究结果为进一步探究CSRP3基因对陆川猪肌肉生长的作用机理提供了重要参考。
4 结论
CSRP3基因在陆川猪心脏中表达量最高,背最长肌次之且明显高于其他组织,说明该基因可能对肌肉生长有一定影响。
参考文献:
白佳灵,王会,柴志欣,王吉坤,王嘉博,武志娟,信金伟,钟金城,陈智华,姬秋梅. 2020. 牦牛CSRP3基因的克隆及组织表达分析[J]. 生物技术通报,36(6):200-207. [Bai J L,Wang H,Chai Z X,Wang J K,Wang J B,Wu Z J,Xin J W,Zhong J C,Chen Z H,Ji Q M. 2020. Cloning and tissue expression analysis of CSRP3 in yak[J]. Biotechnology Bulletin,36(6):200-207.] doi:10.13560/j.cnki.biotech.bull.1985.2019-0873.
鄧章超,赵娟娟,夏琴,韦崇万,黄艳娜. 2019. 陆川猪DGAT2基因克隆、序列分析及表达水平研究[J]. 黑龙江畜牧兽医,(21):6-10. [Deng Z C,Zhao J J,Xia Q,Wei C W,Huang Y N. 2019. Cloning,sequence analysis and expression of DGAT2 gene in Luchuan pigs[J]. Heilongjiang Animal Science and Veterinary Medicine,(21):6-10.] doi:10.13881/j.cnki.hljxmsy.2019.02.0003.
关意寅. 2020. 陆川猪种质资源保护及养殖技术综述[J]. 广西农学报,35(5):72-75. [Guan Y Y. 2020. Review on the conservation and breeding techniques of Luchuan pig germplasm resources[J]. Journal of Guangxi Agriculture,35(5):72-75.] doi:10.3969/j.issn.1003-4374.2020.05.019.
焦迪,潘鹏丞,谢婉,张其伟,曾令湖,孙甜甜,陈宝剑,关志惠,谢炳坤. 2019. 陆川猪IGFBP5基因克隆及其差异表达分析[J]. 南方农业学报,50(6):1347-1355. [Jiao D,Pan P C,Xie W,Zhang Q W,Zeng L H,Sun T T,Chen B J,Guan Z H,Xie B K. 2019. Gene cloning and differen-tial expression analysis of IGFBP5 gene in Luchuan pig[J]. Journal of Southern Agriculture,50(6):1347-1355.] doi:10.3969/j.issn.2095-1191.2019.06.26.
潘鵬丞,温斌华,谢婉,姜长津,焦迪,陈宝剑,关志惠,谢炳坤. 2020. 陆川猪PDK4基因序列分析、真核表达载体构建及组织表达分析[J]. 中国畜牧兽医,47(8):2337-2347. [Pan P C,Wen B H,Xie W,Jiang C J,Jiao D,Chen B J,Guan Z H,Xie B K. 2020. Sequence analysis,eukaryotic expression vector construction and tissue expression analy-sis of PDK4 gene in Luchuan pigs[J]. China Animal Husbandry & Veterinary Medicine,47(8):2337-2347.] doi:10.16431/j.cnki.1671-7236.2020.08.001.
单艳菊,姬改革,邹剑敏,章明,屠云洁,刘一帆,巨晓军,束婧婷. 2020. 鸡CSRP3基因编码区SNPs及其与肌纤维性状的相关分析[J]. 中国家禽,42(1):7-11. [Shan Y J,Ji G G,Zou J M,Zhang M,Tu Y J,Liu Y F,Ju X J,Shu J T. 2020. Polymorphisms of coding region in CSRP3 gene and its association with muscle fiber traits in chickens[J]. China Poultry,42(1):7-11.] doi:10.16372/j.issn.1004-6364.2020.01.002.
谢婉,何剑雄,陈宝剑,关志惠,郭亚芬,兰干球,谢炳坤. 2018. 陆川猪GPR1基因的克隆及生物信息学分析[J]. 基因组学与应用生物学,37(8):3262-3268. [Xie W,He J X,Chen B J,Guan Z H,Guo Y F,Lan G Q,Xie B K. 2018. Cloning and bioinformatics analysis of GPR1 gene in Luchuan pig[J]. Genomics and Applied Biology,37(8):3262-3268.] doi:10.13417/j.gab.037.003262.
Arber S,Caroni P. 1996. Specificity of single LIM motifs in targeting and LIM/LIM interactions in situ[J]. Genes & Development,10(3):289-300. doi:10.1101/gad.10.3.289.
Arber S,Halder G,Caroni P. 1994. Muscle LIM protein,a novel essential regulator of myogenesis,promotes myogenic differentiation[J]. Cell,79(2):221-231. doi:10.1016/ 0092-8674(94)90192-9.
Chang Y,Geng F,Hu Y F,Ding Y C,Zhang R L. 2019. Zebrafish cysteine and glycine-rich protein 3 is essential for mechanical stability in skeletal muscles[J]. Biochemical and Biophysical Research Communications,511(3):604-611. doi:10.1016/j.bbrc.2019.02.115.
Cui C,Han S S,Tang S Y,He H R,Shen X X,Zhao J,Chen Y Q,Wei Y H,Wang Y,Zhu Q,Li D Y,Yin H D. 2020. The autophagy regulatory molecule CSRP3 interacts with LC3 and protects against muscular dystrophy[J]. International Journal of Molecular Sciences,21(3):749. doi:10. 3390/ijms21030749.
Flick M J,Konieczny S F. 2000. The muscle regulatory and structural protein MLP is a cytoskeletal binding partner of betaI-spectrin[J]. Journal of Cell Science,113(Pt 9):1553-1564. doi:10.1242/jcs.113.9.1553.
Han S S,Cui C,Wang Y,He H R,Liu Z H,Shen X X,Chen Y Q,Li D Y,Zhu Q,Yin H D. 2019. Knockdown of CSRP3 inhibits differentiation of chicken satellite cells by promoting TGF-β/Smad3 signaling[J]. Gene,707:36-43. doi:10.1016/j.gene.2019.03.064.
He H,Zhang H L,Li Z X,Liu Y,Liu X L. 2014. Expression,SNV identification,linkage disequilibrium,and combined genotype association analysis of the muscle-specific gene CSRP3 in Chinese cattle[J]. Gene,535(1):17-23. doi:10. 1016/j.gene.2013.11014.
Hernandez-Carretero A,Weber N,Labarge S A ,Peterka V,Doan N Y T,Schenk S,Osborn O. 2018. Cysteine-and glycine-rich protein 3 regulates glucose homeostasis in skeletal muscle[J]. American Journal of Physiology Endocrinology and Metabolism,315(2):E267-E278. doi:10.1152/ajpendo.00435.2017.
Kong Y,Flick M J,Kudla A J,Konieczny S F. 1997. Muscle LIM protein promotes myogenesis by enhancing the acti-vity of MyoD[J]. Molecular and Cellular Biology,17(8):4750-4760. doi:10.1128/MCB.17.8.4750.
Li D F,Pan Z X,Zhang K,Yu M L,Yu D B,Lu Y L,Wang J T,Zhang J,Zhang K N,Du W X. 2020. Identification of the differentially expressed genes of muscle growth and intramuscular fat metabolism in the development stage of yellow broilers[J]. Genes,11(3):244. doi:10.3390/genes 11030244.
Li Y,Cheng Y W,Zhu T Y,Zhang H,Li W,Guo Y S,Qi Y L,Chen X,Zhang J,Sha J H,Zhou Z M,Zhu H,Guo X J. 2019. The protein phosphorylation landscape of mouse spermatids during spermiogenesis[J]. Proteomics,19(11):e1900055. doi:10.1002/pmic.201900055.
Liu G Q,Zhang C L,Wang G Z,Ji Z B,Liu Z H,Chao T L,Zhang S S,Wang J M. 2016. Molecular cloning,characterization and tissue specificity of the expression of the ovine CSRP2 and CSRP3 genes from Small-tail Han sheep (Ovis aries)[J]. Gene,580(1):47-57. doi:10.1016/j.gene. 2016.01.021.
Louis H A,Pino J D,Schmeichel K L,Pomiès P,Beckerle M C. 1997. Comparison of three members of the cysteine-rich protein family reveals functional conservation and divergent patterns of gene expression[J]. The Journal of Biological Chemistry,272(43):27484-27491. doi:10.1074/ jbc.272.43.27484.
Rashid M M,Runci A,Polletta L,Carnevale I,Morgante E,Foglio E,Arcangeli T,Sansone L,Russo M A,Tafani M. 2015. Muscle LIM protein/CSRP3:A mechanosensor with a role in autophagy[J]. Cell Death Discovery,1:15014. doi:10.1038/cddiscovery.2015.14.
Sun J J,Zhang B W,Lan X Y,Zhang C L,Lei C Z,Chen H. 2014. Comparative transcriptome analysis reveals significant differences in MicroRNA expression and their target genes between adipose and muscular tissues in cattle[J]. PLoS One,9(7):e102142. doi:10.1371/journal.pone.010 2142.
Xu X W,Qiu H F,Du Z Q,Fan B,Rothschild M F,Yuan F,Liu B. 2010. Porcine CSRP3:polymorphism and association analyses with meat quality traits and comparative analyses with CSRP1 and CSRP2[J]. Molecular Biology Reports,37(1):451-459. doi:10.1371/journal.pone.0102142.
Zou B,Zhao D,He G J,Nian Y Q,Da D D,Yan J,Li C B. 2020. Acetylation and phosphorylation of proteins affect energy metabolism and pork quality[J]. Journal of Agricultural and Food Chemistry,68(27):7259-7268. doi:10. 1021/acs.jafc.0c01822.
收稿日期:2021-09-08
基金項目:广西科技计划项目(桂科AB21196060);中央引导地方科技发展专项(桂科ZY20198019,桂科ZY21195052)
通讯作者:覃兆鲜(1983-),https://orcid.org/0000-0003-3247-8108,副研究员,主要从事地方猪繁殖育种研究工作,E-mail:zhx_qin@163.com
第一作者:陈云(1996-),https://orcid.org/0000-0001-6797-9098,研究方向为动物遗传育种与繁殖,E-mail:1259314173@qq.com
