紫椴组培快繁技术研究
2022-07-14李庆华王因花孔雨光姚俊修鲁仪增燕丽萍吴德军任飞葛文华
李庆华 王因花 孔雨光 姚俊修 鲁仪增 燕丽萍 吴德军 任飞 葛文华
摘要:为探索建立紫椴组织培养快速繁育体系,以紫椴种子为材料,探讨基本培养基、植物生长调节剂浓度及配比对紫椴组培快繁效果的影响。结果表明,增殖培养基以1/2MS培养基最适宜,添加0.05 mg/L 6-BA和0.03 mg/L IBA后,增殖系数可达13.5;MS培养基最适宜做壮苗培养基和生根培养基,最佳壮苗培养基为MS+0.1 mg/L6-BA+ 0.1 mg/L IBA+ 0.03 mg/LGA3,平均苗高达5.15 cm;最佳生根培养基为MS+ 1.0 mg/L6-BA+ 0.05 mg/L NAA,生根率达93.3%,生根数达5.7根。
关键词:紫椴;组织培养;壮苗培养基;生根培养基;无性繁殖;快繁技术
中图分类号:S文献标志码:A论文编号:cjas20200200029
Study on Tissue Culture and Rapid Propagation of Tilia amurensis LI Qinghua1, WANG Yinhua1, KONG Yuguang2, YAO Junxiu1, LU Yizeng3,
YAN Liping1, WU Dejun1, REN Fei1, GE Wenhua4
(1Shandong Academy of Forestry Sciences/Shandong Key Laboratory of Forest Tree Genetic Improvement, Jinan 250014, Shandong, China;2Shandong Territorial and Spatial Planning Institute, Jinan 250014, Shandong, China; 3Shandong Forest Germplasm Resources Center, Jinan 250014, Shandong, China; 4Dashawa Forest Farm of Rizhao, Rizhao 276825, Shandong, China)
Abstract: To explore the establishment of tissue culture and rapid propagation system of Tilia amurensis, the effects of basic medium, plant growth regulator concentration and ratio on tissue culture and rapid propagation of T. amurensis were studied. The results show that 1/2MS medium is the most suitable medium for proliferation, and the proliferation coefficient could reach 13.5 when 0.05 mg/L 6-BA and 0.03 mg/L IBA are added. MS medium is the most suitable medium for strong seedling and rooting, the best medium for strong seedling is MS+ 0.1 mg/L 6-BA+ 0.1 mg/L IBA+ 0.03 mg/L GA3, with an average seedling height of 5.15 cm. The best rooting medium is MS+ 1.0 mg/L 6-BA+ 0.05 mg/L NAA, the rooting rate is 93.3%, and the number of roots is 5.7.
Keywords: Tilia amurensis; Tissue Culture; Medium for Strong Seedling; Medium for Rooting; Vegetative Propagation; Rapid Propagation
0引言
紫椴(Tilia amurensis)是珍贵的阔叶用材树种,并于1999年被列为国家Ⅱ级珍贵保护植物[1]。紫椴树姿优美,材质优良,既有很高的观赏价值,又是优良的用材树种;同时,也是东北地区主要的蜜源植物,椴树蜜质量优良,在出口蜜中位居榜首[2]。另外,紫椴的花、根等还可入药[3]。多年来,由于人们的过度采伐而又缺乏相应的更新保护措施,使得紫椴这一珍贵树种的数量锐减,为了保护这一珍贵资源,开展高效的繁育方法研究迫在眉睫。
目前,紫椴的繁殖仍以实生育苗为主,但紫椴种子必须经过一定的特殊处理才能顺利萌发[4-6],需要较长的时间,且易造成出苗不齐,从而限制了紫椴实生苗的培育[7]。因此,学者们纷纷开展了紫椴的无性繁殖研究[8-10],其中扦插繁殖由于操作简单、繁殖速度快而广受青睐,但扦插繁殖易受季节、扦插环境限制,具有一定的局限性,难以满足紫椴种苗生产的需要。
组织培养是根据植物细胞全能性发展起来的一项无性繁殖技术,已被广泛应用于木本植物的培养工作中。学者们也对椴树属植物的组培快繁工作展开了研究。吕校石[11]从外植体消毒、基本培养基选择、植物生长調节剂的浓度、生根培养、炼苗移栽等方面对紫椴、糠椴、蒙椴等几个椴树树种的组织培养技术进行了系统研究,并建立了相应的再生体系。王彦彬[12]以4种不同树龄紫椴的顶芽、侧芽为材料,对基本培养基、植物生长调节剂种类及浓度进行了筛选,认为只要选择合适的外源激素,任何培养基均可用于紫椴的组织培养。另有张建瑛等[13]进行了紫椴腋芽增殖途径的组培研究,指出适宜紫椴生长的基本培养基为WPM培养基。目前,有关紫椴的组织培养技术还不成熟,研究结果未得到较为一致的结论,还未形成成熟的技术体系。本研究在已有的基础上,就紫椴无菌苗培养、增殖培养、生根培养等方面进行一系列研究,旨在为其工厂化育苗提供一定的技术支持。
1材料与方法
1.1试验材料
试验材料为紫椴(Tilia Amurensis)种子,采自济南市泉城公园,母树年龄20年,千粒重44.3 g。
1.2试验方法
1.2.1无菌苗培养
(1)培养基质处理。以普通河沙代替MS培养基,将河沙加水拌湿,湿度保持在65%左右;将湿沙分装在培养瓶中进行高压灭菌,121℃、0.12 MPa/cm2下灭菌20 min。
(2)种子处理。将种子放入无菌瓶中,倒入浓硫酸(浓硫酸的用量以没过种子为宜)处理10~20 min,期间不断用玻璃棒进行搅拌;倒掉浓硫酸,用无菌水冲洗种子数次,直至将浓硫酸残留冲洗干净;将种子用0.1%的升汞溶液浸泡5 min,无菌水冲洗5次;用无菌的500 mg/L GA3溶液浸泡种子6 h(种子处理过程均在无菌操作台上进行)。
(3)无菌材料的获得。在无菌操作台上,将处理后的种子放入步骤1.2.1(1)所述湿沙中,每瓶放入20粒左右,之后将培养瓶置于0~4℃环境条件下进行培养(有无光照条件均可),20天左右有90%以上的种子裂口(部分种子已萌发出胚根),此时将培养瓶转移到组培室内(白天温度(25±2)℃,夜间温度(18±2)℃),3~5天种子即可萌发。
1.2.2增殖培养采用正交试验方法,分别对基本培养基、植物生长调节剂及其浓度进行研究。基本培养基采用MS、1/2MS和WPM 3种,植物生长调节剂采用6-BA、IBA。将获得的无菌苗剪成1~2 cm的带芽茎段接于各培养基上,每处理接种3瓶,每瓶接种5个茎段,培养30天后统计平均增殖系数[式(1)]。试验设计见表1。
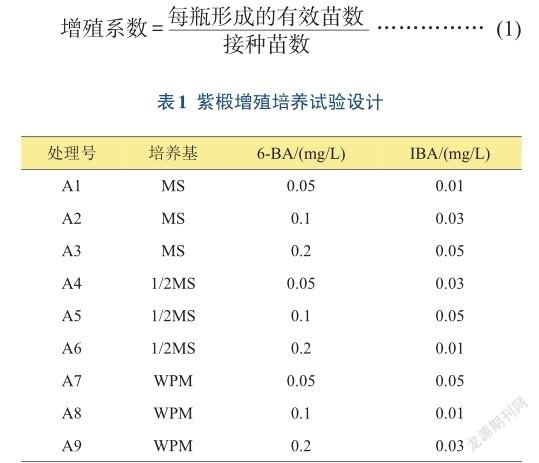

1.2.3壮苗培养以MS为基本培养基,选用IBA、6-BA和GA33种植物生长调节剂(表2),每种培养基接种3瓶,每瓶接种5个茎段,培养30天后统计平均苗高。
1.2.4生根培养待试管苗苗高达3 cm左右时,将其接种于MS培养基上,并添加不同浓度的IBA和NAA(表3),每种培养基接种3瓶,每瓶5棵。培养20天后统计生根情况。

1.2.5统计分析使用SPSS 20. 0软件进行方差分析和多重比较,Excel 2010制图。
2结果与分析
2.1不同培养基对紫椴试管苗增殖的影响
各处理下紫椴试管苗的增殖情况见表4~5。在9种不同的处理中,增殖系数差异达到显著水平(P< 0.05),用其中基本培养基为1/2MS的3个处理(A4、 A5、A6)的增殖系数最为理想,其中A5处理的增殖系数最高,为13.5,其次为A4处理,增殖系数为11.5,A6处理的增殖系数为9.5;基本培养基为MS的3个处理(A1、A2、A3)增殖系数居中;基本培养基为WPM的3个处理(A7、A8、A9)的增殖系数均较低。在3种不同的基本培养基中,MS培养基上的试管苗平均增殖系数为6.2,1/2MS培养基上的平均增殖系数为11.5,而WPM培养基上的平均增殖系数最低,仅为2.7。对各因素进行极差分析,结果表明,基本培养基的极差最大(R=8.8),说明培养基类型对紫椴的增殖培养影响最大。方差分析表明,培养基类型对增殖系数的影响达到显著水平,而6-BA与IBA在本研究设定的浓度范围内对增殖系数的影响均不显著(表5)。3个因素的最佳水平组合为A5处理(1/2MS+ 0.1 mg/L 6-BA+ 0.05 mg/L IBA),其增殖系数最高,为紫椴增殖培养的最佳配方,其次为A4和A6处理。
2.2植物生长调节剂对紫椴试管苗壮苗的影响
在试验中发现,在增殖培养阶段,仅添加6-BA和IBA的培养基虽然大大提高了紫椴的增殖效果,但芽体生长情况较差,不抽茎,矮小,故在配方中添加不同浓度的GA3来促进芽体的伸长生长。结果(表6)表明,添加GA3以后紫椴芽体伸长生长效果明显,其中B2处理的生长情况最好,试管苗生长迅速,叶片大而绿,培养30天苗高可达5.75 cm;其次为B4和B1处理,平均苗高为4.78、4.77 cm。极差分析表明,3种生长调节剂中极差最大的因素为GA3,对紫椴试管苗苗高的影响最大。进一步进行方差分析,结果(表7)表明,GA3和IBA对苗高的影响均达到显著水平,而6-BA对苗高的影响不明显。3个因素的最佳组合为B2,即0.05 mg/L 6-BA+ 0.03 mg/L IBA+ 0.03 mg/LGA3。


2.3植物生长调节剂对紫椴试管苗生根的影响
当试管苗长至2~3 cm时,将其转入添加了不同浓度植物生长调节剂的1/2MS培养基中,以不加生长调节剂的1/2MS培养基为对照。结果(表8)表明,在不同浓度的IBA与NAA组合中,紫椴试管苗的生根率差异达到显著水平(P<0.05)。在9个处理中,C5处理的生根率最高,达93.3%,且其生根数量也最多的,平均生根数量为5.7根,对照生根率为0。
3结论与讨论
选择适宜的培养基是做好组织培养工作的第一步,植物种类不同,适应的培养基也不尽相同。在石仙桃的组织培养研究中,最适宜其种子萌发和原球茎诱导增殖的培养基为MS培养基,适合其假鳞茎的诱导培养基则为1/2MS培養基[14];兴安杜鹃最适宜的培养基则为WPM培养基,其在MS培养基上培养的外植体几乎全部死亡[15];而适宜楸树增殖培养的基本培养基这是DKW培养基[16]。在椴树属植物的组织培养工作中,人们也对基本培养基进行了研究与筛选。刘芳[17]对南京椴组织培养技术的研究指出,MS培养基适合南京椴的不定芽诱导及增殖培养,这与汤诗杰[18]的研究结论较为一致。在对紫椴的组织培养技术进行研究的过程中,WPM被认为是比较适合于紫椴腋芽诱导及增殖培养的培养基[11-13],但在本研究中却发现1/2MS培养基更适合紫椴试管苗的增殖培养,WPM培养基的增殖效果最差,因此选择1/2MS培养基为紫椴增殖培养的基本培养基,而MS培养基则更适用于紫椴的壮苗培养。
细胞分裂素和生长素常被组合应用到植物的组织培养工作中。其中6-BA可显著促进芽的形成,其与低浓度的生长素配合使用更有利于增殖[19]。将一定浓度的6-BA、NAA和IAA配合添加到改良MS培养基上,可使紫霞黄栌的增殖系数达8.97[20];6-BA与KT和IBA协同作用最有利于四药门花的增殖培养[21];6-BA与NAA配合使用也可使小滨菊和簸箕柳获得良好的增殖效果[22- 23]。本研究中,1/2M培养基中添加0.05~ 0.2 mg/L 6-BA,配合使用0.01~0.05 mg/L IBA,可有效促进紫椴试管苗的增殖生长,增殖系数可达13.5。
赤霉素(GA3)常被用于组培苗的增殖和生长[24],其生理作用是促进细胞伸长,从而引起茎秆伸长和植物增高[18]。与细胞分裂素和生长素配合使用,可有效促进组培苗的伸长生长[25]。本研究中,GA3在紫椴组织培养中起着非常重要的作用。当培养基中只添加6-BA和IBA时,紫椴试管苗只进行增殖而不进行增高生长,添加适当浓度的GA3可显著促进试管苗的伸长生长,从而顺利得到了优质的紫椴组培苗,这与汤诗杰等[18]在南京椴的研究中得出的结论一致。
本研究以紫椴种子为材料,初步建立了一套无菌苗培养、增殖培养、壮苗培养及生根培養的技术体系,其中,增殖培养基以1/2MS+0.05mg/L6-BA+0.03 mg/L IBA最适宜,增殖系数为13.5,最佳壮苗培养基为MS+ 0.1 mg/L6-BA+ 0.1 mg/L IBA+ 0.03 mg/LGA3,平均苗高达5.15 cm,最佳生根培养基为MS+ 1.0 mg/L6-BA+ 0.05 mg/L NAA,生根率达93.3%,生根数达5.7根。但本研究但尚未找到可同时满足紫椴增殖生长与增高生长的适宜培养基,这是下一步继续研究的方向,以尽快建立成熟的紫椴组织培养技术体系。
参考文献
[1]国家林业局,农业部.国家重点保护野生植物名录(第一批)[Z].北京,1999.
[2]诸葛仁,唐亚.椴树属形态演化与生物地理学[J].西南林学院学报, 1995,15(4):1-14.
[3]史锋厚,卢芳,沈永宝,等.椴树属植物研究进展[J].林业科技开发, 2006,20(1):12-15.
[4]郑金辉,林士杰,张艳敏,等.NaOH处理对紫椴种子休眠解除及生理生化特性的影响[J].中国农学通报,2014,30(16):35-40.
[5]杨立学,王海南,范晶,等.解除紫椴种子休眠技术的研究[J].北京林业大学学报,2011,33(6):130-134.
[6]王海南.紫椴种子休眠机理及休眠解除技术的研究[D].哈尔滨:东北林业大学,2012.
[7]罗丽芬,王凤霞,赵垦田,等.紫椴种子快速催芽育苗试验研究[J].东北林业大学学报,1990,18(2):103-108.
[8]姚盛智,陈志成,王冰.紫椴嫁接技术[J].东北林业大学学报,1992(6):22-27.
[9]张有富,陈文山,刘高义,等.紫椴硬枝扦插技术[J].吉林林业科技, 2002(2):12-13.
[10]王海南,沈海龙,杨立学.紫椴嫩枝扦插繁殖技术研究[J].经济林研究.2012,30(3):106-110.
[11]吕校石.椴树组织培养研究[D].保定:河北农业大学,2004.
[12]王彦彬,颉玉敏,陈荣,等.紫椴的组织培养技术研究[J].防护林科技,2002(2):37-38,46.
[13]张建瑛,吕跃东,李京,等.紫椴腋芽增殖途径快繁的影响因子分析研究[J].江西农业学报,2018,30(11):23-26.
[14]吴宇函,俞涵曦,李静,等.不同培养基对石仙桃种子萌发的影响[J].农业工程,2019,9(3):107-111.
[15]杜凤国,吕伟伟,王欢,等.兴安杜鹃基本培养基和外殖体选择的初步研究[J].安徽农业科学,2019,47(12):136-138.
[16]孟路,刘勇,贺国鑫,等.楸树优良品种‘朝霞’增殖及生根培养的研究[J].西北林学院学报,2019,34(1):119-123,156.
[17]刘芳.南京椴组织培养的研究[D].南京:南京林业大学,2007.
[18]汤诗杰,李乃伟,汤庚国.南京椴组织培养快繁体系的建立[J].江苏农业科学,2008(6):87-89.
[19]臧文静,陈莹,李青,等.杂交狼尾草不同外植体愈伤组织诱导[J].草业科学,2015,32(9):1451-1456.
[20]吴凡,赵蓓蓓,王浩,等.植物生长调节剂对紫霞黄栌组织培养的影响[J].湖北农业科学,2017,56(15):2942-2946,2958.
[21]孟路,刘勇,贺国鑫,等.楸树优良品种‘朝霞’增殖及生根培养的研究[J].西北林学院学报,2019,34(1):119-123,156.
[22]邵冰洁,刘文竹,许建新,等.小滨菊组培快繁体系的初步建立[J].中国农学通报,2019,35(2):62-67.
[23]孙永莲,戴晓港,李小平,等.簸箕柳组培再生体系的建立[J].南京林业大学学报:自然科学版,2019,43(2):31-37.
[24]付晓佳.二倍体半枝莲愈伤组织诱导与继代培养研究[D].南京:南京师范大学,2016.
[25]刘静.非洲菊组培苗继代增殖与液体生根的研究[D].沈阳:沈阳农业大学,2016.
