3-(3-香豆素基)丙烯醛的制备及其多组分反应构建双杂环化合物*
2022-07-13朱陈浩苏梦洋宗斯轶王慧彦
朱陈浩,苏梦洋,宗斯轶,王慧彦,
(1 江苏海洋大学环境与化学工程学院,江苏 连云港 222005; 2 江苏海洋大学药学院,江苏 连云港 222005)
4H-吡喃及其衍生物是一类重要的含氧杂环化合物,其结构是多种天然产物的核心骨架[1-3]。这类化合物具有多种药理活性和生物活性,如抗肿瘤、抗细胞毒性、抗阿尔茨海默病、抗白血病和抗菌等,被广泛用于医药和农药领域[4-8]。尼奥地平和氨氯地平是一类具有吡啶环结构化合物,该类化合物物具有良好的生理活性[9-11],是一类高效的钙离子通道拮抗剂,可用于治疗各种高血压、心绞痛及心率失常等疾病。因此,对 1, 4-二氢吡啶衍生物的合成及其生物活性进行研究具有重大意义。
尽管已经报道过合成此类杂环化合物的许多方法[12-15],但大多数具有反应条件较苛刻,收率较低,反应时间较长;使用强酸强碱试剂和金属催化剂,操作步骤较为繁琐等缺点。多组分反应(MCRs)[16]作为一种有机合成方法一直备受研究者关注。与传统的多步合成法相比多组分反应具有操作简单、绿色节能、选择性高、效率高等优点[17]。这使得其在天然产物、先导性药物的合成和优化方面具有重大意义[18]。
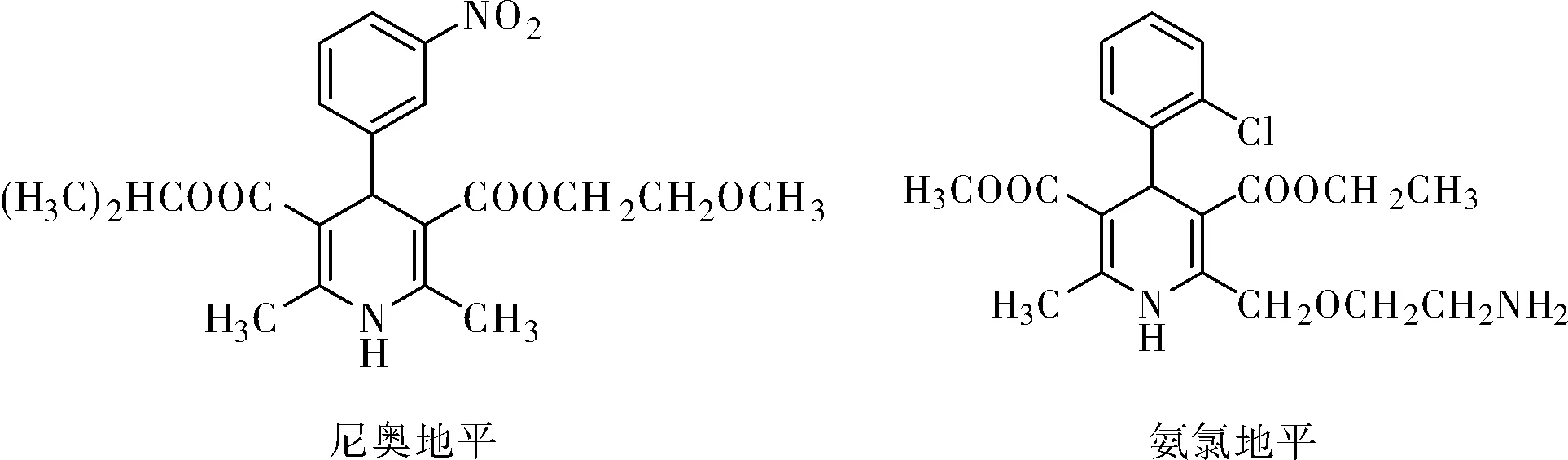
近年来,香豆素类衍生物因其良好的抗肿瘤、消炎、抑菌等活性[19-21]引起人们极大的研究兴趣,有关香豆素类化合物的分子设计、合成与生物活性研究仍为药物合成的重要领域之一。鉴于此,为了进一步寻找具有较好生物活性的杂环化合物,本文以3-乙酰基香豆素与Vilsmeier试剂反应得到3-(3-香豆素基)丙烯醛,并将得到的香豆素丙烯醛用于多组分反应中,方便的构建了既含有香豆素环又含有吡啶/吡喃结构的双杂环化合物。目标化合物的结构经FTIR、NMR、HRMS等方法进行了表征,其中化合物Ⅱa经X射线单晶衍射分析确定结构。得到的化合物可作为化工或医药中间体,用于含香豆素骨架的双杂环化合物的设计和合成。
1 实验部分
1.1 仪器和试剂
取代4-羟基-3-乙酰基香豆素和3-乙酰基香豆素,自制[22];4-羟基香豆素、1,3-环己二酮、达米酮、丙二腈、三氯氧磷,多点化学;取代水杨醛、脱氢醋酸、乙酰乙酸乙酯,国药基团化学试剂有限公司;N,N-二甲基甲酰胺(DMF)、四氢呋喃(THF)、二氧六环、乙酸乙酯、丙酮、石油醚、无水乙醇、无水甲醇等常用有机溶剂,天津市福晨化学试剂厂;其他试剂均为市售AR;薄层层析硅胶板,烟台江友硅胶开发有限公司。
XT5型显微熔点测定仪,温度计未经校正,南北仪器设备有限公司;Tensor27 傅里叶红外光谱仪(KBr压片);SMART APEX2型单晶衍射仪;Bruker micrOTOF-Q质谱仪,德国Bruker公司;Varian Invoa400/300 MHz型核磁共振谱仪(DMSO-d6或DCCl3为溶剂,TMS为内标),美国Varian公司。
1.2 实验方法
1.2.1 3-(3-香豆素基)丙烯醛Ⅱ的合成
合成路线如下所示:

称取3-乙酰基香豆素Ⅰ(12 mmol)加入50 mL干燥的圆底烧瓶中,加入8 mL的DMF,搅拌条件下缓慢滴入一定量的POCl3,升温,保持一定的温度至完全反应(TLC薄层色谱跟踪,展开剂为 V(丙酮)∶V(石油醚)=1∶2)。反应结束后加入25 g 冰水混合物,用饱和碳酸氢钠溶液中合至中性,有固体析出,抽滤,将得到的固体放入烘箱中80 ℃干燥4 h,得中间产物3-(3-香豆素基)丙烯醛Ⅱ。
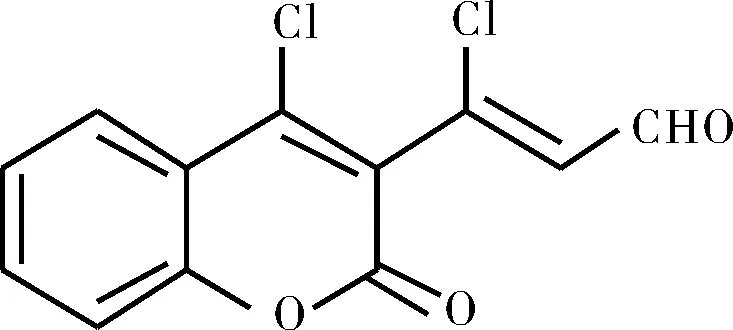
化合物Ⅱa,淡黄色固体,m.p.:182~185 ℃;FTIR(ν/cm-1):3407,3409,3079,3061,2861,1736,1716,1688,1580,1558,1478,1409,1391,1364,1355,1292,1267,1239,1201,1134,1072,989,963,944,925,890,855,777,761,738,689,624;1H NMR(500 MHz, DMSO-d6)δ:10.13(d,J=6.8 Hz,CHO,1H),7.99(d,J=7.9 Hz,ArH,1H),7.83(t,J=7.8 Hz,ArH,1H),7.55(dd,J=14.2,7.8 Hz,ArH,2H),6.71(d,J=6.8 Hz,=CH,1H);13C NMR(126 MHz,DMSO-d6)δ:191.31,156.64,152.38,147.49,142.35,135.18,132.23,126.82,126.10,124.05,117.53,117.32;HRMS(ESI,m/z),calcd for C12H6Cl2NaO3[M+Na]+:290.959 2, found 290.958 3。
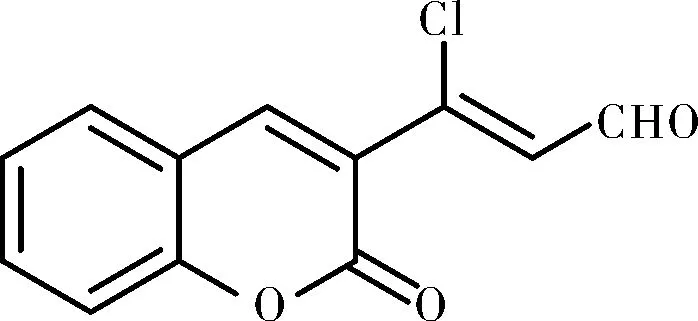
化合物Ⅱb, 淡黄色固体,m.p.:187~189 ℃;FTIR(ν/cm-1):3420,3214,3073,1710,1648,1563,1491,1361,1310,1267,1229,1203,1184,1147,1131,1078,964,829,766,677;1H NMR(500 MHz, DMSO-d6)δ: 10.20(d,J=6.8 Hz, CHO, 1H), 8.86(s, ArH, 1H), 7.99(d,J=7.7 Hz, ArH, 1H), 7.77(t,J=7.8 Hz, ArH, 1H), 7.54~7.40(m, 2×ArH+=CH, 3H);13C NMR(126 MHz, DMSO-d6)δ: 192.52, 157.57, 153.74, 146.19, 144.16, 134.91, 130.74, 128.66, 125.62, 121.73, 118.87, 116.48;HRMS(ESI, m/z), calcd for C12H7ClNaO3[M+Na]+: 256.998 1, found 256.998 4。

化合物Ⅱc, 淡黄色固体, m.p.:178~182 ℃;FTIR(ν/cm-1):3218,3078,2876,1736,1716,1668,1607,1554,1478,1410,1392,1351,1258,1235,1200,1128,1067,1083,983,943,853,836,824,796,76,1648,1563,1491,1361,1310,1203,829;1H NMR(500 MHz, DMSO-d6)δ: 12.52(s, CHO, 1H), 9.77(s, OH, 1H), 7.83(dd,J=7.8, 1.2 Hz, ArH, 1H), 7.68~7.63(m, ArH, 1H), 7.36(dd,J=14.9, 7.8 Hz, ArH+=CH, 2H), 5.61(s,=CH, 1H);HRMS(ESI, m/z), calcd for C12H7ClNaO4[M+Na]+: 272.993 1, found 272.992 8。

化合物Ⅱd, 淡黄色固体, m.p.:209~211 ℃;FTIR(ν/cm-1):3218,3078,2876,1736,1716,1668,1607,1554,1478,1410,1392,1351,1258,1235,1200,1128,1067,1083,983,943,853,836,824,796,769,668,649;1H NMR(500 MHz, DMSO-d6)δ: 12.52(s, CHO, 1H), 7.83(dd,J=7.8, 1.2 Hz, ArH, 1H), 7.67~7.63(m, ArH, 1H), 7.36(dd,J=14.9, 7.8 Hz, ArH+=CH, 2H), 5.61(s,=CH, 1H);HRMS(ESI, m/z), calcd for C12H6Cl2NaO3[M+Na]+: 290.959 2, found 290.959 8。
1.2.2 香豆素吡啶/吡喃类化合物Ⅳ的合成
合成路线如下所示:
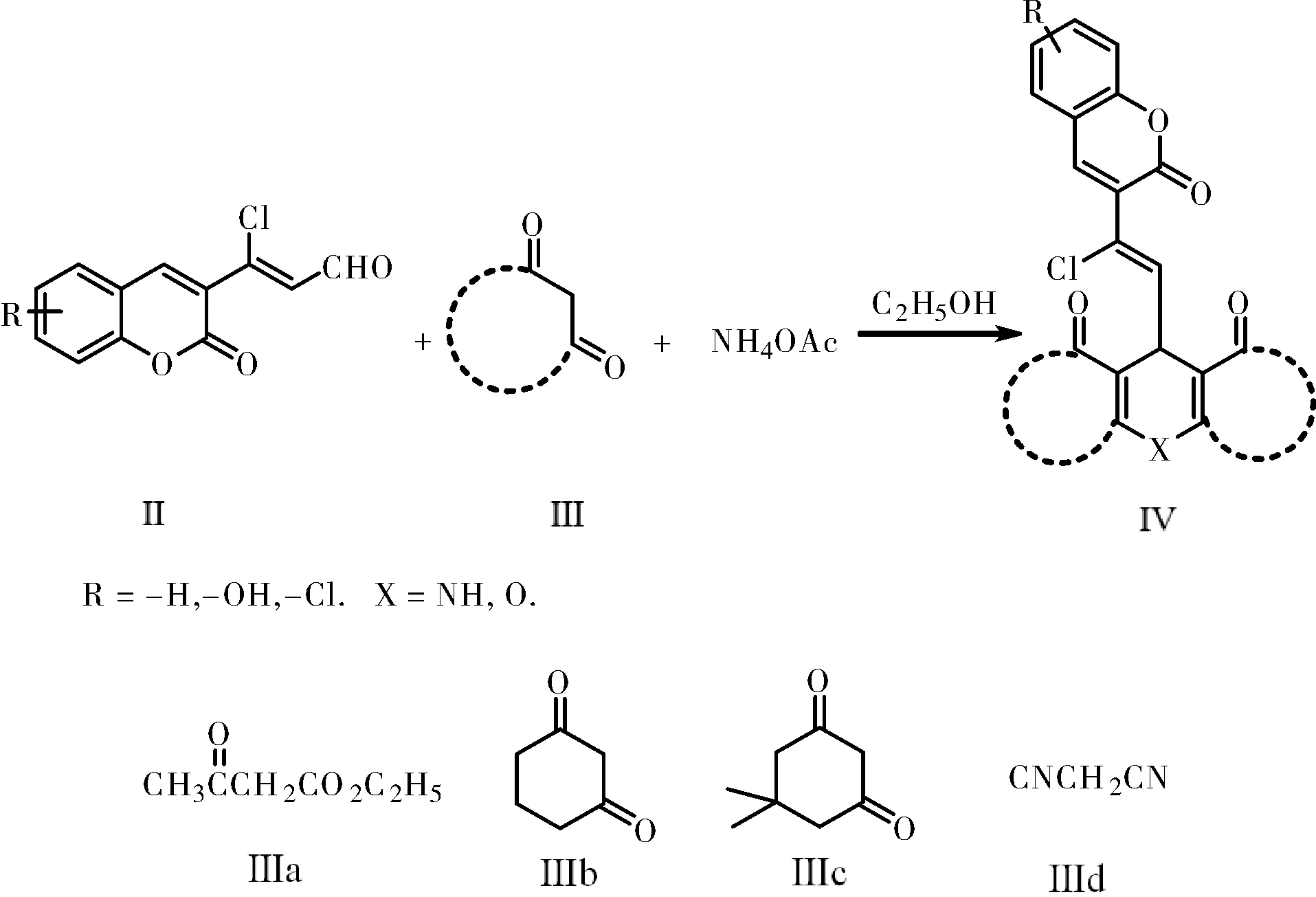
向50 mL圆底烧瓶瓶中依次加入3-(3-香豆素基)丙烯醛Ⅱ(0.5 mmol)、二羰基化合物Ⅲ(1 mmol)、醋酸铵(0.5 mmol)和无水乙醇10 mL。控制反应温度,在搅拌条件下反应至完全(TLC薄层色谱跟踪,展开剂为V(丙酮)∶V(石油醚)=1∶2)。反应结束后冷却反应物,有固体析出,抽滤,无水乙醇重结晶得产物Ⅳ。

化合物Ⅳa:淡黄色固体; m.p.:174~176 ℃,IR(KBr)ν:3320,3089,2978,1713,1688,1606,1561,1239,1056 cm-1δ: 1468,1454,1382,757 cm-1;1H NMR(500 MHz,CDCl3)δ7.90~7.88(m,ArH, 1H), 7.63~7.57(m, ArH, 1H), 7.35(dd,J=17.1, 8.1 Hz, ArH, 2H), 6.04(s, NH, 1H), 5.71(d,J=9.7 Hz,=CH, 1H), 5.15(d,J=9.7 Hz, CH, 1H), 4.31~4.20(m, 2×CH2, 4H), 2.31(s, 2×CH3, 6H), 1.38(t,J=7.1 Hz, 2×CH3, 6H); HRMS(ESI, m/z), calcd for C24H23Cl2NNaO6[M+Na]+: 514.080 0, found 514.081 2。
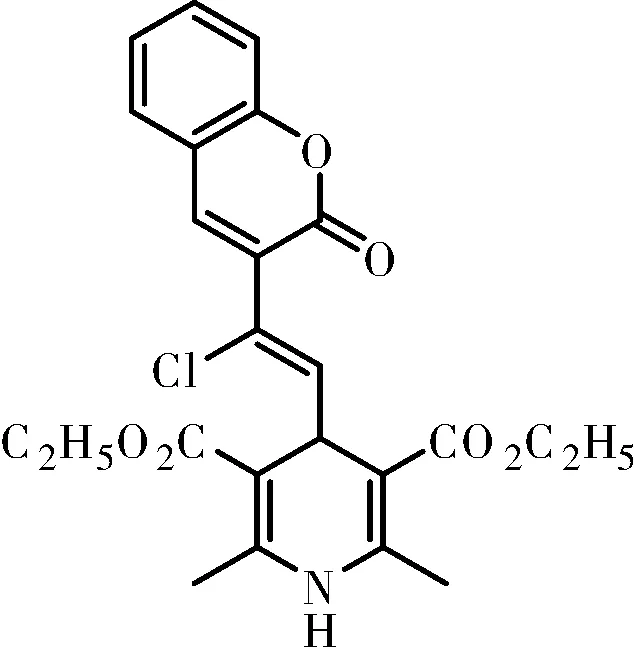
化合物Ⅳb:深黄色固体;m.p.:200~203 ℃,IR(KBr)ν:3427,2980,1703,1688,1622,1488,1362,1303,1275,1244,1206,1107,1061,δ:1454,774,750 cm-1;1H NMR(500 MHz, DMSO-d6)δ9.01(s, NH, 1H), 8.35(s,=CH, 1H), 7.86(dd,J=7.8, 1.4 Hz, ArH, 1H), 7.62(s, ArH, 1H), 7.39(dd,J=16.5, 8.0 Hz, ArH, 2H), 6.79(d,J=9.8 Hz, ArH, 1H), 5.07(d,J=9.8 Hz, ArH, 1H), 4.09~4.03(m, 2×CH2, 4H), 2.25(s, 2×CH3, 6H), 1.23(t,J=7.1 Hz, 2×CH3, 6H);13C NMR(126 MHz, DMSO-d6)δ167.06, 158.22, 152.81, 147.48, 141.89, 134.77, 132.80, 129.5, 125.12, 123.86, 122.16, 119.20, 116.11, 98.77, 59.56, 35.08, 18.55, 14.82;HRMS(ESI, m/z), calcd for C24H24ClNNaO6[M+Na]+: 480.119 0, found 480.119 0。
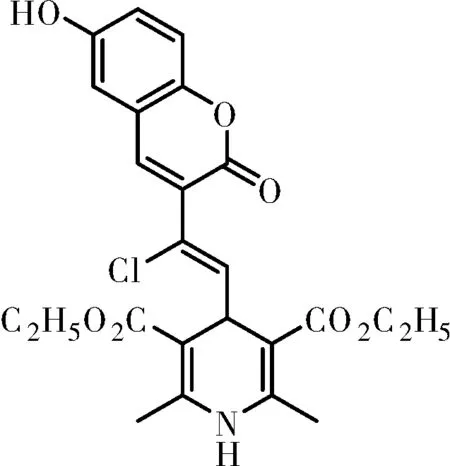
化合物Ⅳc:棕褐色固体,m.p.:250~252 ℃;IR(KBr)ν:3305,3231,3089,2975,1703,1652,1618,1572,1302,1209,1053,δ:1458,1446,1385,750 cm-1;1H NMR(500 MHz, DMSO-d6)δ9.77(s, OH, 1H), 8.95(s, NH, 1H), 7.96(s,=CH, 1H), 7.25(d,J=8.9 Hz, ArH, 1H), 7.15(d,J=2.7 Hz, ArH, 1H), 7.05(dd,J=8.9, 2.8 Hz, ArH, 1H), 6.77(d,J=9.7 Hz, ArH, 1H), 5.06(d,J=9.7 Hz, CH, 1H), 4.13~4.02(m, 2×CH2, 4H), 2.25(s, 2×CH3, 6H), 1.23(t,J=7.1 Hz, 2×CH3, 6H);HRMS(ESI, m/z), calcd for C24H24ClNNaO7[M+Na]+: 496.113 9, found 496.114 2。
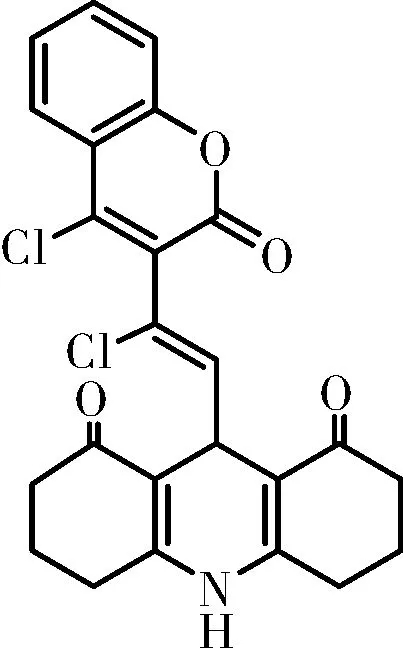
化合物Ⅳd:白色固体, m.p.:280~283 ℃;IR(KBr)ν:3447,3100,1729,1680,1600,1555,1223,1132,1173,δ:2924,2851,1473,752cm-1;1H NMR(500 MHz, DMSO-d6)δ9.46(s, NH, 1H), 7.93~7.86(m, 1H), 7.76~7.71(m, 1H), 7.47(t,J=7.6 Hz, 2H), 5.79(d,J=9.0 Hz,=CH, 1H), 4.84(d,J=9.0 Hz, CH, 1H), 2.47(t,J=5.8 Hz, 2×CH2, 4H), 2.32~2.21(m, 2×CH2, 4H), 1.95(dt,J=12.8, 5.0 Hz, CH2, 2H), 1.87~1.78(m, CH2, 2H);HRMS(ESI, m/z), calcd for C24H19Cl2NNaO4[M+Na]+: 478.058 9, found 478.059 4。

化合物Ⅳe:黄色固体,m.p.:220~223 ℃;IR(KBr)ν:3416,2974,1700,1680,1628,1454,1385,1370,1277,1088,1048,δ:880,773 cm-1;1H NMR(500 MHz, DMSO-d6)δ10.47(s, NH, 1H), 8.34(s,=CH, 1H), 7.87(d,J=7.2 Hz, ArH, 1H), 7.64(t,J=7.3 Hz, ArH, 1H), 7.49~7.32(m, ArH, 2H), 6.34(d,J=4.1 Hz,=CH, 1H), 4.54(s, CH, 1H), 2.59(d,J=17.3 Hz, CH2, 1H), 2.42(d,J=17.3 Hz, 1H), 2.29(dd,J=32.6, 16.4 Hz, 3H), 2.06(d,J=13.7 Hz, 3H), 1.06(d,J=23.5 Hz, 2×CH3, 6H), 0.94(s, 2×CH3, 6H);HRMS(ESI, m/z), calcd for C28H28ClNNaO4[M+Na]+: 500.160 5, found 500.160 0.
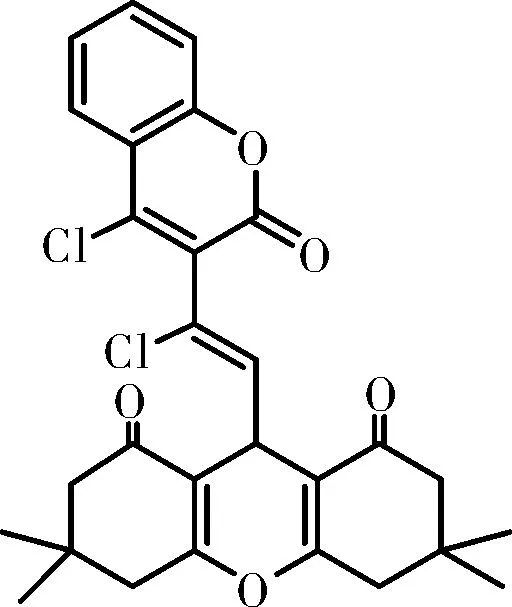
化合物Ⅳf:橙色固体,m.p.:182~184 ℃;IR(KBr,ν,cm-1):3493,2955,2830,2026,1734,1603,1454,1378,1356,1220,1155,1129,1008,940,839,751,657;1H NMR(500 MHz, DMSO-d6)δ7.93(dt,J=8.1, 1.9 Hz, ArH, 1H), 7.77~7.72(m, ArH, 1H), 7.52~7.46(m, ArH, 2H), 6.73(d,J=7.9 Hz,=CH, 1H), 5.49(d,J=7.9 Hz, CH, 1H), 2.31(s, 4×CH2, 8H), 1.01(s, 4×CH3, 12H);HRMS(ESI, m/z), calcd for C28H26Cl2NNaO5[M+Na]+: 535.105 5, found 535.104 2。
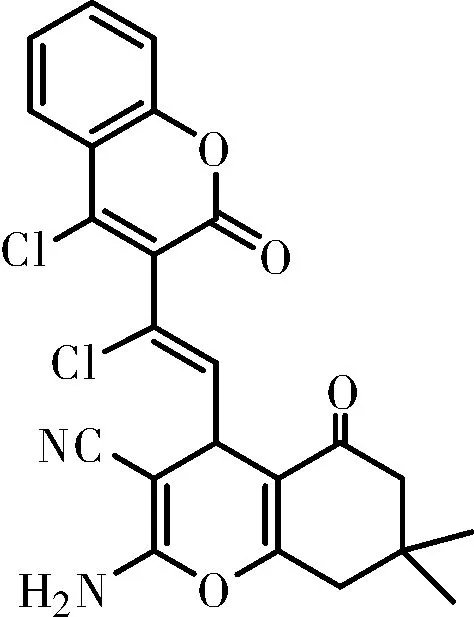
化合物Ⅳg:橘黄色固体,m.p.:187~189 ℃;IR(KBr,ν,cm-1):3423,2973,2830,2192,2026,1740,1605,1451,1397,1366,1301,1255,1221,1142,1075,1044,941,878,839,773,762,668;1H NMR(500 MHz, DMSO-d6)δ7.94(d,J=7.7 Hz, ArH, 1H), 7.76(t,J=7.6 Hz, ArH, 1H), 7.51~7.47(m, ArH, 2H), 7.11(s, NH2, 2H), 5.85(d,J=9.3 Hz,=CH, 1H), 4.29(d,J=9.2 Hz, CH, 1H), 2.49(s, CH2, 1H), 2.37(d,J=17.6 Hz, 1H), 2.32(d,J=16.1 Hz, CH2, 1H), 2.21(d,J=16.0 Hz, 1H), 1.06(s, CH3, 3H), 1.02(s, CH3, 3H);HRMS(ESI, m/z), calcd for C23H18Cl2N2NaO4[M+Na]+: 479.054 1, found 479.054 8。
1.2.3 产物Ⅱa的单晶单晶培养及晶体结构测试
称取0.2680 g(1 mmol)的Ⅱa放入50 mL的小烧杯中,加入20 mL乙醇,室温搅拌,使之溶解,用保鲜膜封住烧杯口,用针扎孔,室温放置1周,得到淡黄色透明晶体。选取合适单晶置于单晶衍射仪上,收集单晶数据。
2 结果与讨论
2.1 反应温度和三氯氧磷用量对合成化合物Ⅱa的影响
以4-羟基-3-乙酰基香豆素与三氯氧磷反应为模板反应,考察了反应温度和三氯氧磷用量对反应的影响,结果见表1。首先固定4-羟基-3-乙酰基香豆素Ⅰa用量为 4 mmol,POCl3用量为1.1 mL,DMF 用量8 mL,在反应温度为30、40、50、60和70 ℃条件下进行反应(序号1~5)。从表1中可以发现,温度对产率的影响不是特别显著,从30~70 ℃都可以得到中等产率,当反应温度为60 ℃时,产率最高,可以达到72%,并且随着温度的升高,产物颜色由浅变深,温度升高至70 ℃,产物颜色变成深红棕色,产率也有所降低,可能是温度过高,副反应增加的原因。选择最佳反应温度为60 ℃,改变三氯氧磷用量为0.8、1.1、1.4和1.6 mL(序号4, 6-9),当三氯氧磷用量为1.6 mL时,产率可以达到82%(序号8)。因此,我们选择反应最佳温度为60 ℃,4-羟基-3-乙酰基香豆素用量 4 mmol、POCl3用量为1.6 mL,DMF 用量为8 mL。
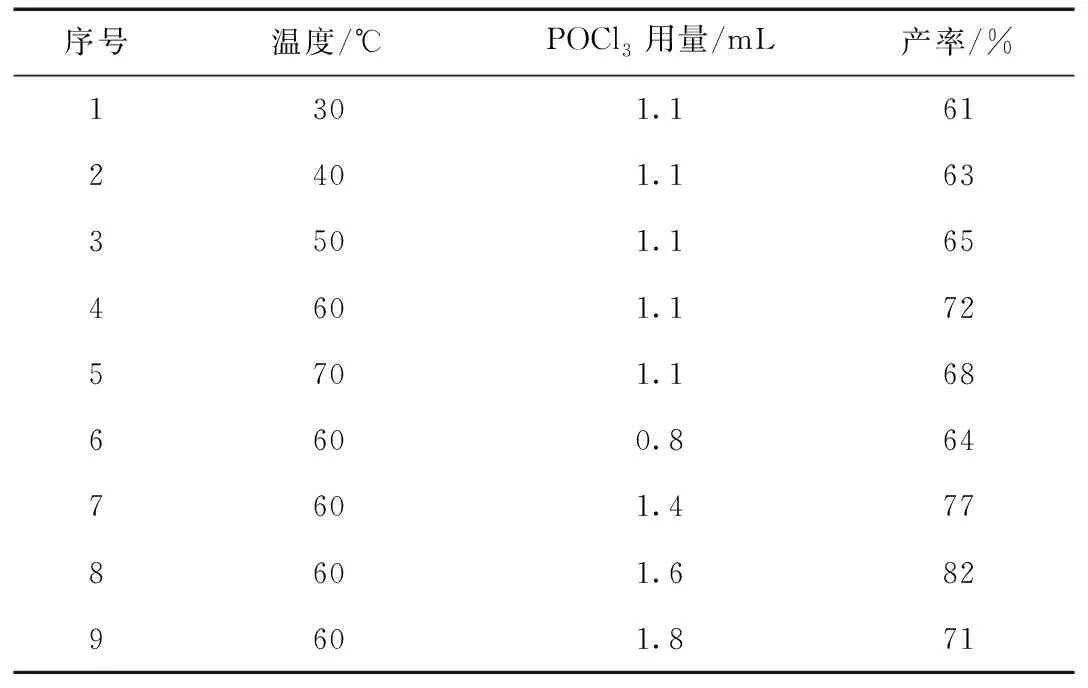
表1 反应温度和POCl3用量对化合物Ⅱa收率的影响Table 1 Effect of temperature and the amount of POCl3 on yield of compound Ⅱa
2.2 不同取代3-(3-香豆素基)丙烯醛化合物Ⅱ的合成
在最佳反应条件下,对反应底物进行拓展,考察了不同取代的3-乙酰基香豆素和POCl3/DMF反应,得到四种不同取代的香豆素丙烯醛,结果见表2。从表2中可以看出,在较短的时间内(小于等于2 h)反应都能顺利进行,并且得到中等以上的收率。
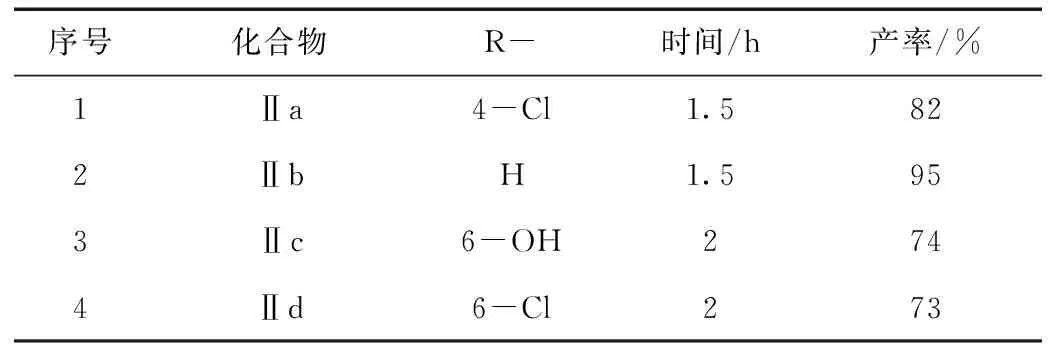
表2 不同取代基的香豆素丙烯醛Ⅱ的合成Table 2 Synthesis of substituted coumarin acrylaldehydes Ⅱ
2.3 反应溶剂和反应温度对化合物Ⅳa收率的影响
以Ⅱa与乙酸乙酸乙酯和醋酸铵为模板反应,考察了溶剂和反应温度对Ⅳa收率的影响,结果见表3。首先选择了甲醇、二氧六环、乙酸乙酯、DMF、THF和乙醇为反应溶剂,考察了不同溶剂对反应的影响(序号1~6)。从结果可以看出,极性质子性溶剂有利于反应进行,以甲醇为溶剂,反应1.5 h可以得到65%的产率,用乙醇为溶剂时,反应1.0 h就能得到78%的产率(序号6)。用弱极性溶剂如二氧六环,乙酸乙酯和THF,还有极性非质子性DMF为溶剂时,几乎没有产物生成(序 号2~5)。确定乙醇为溶剂后,考察了反应温度对产物产率的影响(序号6~9),从表3中可以看出,室温条件下,该反应也能顺利进行,得到42%的产率。随着温度升高,反应产率也逐渐增加,回流条件下产率最高,可以达到78%。
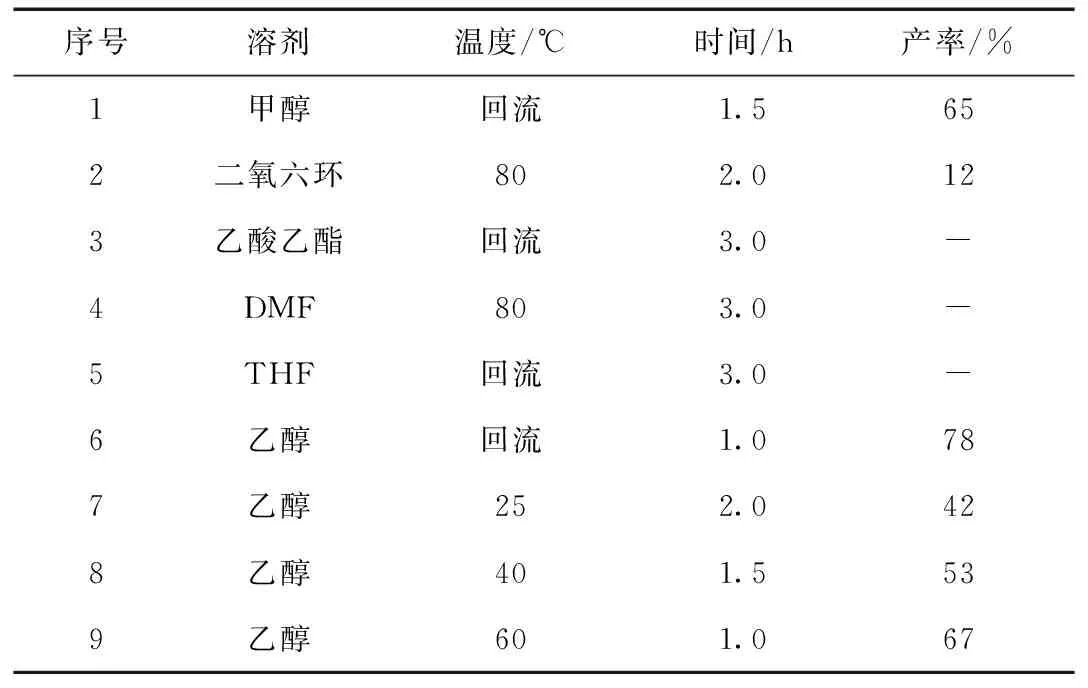
表3 反应溶剂和温度对合成化合物Ⅳa的影响Table 3 Effect of solvent type and temperature on yield of compound Ⅳa
2.4 不同取代香豆素吡啶/吡喃化合物Ⅳ的合成
在最佳反应条件下,对反应底物进行拓展,用不同取代的香豆素丙烯醛和β-二羰基化合物进行反应,二羰基化合物的结构和不同取代的香豆素吡啶/吡喃化合物Ⅳ的产率见表4。从 表4中可以看出,香豆素丙烯醛与β-二羰基化合物按照1:2的比例进行反应,在醋酸铵存在条件下,均可以得到相应的香豆素吡啶类双杂环化合物,产率达到中等以上(序号1~5)。无醋酸铵存在条件下,得到香豆素吡喃双杂环化合物(序号6~7)。值得注意的是,如果我们选择不同的二羰基化合物进行反应,也可以顺利得到中等产率的目标产物(序号7)。

表4 不同取代基的香豆素吡啶/吡喃Ⅳ的合成Table 4 Synthesis of substituted coumarin pyridine/ piran derivatives Ⅳ
2.5 化合物Ⅱa的分子结构、晶胞堆积图和晶体数据
化合物Ⅱa的晶体结构测定是在SMARTAPEX2型单晶衍射仪上进行的,收集到的数据经过Lp(线性规划)校正模型校正,晶体结构用直接法解出,经全矩阵最小二乘法对原子参数进行修正,具体的晶体学数据见表3。用SHELXTL中的XP软件做分子结构图(图1),用Diamond3软件做化合物的晶胞堆积图(图2),可以看出化合物为目标产物。表5为化合物Ⅱa的晶体学数据。
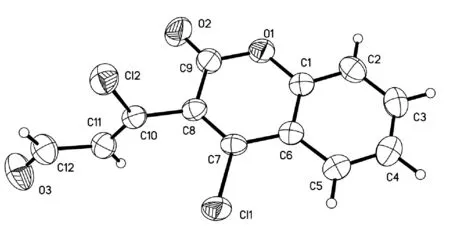
图1 化合物Ⅱa的分子结构图Fig.1 Molecular structure of compound Ⅱa
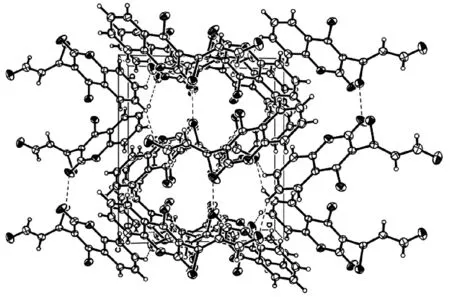
图2 化合物Ⅱa的晶胞堆积图Fig.2 Crystal packing diagram of compound Ⅱa

表5 化合物Ⅱa的晶体数据Table 5 Crystallographic data of compound Ⅱa
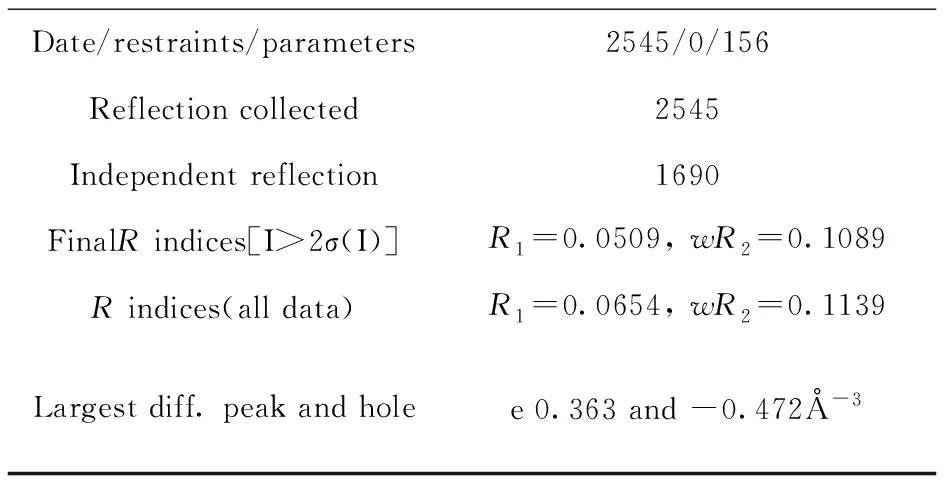
续表5
3 结 论
用不同取代基的3-乙酰基香豆素与Vilsmeier试剂在60 ℃反应,得到4种不同取代基的3-(3-香豆素基)丙烯醛,产率73%~95%。以乙醇为溶剂,回流条件下,香豆素丙烯醛与不同结构的β-二羰基化合物作用得到香豆素/吡喃类双杂环化合物。在醋酸铵存在条件下,香豆素丙烯醛与β-二羰基化合物作用得到香豆素/吡啶类双杂环化合物。该多组分反应反应条件温和,无需外加催化剂,适应性广,所有反应均可得到中等以上的收率(65%~81%)。本研究先在香豆素环上引入活性醛基,再利用多组分反应将具有生理活性的香豆素骨架和吡啶/吡喃环构建到同一个分子中,使产物兼具两种杂环的化学性质和生理活性,更多衍生物的制备及活性研究正在进行中。
