赤铁矿反浮选体系中CaCl2与石英吸附作用机理研究
2022-07-13马艺闻张伦旭
金 丹 马艺闻 侯 英 张伦旭
(辽宁科技大学矿业工程学院,辽宁 鞍山 114051)
矿产资源是人类社会发展必不可少的物质基础,对国民经济发展具有重要的战略意义,而我国作为铁矿石资源大国,铁矿石资源具有贫、细、杂的特点,不利于铁矿石的加工与利用[1-2]。鞍山式铁矿是典型的贫赤铁矿,占全国铁矿资源的50%左右,具有铁品位低、结构构造复杂的特点,主要以赤铁矿和假象赤铁矿为主,脉石矿物主要为石英[3-6]。
在鞍山式赤铁矿阴离子反浮选过程中,淀粉抑制剂对石英和赤铁矿均存在一定的抑制作用,因此活化剂对矿物的活化效用成为影响赤铁矿反浮选的关键因素。目前使用的活化剂主要为含钙活化剂,其与石英之间的作用机理从药剂在矿物表面溶解特性的角度进行分析,主要有2种结论:一是认为活化剂在矿物表面溶解后形成的Ca(OH)+是起活化作用的主要成分[7-11];二是认为活化剂在矿物表面溶解后形成的Ca2+是起活化作用的主要成分[12-13],且有科研学者基于密度泛函理论,通过模拟计算得出Ca 3d-O 2p轨道发生杂化,使Ca2+与石英中的O原子形成共价键,进一步证明Ca2+是起活化作用的主要成分[14]。
本试验从活化剂与矿物表面吸附作用角度入手,通过进行纯矿物吸附特性试验,并结合AFM、Zeta电位、FTIR检测等分析手段,研究了活化剂CaCl2在石英表面和赤铁矿表面吸附特性的差异,进一步阐明活化剂在石英和赤铁矿表面的作用机理,可为赤铁矿反浮选体系中浮选药剂制度的合理优化提供理论依据。
1 试验原料与试验方法
1.1 试验原料与试剂
试验所用石英和赤铁矿取自辽宁鞍山地区,选取其中纯度较高的块矿经人工破碎后采用陶瓷球磨机磨至-0.074 mm占90%,经筛分后干燥。石英采用酸浸法去除矿物中的铁杂质,即将干燥后的石英矿样用稀释后的盐酸溶液(盐酸与去离子水的体积比为2∶1)浸泡24 h,冲洗,反复3次,再烘干备用。赤铁矿磨矿后采用磁选管进行磁选预处理,再烘干,装袋备用。将处理后的赤铁矿和石英矿样进行X射线衍射(XRD)分析。结果见图1。赤铁矿和石英与其标准卡片的特征峰位置一致,因此经上述处理后制得的石英和赤铁矿矿样可作为纯矿物用于试验。

图1 纯矿物XRD谱图Fig.1 XRD spectrum of pure minerals
试验试剂选用氢氧化钠、盐酸和氯化钙,均为分析纯。试验用水为去离子水。
1.2 试验方法
1.2.1 纯矿物吸附试验
称取2.0 g矿样放入50 mL烧杯中,加入25 mL去离子水,经磁力搅拌器搅拌1 min,用0.05 mol/L的HCl或NaOH标准溶液调节矿浆pH值,然后加入一定量的CaCl2,继续搅拌3 min,取一定量搅拌后的矿浆溶液置于 TCL-16G高速离心机中,在 8 000 r/min转速下离心分离5min,用配制好的EDTA标准溶液对离心后的上层清液进行滴定,从而计算CaCl2在矿物表面的吸附量。
1.2.2 Zeta电位分析
采用Zetasizer Nano Puls型电位测定仪进行Zeta电位检测。分别制得赤铁矿、石英纯矿物及在不同吸附条件作用后的矿物样品,取20 mg样品置于装有20mL去离子水的烧杯中,调节矿浆pH值,经磁力搅拌器搅拌后静置,用注射器抽取适量上层清液注入样品池,进行Zeta电位测试。
1.2.3 原子力显微镜分析
采用Bruker Dimension Icon原子力显微镜对吸附前后的石英和赤铁矿进行检测,观察吸附前后矿物形貌和吸附程度的变化。具体操作为:取少量矿样加入20 mL无水乙醇,搅拌后进行超声处理10 min,使矿样在无水乙醇中充分分散,滴一滴混浊液在石墨片上,烘干,再将石墨片置于原子力显微镜下进行扫描检测与分析。
1.2.4 红外光谱分析
采用Vertex 70v傅里叶变换红外光谱仪对吸附前后的矿物样品进行测定,分析活化剂与矿物表面间的作用形式。取少量矿样与光谱纯的KBr混合均匀,矿样与KBr的质量比为1∶100,用玛瑙研钵研磨,压片,样品腔放气后置入样品,抽真空,检测得到对应的红外光谱谱图。
2 试验结果及讨论
2.1 吸附试验
2.1.1 pH值的影响
在矿浆温度35℃、CaCl2用量1 g/L、淀粉浓度为1 g/L、吸附时间5 min条件下,考察了pH值对CaCl2和淀粉在矿物表面吸附特性的影响(参考鞍山式铁矿实际浮选矿浆pH条件,仅在碱性条件下进行试验),试验结果见图2。
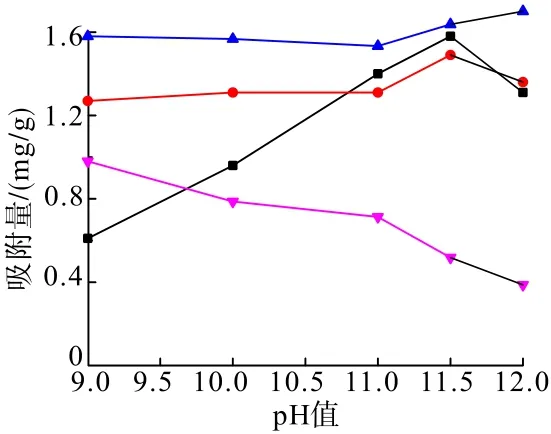
图2 pH值对CaCl2、淀粉抑制剂与矿物吸附量的影响Fig.2 Effect of pH value on adsorption capacity of CaCl2,starch depressant and minerals

从图2可以看出:随着pH值的增加,CaCl2在石英表面的吸附量变化不大,在pH值为11.5时吸附量达到最大值,此时的吸附量为1.5 mg/g;CaCl2同样在赤铁矿表面发生吸附,随着pH值的增加,CaCl2在赤铁矿表面的吸附量先提高后降低,并在pH值为11.5左右时,吸附量达到最大,此后,吸附量出现降低的趋势。当pH值在9.0~10.8的范围内,CaCl2在石英表面的吸附量要大于其在赤铁矿表面的吸附量;当pH值在11.0~12.0时,CaCl2在赤铁矿表面的吸附量接近其在淀粉表面的吸附量,从而得出在pH值为11.0~12.0时,即在实际矿物浮选pH值条件下,CaCl2与淀粉在赤铁矿表面发生了较强烈的竞争吸附,且CaCl2的活化吸附作用小于淀粉的抑制吸附作用,因此CaCl2无法活化被淀粉抑制的赤铁矿。
在矿浆温度35℃、CaCl2用量1 g/L、淀粉浓度1 g/L、吸附时间5 min时,不同pH值条件下CaCl2、淀粉在矿物表面的吸附量见表1、表2(将CaCl2的吸附量记作正吸附,淀粉的吸附量记作负吸附)。

表1 淀粉和CaCl2在石英表面吸附量对比Table 1 Comparison of adsorption amount of starch and CaCl2 on quartz
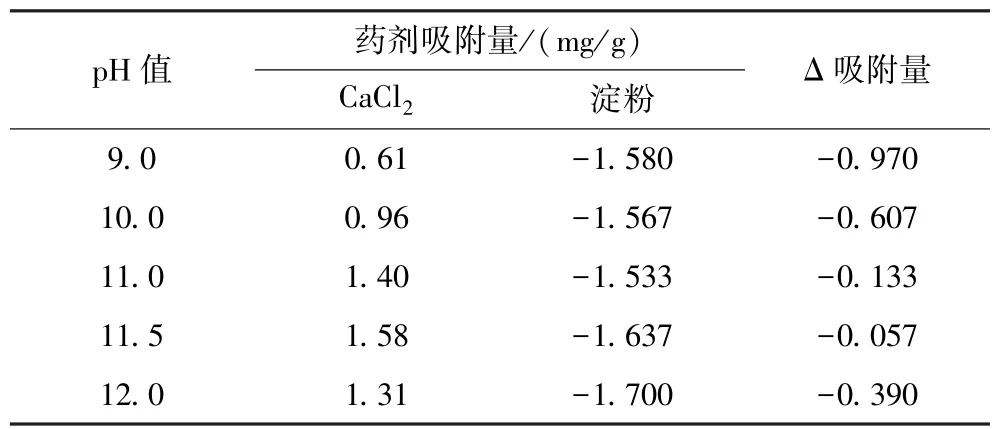
表2 淀粉和CaCl2在赤铁矿表面吸附量对比Table 2 Comparison of adsorption amount of hematite starch and CaCl2 on
从表1、表2可以看出:石英表面的Δ吸附量为正值,即发生的活化吸附作用强于抑制吸附作用;赤铁矿表面的Δ吸附量为负值,即发生的抑制吸附作用强于活化吸附作用。淀粉对赤铁矿的抑制吸附作用强于CaCl2对赤铁矿的活化吸附作用,淀粉可以有效抑制赤铁矿,石英反之,因而CaCl2可有效活化石英,并实现赤铁矿和石英的浮选分离。由此,可从吸附原理角度进一步阐释鞍山式赤铁矿实际浮选时采用加入淀粉抑制赤铁矿、加入含钙活化剂活化石英的反浮选工艺的理论依据。
2.1.2 吸附时间试验
在矿浆温度35℃、CaCl2用量1 g/L、pH=11.5的条件下,分别考察了吸附时间对CaCl2与石英和赤铁矿吸附特性的影响,试验结果见图3。
从图3可以看出:在吸附时间2~15 min的范围内,随着吸附时间的增加,CaCl2在石英和赤铁矿表面的吸附量均不断增加;在吸附时间10 min时,CaCl2在石英表面的吸附量达到最大,为1.58 mg/g,吸附时间15 min时,CaCl2在赤铁矿表面的吸附量达到最大,为1.93 mg/g;此后随着吸附时间的增加,吸附量逐渐下降。综合考虑,选择吸附时间10 min进行试验。
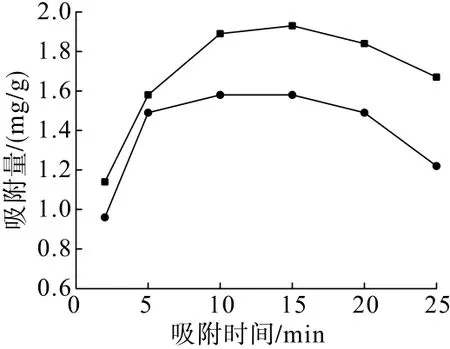
图3 吸附时间对CaCl2与矿物吸附量的影响Fig.3 Effect of adsorption time on the adsorption of CaC l2 with minerals

2.1.3 CaCl2用量试验
在矿浆温度35℃、吸附时间10 min、矿浆 pH=11.5的条件下,分别考察了CaCl2用量对CaCl2与石英及赤铁矿吸附特性的影响,试验结果见图4。
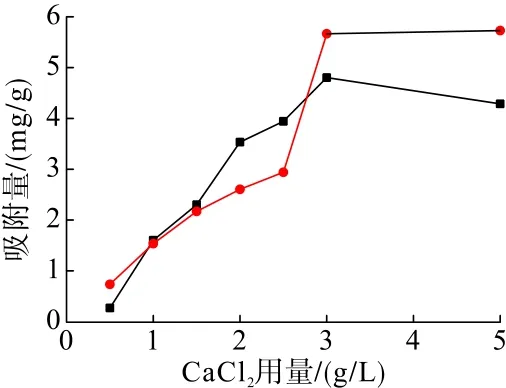
图4 CaCl2用量对CaCl2与矿物吸附量的影响Fig.4 Effect of CaCl2 dosage on the adsorption of CaCl2 with minerals

从图4可以看出,CaCl2浓度小于3.0 g/L时,CaCl2在石英和赤铁矿表面的吸附量随着CaCl2用量的增加均不断增加;当 CaCl2浓度为3.0 g/L时,CaCl2在赤铁矿表面的吸附量达到最大值;当CaCl2浓度由2.5 g/L增加到3.0 g/L时,CaCl2在石英表面的吸附量迅速增加;当CaCl2浓度超过3.0 g/L后,CaCl2在石英表面的吸附量变化趋于平缓,而在赤铁矿表面的吸附量出现下降趋势,其吸附作用差异逐渐增大。因此,当CaCl2的浓度大于3.0 g/L时,更有利于CaCl2活化石英,进而实现赤铁矿和石英的有效分离。
2.2 Zeta电位分析
在浮选过程中药剂在矿浆中由于水解或电离作用产生的离子会吸附在矿物表面,使得矿物表面的电性发生变化,从而改变矿物的可浮性。基于吸附试验研究结果,在矿浆温度35℃、吸附时间10 min、CaCl2浓度3.0 g/L的条件下,对吸附药剂前后的石英和赤铁矿进行Zeta电位检测,结果见图5。

图5 吸附前后矿物表面Zeta电位变化Fig.5 Zeta potential changes of minerals both before and after adsorption
从图5(a)可以看出,石英与CaCl2吸附后其零电点变化不大,而随着pH值的继续增加,添加CaCl2后石英表面Zeta电位较石英原矿显著正移,说明石英和CaCl2之间存在正负电荷的转移,CaCl2与石英发生了静电吸附。
从图5(b)可以看出,赤铁矿与CaCl2吸附后其零电点小幅减小,由5.81减小到4.26,且随着pH值的增加,添加CaCl2后赤铁矿表面Zeta电位较赤铁矿原矿小幅负移,说明赤铁矿和CaCl2之间没有发生正负电荷转移,即两者之间不存在静电吸附。
在浮选矿浆pH=11.5时,矿物与CaCl2吸附后,石英表面Zeta电位由-43 mV变为-9 mV,赤铁矿表面Zeta电位由-23mV变为-29mV,石英表面的电位变化明显大于赤铁矿表面的电位变化,说明石英与CaCl2的吸附作用要比赤铁矿与CaCl2的吸附作用更加强烈。
2.3 原子力显微镜结果与讨论
采用AFM检测分析吸附作用前后矿物表面形貌变化。对石英、赤铁矿纯矿物在温度为35℃、吸附时间为10 min、CaCl2浓度为 3.0 g/L条件下制得的吸附作用前后矿物样品分别进行原子力显微镜扫描,结果见图6、图7。
由图6、图7可以看出,石英与CaCl2吸附前后颗粒的形貌没有发生明显变化,但与CaCl2吸附后的石英颗粒分散度比较好,说明在一定程度上CaCl2改变了石英表面的电荷分布情况,提高了颗粒间的分散性,与Zeta电位测试分析结论一致。赤铁矿在吸附CaCl2后,颗粒形态也没有明显变化,只是发生了部分聚积现象,说明CaCl2也可以在赤铁矿表面发生吸附作用,但与矿物的作用程度较弱。
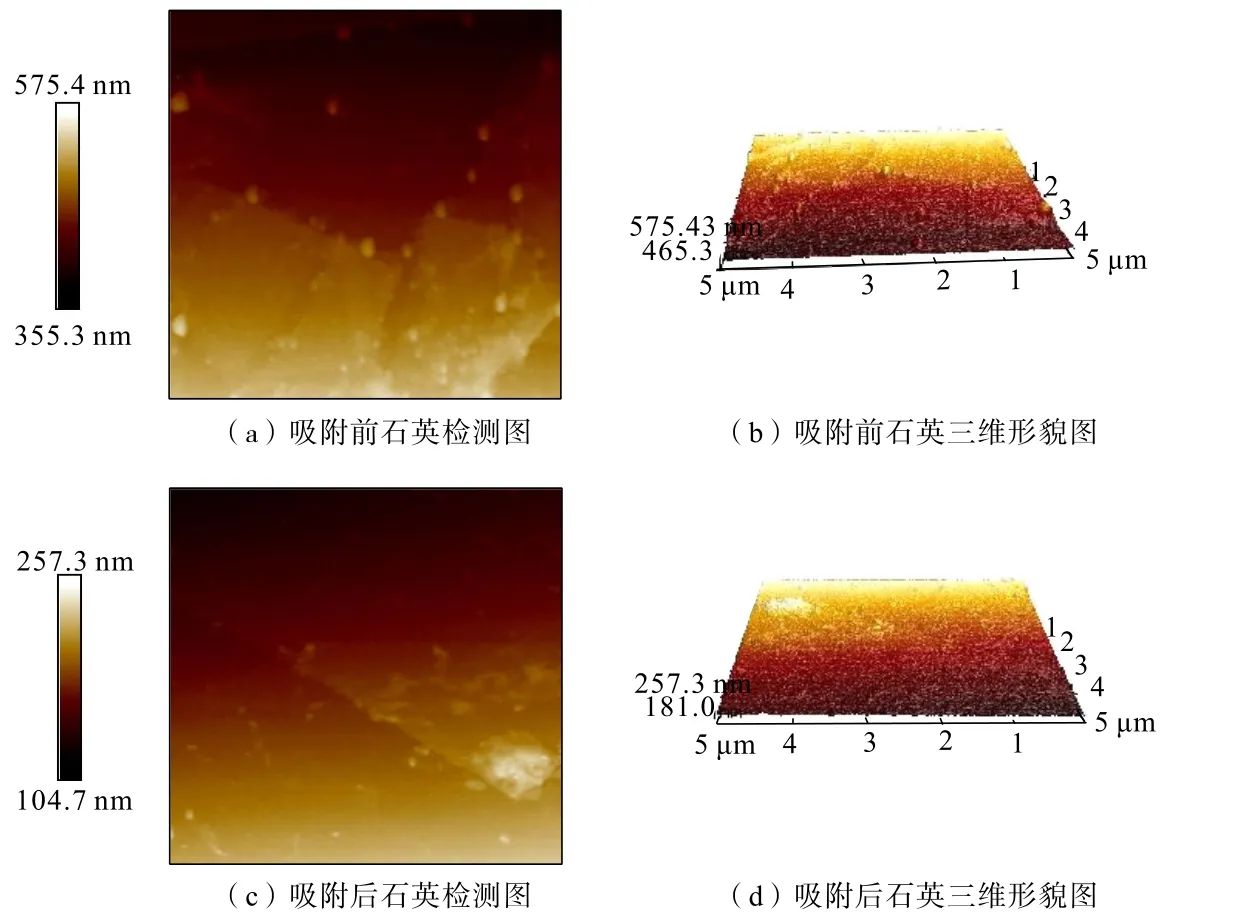
图6 石英与CaCl2吸附前后的AFM图Fig.6 AFM diagram of quartz and CaCl2 both before and after adsorption

图7 赤铁矿与CaCl2吸附前后的AFM检测结果Fig.7 AFM diagram of hematite and CaCl2 both before and after adsorption
2.4 红外光谱结果分析
利用红外光谱测试结果分析CaCl2在石英和赤铁矿表面是否发生化学吸附或氢键吸附。试验中,对石英、赤铁矿纯矿物和在温度为35℃、吸附时间为10 min、CaCl2浓度为 3.0 g/L的条件下制得的吸附作用后矿物样品分别进行红外光谱测试,结果见图8、图 9。
如图8所示,3 469.72 cm-1处为石英与水发生吸附作用的羟基伸缩振动峰,1 616.24 cm-1处为石英与水发生吸附作用的羟基弯曲振动峰,1 082.00 cm-1处为石英Si—O非对称伸缩振动吸收峰,此处为石英的第一特征吸收峰带;796.55 cm-1和694.33 cm-1处为石英 Si—O—Si对称伸缩振动吸收峰[12,15]。与CaCl2吸附后的石英的谱图中,3 469.72 cm-1处吸收峰偏移至3 429.21 cm-1,1 616.24 cm-1处吸收峰偏移至1 612.39 cm-1,1 082.00 cm-1处石英Si—O非对称伸缩振动吸收峰的峰强增加,796.55 cm-1处吸收峰偏移至779.19 cm-1。吸收峰发生了较大变化,可归属为CaCl2和石英之间发生了电子转移,使得CaCl2在石英表面吸附,且表现为较弱的化学吸附作用。
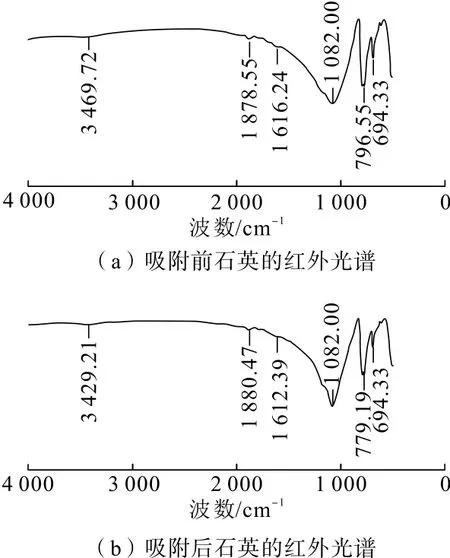
图8 石英与CaCl2吸附前后的红外光谱图Fig.8 FTIR spectrum of quartz both before and after adsorption with CaCl2
如图9所示,1 656.75 cm-1和1 452.30 cm-1处为H—O—H的变形振动吸收峰[7],987.49 cm-1和459.03 cm-1处为Fe—O的弯曲振动吸收峰,534.25 cm-1处为Fe—O的伸缩振动吸收峰[16];459.03 cm-1处振动峰偏移至460.96 cm-1,534.25 cm-1处振动峰偏移至536.18 cm-1,吸收峰变化不大,说明CaCl2和赤铁矿之间不存在明显的化学吸附作用。

图9 赤铁矿与CaCl2吸附前后的红外光谱图Fig.9 FTIR spectrum of hematite both before and after adsorption with CaCl2
2.5 石英与CaCl2吸附等温模型拟合
为了探讨石英与活化剂CaCl2的吸附机理,进行了Langumir、Freundlich以及 Dubinin-Radushkevich 3种吸附等温模型的拟合。
(1)通过Dubinin-Radushkevich吸附等温模型可判断石英与CaCl2的吸附类型,其吸附等温式如下:

式中,qe为吸附平衡时CaCl2的吸附量,mg/g;qm为最大吸附量,mg/g;b为吸附平均自由能相关常数,mol2/kJ2;ε为Polanyi吸附势,ε=RTln(1+Ce-1)。其中Ce为吸附平衡时矿浆中CaCl2的残余浓度,mg/L;R为理想气体常数,R=8.314·mol/K;T为吸附温度,K。
吸附类型可通过平均吸附自由能E进行判断,E=1/(2b)0.5,当E小于8 kJ/mol时,则该吸附属于物理吸附;当E介于8~16 kJ/mol之间,则该吸附属于离子交换吸附;当E大于16 kJ/mol时,则该吸附属于化学吸附。
(2)Langumir吸附等温模型的前提是假设吸附为单分子层吸附,其吸附等温方程式如下:
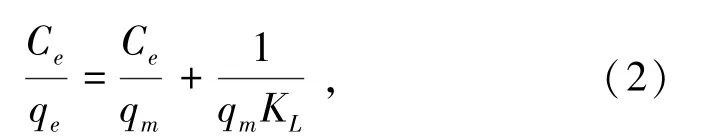
式中,Ce为吸附平衡时矿浆中CaCl2的残余浓度,mg/L;qe为吸附平衡时的吸附量,mg/g;qm为最大吸附量,mg/g;KL为Langumir吸附常数,L/mg。可通过RL来确定吸附的难易程度,RL=(1+KLC0)-1,C0为溶液溶质的初始浓度,当RL=0时为可逆吸附作用;当0<RL<1时为有利吸附;当RL=1时为不利吸附。
(3)Freundlich吸附等温模型表现的是多层吸附行为,其吸附等温方程式如下:
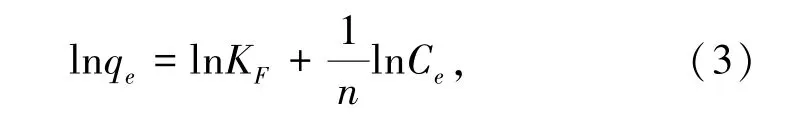
式中,qe为吸附平衡时的吸附量,mol/g;Ce为吸附平衡时矿浆中CaCl2的残余浓度,mol/L;KF为Freundlich平衡吸附常数,反映了吸附能力的强弱;为组分因数,表示吸附量随浓度增长的强度,当大于2时为难吸附,当0.1<<0.5时为容易吸附[17-19]。
根据表3吸附试验结果进行3种吸附等温模型的拟合,吸附等温曲线见图10、图11。拟合参数见表4。
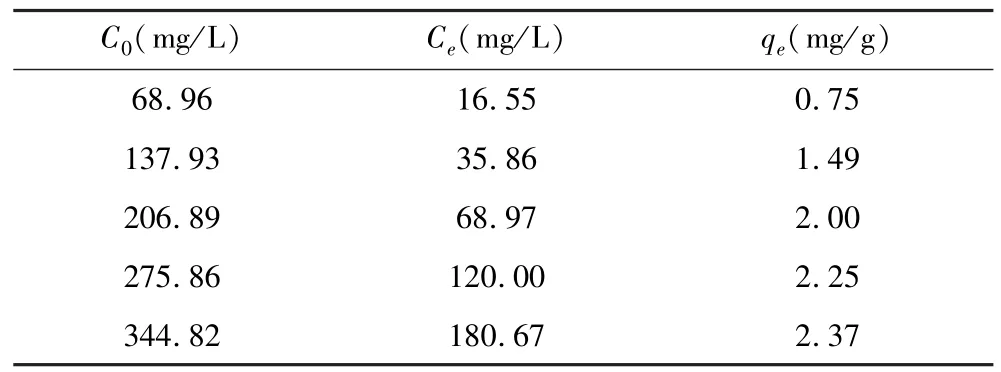
表3 吸附试验结果Table 3 Adsorption test results

表4 吸附等温模型拟合结果Table 4 Results of isothermal adsorption model fitting
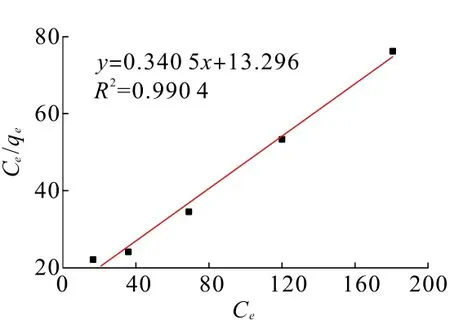
图10 石英Langumir吸附等温模型拟合曲线Fig.10 Fitting curve of quartz Langumir adsorption isotherm model

图11 石英Dubinin-Radushkevich吸附等温模型拟合曲线Fig.11 Fitting curve of quartz Dubinin-Radushkevich adsorption isotherm model
结果显示,Langumir吸附等温模型的拟合相关系数R2为0.990 4,Freundlich吸附等温模型的拟合相关系数R2为0.897 1,石英与CaCl2的吸附更符合Langumir吸附等温模型。Dubinin-Radushkevich吸附等温模型的拟合相关系数R2为0.995 7。通过Langumir吸附等温模型的计算可以看出RL为0.101 7,在0~1之间,说明石英与CaCl2的吸附为单分子层吸附;通过Dubinin-Radushkevich吸附等温模型计算可得:平均吸附自由能E为7.001 4,小于8 kJ/mol,说明石英与CaCl2的吸附主要为物理吸附。结合Zeta电位分析结果可以说明,CaCl2与石英间主要发生了单分子层的静电吸附作用。
3 结 论
(1)纯矿物吸附试验结果表明:CaCl2在石英和赤铁矿表面均发生了吸附作用,随着CaCl2浓度的增加,CaCl2在石英和赤铁矿表面的吸附量不断增加,当CaCl2浓度超过3.0 g/L时,CaCl2在2种矿物表面的吸附量差值逐渐增大,即其在石英表面的吸附效果强于在赤铁矿表面。此外,淀粉和CaCl2在赤铁矿表面共同作用时会发生竞争吸附,且活化吸附作用小于抑制吸附作用;因此,在赤铁矿反浮选的过程中CaCl2能活化石英,而无法活化赤铁矿,从而达到浮选分离的目的。
(2)Zeta电位分析结果表明,CaCl2在石英表面发生了静电吸附,且吸附作用较强;而CaCl2在赤铁矿表面不发生静电吸附。AFM分析结果表明,CaCl2的加入能够改变石英表面电荷分布情况,提高其分散性,进而促进其浮选富集。
(3)结合吸附等温模型的拟合结果得出:石英与CaCl2的吸附作用符合Langumir和Dubinin-Radushkevich吸附等温模型;综合检测分析结果表明,在赤铁矿反浮选体系下,石英与CaCl2的吸附主要为物理吸附,且为单分子层静电吸附。
