微血管超声成像技术评价体外冲击波治疗非感染性骨不连的临床价值
2022-07-13毛浩亮孙建红方铈浩王德鑫汪嫣张莞尔叶思柳朱迎春胡寅峰朱晟
毛浩亮,孙建红,方铈浩,王德鑫,汪嫣,张莞尔,叶思柳,朱迎春,胡寅峰,朱晟
创伤后骨折出现延迟愈合,在骨科临床经常发生,有5%~10%会发生骨不连[1]。手术治疗被外科医生视为最终解决办法[2]。目前各种骨生长诱导因子诱导成骨方法、电磁刺激等物理因素促进骨愈合方法不断推出,其中细胞生长因子和体外冲击波治疗(ESWT)已被证实能有效治疗骨不连[3-4]。评价骨折愈合的方法以X 线片、CT 三维成像最具代表性,但是观察期相对较长,影响后续手术植骨的效果。ESWT 骨不连的原理是扩张血管和血管再生[5],微血管超声成像技术可监测骨痂区新生血管微循环血流灌注。本文探讨微血管超声成像技术在评价ESWT 非感染性骨不连中的临床价值,报道如下。
1 资料与方法
1.1 纳入与排除标准 符合美国食品药品监督管理局(FDA)制定的骨不连诊断标准[6],即骨折9 个月仍未愈合,并且已连续3 个月没有任何愈合迹象。排除标准:(1)合并感染者;(2)伤口不愈合者;(3)合并严重糖尿病及其他严重影响骨折愈合的全身性慢性疾病者;(4)超声多模态技术禁忌证者;(5)不能配合治疗或完成定期随访者。
1.2 一般资料 选取2018 年1 月至2020 年6 月在宁波市第一医院和宁波海曙区第二医院接受ESWT的长骨骨不连患者40 例,其中男22 例,女18 例;年龄18 ~71 岁,平均(49.9±11.7)岁。共40 处骨不连部位(出于对比剂量的谨慎考虑,每例患者只限一个部位):锁骨6例,胫骨远段11 例,腓骨远段4 例,尺骨6 例,股骨6 例,桡骨2 例,肱骨干5 例。本研究通过宁波市第一医院、宁波市海曙区第二医院伦理委员会批准,所有患者均签署知情同意书。
1.3 治疗方法 使用瑞士EMS 冲击波治疗仪每周行1 次ESWT,连续治疗12次。治疗前采用宁波市第一医院专利定位贴膜(图1)对冲击波进行精准定位,选取6 ~8 个治疗点行冲击,冲击4 000 次左右,冲击能量设为患者可接受的最高脉冲能量。治疗前及治疗后每个月予X 线摄片复查骨不连愈合情况,新生骨区域占原骨不连区域的比例60%以上视为有效愈合,再加做CT检查了解骨折愈合情况,并记录愈合时间。对不稳定骨折端进行制动,摄入足够量的维生素D 和钙,并积极治疗其他慢性疾病,减少其他因素造成的骨折不愈合。随访至骨折愈合,12 个月愈合不足60%,视为无效愈合。愈合时间记为13 个月,视情况建议新的治疗方案。

图1 ESWT 治疗方法
1.4 超声检查 予首次治疗前后行微血管超声成像检查,采用TOSHIBA 公司的Aplio500 超声诊断仪,具有造影功能的14L5 线阵探头,调整机器进入造影模式,超声对比剂选用六氟化硫微泡,用5 ml 0.9%氯化钠注射液配制微泡显影剂,一次取2.4ml外周静脉团注,再用5ml 0.9%氯化钠注射液冲洗。一瓶超声对比剂可配制成5 ml 显影剂,配置后需要在6 h 内使用,因此ESWT 前后两次CEUS可以使用同一瓶对比剂,各2.4 ml,以节省费用。微泡通过肺部排泄,半小时内可大部分清除,把两次造影时间间隔控制在4 h 左右,来排除前一次对比剂微泡残留对后一次造影的影响。注射前必须充分摇匀,使微泡均匀,前后两次造影设置相同条件,注射开始时启动定时器,观察3 min,图像存盘,后期分析。数据采集:(1)彩色多普勒(CDFI)、能量多普勒(PDI)、超微血管显像(SMI)、超声造影(CEUS)分别对骨痂区域血供进行评分:根据灌注面积占骨痂面积多少分为4 级,分别记0、1、2、3 分。0 级=0,1级=1%~30%,2 级=31%~70%,3级=71%~100%。(2)骨痂区微血管对比济灌注峰值及达峰时间。比较治疗前后骨痂区峰值、达峰时间差异。
1.5 统计方法 采用SPSS 23.0 统计软件进行分析。计量资料以均数±标准差表示,采用t 检验;等级资料比较采用秩和检验;相关性分析采用Pearson 分析。P <0.05 为差异有统计学意义。
2 结果
随访12 个月中骨不连有效愈合37例,骨折后愈合时间为4 ~12 个月,平均(7.69±2.32)个月;无效愈合3 例。治疗前患者CDFI:0 分30 例,1 分10 例;PDI:0 分29 例,1 分11 例;SMI:0 分28例,1 分12 例;CEUS:0 分24 例,1 分16例;治疗后患者CDFI:0 分14 例,1 分17例,2 分9 例;PDI:0 分11 例,1 分16 例,2分13 例;SMI:0 分13 例,1 分16 例,2 分11 例;CEUS:0 分7 例,1 分10 例,2 分14例,3 分9 例。治疗前后CDFI、PDI、SMI、CEUS的微血管血流评分差异均有统计学意义(Z=4.811、4.587、5.161、5.231,均P <0.05),以CEUS 差异最明显。骨折部位微泡灌注峰值治疗前为(0.67±0.18)×10-5,治疗为(1.47±0.39)×10-5,差异有统计学意义(t=16.97,P <0.05)。骨折部位微泡灌注达峰时间ESWT 前为(26.9±2.7)s,ESWT后为(27.9±3.4)s,差异无统计学意义(t=0.317,P >0.05)。愈合时间与微血管血流评分、骨折部位微泡灌注能量值及微泡灌注能量差值均呈负相关(r=-0.578、-0.653、-0.812,均P <0.05)。
3 讨论
骨折愈合是个复杂的过程,骨不连的发生与早期手术、固定、血供、感染、全身等因素有关[7]。冲击波在不同密度组织之间产生能量差,从而产生扭拉力,造成骨不连局部的微损伤,击碎陈旧的骨痂,刺激骨膜形成小血肿,并释放炎性因子,重新激活骨折愈合的发生[8-9],来达到治疗骨不连的目的。ESWT 已在肌骨疾病临床治疗领域广泛应用[10]。
影像学和计算机断层扫描被广泛用于诊断骨折和监测骨愈合[11],但它们对早期阶段愈合过程的敏感性较低,修复性骨愈伤组织的密度至少修复2 个月以上才足够评估。在骨愈合的早期阶段,平片和计算机断层扫描有助于评估骨碎片的排列,但不能监测骨痂的新生血管。微血管超声多模成像技术利用对比剂能够保持在血管内的内在特性,从而为显示微小的微血管结构提供有用的信息,可评估骨折部位的血管生成[12]。本研究显示微血管超声成像的这些技术都可以评价微血管灌注情况,但是CEUS 的效果是最好的,治疗前后对比剂灌注的变化更能反应治疗效果的好坏(图2 ~3)。骨折愈合是一个复杂的过程,单一的评估方法显然有很多的不足,多项微血管超声成像技术同时评估将更加合理,这也是今后的研究方向。

图2 ESWT 前骨痂区新生血管对比剂灌注评分0 级
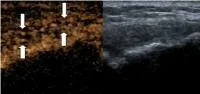
图3 ESWT后骨痂区新生血管对比剂灌注评分3 级
