草甘膦对大豆田土壤养分及其功能酶活性的影响
2022-07-13陈奎元刘卉丁伟
陈奎元, 刘卉, 丁伟
(东北农业大学农学院植保系,哈尔滨 150030)
自1996年转基因抗草甘膦大豆商业化种植以来,草甘膦因其除草效率高、安全性好、成本低等特点成为全球销量第一的除草剂[1]。草甘膦施用后约70%进入土壤,极易被土壤吸附[2],严重影响土壤酶活性[3]。土壤酶活性直接关系土壤养分的代谢,其中土壤脲酶及大豆根瘤固氮酶是参与土壤氮素循环的重要组分,土壤酸性磷酸酶与土壤磷素循环关系密切,土壤纤维素酶在土壤碳循环中起着重要作用[4]。因此,研究草甘膦对土壤养分及其功能酶活性的影响可为未来抗草甘膦作物在中国应用提供土壤环境安全基础数据。
已有室内模拟研究表明,向不同土壤中加入草甘膦后,土壤有效磷、速效钾含量显著升高[5],土壤脲酶、蔗糖转化酶和脱氢酶活性升高,磷酸酶活性降低[6]。然而,实际生产中因受多种因素共同作用,不同水平草甘膦对不同土壤的影响远比室内结果更复杂。研究表明,低水平的草甘膦在6 d内对水稻试验田耕层土壤蔗糖酶和过氧化氢酶的活性有促进作用[7],而高水平的草甘膦会抑制土壤中的过氧化氢酶活性,水平越高抑制作用越强[6],当草甘膦在土壤中降解后,这种抑制作用会逐步减弱[8]。草甘膦会抑制转基因抗草甘膦大豆的根瘤固氮酶活性[9],并与土壤氮含量呈显著负相关[10];有研究表明,草甘膦施用后,对棉花田土壤脲酶活性先抑制后促进[11],桉树林表层土壤纤维素酶和磷酸酶活性降低,土壤全氮全磷含量降低,不利于土壤养分循环[12]。目前为止,草甘膦对大豆田土壤养分与土壤功能酶相互关系尚缺乏系统研究。大豆是重要的粮食兼油料作物,随着转基因抗草甘膦大豆在世界范围内的广泛种植和中国对转基因抗草甘膦大豆研究的不断深入,开展草甘膦对土壤养分及其功能酶活性的研究,可为转基因抗草甘膦大豆种植提供土壤安全性基础数据。
本研究以大豆田土壤为研究对象,采用2年田间定位试验方法,研究草甘膦对土壤氮(N)、磷(P)、钾(K)与脲酶、磷酸酶、纤维素酶、过氧化氢酶和根瘤固氮酶活性及其相互关系的影响,以期为转基因抗草甘膦大豆商业化安全应用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试材料 供试大豆品系为转基因抗草甘膦大豆呼交06-698,由中国农业科学院作物科学研究所提供。
1.1.2 供试土壤 采用5点取样法,取0—20 cm土层大豆根际抖落土混匀。将同一小区内5点土壤样品均匀混合,土壤自然风干后过2 mm筛,用于测定土壤养分含量及土壤酶活性,每处理重复测定3次。
1.1.3 供试药剂 41%草甘膦异丙胺盐水剂,美国孟山都公司生产。
1.2 试验设计
试验于2019—2020年在东北农业大学转基因试验基地进行,试验地周围有高2 m的围墙防护,专人看管,围墙外无任何其他作物种植,试验地周围200 m内无其他大豆种植。试验期间除草甘膦以外无任何其他除草剂施用。采用完全随机区组设计,设4个处理,草甘膦施药有效量为0.0、1.2、2.4、3.6 kg·hm-2,分别用CK、T1、T2、T3表示,每个小区界限明晰且各年度固定在同一位置,每个小区面积为12.0 m2,播期和密度与当地大田一致,每年均在大豆第1片复叶完全展开期喷施草甘膦,分别在施药后7、14、21、28 d进行调查,每处理3次重复测定。
1.3 测定方法
1.3.1 土壤养分含量测定 采用碱解扩散法测定土壤碱解氮含量,采用钼锑抗比色法测定速效磷含量,采用火焰光度法测定速效钾含量[13]。
1.3.2 土壤酶活性测定 采用靛酚比色法测定土壤脲酶活性,采用磷酸苯二钠法测定磷酸酶活性,采用高锰酸钾滴定法测定过氧化氢酶活性,采用蒽酮比色法测定纤维素酶活性[13]。
1.3.3 大豆根瘤固氮酶活性的测定 利用TRACE 1300气相色谱仪(赛默飞世尔科技(中国)有限公司),采用乙炔还原法活体测定大豆根瘤固氮酶活性[14]。
1.4 数据处理
采用Excel 2013软件处理原始数据,应用DPS 10.05软件进行方差分析,通过LSD法在P<0.05水平下比较数据之间的差异显著性,利用SPSS Statistics 22.0软件进行相关性和主成分分析。
2 结果与分析
2.1 草甘膦对土壤养分含量的影响
2.1.1 草甘膦施用对土壤碱解氮含量的影响 由表1可知,施用草甘膦7 d后,2019年各处理土壤碱解氮含量显著升高,2020年各处理土壤碱解氮含量显著降低。施用14 d后,2019年T1处理土壤碱解氮含量高于CK,T2及T3处理土壤碱解氮含量低于CK。施用21 d后,2019年各处理土壤碱解氮含量显著降低;2020年T1及T2处理土壤碱解氮含量显著低于CK。施用28 d后,2019年除T3处理土壤碱解氮含量显著低于CK以外,其余各处理均显著高于CK;2020年T1和T3处理土壤碱解氮含量与CK无显著差异,T2处理土壤碱解氮含量显著低于CK。2年平均降低峰值为施用14 d后T2处理,比CK降低了10.57%。
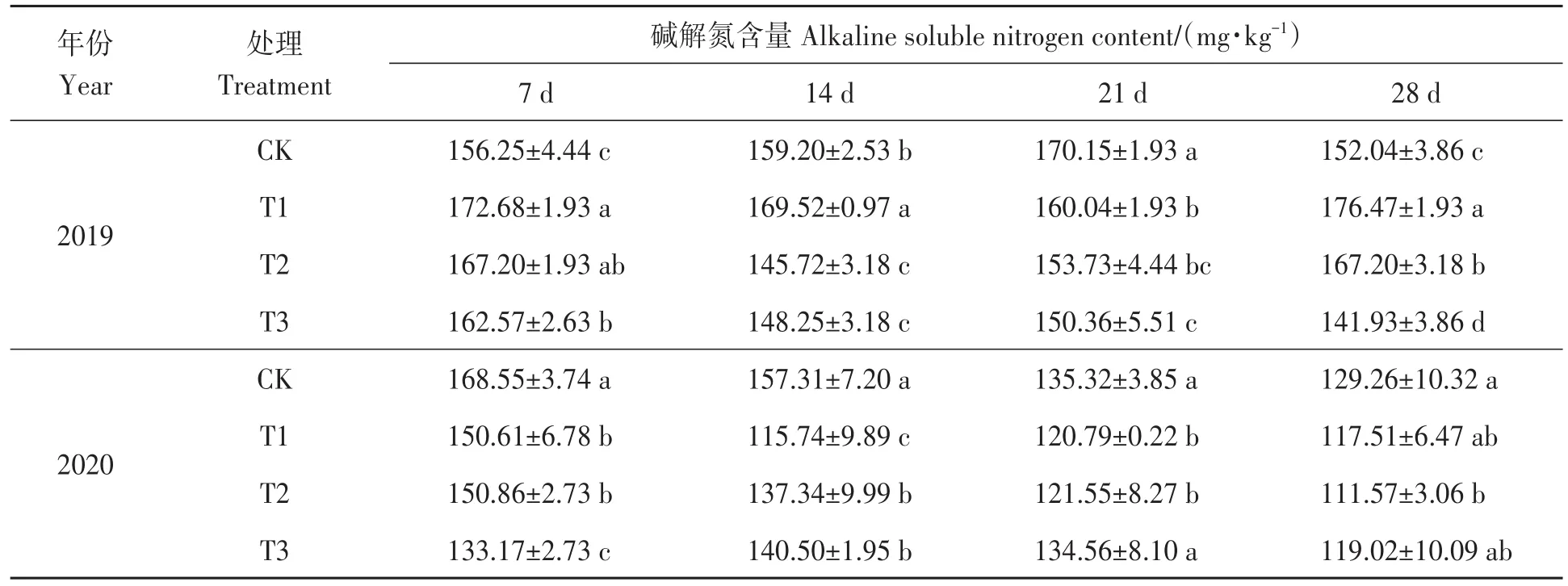
表1 不同处理下土壤碱解氮含量Table 1 Soil alkaline soluble nitrogen content under different treatments
2.1.2 草甘膦施用对土壤速效磷含量的影响 由表2可知,施用草甘膦7 d后,2019年各处理土壤速效磷含量均显著高于CK;2020年T1处理土壤速效磷含量显著高于CK,T2及T3处理土壤速效磷含量与CK无显著差异。施用14 d后,2019年及2020年各处理土壤速效磷含量均显著低于CK。施用21 d后,2019年土壤速效磷含量T1处理显著低于CK,T2处理与CK无显著差异,T3处理显著高于CK。施用28 d后,2019年与2020年T1处理土壤速效磷含量显著低于CK;T2处理与CK无显著差异,T3处理2019年显著低于CK,2020年与CK无显著差异。2年平均降低峰值为施用14 d后T2处理,比 CK降低了11.30%。
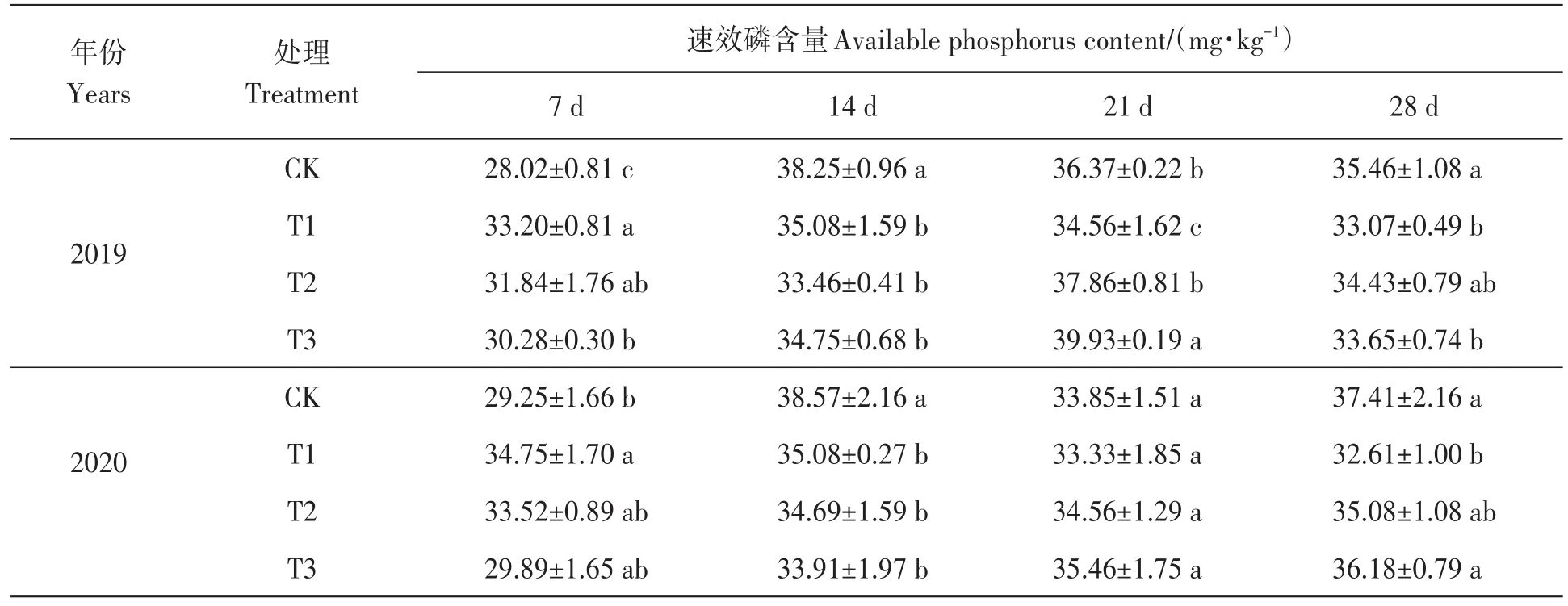
表2 不同处理下土壤速效磷含量Table 2 Soil available phosphorus content under different treatments
2.1.3 草甘膦施用对土壤速效钾含量的影响2019年和2020年试验结果(图1)均显示,草甘膦施用后的7、14、21、28 d,各处理土壤速效钾含量与CK相比均无显著差异。
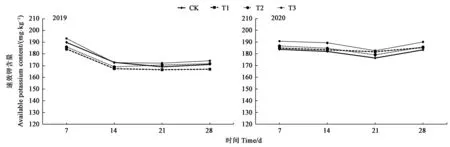
图1 不同处理下土壤速效钾含量Fig.1 Soil available potassium content under different treatments
2.2 草甘膦对土壤酶活性的影响
2.2.1 草甘膦对土壤脲酶活性的影响 2年试验结果表明,施用草甘膦后,T1处理土壤脲酶活性先升高后降低,T2与T3处理土壤脲酶活性先降低再升高。2019年在施用14~28 d内,与CK相比,T1处理土壤脲酶活性显著升高,T3处理土壤脲酶活性显著降低。2年平均降低峰值为施用21 d后T2处理,比 CK降低了67.66%(图2)。
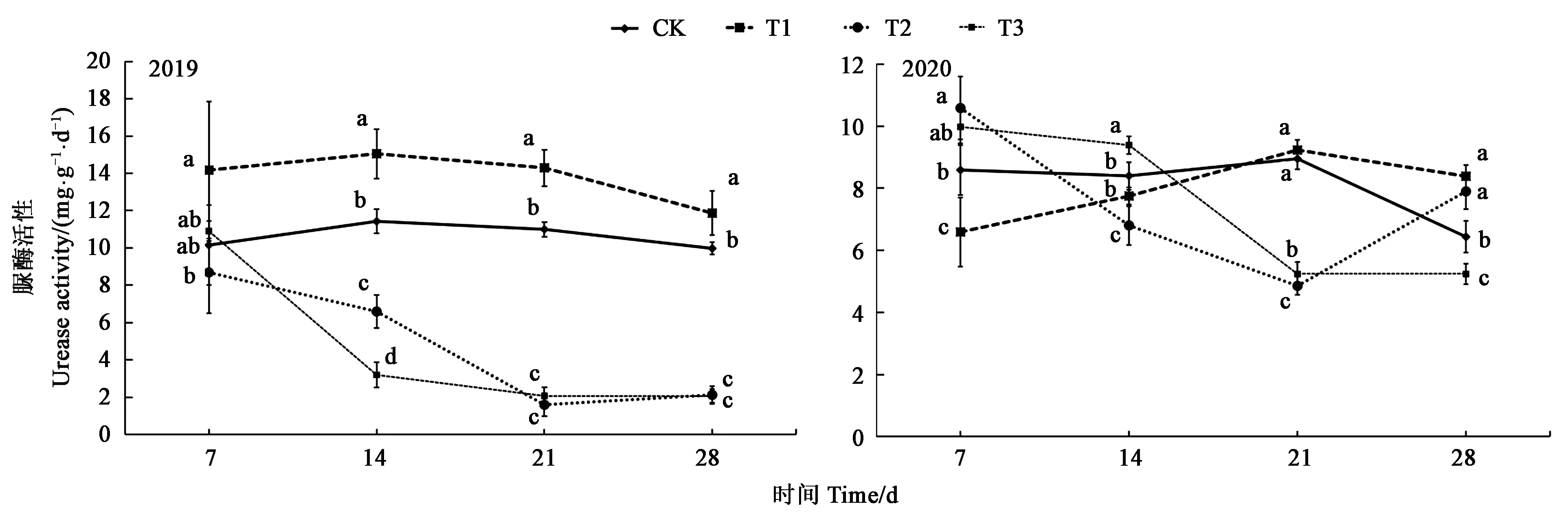
图2 不同处理下土壤脲酶活性Fig.2 Soil urease activity under different treatments
2.2.2 草甘膦对土壤磷酸酶活性的影响 施用草甘膦7 d后,T1与T3处理土壤磷酸酶活性显著高于CK,施用7 d以后土壤磷酸酶活性开始降低,施用14~21 d后土壤磷酸酶活性受到抑制,2019年抑制峰值出现在第21天,2020年抑制峰值出现在第14天,第28天时土壤磷酸酶活性逐渐恢复至第7天水平。2年平均降低峰值为21 d后的T1处理,比CK降低了40.62%(图3)。
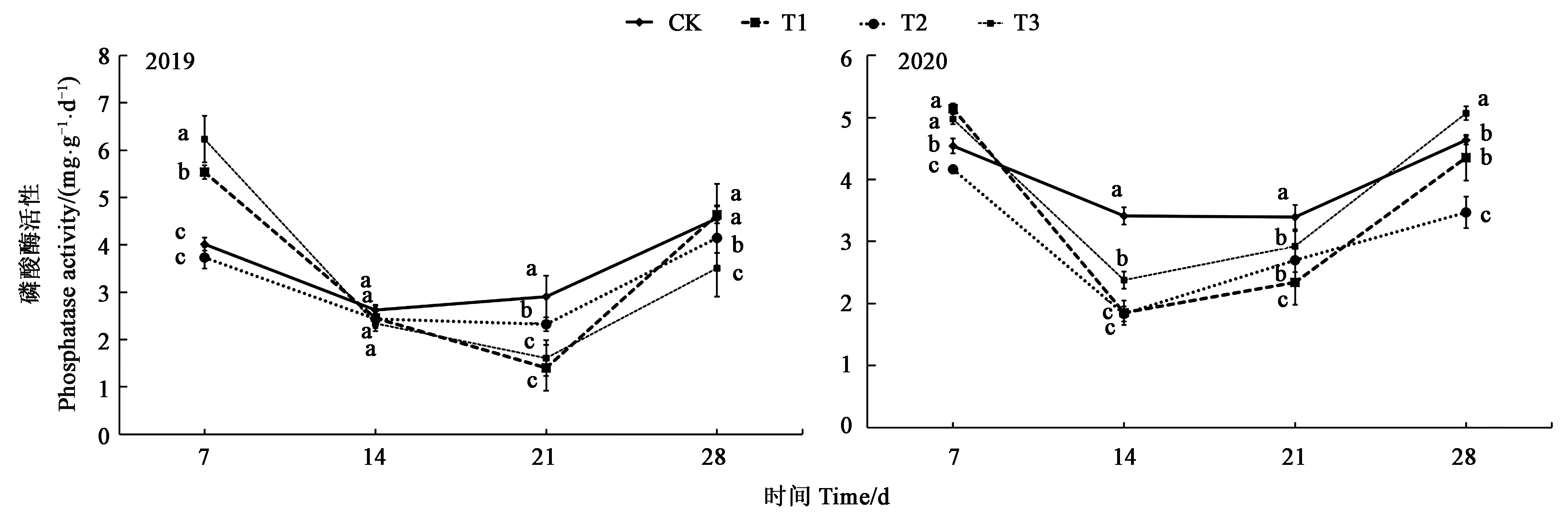
图3 不同处理下土壤磷酸酶活性Fig.3 Soil phosphatase activity under different treatments
2.2.3 草甘膦对土壤过氧化氢酶活性的影响 随着时间的推移,7~28 d内土壤过氧化氢酶活性先降低后升高,2年降低峰值均出现在施药后第14天,以后逐渐升高,28 d后逐渐恢复正常。施用草甘膦后,除2019年21~28 d内的T2处理外,2年各处理土壤过氧化氢酶活性均显著高于CK。2年平均降低峰值为施药14 d后T1处理,比CK升高了131.93%(图4)。
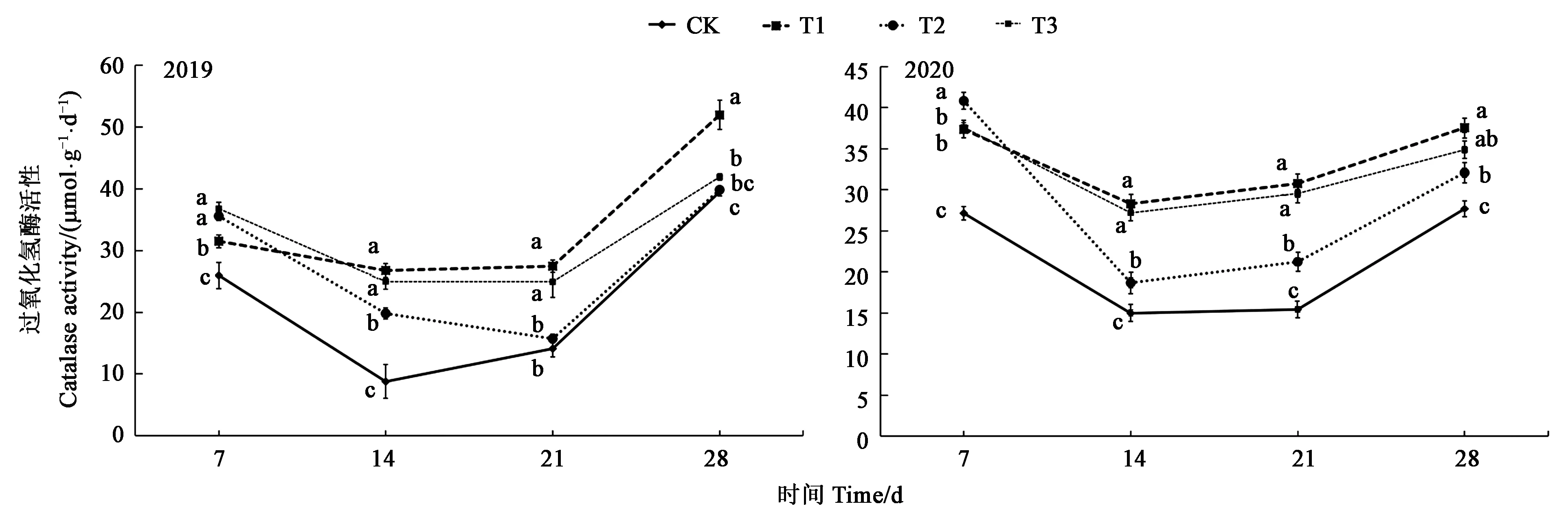
图4 不同处理下土壤过氧化氢酶活性Fig.4 Soil catalase activity under different treatments
2.2.4 草甘膦对土壤纤维素酶活性的影响 随着施用时间的推移,7~28 d内大豆田土壤纤维素酶活性降低峰值除2019年的T2处理出现在第14天外,其余各处理均出现在第21天,然后逐渐恢复。草甘膦施用后7 d,2019年T1与T3处理土壤纤维素酶活性显著高于CK,T2处理与CK相比无显著差异;2020年T1处理与CK无显著差异,T2与T3处理显著高于CK。施用后第14天,2019年T1与T2处理土壤纤维素酶活性显著低于CK,T3处理显著高于CK;2020年各处理土壤纤维素酶活性与CK相比均无显著差异。施用后第21天,2019年T1处理土壤纤维素酶活性显著低于CK,T2和T3处理与CK无显著差异;2020年T1和T2处理均显著低于CK,T3处理与CK无显著差异。施用后第28天,2019年T1处理纤维素酶活性显著低于CK,T2及T3处理与CK相比均无显著差异;2020年T1和T3处理与CK相比无显著差异,T2处理与CK相比显著降低了27.63%。2年平均降低峰值为施药21 d后的T1处理,比CK降低了45.88%(图5)。
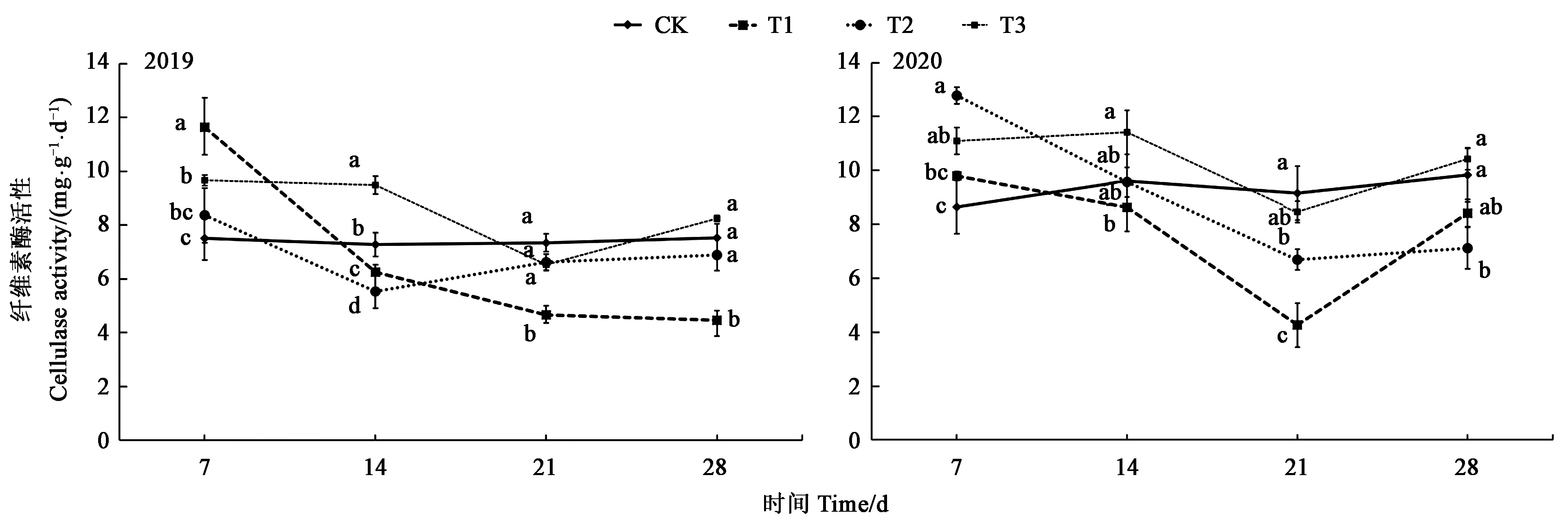
图5 不同处理下土壤纤维素酶活性Fig.5 Soil cellulase activity under different treatments
2.2.5 草甘膦对大豆根瘤固氮酶活性的影响 2年间大豆根瘤固氮酶活性变化规律相似,施用后随时间推移逐渐降低。草甘膦施药7 d后,2年T2与T3处理呼交06-698大豆根瘤固氮酶活性均显著低于CK。施药14 d后,2019年各处理显著低于CK,2020年各处理与CK相比无显著差异。施药21~28 d后,2年各处理与CK均无显著差异。2年平均降低峰值为施药7 d后T3处理,比CK降低了74.49%(图6)。
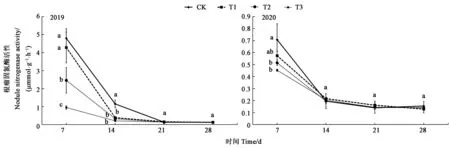
图6 不同处理下根瘤固氮酶活性Fig.6 Nodule nitrogenase activity under different treatments
2.3 土壤酶活性与土壤养分含量的相关性分析
从相关系数矩阵可知,2019年与2020年土壤酶活性及土壤养分含量之间存在一定的相关性。施用草甘膦后,转基因大豆田大豆根瘤固氮酶与脲酶活性呈显著正相关;土壤磷酸酶与过氧化氢酶、纤维素酶活性呈极显著正相关;土壤速效磷含量与过氧化氢酶活性呈显著负相关,与磷酸酶、根瘤固氮酶活性均呈极显著负相关;速效钾含量除与土壤磷酸酶活性、纤维素酶活性呈极显著正相关外,还与碱解氮含量呈显著负相关、与速效磷含量呈极显著负相关(表3)。这些相关性说明各指标之间反映的信息存在重叠,需通过主成分法进行简化分析。
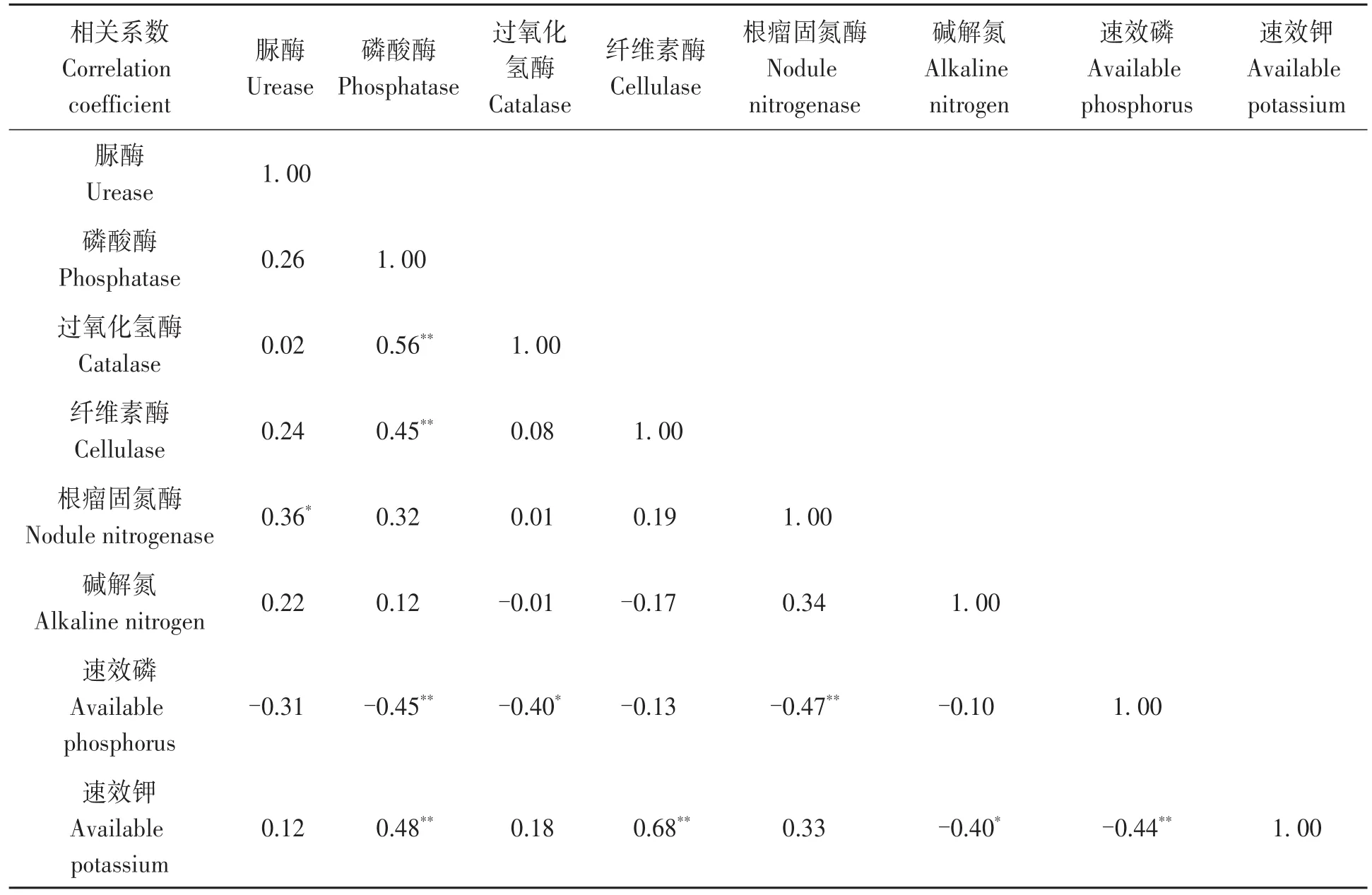
表3 土壤酶活性及土壤养分含量的相关性Table 3 Correlation between soil enzyme activity and soil nutrients
2.4 土壤酶活性与土壤养分的主成分分析
对2019年及2020年草甘膦施用后大豆田土壤养分及其功能酶的8个指标进行主成分分析,并提取出3个主成分因子,累计贡献率达到72.308%,能够较全面地反映大豆田养分及其功能酶活性的8种指标(见表4)。其中第1主成分的特征值2.938,方差贡献率36.730%,第1主成分中载荷较高的是速效磷及磷酸酶,能解释土壤磷素循环的大部分信息。第2主成分的特征值1.645,方差贡献率20.566%,在第2主成分中载荷较高的是碱解氮、脲酶及大豆根瘤固氮酶,因此第2主成分能解释土壤氮素循环的大部分信息。第3主成分的特征值1.201,方差贡献率15.012%,第3主成分中载荷较高的是纤维素酶和速效钾,能在一定程度上解释土壤钾素变化特征。
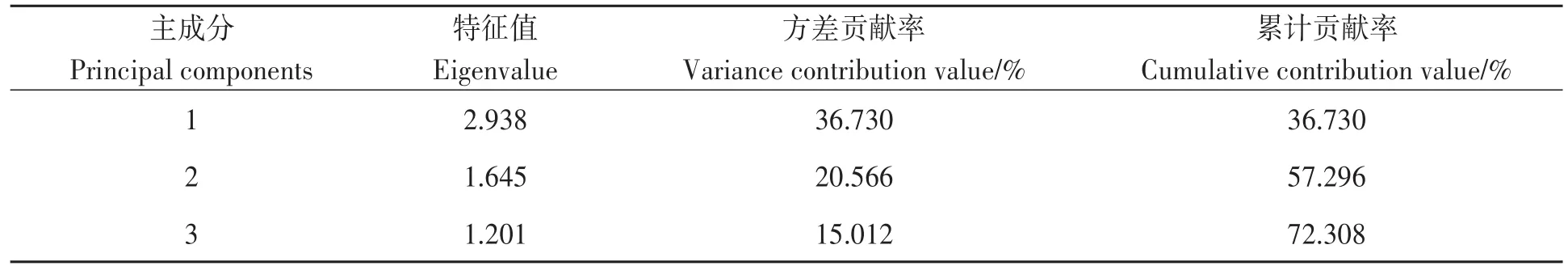
表4 主成分的特征值、方差贡献率和累计方差贡献率Table 4 Eigenvalue,variance contribution rate and cumulative variance contribution rate of principal components
特征向量是各指标的主成分载荷与其特征值之比的平方根,以每个指标特征向量的主成分得分构建函数表达式(F1、F2、F3依次为第1、2、3主成分的得分)。以各主成分的贡献率与总和之比为权重,得到各浓度草甘膦施用后大豆田土壤质量综合得分(S)模型。
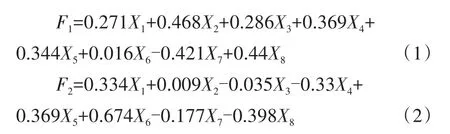
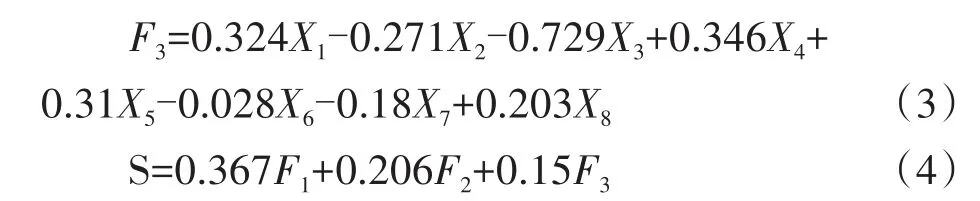
根据综合得分模型可计算出各处理草甘膦施用后大豆田土壤质量的综合得分(表5),得分越低,土壤质量越差。施用不同含量草甘膦后,以土壤N、P、K养分及其功能酶为主成分的土壤质量综合得分从高到低依次为T2>T3>CK>T1。
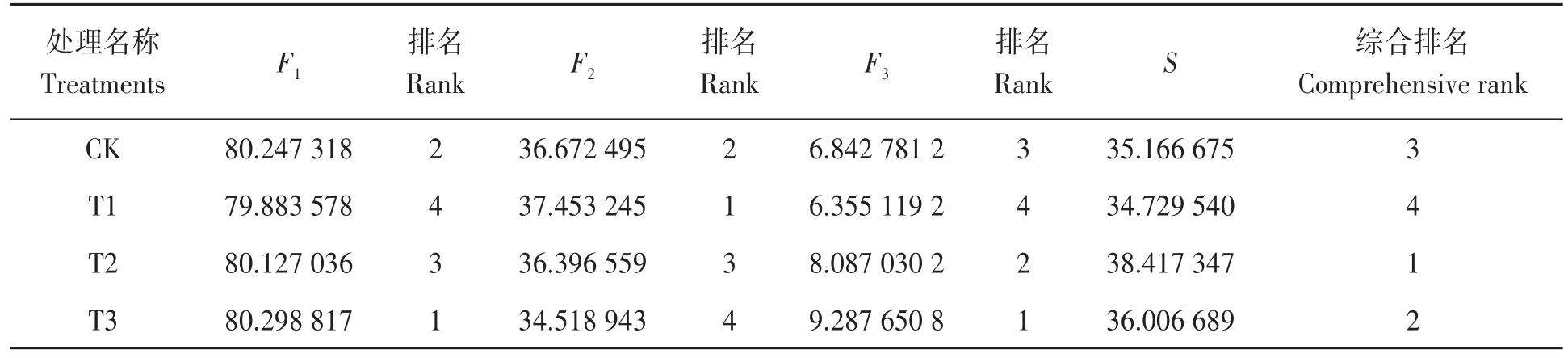
表5 土壤质量主成分得分及排名Table 5 Soil nutrient principal components scores and rankings
3 讨论
碱解氮、速效磷和速效钾含量能较好地反映近期土壤各元素供应状况,是土壤供肥水平的主要指标[15]。草甘膦影响作物的根际养分[16],可能是由于草甘膦施用后对土壤微生物及酶活性的影响造成的[17]。草甘膦施用后抑制土壤中固氮微生物的活性[9],同时大豆田杂草数量降低[18],大豆竞争吸收养分量增加,这可能是草甘膦施用后土壤碱解氮含量显著降低的重要原因。草甘膦不会对土壤钾含量造成影响[3],但长期喷洒草甘膦会影响土壤中磷的含量[19]。草甘膦与土壤铁元素形成的螯合物不稳定[20],易被磷酸盐解吸,增加土壤Fe-P含量从而降低土壤速效磷含量[21]。本研究发现,施用草甘膦对土壤速效钾含量无显著影响、速效磷含量显著降低,这与上述研究结果相似。
土壤酶是土壤环境重要的组成部分,与土壤环境的动态变化密不可分。过氧化氢酶、脲酶、磷酸酶、纤维素酶等与土壤养分循环显著相关[7]。土壤过氧化氢酶是土壤微生物代谢的重要酶,在清除H2O2和保护植物免受氧化胁迫中起着重要作用[22]。脲酶与土壤氮素循环密切相关,能催化尿素水解为氨和二氧化碳。草甘膦施用后会激活土壤脲酶活性[6],抑制过氧化氢酶活性[11]。土壤酸性磷酸酶与土壤磷素循环密切相关[23],由于草甘膦在土壤中的降解与C-P键的断裂密切相关[24],土壤磷酸酶活性随草甘膦的施用量不同而受到抑制或激活[6],低水平表现为抑制而高水平处理表现为激活。草甘膦连续施用会抑制土壤酸性磷酸酶活性[25],从而降低土壤磷素含量。土壤纤维素酶在纤维素的分解转化中起着重要作用。已有研究表明,施用草甘膦后纤维素酶活性受到抑制[6]。大豆根瘤固氮酶能为大豆提供共生固态氮[4],Fan等[9]发现草甘膦影响固氮菌的生长,导致固氮酶活性迅速下降。也有研究表明在不敏感根瘤菌系形成的根瘤中,草甘膦的高水平积累不会降低根瘤固氮酶活性[26]。面对复杂且具有相关性的多个土壤酶活性与土壤养分含量等评价指标,主成分分析能够客观准确地评价土壤质量[27]。本研究采用主成分及综合评价法对土壤养分及其功能酶活性综合分析,发现中、高剂量草甘膦施用后,短时间内土壤脲酶活性、土壤纤维素酶活性、磷酸酶活性和根瘤固氮酶活性显著降低,过氧化氢酶活性显著增高,短时间内会导致土壤中过氧化氢增加,影响土壤氮素代谢和磷素的转化,但这种不利影响随草甘膦施用后时间延长而逐步恢复正常,长时间不会对土壤养分及其功能酶活性带来不利影响。
