玉米ZmSNAC13等位变异对抗旱性的调控研究
2022-07-13程名朱莹王晓楠罗平陈勇郝转芳席章营
程名, 朱莹, 王晓楠, 罗平, 陈勇, 郝转芳*, 席章营*
(1.河南农业大学农学院,郑州 450046;2.中国农业科学院作物科学研究所,北京 100081)
植物在生长过程中会遇到各种生物和非生物胁迫[1]。生物胁迫主要来源于病虫害和微生物侵染,非生物胁迫指干旱、高温、高盐、低温、涝害等不利环境因素[2]。干旱是限制作物生产的主要胁迫因素之一,影响作物的生长发育和生理代谢[3]。据统计,1978—2016年年平均干旱受灾面积为2 267.6万hm2,占我国气象灾害总受灾面积的53%[4]。
植物受干旱胁迫后,细胞感受器感知胁迫并产生脱落酸(abscisic acid,ABA)等信号分子,经过信号转导途径传递给转录因子,转录因子特异性识别并激活或抑制下游靶基因的表达,进而响应和抵御干旱胁迫[5]。转录因子能控制基因的表达,在植物胁迫反应中扮演着重要角色,如NAC(NAM、ATAF1/2和CUC2)家族转录因子,其为植物所特有,具有保守的NAC结构域和多样的生物学功能。首先被克隆的NAC转录因子是矮牵牛NAM基因,参与胚的生长发育,随后在拟南芥中发现了与NAM功能不同但N端结构相似的ATAF1/2和CUC2基因,取其名称首字母命名为NAC结构域,NAC结构域又可分为A、B、C、D和E 5个亚域,通过盐桥等作用形成有功能的NAC蛋白二聚体[6-8]。
NAC家族转录因子在植物干旱胁迫响应中发挥着重要作用。SNAC1(STRESS-RESPONSIVE NAC 1)基因受干旱诱导表达,田间严重干旱下过表达SNAC1基因能够明显提高水稻生殖阶段的抗旱能力[9]。此外,玉米ZmSNAC1也受干旱诱导表达,过表达ZmSNAC1的拟南芥幼苗脱水耐受性显著提高[10]。Xiang等[11]发现,ZmNAC49能够特异性结合气孔发育相关基因ZmMUTE的启动子,通过抑制该基因的表达,降低气孔密度进而提高玉米的耐旱性。Mao等[12]研究表明,提高ZmNAC111的表达量能够提高玉米水分利用率,增强玉米苗期的耐旱性,而启动子区MITE(miniature inverted repeat transposable element,微型反向重复转座元件)的插入会引起RNA介导的DNA和组蛋白甲基化,从而降低ZmNAC111的表达,因此,ZmNAC111启动子区MITE的发现可作为一个玉米苗期耐旱性的遗传标记,在苗期阶段用于初步判别玉米材料的耐旱能力。玉米ZmNAC55、水稻OsNAC2、棉花GhNAC4、大豆GmNAC109和水稻ONAC022也在抵御干旱胁迫反应中起正向调控作用[13-17]。
近几年,国内外鉴定出一些逆境相关基因的等位变异,发现它们能够影响基因的表达和功能,挖掘抗逆基因的优异变异对于作物抗逆育种意义重大。ZmVPP1编码液泡H+型焦磷酸酶,过表达ZmVPP1能够提高玉米的抗旱能力,其启动子区366 bp片段的插入诱导其在干旱条件下表达[18]。ZmTIP1编码S-酰基转移酶,调控玉米根毛伸长[19]。通过对166份来源不同的玉米自交系进行重新测序,发现ZmTIP1的启动子区存在大量变异,主要分为2种单体型,携带单体型2的玉米自交系在干旱胁迫下较单体型1的存活率更高、根毛更长,表明单体型2所携带的变异是耐旱等位变异,而单体型1所携带的变异是干旱敏感性等位变异。本课题组前期基于候选基因关联分析发现玉米ZmSNAC13基因5’-UTR区存在2个与耐旱选择指数SI(selection index)相关的位点80308-SNP-220和80308-SNP-219,根据携带这2个位点的9个高度连锁位点将玉米自交系划分成2种单体型[20],但是目前ZmSNAC13等位变异响应耐旱的分子机制尚未明确。本研究以耐旱性不同的单体型玉米B73(干旱敏感)和Qi319(耐旱)为材料,利用荧光定量PCR分析干旱胁迫下ZmSNAC13基因的表达,采用双荧光素酶报告系统分析等位变异对不同单体型启动子活性的影响及其对ZmSNAC13基因表达的调控作用,为玉米抗旱育种提供依据。
1 材料与方法
1.1 试验材料
载体pGreenⅡ0800、玉米自交系B73和Qi319均由中国农业科学院作物科学研究所玉米优质抗逆育种课题组保存和提供。
1.2 试验方法
1.2.1 玉米ZmSNAC13基因的生物信息学分析利用NCBI(https://www.ncbi.nlm.nih.gov/)检索拟南芥、矮牵牛、小麦、棉花、水稻和玉米6个物种中10个典型的与耐旱性相关的NAC基因,以及NAM、CUC2、ATAF2的氨基酸序列,利用DNAMAN软件进行氨基酸序列比对,采用MEGA7.0软件构建系统进化树,使用邻近法(Neighbor-joining),设置Bootstrap值为1 000。
1.2.2 玉米幼苗的种植与干旱处理 将玉米自交系B73和Qi319种子清洗干净,均匀铺放在发芽盒中的滤纸上,再盖上1层滤纸,浸湿后放置于28℃植物培养箱(CU-36L5,美国PERCIVAL科技公司)黑暗培养至发芽,期间补加清水保持湿度,选取发芽一致的种子移至含育苗基质的培养盒中,所有材料种植在同一培养盒中并做好标记,待幼苗长至三叶期时停止浇水作干旱处理,0、5、8、10、12 d分别取根、茎和叶,迅速放入液氮冷冻,于-80℃超低温冰箱保存。每个样品各有3个生物学重复。
1.2.3 干旱胁迫下玉米ZmSNAC13基因的表达分析 使用TransZol Up Plus RNA Kit(全式金生物技术有限公司)提取RNA,用琼脂糖凝胶检测质量,使用Thermo Nanodrop 2000(美国)检测浓度。质量检测合格的RNA使用FastKing gDNA Dispelling RT SuperMix试剂(天根生化科技有限公司)进行反转录。将cDNA样品稀释10倍,采用SuperReal PreMix Plus(SYBR Green,天根生化科技有限公司)试剂盒进行荧光定量PCR,反应体系:2×SuperReal PreMix Plus 10 μL,10 μmol·L-1正向和反向引物(表1)各0.6 μL,cDNA模板 2 μL,加RNase-free ddH2O补至20 μL。反应程序:设置95℃预变性15 min;95℃变性10 s,58℃退火 30 s,72 ℃延伸32 s,40个循环。采用2-△△CT法[21]计算基因的相对表达量,每个样品各有3个生物学重复,3次技术重复。
1.2.4 ZmSNAC13基因启动子的克隆及载体的构建 从Gramene(http://ensembl.gramene.org/index.html)下载 ZmSNAC13基因组序列,利用PlantCARE(https://www.plantcaretools.com)预测启动子顺式作用元件。以ATG上游1 500 bp为参考序列设计引物(表1),采用CTAB法[22]提取B73和Qi319的叶片基因组DNA,以基因组DNA为模板,采用常规PCR方法扩增玉米ZmSNAC13基因的启动子序列,经2%琼脂糖凝胶电泳检测条带大小,将条带大小与预期相符的扩增产物送至华大公司测序。PCR 反应体系:10×Buffer 25 μL,dNTPs 10 μL,KOD 1 μL,正向引物和反向引物各1.5 μL,DNA模板3 μL,ddH2O 8 μL。PCR程序:94℃预变性2 min;98℃变性10 s,58℃退火30 s,68℃延伸1 min 40 s,35个循环;68℃延伸5 min,12℃保存。In-Fusion连接法[23]将启动子区序列连接到pGreenII0800-LUC载体上,酶切位点选用BamHⅠ,构建重组载体pZmSNAC13-B73和pZmSNAC13-Qi319。由华大公司通过基因组合成的方式将B73中ZmSNAC13基因5’-UTR区9个高度连锁的变异替换成Qi319的变异,反之将Qi319中9个高度连锁的变异替换成B73的变异,启动子区其他序列保持不变,构建重组载体pZmSNAC13-B73m和pZmSNAC13-Qi319m。

表1 本研究所用引物Table 1 Primers used in this study
1.2.5 脱落酸处理下玉米ZmSNAC13基因的启动子活性检测 参照Yoo等[24]方法提取玉米原生质体,通过PEG-Ca2+介导法将空载pGreenⅡ0800和重组载体 pZmSNAC13-B73、pZmSNAC13-Qi319、pZmSNAC13-B73m、pZmSNAC13-Qi319m分别转化到玉米原生质体中,用0和10 μmol·L-1ABA处理的W5缓冲液室温暗培养16 h。孵育完成后的原生质体使用Dual-Luciferase®Reporter Assay System试剂盒(Promega)进行处理,在荧光检测仪器上测定萤火虫荧光素酶活性(firefly luciferase activity,LUC)与 海 肾 荧 光 素 酶 活 性(renilla luciferase activity,REN),计算LUC/REN比值,即为相对荧光素酶活性。每个样品3次重复,数据分析使用Excel进行t检验分析。
2 结果与分析
2.1 ZmSNAC13基因的生物信息学分析
基因结构是其发挥功能的基础,植物NAC家族转录因子在抵御非生物胁迫中具有重要的作用。对玉米ZmSNAC13与其他不同物种中参与非生物胁迫应答的NAC转录因子进行氨基酸序列比对,发现这些NAC转录因子氨基酸序列的N端均具有保守的NAC结构域,由大约160个氨基酸残基组成,可分为A、B、C、D和E共5个亚结构域,其中A、C、D亚结构域高度保守,B和E亚结构域保守性不强;而C端具有高度变异的氨基酸序列,同时富含丝氨酸、脯氨酸、谷氨酸、谷氨酰胺等。玉米ZmSNAC13氨基酸序列N端保守、C端高度变异。保守的N端可能与其他NAC蛋白一样负责DNA或蛋白的结合,C端是转录激活区,C端的高度变异说明ZmSNAC13可能具有独特的生物学功能。
进一步对ZmSNAC13与其他物种NAC转录因子的系统进化树分析发现,ZmSNAC13与玉米ZmSNAC1[10]、水稻 SNAC1[9]、水稻 OsNAC3[25]和小麦TaNAC67[26]的进化关系最近(图1)。这4个与ZmSNAC13进化关系最为相近的NAC转录因子都已被证实响应多种非生物胁迫刺激,且均参与干旱胁迫应答,正向调节植物的抗旱能力,由此推测ZmSNAC13也参与干旱胁迫应答,在玉米抵御干旱的生物过程中有重要的作用。
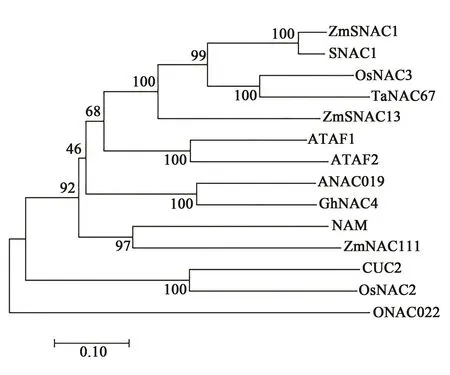
图1 不同物种NAC转录因子系统进化树Fig.1 Phylogenetic tree of NAC transcription factors among different species
2.2 干旱处理下ZmSNAC13基因的表达分析
荧光定量结果(图2)表明,玉米自交系B73和Qi319根中ZmSNAC13基因的相对表达量在干旱处理后表现下调,分别在干旱处理8、10 d达到最低;B73和Qi319茎中ZmSNAC13的相对表达量均在干旱处理12 d达到最高,相比于干旱胁迫前分别上调表达3.27和2.43倍;Qi319叶中ZmSNAC13基因的相对表达量在干旱处理12 d上调2.78倍,而B73叶中ZmSNAC13基因的相对表达量在干旱处理8和10 d下调。干旱胁迫下玉米B73和Qi319的根、茎、叶中ZmSNAC13基因的表达模式各有不同,在干旱胁迫处理12 d的B73茎中的上调表达倍数最高,而Qi319叶中上调表达倍数最高。以上结果表明,ZmSNAC13基因响应干旱胁迫,可能参与调控玉米干旱胁迫应答。
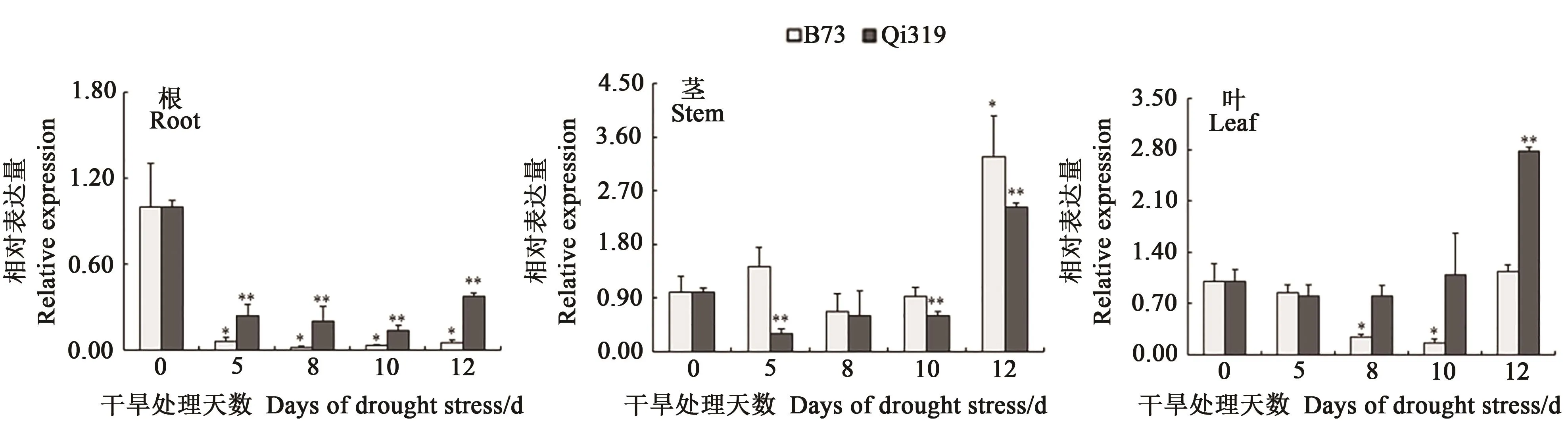
图2 干旱处理下玉米B73与Qi319根、茎和叶中ZmSNAC13基因的相对表达量Fig.2 Relative expression of ZmSNAC13 gene in roots,stems and leaves of maize B73 and Qi319 under drought stress
2.3 ZmSNAC13基因启动子元件及其活性分析
B73的ZmSNAC13上游非编码区启动子序列扩增长度为1 500 bp,而Qi319的ZmSNAC13上游非编码区启动子序列扩增长度为2 222 bp。经预测发现,B73和Qi319的ZmSNAC13启动子序列除了含有基本顺式作用元件CAAT-box和TATA-box外,都含有激素响应元件ABRE(脱落酸顺式作用元件)、CGTCA-motif和TGACG-motif(茉莉酸甲酯顺式作用元件),干旱响应元件MBS,光响应元件Box4、G-Box和 G-box。 除 此 之 外 ,Qi319的ZmSNAC13启动子序列还包含参与胚乳调控的元件 AACA-motif,光响应元件 GT1-motif、Sp1、TCT-motif和chs-CMA1a。
利用双荧光素酶报告体系分析ZmSNAC13基因的启动子活性,发现在无ABA处理下B73和Qi319 ZmSNAC13启动子控制的LUC/REN比值无显著差异;而在 10 μmol·L-1ABA处理下,Qi319 ZmSNAC13启动子控制的LUC/REN比值是B73的1.54倍(图 3),说明 ABA处理下 Qi319的ZmSNAC13启动子活性高于B73。同时,在干旱处理12 d时,Qi319叶中ZmSNAC13基因的相对表达量上调表达倍数高于B73(图2),2个材料ZmSNAC13基因启动子区均含有8个ABA响应元件(ABRE),由此推测玉米ZmSNAC13基因可能依赖于ABA信号通路参与干旱胁迫应答。
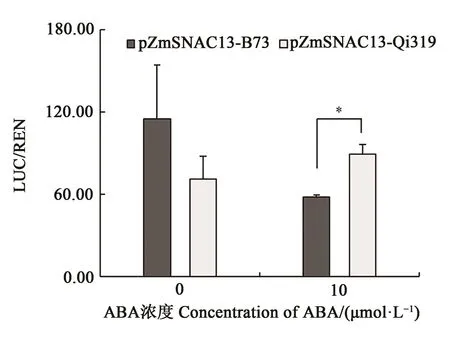
图3 ABA处理下ZmSNAC13基因的启动子活性分析Fig.3 Activity of the ZmSNAC13 promoter under ABA treatment
从图4可以看出,ZmSNAC13基因启动子9个高度连锁的变异位点包括7个单核苷酸多态性(single nucleotide polymorphisms,SNPs)和 2个插入-缺失(insertions-deletions,InDels)变异。SNP为5’-UTR区T/A(ATG中的A记为+1 bp,位置为-220 bp)、T/C(-219 bp)、T/G(-155 bp)、C/T(-60 bp)、T/C(-42 bp)、C/G(-23 bp)和 C/G(-20bp);InDels为-/GGC(-147bp)、-/GT(-142bp)。进一步分析发现,在 0 和 10 μmol·L-1ABA 处理下,pZmSNAC13-B73m驱动的LUC/REN值分别是pZmSNAC13-Qi319m的1.62和1.80倍,说明B73 ZmSNAC13 5’-UTR区替换成Qi319 ZmSNAC13携带的9个连锁变异后启动子活性显著增强,而Qi319 ZmSNAC13 5’-UTR区替换变异后启动子活性下降,说明ZmSNAC13 5’-UTR区的9个连锁变异互换使B73 ZmSNAC13启动子活性强于Qi319,这些变异位点能够影响启动子的活性,进而调控基因的表达。
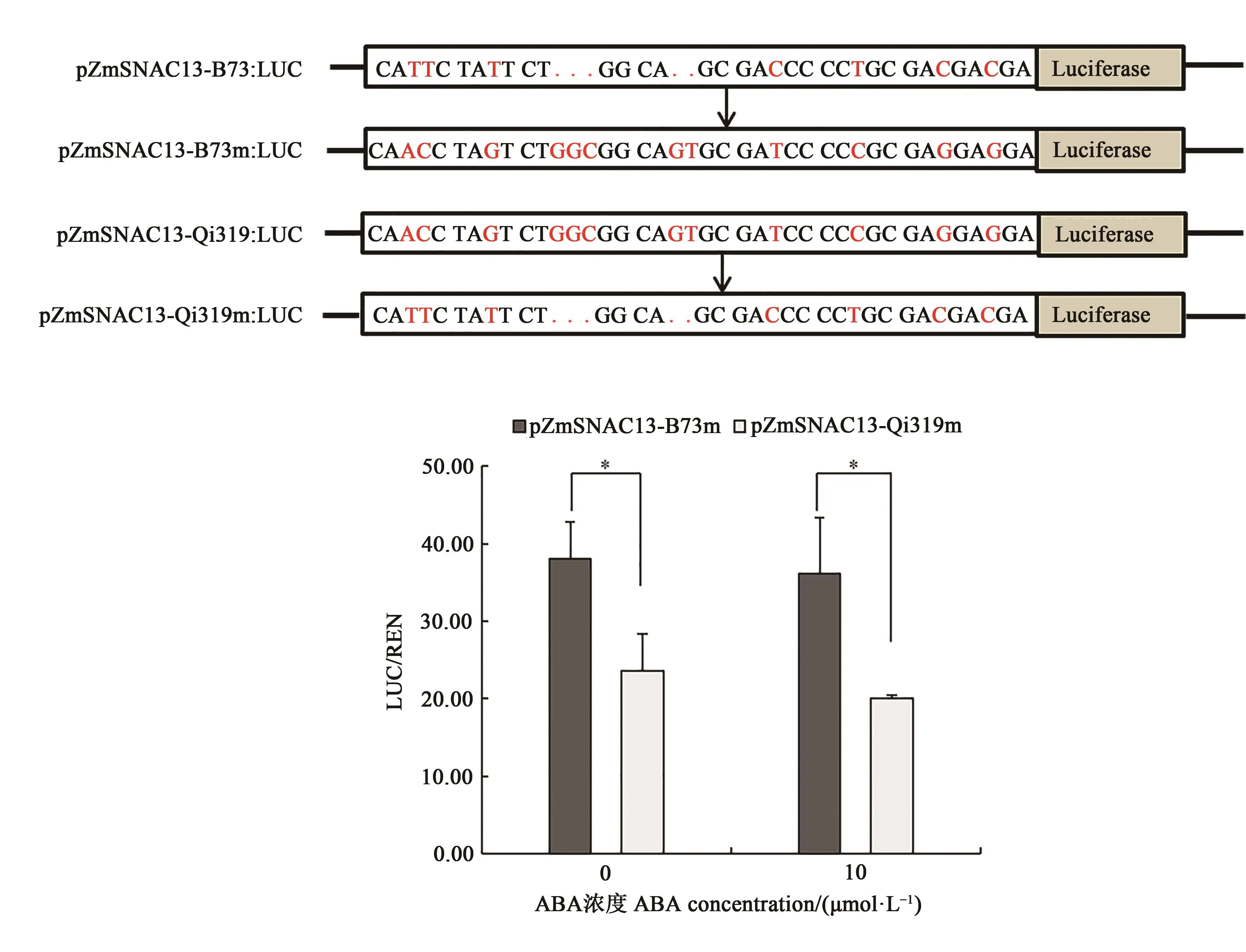
图4 ZmSNAC13的9个连锁变异影响启动子活性Fig.4 9 linkage variants of ZmSNAC13 affect promoter activity
3 讨论
3.1 ZmSNAC13基因响应干旱胁迫
NAC家族转录因子广泛分布于植物基因组中,在植物的非生物胁迫应答中起着重要的调控作 用[27]。 水 稻 SNAC1[9]与 OsNAC3[25]、玉 米ZmSNAC1[10]和小麦TaNAC67[26]都受干旱胁迫诱导表达,提高它们的表达量能分别增强植物的耐旱能力。系统进化树分析发现,玉米ZmSNAC13与水稻SNAC1、水稻OsNAC3、玉米ZmSNAC1和小麦TaNAC67的进化关系较近,同时qRT-PCR验证了ZmSNAC13基因受干旱诱导表达,由此推测ZmSNAC13基因也参与调控玉米的耐旱机制。ABA信号转导途径是植物干旱胁迫的核心[28],其通过促使气孔关闭减少水分散失以适应干旱环境,葡萄VvNAC17可以被干旱和脱落酸诱导表达,过表达VvNAC17拟南芥通过调节参与ABA介导途径的基因表达提高植株的耐旱能力[29]。ZmSNAC13基因的启动子序列含有ABA和干旱诱导响应的顺式作用元件,表明ZmSNAC13可能依赖ABA信号转导途径参与干旱胁迫应答。
3.2 ZmSNAC13基因5’-UTR区遗传等位变异影响启动子活性
变异影响基因的表达或功能,精准测序使基因的变异位点更易检出,有利的变异位点可以被开发成分子标记用于辅助育种。ZmTIP1CIMBL55上游1.5 kb片段中包含6个MybSt1结合位点,而ZmTIP1B73和ZmTIP1Mo17只含有1个MybSt1结合位点,利用GUS报告基因分析启动子促进基因表达的能力,发现ZmTIP1CIMBL55启动子比ZmTIP1B73和ZmTIP1Mo17启动子能增强GUS酶活,表明ZmTIP1启动子区的序列差异影响基因的表达[19]。苹果MdhpRNA277启动子区的基序b(-1 186 bp)位点G/T的突变能够消除MdhpRNA277启动子的活性[30]。TaSNAC8-6A是干旱响应基因,在有无ABA处理下TaSNAC8-6AIn-313启动子的活性都要高于TaSNAC8-6ADel-313,TaSNAC8-6A 中 InDel-313位点的插入变异能够提高TaSNAC8-6A的表达[31]。Wang等[18]研究发现,玉米ZmVPP1CIMBL55和ZmVPP1B73启动子片段控制的GUS在无ABA处理时处于低水平表达,而10 μmol·L-1ABA处理极大地增强了由ZmVPP1CIMBL55启动子片段控制的GUS的表达,同时高于ZmVPP1B73启动子片段控制的GUS的表达。ZmVPP1CIMBL55启动子片段存在366 bp插入变异,该变异中包含的3个MYB转录因子结合序列能够介导胁迫下耐旱等位基因ZmVPP1CIMBL55的表达。本研究中,10 μmol·L-1ABA处理下,Qi319材料ZmSNAC13启动子的活性要高于B73材料,且Qi319材料所携带的该基因5’-UTR区9个高度连锁的变异能够增强启动子的活性,分析发现Qi319 ZmSNAC13基因5’-UTR区9个高度连锁的变异增加了1个Sp1光响应元件,猜测Qi319材料ZmSNAC13基因5’-UTR区9个高度连锁的变异中包含的Sp1光响应元件介导了干旱胁迫下耐旱ZmSNAC13等位基因的表达。本研究为解析玉米在干旱胁迫下的响应机理奠定了基础。
