急性髓系白血病治疗药物临床研究新进展
2022-07-12马家乐葛峥
马家乐 ,葛峥
(1.东南大学附属中大医院血液科 东南大学血液病研究所,江苏 南京 210009;2. 徐州市中心医院血液科,江苏 徐州 221000)
急性髓系白血病(acute myeloid leukemia,AML)是一种高度异质性的血液系统恶性肿瘤,是成人中最常见的急性白血病类型,约占成人白血病的70%。AML特征为外周血、骨髓(BM)和(或)其他组织中髓系原始细胞的克隆扩增和分化障碍。AML的发病率随年龄增加而增加,美国国家癌症研究所的SEER数据库显示,AML确诊时患者中位年龄为68 ~ 71岁,约54%的AML患者确诊时的年龄在65岁以上[1]。AML经典的传统治疗方案从基于阿糖胞苷(cytarabine,Ara-C)的化疗到造血干细胞移植(hematopoietic stem cell transplantation,HSCT),虽然显著改善AML年轻患者的预后,60岁以下患者的5年总生存(overall survival,OS)率为40%,但对于占AML病例大部分的60岁以上老年人,其5年OS率仅为10% ~ 20%[2],传统方案下老年患者的预后仍很差。在过去三四十年间,标准治疗一直停滞不前,但随着各种分子技术的发展,更多的遗传学异常、细胞表面标记和基因突变被发现,使得自2017年起AML的治疗迎来重大进展,美国食品和药品管理局(FDA)连续批准了多款治疗AML的药物,并取得了可喜的临床疗效,改善了AML患者的预后(见表1)。近年来AML的治疗进展主要包括改进传统细胞毒性的化疗、靶向治疗以及免疫治疗,尤其是靶向治疗的进展,为AML提供了更精准和个体化的治疗,未来的方向将侧重于新颖、高效和有针对性的组合、低毒维持和个性化精准治疗策略。本文就AML靶向治疗、免疫治疗以及传统方案的改进3个方面的进展进行综述。
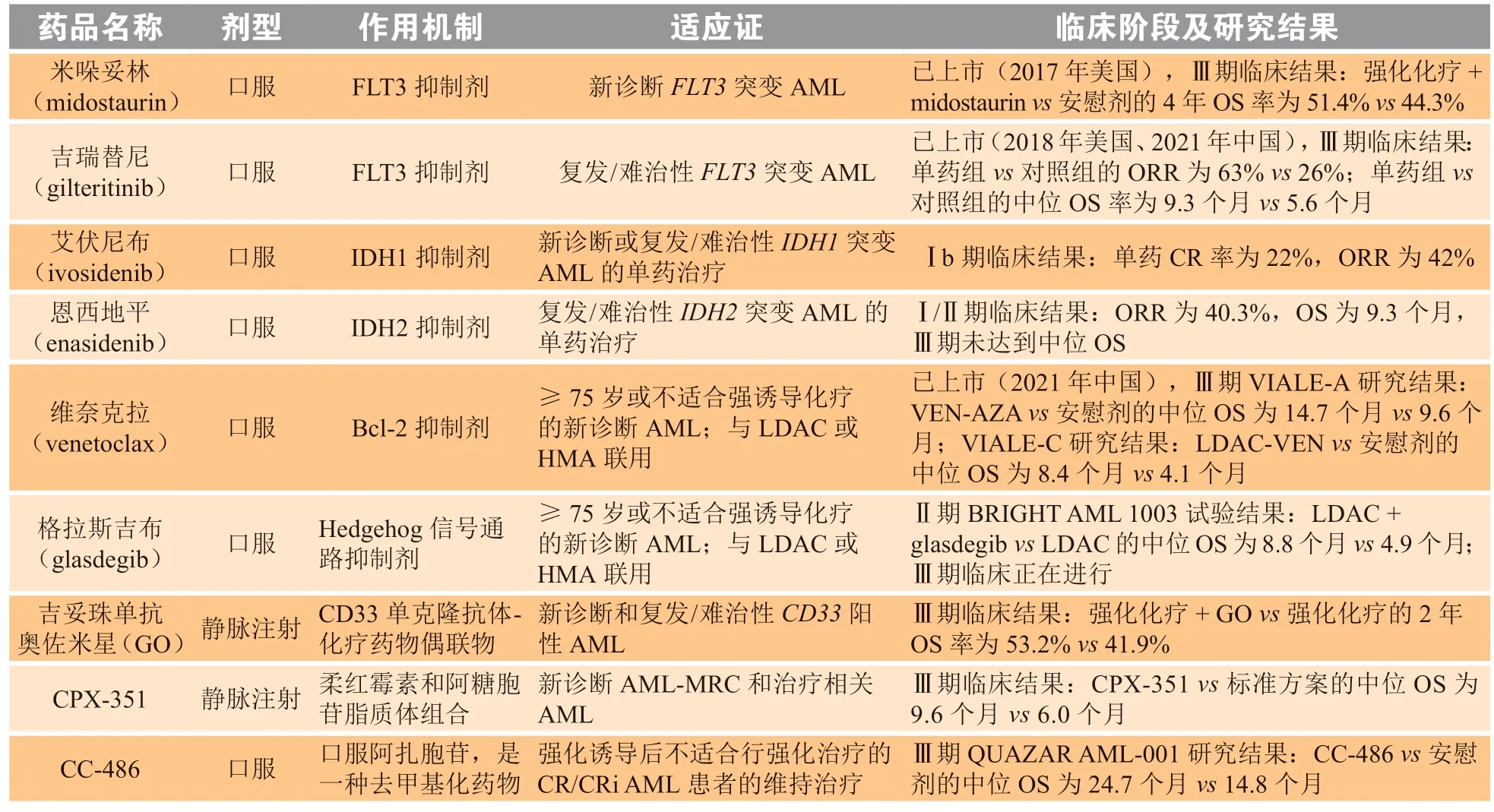
表1 FDA批准的急性髓系白血病治疗药物Table 1 Agents approved by FDA for acute myeloid leukemia
1 靶向治疗药物
近年来,深度测序技术的发展和应用使人们对AML的基因突变谱从宏观上有了一个全景式的认识。基于各种突变的研究,各种小分子靶向药物应运而生,并取得了令人瞩目的成果。目前AML靶向药物的治疗主要包括靶向基因突变、靶向关键信号通路、表观遗传学修饰及靶向细胞表面分子的抗体或抗体偶联物等。
1.1 靶向基因突变药物
1.1.1 FLT3抑制剂
FMS样酪氨酸激酶3(FMS-like tyrosine kinase 3,FLT3)是一种Ⅲ类酪氨酸激酶受体,可刺激原始造血干细胞/祖细胞的正常造血和细胞增殖。FLT3突变有2种类型,包括ITD和TKD 2个位点的突变,且与不良预后相关。目前对于FLT3抑制剂的研究主要在突变率更高的FLT3-ITD上。第1代FLT3抑制剂,如米哚妥林(蛋白激酶C抑制剂)、舒尼替尼[血管内皮生长因子受体(VEGFR)抑制剂]、索拉非尼(Raf激酶抑制剂)、来他替尼和波纳替尼(酪氨酸激酶抑制剂)是多靶点激酶抑制剂,反应持续时间短[3]。第2代FLT3抑制剂包括奎扎替尼、吉瑞替尼、克若拉尼和pexidartinib,且比第1代更具选择性和更少的脱靶效应。在所有这些FLT3-ITD抑制剂中,只有米哚妥林和吉瑞替尼被FDA批准用于FLT3突变的AML患者。
1.1.1.1 米哚妥林作为第1代多靶点药物,米哚妥林(PKC412)可抑制FLT3、原癌基因蛋白c-KIT(c-kit proto-oncogene protein)、血小板衍生生长因子受体(PDGFR)、VEGFR和蛋白激酶C[4]。全球多中心前瞻性RATIFY研究证实,米哚妥林与标准化疗联合可以显著提高FLT3突变成人AML患者的OS(74.7个月vs25.6个月,P=0.009)[5],基于这项研究结果,美国FDA于2017年批准米哚妥林用于FLT3-ITD突变初治AML患者的治疗。AMLSG 16-10研究又进一步评价了米哚妥林在更广的年龄范围(18~70岁)AML患者中的疗效,证实了米哚妥林不论是在年轻患者还是老年患者均具有疗效和生存优势[6]。
1.1.1.2 索拉非尼索拉非尼(sorafenib)是Raf激酶、VEGFR-2、c-KIT 和 FLT3的多靶向小分子抑制剂,具有下调丝裂原活化蛋白激酶(MAPK)通路髓细胞白血病因子-1(Mcl-1)水平并抑制具有FLT3-ITD突变的AML细胞生长活性。一项来自德国的安慰剂、对照、随机Ⅱ期SORAML研究纳入了276名18~60岁的初诊AML患者,结果证实与安慰剂相比,索拉菲尼加入标准柔红霉素和Ara-C(3+7)方案3年无事件生存(event-free survival,EFS)率(40%vs22%,P=0.013)和无复发生存(relapse-free survival,RFS)率(56%vs38%,P=0.017)显著延长,而OS率和完全缓解(complete remission,CR)率无改善,但索拉非尼组的3级及以上的不良反应如发热、腹泻、出血、心脏事件、手足皮肤反应和皮疹的发生率显著高于安慰剂组[7]。与该研究相反,第2项在201名61~80岁的老年AML患者中进行的随机研究显示,与安慰剂相比,EFS率、CR率和OS率无改善,早期死亡率更高(17%vs7%,P=0.052)[8]。从以上2项研究结果的差异可见,索拉非尼联合强化化疗对老年AML患者可能毒性太大,其预后较差主要是由于耐药性和耐受性较差。因此,对于老年AML患者,将多激酶抑制剂与低强度治疗[如去甲基化药物(hypomethylating agents,HMA)]相结合可能是一种替代选择[4]。最近研究表明,索拉非尼在移植后AML患者的维持治疗中存在潜在的益处。我国一项开放、随机、多中心Ⅲ期临床试验在FLT3-ITD阳性AML患者移植后30~60 d给予索拉非尼400 mg(bid)或无维持治疗,主要终点为1年累积复发率,结果显示索拉非尼组和对照组的1年累积复发率分别为7%和24.5%(P=0.001),故移植后索拉非尼维持治疗可降低复发率[9]。
1.1.1.3 吉瑞替尼吉瑞替尼(ASP2215)是一种新型、强效、高选择性、Ⅰ型口服FLT3/AXL抑制剂,与Ⅱ型抑制剂的不同在于吉瑞替尼通常不受激活环突变(例如D835点突变)的影响,能够结合FLT3突变的活性构象和非活性构象。Ⅲ期临床试验结果显示,吉瑞替尼在FLT3突变的复发性难治性AML(R/R AML)患者中单药完全缓解率可提高至34.5%,总有效率(overall response rate,ORR)高达63%(对照组约26%),中位OS可达9.3个月(对照组5.6个月)[10]。另外,吉瑞替尼可使死亡风险降低约36%,作为患者移植后的维持治疗方案,可显著改善远期生存,甚至可达到临床治愈。值得注意的是,相较于奎扎替尼,吉瑞替尼具有较低的c-KIT抑制活性,因此其骨髓抑制作用较弱[11]。目前吉瑞替尼与其他药物联合治疗FLT3突变的R/R AML的研究也在进行中。临床前研究表明,吉瑞替尼或米哚妥林与venetoclax联合具有协同作用,且有效诱导细胞凋亡[12]。在2020年美国血液学会(ASH)年会上报道的相关研究中比较了既往接受米哚妥林或索拉非尼的FLT3突变R/R AML患者接受吉瑞替尼治疗的结果。该研究发现,吉瑞替尼比其他靶向药物能获得更好的疗效,成为治疗FLT3抑制剂治疗后R/R AML挽救性治疗有效药物。目前,血液学专家提倡吉瑞替尼联合X方案,X包括靶向药物、化疗药物、HMA,可能会使AML患者获得更好的长期生存,因此需要更多的研究进一步证实。
1.1.1.4 奎扎替尼奎扎替尼(quizartinib,AC220)是一种口服、高效、选择性的第二代 FLT3抑制剂,同时也选择性抑制c-KIT和PDGFRa。多中心Ⅲ期QuANTUM-R临床试验显示,奎扎替尼单药治疗FLT3-ITD突变R/R AML与挽救化疗相比,中位生存时间分别为6.2和4.7个月[13],首次证实了FLT3抑制剂能够延长FLT3-ITD突变R/R AML患者总体生存时间。奎扎替尼对TKD无明显抑制作用,但对c-KIT有一定抑制作用,因此,FLT3点突变所致的耐药及脱靶效应使得奎扎替尼在临床应用中面临诸多挑战。
1.1.1.5 克若拉尼克若拉尼(crenolanib,CP868596)作为一种新型FLT3抑制剂,也是一种选择性泛抑制剂,对FLT3-ITD和FLT3-TKDD835突变均具有活性[11]。Ⅰ期研究结果显示,crenolanib最常见的剂量限制性毒性包括血尿、谷丙转氨酶(ALT)或γ-谷氨酰转移酶升高、恶心/呕吐和失眠[14]。Crenolanib在一项Ⅱ期新诊断的FLT3突变AML患者的联合治疗中显示较好的疗效,中位随访为29个月,CR率为85%,70%的患者保持无病生存[15]。同样,在61~75岁老年患者中使用crenolanib联合化疗的Ⅱ期临床试验也显示出高达86%的CR率[11]。在R/R AML患者中,crenolanib也是安全有效的,与先前接受过FLT3抑制剂的患者相比,未使用过FLT3抑制剂的R/R AML患者在接受crenolanib治疗后具有更高缓解率和更长的OS[16],大多数患者由于疾病进展(66%)和缺乏反应(16%)而停用crenolanib,最常见的3级或更高不良反应主要为腹痛和恶心。目前比较crenolanib和midostaurin在新诊断的FLT3突变AML患者诱导和巩固治疗的Ⅲ期临床(NCT03258931)以及crenolanib与安慰剂联合挽救性化疗在FLT3突变的R/R AML患者的临床试验(NCT03250338)正在进行,正在进行的临床试验将更深入地研究crenolanib在治疗FLT3突变的AML中的作用。
1.1.1.6 pexidartinib Pexidartinib是FDA批准的用于治疗关节肿瘤药物,是一种选择性的CSF1R、c-KIT和FLT3-ITD小分子激酶抑制剂。Pexidartinib在AML的研究集中在R/R AML患者中,其单药治疗R/R AML的Ⅰ/Ⅱ期临床试验显示ORR为21%,CR率为11%,低于奎扎替尼或吉瑞替尼的约40% ~50%的细胞遗传学完全缓解(CRc)率,剂量扩大组和完全缓解的反应者的中位OS分别为3.7和8.8个月[17]。
1.1.2 IDH抑制剂
异柠檬酸脱氢酶1(IDH1)和IDH2突变是AML中的反复突变。IDH1/2的体细胞点突变导致D-2-羟基戊二酸(D-2HG)的过度分泌。D-2HG主要通过干扰细胞代谢和表观遗传调控促进肿瘤的发生,从而导致造血干细胞的扩增和分化[18-19]。因此,靶向IDH1/2的小分子抑制剂在临床研究中显示出较强的治疗活性。
1.1.2.1 艾伏尼布艾伏尼布(AG-120)是一种口服、靶向、小分子IDH1突变抑制剂。Ivosidenib可以恢复正常分化并导致IDH1突变R/R AML患者的临床反应,RTK通路突变和2-HG恢复突变的产生导致获得性耐药[20]。Ivosidenib目前被FDA批准主要用于治疗IDH1突变的R/R AML。Ⅰ期临床试验的结果显示,ivosidenib治疗IDH1突变的R/R AML的客观缓解率为41.6%,主要的治疗相关不良反应是QT间期延长(7.8%)、IDH分化综合征(3.9%)、贫血(2.2%)、血小板减少症或血小板计数减少(3.4%)和白细胞增多症(1.7%),因此,ivosidenib的单药治疗总体耐受性良好[21]。在IDH1突变的初诊AML患者中,ivosidenib也同样具有喜人的疗效。Roboz等[22]的研究显示,与IDH1突变的R/R AML患者相比,IDH1突变新诊断AML患者的CR伴部分血液学缓解(CR with partial hematologic recovery,CRh)和CR率更高;在新诊断的IDH1突变AML患者中,使用ivosidenib单药治疗的CR/CRh率为42.4%,中位OS为12.6个月,总体耐受性良好。
1.1.2.2 恩西地平恩西地平(AG-221)是一种口服小分子IDH2抑制剂,于2017年被FDA批准用于治疗成年IDH2突变的R/R AML患者。Enasidenib的Ⅰ/Ⅱ期临床研究在40.3%的R/R AML患者中引起了总体反应,19.3%的患者达到CR,中位OS为9.3个月,达到CR患者的OS为19.7个月,高胆红素血症和IDH分化综合征是其最突出的毒性[23]。一项剂量递增和扩展试验345名R/R AML患者中有214名(62%)接受了enasidenib(100 mg · d-1)治疗,结果显示其单药治疗的CR率为19.6%,10.3%的患者进行异基因造血干细胞移植,ORR为38.8%,中位OS为8.8个月,在复发(37.7%)或对强化(37.5%)或非强化(43.2%)治疗无效的患者中ORR的结果相似[24]。然而enasidenib的Ⅲ期试验IDHENTIFY研究未达到OS主要终点。
IDH抑制剂除单药疗效尚可,最新研究结果显示,ivosidenib和enasidenib联合标准“3+7”方案治疗IDH1或IDH2突变初诊AML也取得较好的疗效。接受ivosidenib和enasidenib治疗的AML患者中,诱导治疗CR率分别为55%和47%,CR/CRi(CR with incomplete hematologic recovery,血细胞未完全恢复的形态学完全缓解)/CRh率分别为72%和63%;在获得最佳反应的AML患者中,39%接受ivosidenib治疗获得IDH1突变的清除,23%的接受enasidenib治疗的AML患者获得IDH2突变的清除。值得关注的是,联合用药的安全性与单独诱导或巩固化疗的安全性基本一致,IDH分化综合征的发生频率较低,并且接受ivosidenib治疗的患者QT间期延长的频率和程度与单药相似,但是接受enasidenib治疗的患者中更常见到总胆红素的升高,因此,不良反应是临床治疗过程中需要重视的问题[25]。
1.1.3 TP53抑制剂
抑癌基因TP53编码肿瘤蛋白p53,作为一个多功能转录因子,在调控细胞周期、凋亡、分化、DNA修复和保持基因稳定性等方面发挥重要作用。TP53突变在AML患者的发生率超过10%,与不良预后的细胞遗传学异常相关,携带TP53突变的AML患者对传统化疗的治疗反应及预后均较差[26]。
Eprenetapopt(APR-246)是一种新型、靶向TP53突变的甲基化突变型p53复活剂(PRIMA-1)类似物,可选择性诱导TP53突变的肿瘤细胞凋亡[27]。APR-246在生理条件下,会自发转化为亚甲基奎宁环酮,与突变体p53中的半胱氨酸残基共价结合,导致p53蛋白的热力学稳定性发生改变,并将平衡性构象转变为功能性构象。此外,APR-246通过消耗谷胱甘肽和抑制硫氧还蛋白还原酶增加氧化应激,导致活性氧的积累并进一步促进肿瘤细胞死亡。体内模型显示,APR-246在TP53突变的骨髓增生异常综合征(myelodysplastic syndrome,MDS)和AML细胞系中与阿扎胞苷(azacitidine,AZA)结合时具有协同细胞毒性[28]。Ⅰ期临床研究的数据证实了APR-246在AML患者中的临床疗效,并相应激活p53依赖性通路[29-30]。2020年1月,FDA批准了APR-246联合AZA治疗TP53突变的MDS患者的突破性治疗。最近的2项研究评估了APR-246联合AZA的疗效及预后。一项针对TP53突变的MDS或低原始细胞AML患者的Ⅰb/Ⅱ期研究表明,APR-246联合AZA治疗安全且耐受性良好,ORR为88%,MDS队列CR率为61%,AML队列CR率为50%;中位OS为10.8 个月(95% CI:8.1 ~ 13.4个月)[27]。另一项APR-246联合AZA的Ⅱ期研究结果表明,MDS和低原始细胞AML队列的反应率和OS率与前一项试验相似,但是,ORR和OS率在原始细胞比例大于30%的AML患者中较低(ORR为50%,CR率为0%,OS为3个月)[31]。这些研究结果对伴有TP53突变的MDS或低原始细胞AML患者是令人鼓舞的,但对于原始细胞比例较高的AML患者建议探索三联疗法或与APR-246的其他组合。目前,一项针对APR-246联合AZA和venetoclax的此类研究(NCT04214860)正在进行中。
1.2 靶向信号通路药物
1.2.1 Bcl-2抑制剂
Bcl-2家族蛋白是线粒体外膜细胞凋亡调控的关键分子。抑制Bcl-2蛋白的表达可促进肿瘤细胞凋亡、抑制血管生成及改善肿瘤耐药。
维奈克拉是一种高选择性口服小分子Bcl-2抑制剂,目前在临床上获得广泛关注。2018年FDA批准了venetoclax联合HMA或联合Ara-C用于年龄≥75岁或不能耐受标准诱导化疗的初诊AML患者的治疗。2021版美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)指南中将venetoclax联合HMA方案作为无基因突变的≥60岁AML患者的唯一优选方案,并将venetoclax联合AZA方案提高至1类推荐。一项纳入了431例≥75岁不适合接受强化诱导的新诊断的AML患者的Viale-A研究[32]显示,中位随访20.5个月,venetoclax联合AZA治疗中位OS长达14.7个月,而安慰剂组联合AZA治疗中位OS为9.6个月(HR =0.662,95%CI:0.518 ~ 0.845,P<0.001),venetoclax联合AZA的中位OS较AZA单药提高50%。另外,venetoclax联合AZA较AZA单药达到更高、更深的缓解,venetoclax联合AZA的CR/CRi率达66.4%,是对照组(28.3%)的2倍以上;venetoclax联合AZA的微小残留病变(minimal residual disease,MRD)缓解率达23.4%,约是对照组(7.6%)的3倍。该研究的亚组分析显示,venetoclax联合AZA以及单药AZA在不同基因突变亚组的最佳复合缓解率(CCR=CR+CRi)分别为IDH1/IDH2亚组(75.4%vs10.7%,P<0.001)、FLT3亚组(72.4%vs36.4%,P= 0.021)、NPM1亚组(66.7%vs23.5%)、TP53亚 组(55.3%vs0,P<0.001)。基于此,NCCN指南1类推荐venetoclax+AZA方案作为伴IDH1/IDH2及FLT3基因突变患者的优选方案,且将venetoclax+HMA方案作为FLT3突变患者的唯一优选方案。M14-358研究和M14-387研究均证实了即使在预后不良细胞遗传学的患者中,venetoclax联合HMA或低剂量阿糖胞苷(LDAC)治疗亦可带来明显获益[33]。M14-358研究是一项大型、多中心、Ⅰb期剂量递增和扩展研究,共纳入145例年龄≥65岁、不适合进行强化化疗的初治AML患者,接受venetoclax联合地西他滨(decitabine,DAC)或AZA治疗,评估venetoclax联合HMA方案在老年AML患者中的疗效和安全性,研究结果表明,venetoclax+HMA在预后不良细胞遗传学组的CR/CRi率为60%,中位OS为9.6个月。M14-387研究是一项开放标签的Ⅰ/Ⅱ期研究,纳入了年龄≥65岁、不适合进行强化化疗的初治AML患者,接受venetoclax联合LDAC治疗,评估该方案在未经治疗的AML患者的疗效和安全性,结果显示,venetoclax+LDAC治疗具有预后不良细胞遗传学风险的老年AML患者的CR/CRi率为47%,中位OS为5.7个月。真实世界的数据同样证实了venetoclax的有效性,2021年ASH会议上报道的一项以venetoclax为基础治疗新诊断的AML的前瞻性Revive研究的初步结果显示,中位治疗3.8个周期,CCR为57%,中位OS约为9.6个月,达CCR的患者具有更长的OS(13.6个月)[34]。
Venetoclax在老年AML患者中显示出了很好的疗效,在欧洲白血病网(European LeukemiaNet,ELN)不良风险的年轻AML患者中也具有较高的缓解率和低感染、低死亡率。一项正在进行的前瞻性、多中心、单臂Ⅱ期临床试验(NCT04752527)中期分析结果显示,在纳入的42例18 ~ 59岁未经治疗的ELN不良风险AML患者中,venetoclax联合DAC的CR/CRh率为64.3%,高于历史队列(38.3%)。
Venetoclax不仅在新发AML患者中具有很好的疗效,在R/R AML患者的治疗中也是“明星”药物。同样在2021年ASH会议的加拿大的一项回顾性研究发现,基于venetoclax的方案在R/R AML患者的CCR高达40%,在NPM1和IDH突变患者中具有更高的缓解率(CCR为87%)。Venetoclax联合柔红霉素、Ara-C(DAV方案),venetoclax联合氟达拉滨(Flud)+Ara-C+粒细胞集落刺激因子(G-CSF)+去甲氧柔红霉素(IDA)(FLAG-IDA方案)等药物组合方案也在初治年轻AML患者的诱导和巩固治疗中不断探索,目前更多的研究关注venetoclax+HMA联合X(包括靶向药物、传统化疗药物等)方案的疗效及安全性,正在进行的临床试验将更深入地了解venetoclax联合用药在治疗AML中的作用。
1.2.2 Hedgehog信号通路抑制剂
Hedgehog信号通路是人体胚胎发育及组织再生的关键通路。Hedgehog通路异常激活会导致Smoothened(SMO)及其下游通路的异常激活,诱导与发育相关蛋白的表达,进而促进肿瘤干细胞的发育和持续存活。Hedgehog信号通路抑制剂的典型代表药物为SMO抑制剂格拉斯吉布(glasdegib)。
SMO抑制剂glasdegib通过抑制Hedgehog信号通路,阻断肿瘤干细胞的发育和存活,进而发挥治疗AML的作用。Glasdegib联合LDAC于2018年11月被FDA批准用于治疗不符合强化化疗条件的成人新诊断的AML[35]。在Ⅱ期研究中,glasdegib联合LDAC(26.9%)的ORR高于LDAC(5.3%)。此外,与LDAC相比,接受glasdegib联合LDAC治疗患者的死亡风险降低了49%(中位OS分别为8.8和4.9个月,P= 0.000 4)。最常见的不良事件是血细胞减少症和胃肠道事件(主要是1 ~ 2级)[36]。Tavares等[37]报道了6名R/R AML或高危MDS患者接受glasdegib联合LDAC治疗的结果,中位随访时间为7个月(0.1 ~ 15.1个月),4名(66.7%)患者在治疗2个月后病情稳定,4名患者存活超过6个月。未来应进行包括更多R/R AML或R/R MDS患者在内的进一步研究,以探索glasdegib与其他新药或标准疗法联合的疗效和安全性。
除以上关键信号通路的靶向药物外,目前一些靶向凋亡通路的AML治疗药物也在临床试验中(见表2)。靶向药物为AML的治疗提供了新的选择,并获得了一定的缓解率,但CR的中位持续时间较短,患者OS的延长并不理想。多项临床试验结果证实,早期应用靶向药物可以获得更深、更可持续的缓解,从而为AML,尤其是R/R AML患者带来生存获益。因此,选择靶向药物的最佳时机需要进一步探索。另外,靶向药物一般只针对特定靶点,但在疾病进展过程中,克隆进化、基因丢失或复发、功能差异较大的亚克隆的频繁出现等因素均可能影响靶向药物的疗效。因此,专注于新靶向药物的单药试验存在问题,在合理的生物学原理假设下,联合治疗可能是一个重要的解决方案。
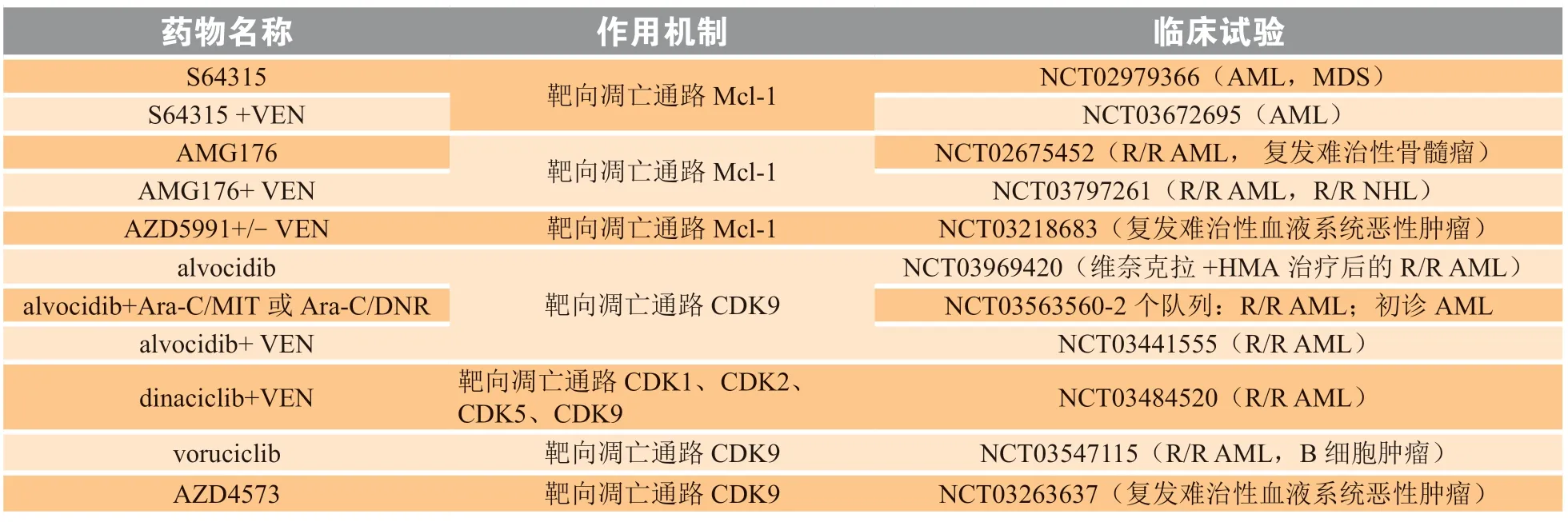
表 2 靶向凋亡通路的急性髓系白血病治疗药物Table 2 Agents targeting apoptosis pathway of AML
1.3 靶向表观遗传学修饰
表观遗传学是由非DNA序列改变所引起基因表达水平上的可遗传性改变,其机制主要包括胞嘧啶的DNA甲基化、组蛋白的乙酰化或甲基化、染色质结构重塑和RNA相关基因沉默等[38]。表观遗传调控广泛参与细胞周期调控、DNA复制、损伤及修复、细胞增殖、分化及凋亡等极为重要的生命活动,在AML的发病机制中发挥重要的作用[38]。
1.3.1 DNA甲基化转移酶抑制剂
DNA甲基化指在DNA甲基化转移酶(DNA methylationtransferase,DNMT)的作用下将甲基选择性地添加到胞嘧啶上形成5'胞嘧啶的过程。研究发现,DNMT在白血病、肺癌、乳腺癌、消化道肿瘤等多种肿瘤中表达上调,同时P15、P16、MLH1和RB等抑癌基因的启动子区域过度甲基化,因此DNMT抑制剂能够通过降低这些抑癌基因启动子的甲基化水平使被异常沉默的抑癌基因重新激活,发挥抗肿瘤效应。近年来,DNMT抑制剂AZA和DAC被FDA批准用于MDS和AML等恶性血液肿瘤疾病的治疗。体外实验证实,HMA与蒽环类药物、Ara-C等抗肿瘤药物联合能明显改善AML对化疗药物的敏感性,增强药物的细胞毒性反应,从而更有效地抑制AML细胞增殖,促进细胞凋亡[39]。
1.3.1.1 地西他滨一项多中心Ⅱ期临床研究发现,DAC在老年不适合高强度化疗(unfit)的AML患者中疗效显著,ORR为26%,中位OS为5.5个月[40]。Ⅲ期临床试验也证实了DAC在老年AML患者中的复合CR/CRi率明显高于其他治疗方案组(27%vs11%),中位OS也明显延长(8.6个月vs4.7个月,P= 0.003)[41]。另外,相较于传统的“3+7”方案,DAC联合Ara-C+阿柔比星(Acla)+G-CSF(CAG)方案明显提高了AML患者的CR率和长期生存率[42]。
1.3.1.2 阿扎胞苷AZA治疗老年AML和高危MDS患者也具有较好的疗效,在50岁以上R/R AML患者中,AZA治疗的CR/CRi率为17%,中位OS为8.4个月[43]。在强化治疗后,应用AZA作为老年AML患者的维持治疗方案,能够显著提高AML患者的无病生存期(disease-free survival,DFS)[43]。
1.3.1.3 DNMT抑制剂联用DNMT抑制剂联合传统化疗药物、新型靶向药物是目前研究的焦点,无论是联合维奈克拉或GO均取得了显著的疗效,并改善了AML患者的预后[33,44]。同时,DAC和AZA的口服治疗也在临床试验研究中,可以更好地改善患者的依从性和耐受性。另外,DAC和AZA在临床上的选择问题也是目前存在的争议点,meta分析结果提示,在AML和高危MDS患者中,DAC具有相对较高的CR率,而AZA的不良反应则较小[45]。2021年ASH会议报道的一项大型回顾性队列对比了DAC与AZA治疗AML的结果表明,两者CR率及缓解率无明显差异,美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)制定的体能状态评分≥2分、骨髓原始细胞计数<50%,继发性AML或伴有不良遗传学患者接受DAC治疗缓解率更高,但AZA在年龄≥80岁、白细胞≥10×109/L、血小板<20×109/L以及估算的肾小球滤过率(eGFR)≥45mL · min-1· 1.73m-2的患者中OS更长。因此,低剂量DNMT抑制剂是AML患者,尤其是老年或unfit患者值得选择的治疗策略,但其与新型靶向药物的联合方案的疗效和安全性需要进一步验证,DNMT抑制剂的选择也要依据患者的身体条件、依从性等加以考虑。
1.3.2 组蛋白去乙酰化酶抑制剂
组蛋白去乙酰化酶(histone deacetylases,HDAC)可通过逆转组蛋白乙酰化状态,直接参与基因表达的表观遗传调控和细胞活性控制过程[46]。HDAC抑制剂(histone deacetylases inhibitor,HDACi)通过抑制HDAC活性改变组蛋白和非组蛋白的组成,导致乙酰化水平增加,进而促进每种细胞类型中不同沉默基因的重新表达。虽然HDAC抑制剂的确切作用机制尚不明确,但已有的研究表明,其在细胞表观遗传和非表观遗传调控中有重要作用,能诱导肿瘤细胞分化、细胞周期阻滞和凋亡[47]。
1.3.2.1 西达本胺西达本胺是我国自主研发的一种新型HADCi口服制剂,属于苯酰胺类化合物,可选择性地抑制HDAC1、HDAC2、HDAC3和HDAC10,特别是对于HDAC2和HDAC3[48],产生抗肿瘤作用。临床前研究结果证实,西达本胺一方面通过抑制JAK2/STAT3信号通路诱导白血病细胞周期阻滞,促进白血病细胞凋亡;另一方面通过增强NK细胞杀伤活性介导抗白血病作用[49]。在联合用药的细胞凋亡实验中发现,LDAC和西达本胺具有协同抗白血病作用,两者以时间和剂量依赖性方式抑制K562和THP-1阳性细胞的增殖,并且西达本胺能增强DAC对AML细胞的凋亡作用[50]。陈琳等[51]研究发现,应用西达本胺、DAC联合Acla+高三尖杉酯碱(HHT)+Ara-C(CHAG)方案治疗R/R AML患者,ORR为75%,由此可见,西达本胺联合化疗方案治疗AML具有较好的临床应用前景。因此,西达本胺与低剂量表观遗传药物联合应用于AML的治疗是未来白血病研究的新焦点。
1.3.2.2 vorinostatVorinostat能够非特异性地结合HDACs的活性位点,诱导AML细胞的DNA损伤,影响ASXL1等基因的转录和表达,从而抑制细胞生长、诱导细胞凋亡。Ⅰ期临床研究的结果表明,在R/R AML患者中,vorinostat联合DAC和Ara-C的ORR可达35%,且安全性和耐受性良好[52]。然而,vorinostat单药治疗的效果并不理想[53]。
1.3.2.3 panobinostatPanobinostat在多发性骨髓瘤中取得了显著疗效,但在AML中疗效有限[54]。临床前研究表明,panobinostat联合DNMT抑制剂能够下调MYC基因的表达,并协同和增强其抗AML活性[55]。Panobinostat单药疗效有限,但在联合方案中疗效显著,CR/CRi率分别为10.5%和45.8%[56]。
除上述提及的HDACi外,还有entinostat、belinostat、romidepsin和apicidin等更多HDACi药物正处于临床研究中。
1.3.3 DOT1L抑制剂
DOT1样组蛋白H3甲基转移酶(DOT1-like,histone H3 methyltransferase,DOT1L)属于组蛋白赖氨酸甲基转移酶(histone lysine methyltransferases,HKMTs)的一种,是一类表观遗传调节酶,通过使组蛋白H3单甲基K79(H3K79)发生甲基化在基因调控、DNA复制和细胞分化等方面具有重要作用[57]。
Pinometostat(EPZ-5676)是DOT1L小分子靶向抑制剂,用于治疗携带MLL基因重排的R/R AML。Ⅰ期临床研究结果表明,伴MLL基因重排的R/R AML患者经pinometostat治疗后,其体内的H3K79me2水平显著降低[58]。由此可见,AML患者尤其是R/R AML患者表观基因组学检测的必要性,基因组学的结果为表观遗传药物治疗的选择及联合治疗方案提供了重要的参考依据。除上文所述的小分子抑制剂外,溴结构域和超末端结构域(bromodomain and extra terminal domain,BET)抑制剂、polo样激酶抑制剂[59]和鼠双微体基因2(murine double minute 2,MDM2)抑制剂[60]等也是具有前途的AML治疗新药类别,它们不依赖于特定突变的存在,目前尚处于临床前研究阶段。
综上所述,表观遗传学在AML的发生和发展中起到了重要作用,为AML药物研究的靶向治疗提供了大量机会。虽然表观遗传药物在AML中取得重要进展,但是免疫逃逸、耐药性、单药治疗的临床局限性等均限制了表观遗传药物的应用,因此,寻找不同表观遗传药物之间的联合以及与其他抗肿瘤药物联合的治疗方案是目前研究的重点,并且为不能耐受高强度化疗的R/R AML患者治疗提供了新的思路和方向,未来具有巨大的临床应用前景。
2 免疫治疗
2.1 抗体偶联药物
抗体偶联药物(antibody-drug conjugate,ADC)是一种结合具有靶向特异性的单克隆抗体和具有高毒性的小分子的新型疗法。
2.1.1 gemtuzumab ozogamicin
CD33抗原是AML的一个典型靶标。CD33在90%以上的AML患者中表达,而在多能造血干细胞上不表达,从而避免了造血系统的永久性抑制。Gemtuzumab ozogamicin(GO)是一种由CD33单抗与DNA裂解细胞毒剂加利车霉素共价连接组成的药物。Ⅲ期临床研究表明,标准方案上加用低单次剂量的GO可显著延长新诊断AML患者的EFS和OS,标准治疗组和GO组的CR/CRi率分别为75%和81%,2年EFS率分别为17.1%和40.8%,OS率分别为41.9%和53.2%,RFS率分别为22.7%和50.3%,与标准治疗组相比,GO的血液学毒性尤其是持续性血小板减少更常见,但毒性死亡风险未增加[61]。在R/R AML中,GO单药治疗的OR率为26% ~ 33%,中位OS为4 ~ 6个月,但具有高度的血液学和肝毒性[62-64]。在最近的一项研究中331名患者接受了GO作为R/R AML的单药(n= 139)、联合(n= 183)或R/R急性早幼粒细胞白血病(APL,n= 9)的治疗,结果显示:在单药治疗、联合治疗和APL治疗组中,相应的治疗中断发生率分别为68%、39%和33%;52%、22%和22%的患者分别发生了5级不良事件(AEs);60%、55%和78%的患者报告了相应的3级和4级治疗相关的AEs;5名患者发生肝毒性,包括静脉闭塞性疾病(n= 4)和药物性肝损伤(n= 1)[65]。然而,与单药相比,在GO中加入Ara-C和米托蒽醌(MIT)具有更高的ORR(60% ~ 70%)和更长的生存期(中位OS超过9个月)[66]。基于GO的强化方案可能是挽救治疗的可行选择,也是同种异体移植的桥梁。在法国开展的一项纳入58例原发R/R AML患者的研究中评价了GO联合Ara-C和MIT(MYLODAM方案)的疗效和安全性,结果显示,ORR为67%,2年EFS率和OS率分别为36%和54%;非复发死亡率、Ⅱ~Ⅳ级急性移植物抗宿主病(GVHD)和慢性GVHD的发生率分别为16%、40%和45%[67]。因此,基于GO的强化治疗方案对于R/R AML来说也是不错的选择。基于GO的联合用药方案仍需要更多的探索。
2.1.2 IMGN632
IL-3受体α亚单位CD123在AML原始细胞中过度表达。IMGN632是一种CD123靶向ADC。临床前研究结果证实了IMGN632在AML中的抗白血病活性[68]。2021年ASH会议中报道了IMGN632联合venetoclax和AZA在R/R AML患者的治疗结果,三药联合方案安全可控,ORR为55%,CCR为31%,显示出较好的抗白血病活性[69]。
2.1.3 双功能抗体
除ADC外,目前双功能抗体也在研究中。一项Ⅰ期临床试验结果显示,CD123×CD3双功能抗体(flotetuzumab)在化疗后复发的AML患者中的CR/CRi率为31%,但在难治性 AML患者中未观察到治疗反应[70-71]。CD33×CD3双功能抗体AMG330在R/R AML患者中的耐受性和抗白血病活性也已得到证实[72]。更多双特异性抗体如SGNCD33A(CD33抗体偶联药物)、IMGN779(CD33抗体偶联药物)、IMGN632(CD123抗体偶联药物)正在研究中[73]。
2.2 免疫检查点抑制剂
2.2.1 magrolimab
Magrolimab是一种针对CD47的巨噬细胞免疫检查点抑制剂。CD47是在多种癌症中(包括AML)过度表达的“不要吃我”信号,它的激活导致巨噬细胞免疫逃避。Magrolimab通过巨噬细胞吞噬作用消除肿瘤细胞。Magrolimab单药疗效及安全性已在Ⅰ期试验中得到证实[74-75]。2021年ASH会议上报道的一项研究数据证实magrolimab+venetoclax(VEN)+AZA三药联合方案的安全性,老年unfit及高危新诊断的AML患者CR/CRi率为94%,CR率为81%,8周死亡率为0%,且骨髓抑制作用较弱[76]。目前,一项关于magrolimab 联合AZA对比AZA-VEN或强化诱导作为TP53突变型AML的一线治疗的随机Ⅲ期临床试验(NCT04778397)也正在招募患者入组。
2.2.2 cusatuzumab
Cusatuzumab是一种具有增强抗体依赖性细胞毒性活性的人αCD70单克隆抗体,通过阻断CD70/CD27信号传导并靶向表达CD70的白血病干细胞(LSC)发挥作用,在体外和异种移植实验中均观察到其对LSC的消除作用[77]。2021年ASH会议上的Ⅰb期试验数据显示,44例新诊断的AML患者(中位年龄75岁)接受cusatuzumab联合venetoclax和AZA治疗的ORR为77.3%,CR率为45.5%,缓解患者47%达到MRD阴性,总体耐受性良好[78]。
2.3 嵌合抗原受体T细胞疗法
嵌合抗原受体T细胞(chimeric antigen receptor T cells,CAR-T)治疗是采用基因编辑的手段将一种或多种特异性CAR表达于患者的T细胞使其可靶向消灭肿瘤细胞的过继免疫疗法[79]。CAR-T治疗的前提是抗原的高度特异性,即特异性表达于肿瘤细胞而不表达于正常组织细胞(见表3),否则会导致脱靶效应和细胞毒性。近年来,以抗CD19和CD20的CAR-T 细胞在急性淋巴细胞白血病和非霍奇金性淋巴瘤患者的治疗中表现出较满意的疗效,从而激起研究者将CAR-T治疗应用于其他血液系统恶性疾病的兴趣。本节将介绍CAR-T在AML中的主要应用。
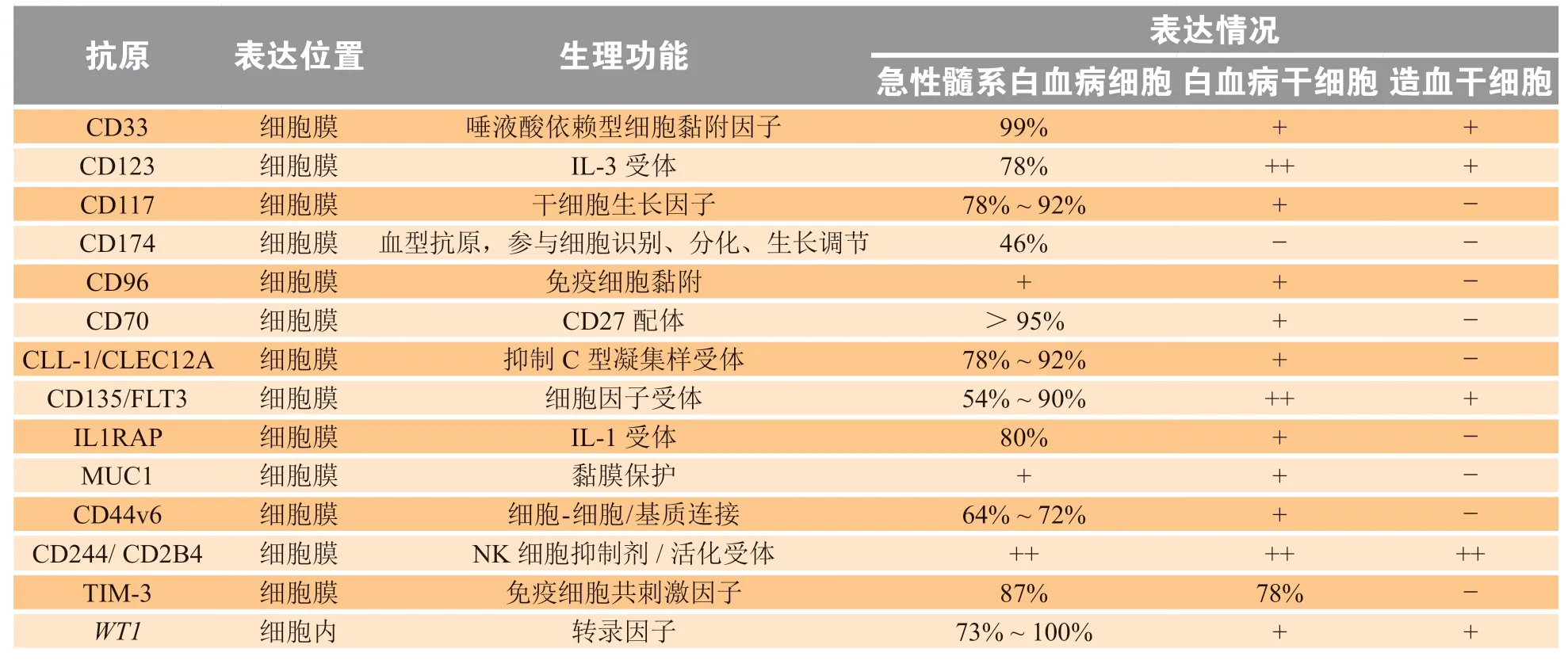
表3 急性髓系白血病细胞治疗的靶抗原[80]Table 3 Targeting antigens of AML cell therapy
2.3.1 CD33
如前所述,90%以上的AML患者骨髓细胞表面表达CD33,临床上已证实典型的ADC药物GO可改善AML患者的生存率,且对于诱导化疗失败的患者而言,含GO的化疗方案的有效率达50%,因此,CD33可作为治疗AML的有效靶点之一。临床前研究已证实,CAR-T细胞具有体内外杀伤AML细胞的作用[81-82]。Wang等[83]对1例R/R AML患者进行了自体CAR-T细胞输注,输注后2周内患者骨髓白血病细胞由50%下降至6%,但在第5周出现复发并死亡,主要不良反应为轻度的细胞因子释放综合征(cytokine releasing syndrome,CRS)和胆红素升高。因此,靶向CD33的CAT-T细胞治疗AML的疗效持久性和安全性仍需进一步提高。
2.3.2 CD123
CD123是IL-3受体α链,具有促进细胞增殖和分化的作用。CD123在约95%AML细胞表面高表达,而在正常造血干细胞、髓系祖细胞、树突细胞、部分B细胞、巨核细胞、单核细胞表面低表达。体内外实验已证实,CD123 CAR-T细胞具有有效杀伤原代AML细胞的作用和显著的清髓效应,相较于CD33 CAR修饰细胞周期蛋白依赖性激酶抑制因子(CDK inhibitor,CKI)细胞,抗CD123 CAR对正常髓系细胞损伤较小[68,84]。在针对R/R AML的Ⅰ期临床试验表明,4例接受抗CD123 CAR-T细胞治疗的患者中,所有患者均获得不同程度的缓解,2例CR后接受HSCT,2例肿瘤负荷降低(其中1例骨髓完全缓解)[80]。因此,靶向CD123的CAR-T细胞治疗AML具有深入探索的意义。
2.3.3 CD174
CD174又称Lewis Y(LeY),属于血型抗原ABH和Lewis抗原家族之一。4例接受抗LeY CAR-T细胞治疗AML患者的Ⅰ期临床试验表明,3例患者获得部分缓解(partial remission,PR)复发,最长持续缓解23个月,所有患者对LeY CAR-T细胞治疗耐受性良好。外周血和骨髓PCR检测提示,注入的CAR-T细胞可以持续长达10个月,该研究证实了CAR-T细胞治疗高危AML的可行性、安全性和体内持久性[85]。
2.3.4 NKG2D配体
由KLRK1基因编码的42 KDa蛋白(NKG2D)配体表达于各种实体瘤、急慢性髓系白血病、骨髓瘤及免疫抑制细胞、炎症细胞表面[86]。靶向NKG2D的CAR-T治疗Ⅰ期临床试验表明,8例R/R AML患者中有7例患者显示有治疗反应,其中1例在桥接自体HSCT后治疗反应超过1年,CRS处于可控范围[87]。然而,Baragaño Raneros 等[88]研究发现,随着AML患者病情进展,NKG2DL可能被DNA甲基化导致表达沉默致使免疫逃逸。因此,未来仍需更多临床试验去验证NKG2D配体是否可作为合适的CAR-T细胞治疗靶点。
除上述免疫治疗药物之外,尚有针对其他靶点的药物处于临床试验阶段(见表4),免疫治疗正如火如荼的进行,期待这些试验能为AML的治疗带来更多的选择。
3 传统方案的改进
细胞及动物临床前研究也证实了CD44v6[89]、叶酸受体β(folate receptor,FRβ)[90]、C型凝集素样分子1(C type lectin like molecule-1,CLL-1)[91]、CD38[92]等可作为治疗AML的靶点(见表4),未来有望在临床试验中开展上述各靶点的CAR-T治疗AML的方案。
3.1 CPX-351
CPX-351是近年来出现的新型注射剂,是Ara-C和柔红霉素按5∶1比例组成的双药脂质体包封剂,该比例在白血病细胞中具有最佳的协同作用。先前的临床研究表明,在新诊断为继发性急性髓系白血病(sAML)的老年患者中,与标准“3+7方案”相比,CPX-351在体内的药物比率、暴露持续时间均较“3+7方案”长,且CPX-351延长了患者的中位OS[93]。在一项开放标签、随机、Ⅲ期临床试验中,309名60 ~ 75岁的新诊断高危/继发的AML患者接受了1 ~ 2个疗程CPX-351或“3+7方案”诱导治疗,主要终点是OS。该研究结果显示,CPX-351较“3+7方案”显著改善了中位OS(9.56个月vs5.95个月;HR = 0.69,95% CI:0.52 ~ 0.90,P= 0.003);CPX-351的总体缓解率也显著高于“3+7方案”(47.7%vs33.3%,P= 0.016);两组的不良反应相似[94]。
3.2 口服阿扎胞苷
表观遗传修饰剂阿扎胞苷(CC-486,美国Celgene公司开发)是一种生物可利用的AZA口服制剂。与注射剂相比,口服给药消除了注射部位反应,且最大限度地提高了便利性,但其与注射用AZA不具有生物等效性。CC-486在Ⅰ期研究中对AML具有良好的临床活性[95]。一项随机、双盲、安慰剂对照Ⅲ期临床试验结果显示,化疗后缓解的老年AML患者中接受CC-486维持治疗与安慰剂相比,具有显著延长的OS(24.7个月vs14.8个月,P<0.001)和RFS(10.2个月vs4.8个月,P<0.001),CC-486主要副作用是胃肠道症状和中性粒细胞减少[96]。
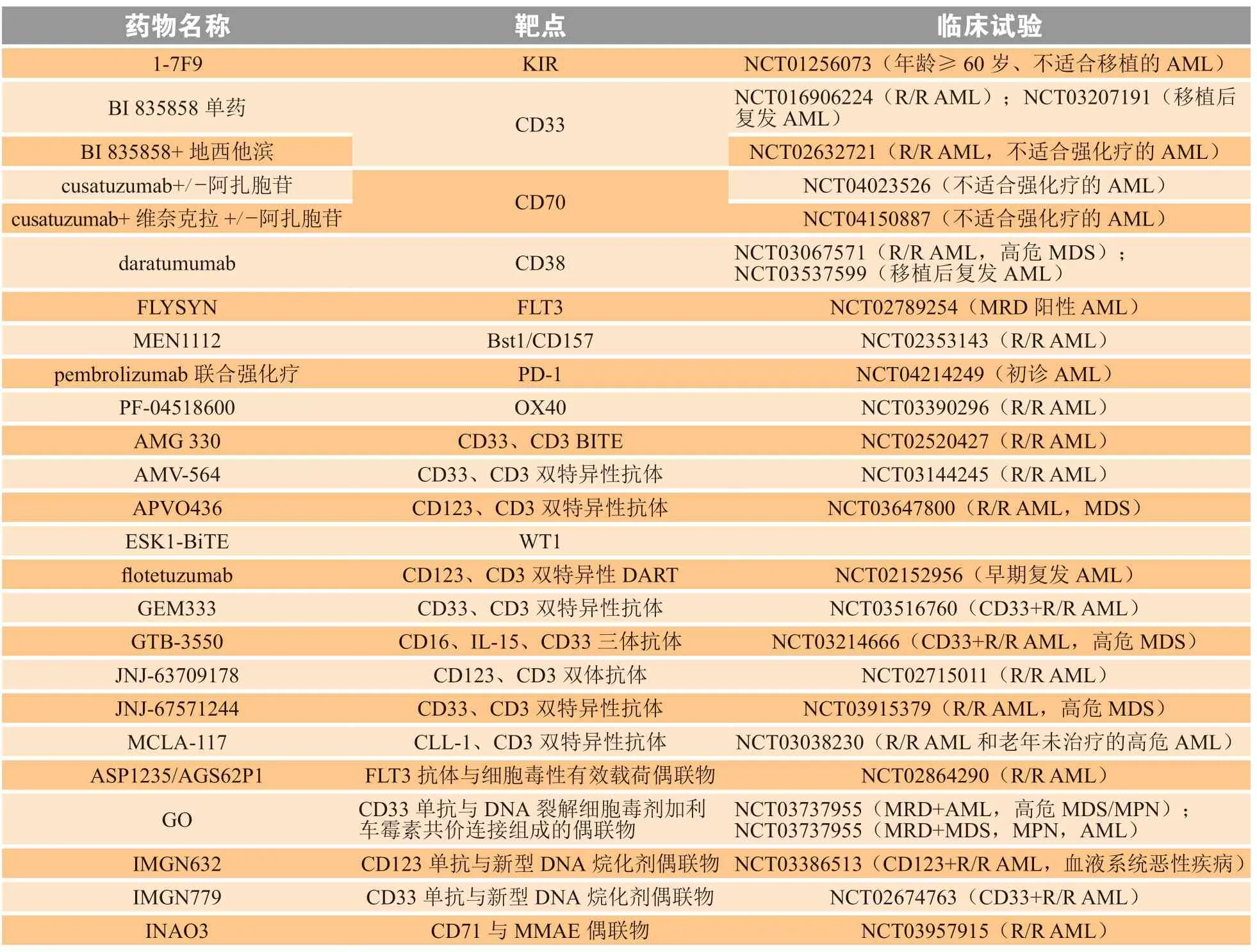
表 4 急性髓系白血病免疫治疗药物Table 4 Immunotherapeutic agents for AML
3.3 其他
除上述提到的近几年出现的新药,尚有对传统方案剂量的探究、各种药物组合、同类别药物比较等各类研究,老药新用也是目前的创新思路。
4 结语与展望
对于能够接受强化治疗方案的AML患者,“3+7方案”序贯异基因造血干细胞移植等巩固治疗目前仍是治疗的金标准。但随着各种新型靶向药物的问世,AML的整体治疗策略发生了重大变化。目前AML的治疗方案不再局限于标准的“3+7方案”和异基因造血干细胞移植,新型小分子靶向药物、抗体类药物、免疫治疗药物、CAR-T免疫疗法在AML的治疗中均有着广阔的应用前景。目前AML靶向治疗主要包括3个方向:1)各类小分子靶向药,如IDH1/IDH2抑制剂、FLT3抑制剂、Bcl-2抑制剂等,虽然近几年治疗AML的靶向药物层出不穷,但仍缺乏诸如用于骨髓瘤的硼替佐米、用于淋巴瘤的利妥昔单抗等此类具有“划时代意义”的靶向药物。2)CAR-T疗法在治疗B细胞急性淋巴细胞白血病(B-ALL)方面取得了重大突破,但在AML领域却乏善可陈。3)抗体类药物,如单抗、双抗及三抗类药物。目前国内正在开展多项CD47抗体治疗AML的临床试验,针对其他靶点如CD70、CD23、CD33等的相关药物目前也在AML中开展研究。期待未来出现更高效的靶向药物,配合传统的诱导化疗、异基因造血干细胞移植,提升AML患者诱导治疗、巩固治疗、维持治疗、复发后治疗的疗效。
未来AML的诊疗发展前景主要集中在3个方面:1)精准诊断。高通量测序技术的发展与应用使得AML的诊断不仅仅局限于形态学、流式细胞术和染色体常规检查,快速及精准的诊断技术发展为探究AML发病机制及药物选择提供了重要支撑。未来随着RNAseq和单细胞测序等高通量检测技术的引入,AML有争议的亚组分类有望更加精确,从而获得更精准的治疗策略指导。期待未来相关检测技术的引入、发展能够进一步提升AML的总体诊断水平。2)治疗方式的转变。既往AML的治疗主要以细胞毒性药物和异基因造血干细胞移植为主,治疗手段相对单一,但随着新型靶向药物、抗体类药物、细胞治疗药物的引入,部分患者将从强化治疗方案转变为无化疗或低毒性药物治疗。3)对免疫系统检测的重视。靶向治疗的脱靶效应、免疫逃逸、耐药是靶向治疗不可避免的问题,因此,对AML患者自诊断、治疗及治疗后有必要对免疫系统进行监测调整。相信随着分子技术以及测序手段的发展,不久的将来,会有更多低毒、高效的新型治疗方案,为更多AML患者带来临床获益,真正实现在精准诊断的基础上做到个体化的精准治疗。
