多发性骨髓瘤靶向新药研究进展
2022-07-12卢静杜鹃
卢静,杜鹃
(海军军医大学第二附属医院/上海长征医院血液病科 全军骨髓瘤与淋巴瘤疾病中心,上海200003)
多发性骨髓瘤(multiple myeloma,MM)是一种好发于老年人的恶性浆细胞肿瘤,1844年由Solly医生首次报道,随着全球人口老龄化,MM发病率逐年增高[1]。过去30年间,大剂量化疗、免疫调节剂(immunomodulatory drugs,IMiDs)、蛋白酶体抑制剂(proteasome inhibitors,PIs)、造血干细胞移植等广泛应用,极大地改善患者的生存质量,MM患者的中位生存期(median overall survival,mOS)从不足2年延长到5 ~ 8年[2],但目前MM仍无法治愈,且面临疾病复发进而进展为难治性MM。病程中MM细胞克隆演变、免疫抑制性肿瘤微环境是MM复发进展及耐药的主要原因,因此,迫切需要使用替代靶点的新治疗策略。20世纪以来,随着科技的进步,不同机制的靶向药物取得革命性突破,新药的研发进入快速发展时期。新一代PIs、IMiDs、肿瘤免疫药物,包括嵌合抗原受体T细胞免疫治疗(chimeric antigen receptor T-cell immunotherapy,CAR-T)治 疗、单克隆抗体(monoclonal antibody,mAB)、双特异性抗体(bispecific antibody,BsAb)、抗体偶联药物(antibody-drug conjugate,ADC)等靶向新药与肿瘤免疫药物先后面世,为MM治疗带来突破性进展(见图1)。大量新药进入临床,有些还在临床前期阶段,例如围绕B细胞成熟抗原(B cell maturation antigen,BCMA)的CAR-T细胞治疗、BCMA双抗、BCMA ADC等。本文对近年来MM领域的靶向新药的研究进展进行综述。
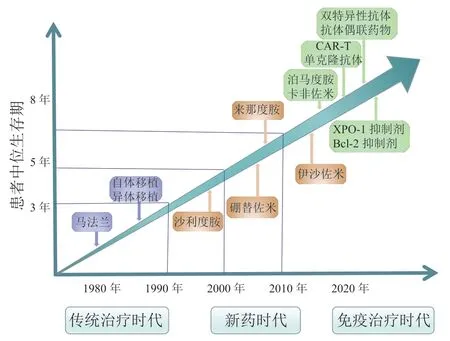
图1 多发性骨髓瘤治疗新药发展进程与患者预后Figure 1 Development of novel agents for multiple myeloma and prognosis of patients
1 原有抗骨髓瘤靶向迭代药物
过去20年间,随着MM基础研究的深入,第1代PI(硼替佐米),第1、2代IMiDs(沙利度胺、来那度胺)等小分子靶向药物成功应用于临床,极大改善MM患者预后,使MM诊疗从20世纪的传统化疗时代,跨入新药治疗时代。
1.1 新型蛋白酶体抑制剂
PIs是MM治疗领域中具有里程碑意义的靶向新药。MM细胞分泌大量单克隆免疫球蛋白,高度依赖泛素-蛋白酶体系统,降解细胞内错误折叠蛋白,维持细胞内蛋白质稳态。蛋白酶体中20S核心颗粒有3个催化位点,PI是短肽类药物,可与催化位点结合,导致MM细胞内错误折叠蛋白过度堆积,介导持续的内质网应激,促使MM细胞凋亡[3]。硼替佐米是第1代可逆性PI,2003年获批上市,以硼替佐米为基础的三药联用方案疗效显著,总缓解率可达80%以上,是目前国内外MM指南中推荐的一线治疗方案。硼替佐米治疗MM主要不良反应为周围神经病变(peripheral neuropathy,PN)、带状疱疹及血液学毒性。硼替佐米耐药与蛋白酶体表达下调及位点突变、未折叠蛋白反应异常、自噬增加、药物流出等原因相关[4]。新型PIs通过结构改良,进一步提高对蛋白酶体抑制的效率,可有效克服硼替佐米耐药,降低包括PN在内的不良反应发生率。
1.1.1 卡非佐米
卡非佐米(carfilzomib,K)属于第2代PIs,可选择性、不可逆性共价结合20S蛋白酶体的糜蛋白酶样活性位点,对蛋白酶体的抑制效率比硼替佐米更强。在一项纳入266例复发难治性骨髓瘤(relapsed and refractory multiple myeloma,RRMM)患者临床研究中,卡非佐米单药总有效率(overall response rate,ORR)为23.7%,mOS为15.6个月[5]。基于上述结果,2012年美国食品和药品管理局(FDA)批准卡非佐米用于RRMM患者。后续研究关注卡非佐米联合治疗方案疗效。ASPIRE研究显示,KRd(卡非佐米、来那度胺、地塞米松)治疗疗效优于Rd(来那度胺、地塞米松),中位无进展生存期(median progression-free survival,mPFS)分别为26.3个月和17.6个月[6]。ASPIRE研究最终分析证实,KRd与Rd相比可使患者长期获益[7]。ARROW研究中高剂量(70 mg · m-2)卡非佐米每周1次与常规剂量(27 mg · m-2)卡非佐米每周2次分别联合地塞米松治疗,高剂量组缓解率更高(62.9%vs40.8%),两组不良反应总体无明显差异;这些不良反应包括贫血、发热、腹泻、疲劳、失眠和高血压,多为1 ~ 2级,心功能不全发生率为9%和12%,PN发生率为10%和16%,急性肾损伤是致停药的最常见原因,发生率均为2%[8]。
美国国家综合癌症网络(NCCN)指南推荐初诊MM及RRMM患者可选用卡非佐米为基础的联合化疗方案。卡非佐米制剂近期已在中国获批上市,适应证为RRMM。以卡非佐米为基础的联合治疗方案疗效显著,耐受性良好,PN发生率低,是RRMM患者重要的治疗选择。临床应用中值得警惕的是少数患者在卡非佐米治疗期间出现严重心功能不全、肿瘤溶解综合征及急性肾功能衰竭等不良反应,建议密切监测患者病情变化。
1.1.2 marizomib
Marizomib(MRZ)是一种新型广谱PI,自海洋放线菌Salinisporatropica的代谢产物中分离而来,能不可逆结合20S蛋白酶的3个蛋白酶活性位点,其中与糜蛋白酶活性位点的结合效率是硼替佐米的2倍。MRZ可穿过血脑屏障,2015年FDA批准MRZ用于治疗恶性胶质瘤。MRZ在RRMM中开展相关研究提示,MRZ可诱导对硼替佐米耐药的MM细胞凋亡[9]。目前Ⅰ期临床试验中MRZ联合泊马度胺和地塞米松(Pd)治疗的ORR为53%,常见不良反应(≥3级)分别是:中性粒细胞减少症(29%)、肺炎(11%)、贫血(11%)和血小板减少症(11%)[10]。目前MRZ尚处于临床试验阶段,MRZ联合Pd方案疗效显著,耐受性良好,未来可作为硼替佐米、来那度胺耐药患者的又一治疗选择。
1.2 新型免疫调节剂
MM细胞高度依赖肿瘤微环境,骨髓基质细胞与MM细胞间通过细胞因子、黏附因子等相互作用,形成免疫抑制微环境,介导MM细胞增殖及耐药[11]。IMiDs主要包括沙利度胺、来那度胺和泊马度胺,可作用于MM细胞及骨髓微环境,发挥调节免疫系统功能和抗MM双重作用。沙利度胺又称反应停,是谷氨酸的衍生物,20世纪60年代因“海豹肢胎儿事件”而退出市场;90年代发现沙利度胺具有免疫调节功能,对MM有较好疗效。沙利度胺价格便宜,MM治疗缓解率为60%,治疗相关不良反应较多,如过敏、窦性心动过缓、PN及血栓形成等,目前已逐步被第2代IMiD来那度胺所取代。来那度胺是沙利度胺衍生药物,抗MM效率更强,常见副作用为白细胞及血小板减少、静脉血栓,其PN发生率低,无明显心脏毒性[12]。
Cereblon(CRBN)是一种具有离子蛋白酶活性的大脑相关蛋白,是IMiDs类药物的直接作用靶点,可与DNA损伤结合蛋白-1(damage specific DNA binding protein 1,DDB1)、滞 蛋 白4(cullin 4,CUL4)和调节因子cullins-1(regulator of cullins-1,ROC1)结合形成E3泛素化连接酶复合物,结合底物通过泛素-蛋白酶体途径进行蛋白水解。研究发现,沙利度胺与CRBN结合,激活CRBN E3泛素化连接酶复合物活性,泛素化修饰下游靶蛋白,包括转录因子Ikaros(IKZF1)、Aiolos(IKZF3),通过蛋白酶体途径降解靶蛋白,下调干扰素调节因子4(interferon regulatory factor 4,IRF4)和MYC[13-14]。IMiD耐药与CRBN表达下调及突变、CRBN-Ikaros轴突变等多因素相关[4]。晶体结构揭示,沙利度胺及其衍生物与CRBN结合位点为CRBN表面3个色氨酸残基的浅层疏水囊区域。泊马度胺和来那度胺结构中含C4氨基基团,该基团通过水介导的氢键增强与IKZF1和IKZF3相互作用,沙利度胺缺乏C4氨基,故其结合IKZF1/IKZF3的能力较低[4]。目前分子胶类药物IMiDs的发展,从最初偶然发现沙利度胺,逐渐步入自主设计靶向新药阶段,研究者精准设计及筛选出结构改良的新型IMiDs,进一步克服IMiDs耐药[15]。
1.2.1 泊马度胺
泊马度胺(pomalidomide,P)是来那度胺的衍生品,属第3代IMiDs,其抗MM疗效比沙利度胺和来那度胺更强。2013年泊马度胺被FDA批准用于治疗RRMM。NIMBUS试验显示,在至少接受2种治疗的RRMM患者中,泊马度胺联合低剂量Pd与联合高剂量Pd相比,ORR更高(31%vs10%)[16]。泊马度胺、地塞米松联合克拉霉素(ClaPd)治疗多重耐药的RRMM患者的ORR为60%,其中非常好的部分缓解(very good partial response,VGPR)及以上缓解率为23%,mPFS为7.7个月[17]。在老年RRMM患者中泊马度胺、环磷酰胺联合地塞米松(PCd)方案治疗的ORR为58.2%,mPFS为6.9个月[18]。基于泊马度胺与硼替佐米的联合方案中,OPTIMISMM研究显示泊马度胺与Vd(硼替佐米、地塞米松)组成的PVd,与Vd方案相比,PVd显著提高患者的缓解率,ORR分别为82.2%vs50%[19]。
国产泊马度胺仿制药已获批上市,用于接受至少2种既往治疗(包括来那度胺和硼替佐米)的RRMM患者。泊马度胺药物经肾脏代谢,血清肌酐大于3.0 mg · dL-1的MM患者建议调整剂量使用。以泊马度胺为基础的联合治疗(如PCd、ClaPd、PVd等)是对RRMM有效的联合治疗方案,老年体弱的患者可考虑Pd方案。泊马度胺常见副作用为贫血、中性粒细胞减少、血小板减少、感染、疲劳、背痛等,通常为1 ~ 2级,3级以上的严重不良反应较为少见,血栓风险较沙利度胺及来那度胺少,但临床仍需注意抗凝。
1.2.2 CC-122
Avadomide(CC-122)是新型CRBN E3连接酶调节剂,与来那度胺相比CC-122与CRBN的结合亲和力高20倍,能克服Ikaros轴依赖性IMiD耐药。目前CC-122正处于临床研究阶段[20],提高对转录因子IKZF1/IKZF3的降解效率,调节T细胞和自然杀伤(natural killer,NK)细胞功能。Ⅰ期临床研究(NCT01421524)探索CC-122在RRMM患者中的疗效及安全性,结果显示1/2(50%)RRMM患者疗效评估为病情稳定,安全性良好。期待未来CC-122更多的研究数据发表[21]。
2 抗肿瘤免疫疗法药物
MM是一种恶性浆细胞肿瘤,浆细胞是体液免疫细胞,免疫功能障碍是MM的临床特征之一。MM细胞与骨髓基质细胞相互作用,促进肿瘤生长并产生免疫抑制的肿瘤微环境。免疫系统是MM治疗的重要靶点。在过去10余年间,MM肿瘤免疫治疗取得了长足的进步。肿瘤免疫治疗药物与传统化疗药相比具有更加高效、低脱靶效应、反应时间持久等显著优势,目前免疫治疗已成为抗肿瘤领域的“明星”。肿瘤领域免疫疗法可分为四大类:靶向抗体、过继细胞疗法、肿瘤疫苗以及溶瘤病毒。目前在MM中研究较为深入的是抗体药物与CAR-T细胞治疗。
2.1 抗体类药物
近10年,MM领域最重要的进展之一是抗体类药物的发展。美国FDA在此期间批准了9种MM靶向新药上市,其中4种为抗体类药物。抗体类药物是目前临床最常用的肿瘤免疫疗法,涵盖mAb、BsAb和ADC。抗体药物靶向肿瘤细胞上差异表达的表面抗原,通过免疫功能杀伤肿瘤细胞。抗体类药物在临床的应用,改变了目前复发难治及高危MM患者的治疗策略,在未来MM诊治中具有极大的应用前景。
2.1.1 单克隆抗体
目前MM领域临床应用最广泛的是CD38单抗,其他多种单抗包括CS-1、CD138、PD-1、IL-6和CD40等也已在临床研究中,未来新的靶向单抗疗效有待更多的研究及临床试验加以验证。
2.1.1.1 CD38单抗CD38是一种在淋巴样细胞上表达的跨膜糖蛋白,且在MM细胞上高表达,是抗MM理想的靶点之一。CD38单抗是目前应用最为广泛的MM单抗,靶向MM细胞表面CD38分子,通过抗体依赖的细胞毒效应(antibody-dependent cellmediated cytotoxicity,ADCC)、补体介导的细胞毒效应(complement dependent cytotoxicity,CDC)、抗体依赖性细胞吞噬作用(antibodydependent phagocytosis,ADPC)以及抑制CD38的酶活性等多方面来发挥抗MM作用。
Daratumumab(Dara)是首个获批的针对CD38人源化IgG1κ单抗。在Ⅱ期SIRUS研究中RRMM患者Dara单药治疗的ORR为29%;Dara与来那度胺或硼替佐米联用,可进一步提高疗效[22]。在CASTOR研究中Dara+Vd联用组与Vd组相比,可明显提高患者缓解,ORR分别为84%和63%,18个月的PFS率分别为48%和8%;与Vd组患者相比,Dara+Vd联用组患者微小残留病灶(minimal residual disease,MRD)转阴率更高,分别为19%和4%[23]。POLLUX研 究 中,Dara+Rd联 用 组 的ORR和完全缓解(complete response,CR)率分别为92.9%和43.1%,Vd组仅为76.4%和19.2%[24]。鉴于Dara在RRMM患者中的成功应用,后续临床研究关注Dara在初诊多发性骨髓瘤(newly diagnosed with multiple myeloma,NDMM)患者治疗中的效果。在关于不适合移植初诊MM患者的ALCYONE研究中,Dara与硼替佐米、美法仑、泼尼松(VMP)联用组与VMP组相比可明显延长患者PFS(36.4个月vs19.3个月)[25]。在欧洲CASSIOPEA研究符合移植条件的NDMM患者中,Dara联合VTD(硼替佐米、沙利度胺、地塞米松)与VTD相比可进一步改善患者的缓解率及缓解深度,CR率分别为39%和26%[26]。
约50%的患者首次输注Dara出现输液相关反应,大部分为1 ~ 2级。Dara与重组人透明质酸PH20(hyaluronidase-fihj,rHuPH20)共 同 配 制 成CD38皮下注射剂型。 rHuPH20是一种具有通透性的酶,可分解皮肤及皮下组织细胞外基质中的皮下多糖,从而促进生物制剂的装载、分散和吸收。Dara 1 800 mg 皮下注射35 min,与静脉输注Dara相比,ORR分别为41%和37%,药物谷浓度分别为593和522 mg · L-1,输液反应发生率分别为13%和24%[27]。CD38皮下注射安全有效,已获得FDA批准用于NDMM和RRMM的治疗。
2019年10月Dara在我国获批上市,用于既往接受包括PI和IMiD治疗的RRMM患者,因其价格昂贵,仅部分患者可以承担,经济因素是限制其应用的重要原因。在美、欧及多国,以Dara为基础的联合方案MM患者可获得深度缓解,且安全性良好,已成为初诊及复发MM患者治疗的重要基石。Dara治疗需警惕输液反应、感染、血液学毒性。CD38在红细胞表面少量表达,Dara会与CD38结合,造成间接Coombs试验假阳性,干扰交叉配血,建议首次用药前常规完善血型鉴定及抗体筛查。
Isatuximab是一种嵌合免疫球蛋G1单克隆抗体,与Dara相比,靶向CD38上不同的表位,诱导MM细胞凋亡。Isatuximab 10 mg · kg-1静脉用药,第1疗程每周用药1次,第2疗程开始每2周用药1次。针对RRMM的Ⅲ期ICARIA-MM研究中IsaPd组(isatuximab、泊马度胺、地塞米松)和Pd组(泊马度胺、地塞米松)的mPFS分别为11.5个月和6.5个月[28]。2020年3月FDA批准isatuximab上市,与Pd联合用于至少接受2线治疗的RRMM患者。
2.1.1.2 CS1单克隆抗体单克隆抗体elotuzumab靶向抗信号淋巴细胞激活标志物 F7(SLAMF7)。SLAMF7又称细胞表面糖蛋白CD2子集1(CS1),在MM细胞和NK细胞上表达[29]。CS1单克隆抗体具有双重作用机制:1)靶向作用MM细胞表面SLAMF7分子,通过ADCC作用,选择性杀伤MM细胞,并抑制MM细胞与骨髓基质细胞间黏附;2)通过SLAMF7通路和Fc结构域,促进NK细胞增殖,激活免疫系统,增强NK细胞杀伤MM细胞的效力。在RRMM中elotuzumab单药疗法并未显示临床活性,在后续的ELOQUENT-2研究中发现,elotuzumab和Rd联合与Rd治疗相比,可进一步提高患者的缓解率(ORR:79%vs66%),延长患者的PFS(19.4个 月vs14.9个 月)[30]。ELOQENT-3研究中,elotuzumab联合Pd(EloPd)组比Pd组具有更好的PFS(10.3个月vs4.7个月)和ORR(53%vs26%)[31]。Elotuzumab与IMiD联合使用时抗MM活性显著。目前,elotuzumab与来那度胺或泊马度胺和地塞米松联合使用获批用于治疗复发性骨髓瘤。
2.1.2 双特异性抗体
BsAb是MM免疫治疗领域中又一全新的成员,具有2个结合结构域,一端与肿瘤表面抗原结合(如CD19、CD33或BCMA),另一端与T细胞表面的受体结合(如CD3),将T细胞募集到肿瘤细胞附近,使T细胞不受组织相容性复合物(major histocompatibility complex,MHC)限制而直接活化,释放穿孔素和颗粒酶导致肿瘤细胞裂解。根据BsAb结构上是否存在Fc段,可将其分为2类,没有Fc结构域的构建体又被称为双特异性T细胞结合器(bispecific T-cell engagers,BiTEs),是由2种抗原结合区域(Fab)组装的融合蛋白,制备工艺简单,无法与体内Fc受体结合,很快被肾脏清除,半衰期极短,需要长时间连续输注用药,临床应用受到极大限制。后续改良的BsAb结构上增加Fc段,半衰期明显延长,此外Fc区可诱导ADCC作用并介导CDC作用,抗肿瘤免疫效果更强。
目前双抗治疗领域主要为肿瘤与自身免疫性疾病,在抗肿瘤领域应用更为广泛,其中最耀眼的“明珠”是CD3 T细胞双抗。Blinatumomab是全球首个CD19-CD3双特异性抗体,2014年获批用于复发或难治性急性淋巴性白血病治疗。Blinatumomab成功应用推动了整个BsAb领域的发展。迄今为止,在MM领域已有10余种不同的BsAbs进入临床研究,多为BCMA/CD3 BsAb,如:teclistamab、AMG420、AMG701、REGN5458、CC-93269和TNB-383B等,部分针对RRMM患者Ⅰ/Ⅱ期临床研究疗效令人惊喜,单药治疗总缓解率达62.5% ~ 89%[32],是目前最有治疗前景的免疫治疗新药之一。
2.1.2.1 teclistamabTeclistamab是以BCMA和T细胞CD3受体为靶点的人源化IgG4型BsAb。目前,在临床研究阶段评估单药及联合治疗RRMM的疗效。在Ⅰ期MajesTEC-1研究中,纳入78例前期中位线数治疗为6线的RRMM患者,接受0.3 ~ 720µg · kg-1teclistamab静 脉 给 药 治 疗,结 果 显 示ORR随剂量增大而增加;12名接受270 μg · kg-1teclistamab治疗的患者,ORR为67%,其中VGPR及以上疗效达50%,最常见的AE为贫血、细胞因子释放综合征(cytokine release syndrome,CRS)、中性粒细胞减少和血小板减少,其中所有CRS均为1 ~ 2级[33]。后续研究证实,不同剂量teclistamab治疗,无论是静脉注射还是皮下注射,患者均获得深度持久性缓解[34]。
在多重耐药的RRMM患者中teclistamab疗效令人鼓舞,安全性良好。2021年美国FDA授予teclistamab突破性疗法认定,用于治疗RRMM患者。2.1.2.2 AMG420和AMG701 AMG420是抗BCMA/CD3 BsAb,半衰期仅为数小时。首次人体研究显示,在中位线数治疗为5线的RRMM患者中,AMG420治疗剂量为400 µg · d-1,ORR达70%,其中缓解患者PFS为23.5个月[35]。AMG420治疗疗效肯定,安全性良好,但由于需持续静脉输注维持血药浓度,目前已停止其后续研究。AMG701是AMG420的升级产品,结构上额外增加Fc片段,半衰期延长至5 d,可每周给药1次,与来那度胺联合使用可改善MM患者预后[36]。但目前AMG701因Ⅰ期临床研究中CRS问题,已暂停AMG701后续临床试验招募。
MM领域中BsAb治疗的不良反应主要是CRS、神经毒性、血细胞减少和感染。CRS通常在BsAb首次使用或剂量递增时发生。此外,RRMM患者体内T细胞数量减少且功能下降,处于免疫抑制状态,导致肿瘤抗原逃逸以及免疫抑制肿瘤微环境等多因素相关耐药。研究者尝试通过改良双抗结构缩短肿瘤靶点与T细胞的距离、联合靶向多种抗原、与IMiD联合使用等多种治疗策略,以期解决上述难题,相关研究仍在进行中,期待后续能有积极的数据公布。
2.1.3 抗体偶联药物
基于抗体的免疫治疗和基于小分子化合物的化疗是肿瘤治疗的两大支柱。免疫治疗以肿瘤特异性抗原为靶点,在实体瘤和血液肿瘤治疗上取得巨大成功。小分子化疗药是肿瘤治疗的基石,有近百年历史,通过多种途径杀伤肿瘤细胞。由于传统化疗选择性差,副作用明显,因此常限制其临床应用。随着基因工程技术和化学连接技术的成熟,研究者们积极尝试,以抗体作为载体,通过连接片段连接细胞毒药物,将靶向单抗与化疗药物合二为一,构建出ADC这一新型免疫治疗药物,成功实现两大类药物的优势互补。
2000年首个ADC药物MylotargTM获批上市。ADC类药物逐步成熟,在实体肿瘤(乳腺癌、黑色素瘤、结直肠癌、胰腺癌、卵巢癌等)和血液肿瘤(白血病、淋巴瘤和多发性骨髓瘤)治疗领域有诸多研究进展,尤其在乳腺癌及血液肿瘤领域成绩斐然,现已有多个ADC药物应用于临床。肿瘤细胞具有显著异质性,单一抗体很难涵盖所有类别的肿瘤细胞,抗体类药物杀伤具有阳性靶标的肿瘤细胞后,被动筛选出无阳性靶点的肿瘤细胞群体,克隆演变进而导致肿瘤进展。ADC类药物一大显著优势是具有特殊的“旁观者效应(bystander effect)”,即ADC药物被抗原阳性肿瘤细胞内化后,释放出来细胞毒药物,不仅杀伤抗原阳性肿瘤细胞,还可透过细胞膜杀死周围的抗原阴性肿瘤细胞,有效克服肿瘤异质性这一治疗难题,使ADC类药物成为抗肿瘤药物中的重要成员。
Balantamab mafodotin(Blenrep)是 一 种 新 型ADC药物,由人源化BCMA抗体J6M0偶联微管破坏剂monomethylauristatin F(MMAF)构成。Blenrep与B细胞激活因子(B-cell activation factor,BAFF)和增殖诱导配体(a proliferation inducing ligand,APRIL)竞争性结合MM细胞表面BCMA,被MM细胞内化,随后在溶酶体降解并释放出MMAF,导致时间和剂量依赖性G2/M细胞周期停滞,抑制MM细胞有丝分裂,促进MM细胞凋亡。同时Blenrep结构中的Fc段可与巨噬细胞表面的Fc受体结合,诱发抗体介导的细胞溶解效应,进一步增强抗肿瘤作用。在多重耐药的RRMM患者进行的DREAMM-1研究中,Blenrep治疗的ORR达60%,其中VGPR及以上疗效达54%,mPFS达12个月,首次证实Blenrep治疗可获得持久的深度缓解,常见的不良事件是角膜病变和血小板减少[37]。角膜病变是指在眼科检查中发现角膜微囊样上皮改变,可伴或不伴有视物模糊、畏光和眼干等症状,发生率为53% ~ 63%,症状可逆,与角膜基底上皮细胞非特异性摄取Blenrep,局部释放MMAF诱导细胞凋亡相关。建议患者在Blenrep用药期间定期至眼科评估,可使用人工泪液,避免佩戴隐形眼镜及使用含激素眼药水。DREAMM-2研究中,Blenrep低剂量组(2.5 mg · kg-1)与高剂量组(3.4 mg · kg-1)疗效相当(ORR分别为31%和34%),低剂量组安全性更高。近期,Blenrep单药2.5 mg · kg-1剂量组获批用于前期至少接受过4线治疗(包括PI、IMiD和CD38单抗)的RRMM患者。鉴于目前多重耐药的RRMM患者的治疗药物选择极为有限,belantamab mafodotin单药治疗获批上市具有重要的临床意义[38]。近期Blenrep与泊马度胺、硼替佐米等不同药物联合治疗的相关临床试验正在进行中。
ADC药物具有特异性高、耐药性低和具有协同效应等优势。目前诸如靶向肿瘤血管、肿瘤干细胞等ADC药物也在探索中。ADC药物治疗现面临以下几大难题,包括药物输送效率较低、靶点抗原在非肿瘤组织中表达导致的特异性不良反应、肿瘤细胞异质性靶点抗原表达不均一等,限制其应用。ADC药物每个抗体上连接的细胞毒药物数量称为药物抗体比(drug-to-antibody ratio,DAR),DAR为4时药效最理想,DAR越大,药物代谢速率越高,半衰期越短,治疗相关毒性作用也会相应增加。期待随着结构改良的新型ADC药物、新型细胞毒药物的研发进展,未来ADC药物安全性及疗效得以进一步提高,减轻包括眼部毒性在内的毒性作用,使得RRMM患者在诊治过程中更加安全有效。
2.2 细胞过继免疫治疗
近年来免疫治疗是肿瘤研究领域的焦点。肿瘤具有异质性,理想的治疗方式是能精准针对每种不同的肿瘤类型,针对每位不同肿瘤患者进行设计。近20年来随着基因工程的进步,研究者成功改造免疫细胞,使过继细胞免疫治疗(adoptive cellular immunotherapy,ACT)成为一种有效治疗肿瘤的个体化疗法。MM领域ACT治疗是当前一大热点,通过从MM患者体内分离免疫细胞,体外改造扩增后,回输到患者体内,从而达到增强免疫,特异性杀伤MM细胞的目的。MM的ACT治疗主要包括CAR-T、CAR-NK两大类,当前研究最深入的是CAR-T疗法。
2.2.1 CAR-T治疗
CAR-T治疗是近年来肿瘤治疗领域的重大突破,尤其在血液肿瘤系统发展迅速,取得令人瞩目的成绩。CAR由胞外抗原结合区、跨膜区域和胞内信号转导区构成。CAR-T细胞不受MHC分子限制与肿瘤细胞结合,胞内区域提供T细胞活化的共刺激分子,促进T细胞增殖,分泌促炎细胞因子,靶向杀伤肿瘤细胞。CAR-T细胞疗法是目前MM免疫治疗中最具前景的疗法,作为一种个体化活细胞类药物,临床疗效显著,仅需一次或数次输注治疗,即可快速获得深度的疾病缓解。靶向CD19的CAR-T细胞在不同的血液系统恶性肿瘤中取得令人满意的疗效,获批用于急性淋巴细胞白血病、弥漫性大B细胞淋巴瘤和套细胞淋巴瘤治疗。与之相比,目前MM领域CAR-T研究多处于临床试验阶段。
2.2.1.1 抗BCMA CAR-T目前研究最为广泛的MM CAR靶点是BCMA。蓝鸟公司开发的CAR-T产品,bb2121是包含4-1BB共刺激域的第二代CAR-T产品。Ⅱ期KarMMa试验中,在前期接受3线治疗的RRMM患者中,bb2121治疗ORR达73%,其中26%的患者获得MRD阴性的完全缓解或严格意义的完全缓解(stringent complete response,sCR),84%患者出现治疗相关CRS,大部分为1级[39]。2021年3月靶向BCMA的CAR-T产品Abacma获得美国FDA批准。Abacma后续升级产品bb212117,其结构上添加磷酯酰肌醇-3-激酶(phosphatidylinositol 3 kinase,PI3K)抑制信号,产生含富集“记忆T细胞”的CAR-T产品,具有更持久的抗肿瘤活性。一项对23种不同的BCMACAR-T细胞治疗的荟萃分析,共纳入640名MM患者,结果显示ORR达80.5%,CR率为44.8%,mPFS达12.2个月[40]。
国内MM的CAR-T细胞治疗进展飞速,多款CAR-T细胞产品与国外同步处于临床试验阶段,部分达到国际领先水平。聚焦CAR-T治疗,国内已有较多中心展示了较好的临床效果。2016年西安开展CAR-T细胞(LCAR-B38M)治疗RRMM临床研究,共纳入57例RRMM患者,总有效率为88%,68%获得CR,中位起效时间1个月,mPFS为15个月[41]。有效率显著优于国内外同类产品,引起国内外学术界关注,代表我国CAR-T治疗取得突破性进展。2019年国家转化医学中心联合中国多家中心合作临床研究,包括瑞金医院、上海长征医院、江苏省人民医院等,开展LCAR-B38M多中心Ⅰ期临床试验,总缓解率达88.2%,治疗11个月后7例患者仍为sCR[42]。
目前在研的CAR-T细胞多数为鼠源性。同济医学院团队开展全人源CAR-T(CT103)研究,Ⅰ期临床试验共纳入18例RRMM患者,ORR高达100%,CR率达72.2%[43]。CT103A是目前治疗RRMM患者有效率最高的CAR-T产品,对既往接受鼠源性CAR-T治疗及伴有髓外病变的MM患者同样100%有效,结果令人振奋。
MM领域CAR-T细胞疗法疗效肯定,但通常合并严重的毒性反应,威胁患者健康。因此CAR-T治疗中安全性问题是临床关注的重点,主要包括3个方面:细胞因子释放综合征、神经毒性和脱靶效应。目前携带抑制/自杀基因CAR-T已进入临床研究,必要时可触发基因关闭T细胞信号传导,防止CAR-T细胞过度扩增,减轻毒性反应。
笔者所在科在研一种新型自杀基因修饰的靶向BCMA的第2代4-1BB CAR-T,结构上增加一个截断的表皮生长因子受体(EGFRt)作为安全开关,在毒性反应早期可通过激活自杀基因诱导CAR-T细胞凋亡,有效提高CAR-T治疗的安全性。Ⅰ期临床研究(NCT03093168)显示,总缓解率达79.6%,2年PFS率和2年OS率分别为49.16%和53.95%;1 ~ 2级CRS发生率为22.7%,3级CRS发生率仅为6.8%,无3级以上CRS发生,所有患者毒性反应均可逆,安全性明显优于其他同类产品[44]。
2.2.1.2 BCMA/CD19双靶点CAR-TCAR-T细胞治疗中耐药是临床亟需解决的难点,潜在机制包括对MM细胞克隆筛选,抗原逃逸以及BCMA双等位基因失活等,在克服抗原丢失的克隆选择方面,可通过鸡尾酒疗法输注多种CAR-T细胞或CAR-T细胞同时靶向2种肿瘤抗原。徐州医科大学CAR-T研究团队,采用人源化CD19 CAR-T和BCMA CAR-T的联合输注,总缓解率达95%,43%获得sCR[45]。
随着科技的进步,新的制备方法如mRNA电穿孔、睡美人基因传递系统、FasTCAR平台等逐渐走进临床研究,进一步优化CAR-T制备工艺。笔者所在科在2020年美国血液学会(ASH)会议上率先报道了国际首个基于FasTCAR平台制备的BCMA/CD19双靶点自体CAR-T(GC012F)国内多中心临床研究[46]。该研究纳入16例RRMM患者,输注CAR-T细胞数量分别为 1×105、2×105和3×105cells/kg,93.8%患者获得VGPR或以上疗效,高剂量组100%获得MRD阴性的sCR。2021年第26届欧洲血液学年会上报道了GC012F的更新结果,19例RRMM患者总缓解率为94.7%,大多数CRS为1 ~ 2级,中位持续时间为4 d[47]。双靶点CAR-T与传统CAR-T产品相比,可覆盖更多的MM细胞,在不增加毒性反应基础上,有效率更高,FasTCAR平台将细胞制备周期从14 ~ 21 d缩短到2 ~ 3 d,为疾病快速进展的高危患者争取治疗时机,具有重要临床意义。
CAR-T治疗在MM领域诊治中发挥重要的作用,未来大有可为。新的靶点包括SLAMF7/CS1、CD38、CD19、CD138、CD56、CD44v6、κ轻链等均在临床研究中,期待未来发现新的突破性靶点。CAR-T与其他靶向药联合,可增强CAR-T细胞的持久性与活性。r-分泌酶抑制剂、全反式维甲酸等药物可增加MM细胞表面BCMA密度,改善治疗耐药。有研究探索从健康供者获取T细胞,制成CAR-T产品,以解决MM患者CAR-T细胞制备不足与功能缺陷的难题。迄今为止,CAR-T在多线复发的MM患者中疗效确切,未来能否应用于初诊高危MM患者,清除微小残留病灶,使患者长期生存,仍有待进一步临床研究结果。
2.2.2 CAR-NK治疗
借鉴CAR-T细胞治疗的成功先例,CAR-NK细胞治疗领域也受到越来越多的研究者关注。NK细胞是人体固有免疫系统的重要组分,可非特异性杀伤肿瘤细胞,不分泌IL-6、IL-1等炎性因子。因此,NK细胞被认为是癌症免疫治疗的潜在靶标。CARNK治疗是过继免疫细胞治疗的新成员,利用基因工程给NK细胞装上可同时识别肿瘤细胞并激活NK细胞的嵌合抗体,有效杀伤肿瘤细胞,且治疗中无CAR-T细胞治疗中常见的CRS困扰。目前关于CAR-NK细胞的研究较少。NKG2D是一种NK的活化型受体,其配体在包括MM在内的血液肿瘤细胞中高表达。Leivas等[48]研究发现,NKG2DCAR转导的NK细胞可有效靶向MM,对健康细胞的活性较低;体内试验25%的小鼠治疗后获得完全缓解,证实CAR-NK细胞可清除MM细胞,具有临床前功效。MM领域CAR-NK细胞治疗需克服MM患者体内免疫抑制状态,免疫细胞及数量功能受抑,CAR-NK细胞存在扩增有限、疗效欠佳、制备工艺需改进等多个难题。目前CAR-T细胞治疗研究还处于临床前及探索阶段,尚无临床数据,未来距离临床应用还有很长的路要走。
3 其他新机制的靶向药物
尽管前期靶向新药、单克隆抗体和免疫细胞治疗取得了巨大的进步。但迄今为止骨髓瘤仍是一种不能治愈的疾病,部分高危及RRMM患者的预后仍极差。MM细胞呈高度异质性,随着疾病的发展,MM耐药克隆选择性增殖,疾病侵袭性增高,治疗难度增加。近年来随着MM相关驱动基因突变及信号转导通路研究的进步,新的靶点及靶向新药不断涌现,如B细胞淋巴瘤-2(Bcl-2)抑制剂、核输出蛋白1(exportin-1,XPO1)抑制剂及新型肽偶联药(peptide drug conjugate,PDC)等,为MM联合治疗提供新的药物选择。
3.1 Bcl-2抑制剂
Bcl-2是一种原癌基因。维奈克拉(venetoclax)是首个高选择性、强效口服Bcl-2抑制剂,可诱导肿瘤细胞凋亡,2016年4月获得美国FDA批准用于慢性淋巴细胞白血病患者。大量研究表明,Bcl-2抑制剂在其他血液肿瘤,包括淋巴瘤、MM、急性髓系白血病中具有抗肿瘤作用。Venetoclax单药治疗RRMM患者ORR为21%,在t(11;14)染色体异常和Bcl-2高表达的MM患者中总缓解率更高(40%)[49]。一项Ⅱ期临床研究显示,在49例既往至少接受1线治疗的RRMM患者中,venetoclax联合Kd(卡非佐米和地塞米松)ORR达80%,mPFS为22.8个月。在合并t(11;14)和无t(11;14)的MM患者中,ORR分别为92%和75%,最常见的不良事件是腹泻、疲劳、恶心和淋巴细胞减少。该研究证实RRMM患者venetoclax联合Kd疗效肯定,耐受性良好,在合并t(11;14)患者中缓解率更高[50]。
3.2 XPO1抑制剂
XPO1也称为染色体区域稳定蛋白1,是细胞中的核质转运蛋白,调节从细胞核到细胞质物质(包括肿瘤抑制蛋白质和RNA)转运,在维持细胞稳态中发挥关键作用。核质转运是细胞内信号传递、参与细胞核反应(即细胞增殖、分化、凋亡等核反应)调控,进而基因复制、转录和翻译的重要环节。核质转运包括入核蛋白、胞质中的具有核定位信号肽的转运蛋白和出核蛋白,转运具有出核转运信号肽的核输出蛋白。已有7个已知的核输出蛋白,其中最具特点的是1997年发现的XPO1。XPO1可以介导将近285个不同的货物蛋白质的核输出,最重要的是XPO1为p53、p73、叉头框蛋白O(FOXO)和蛋白磷酸酶2(PP2A)这些肿瘤抑制蛋白及生长调节因子的唯一核输出协助蛋白,因此抑制XPO1是抗肿瘤治疗中又一重要靶点。
Selinexor(SEL)是首款用于MM治疗的选择性、口服核输出蛋白抑制剂,可与XPO1结合并抑制其功能,使肿瘤抑制蛋白在细胞核内堆积,导致肿瘤细胞选择性凋亡。在Ⅱ期STORM临床试验中评估SEL与小剂量地塞米松联合疗效,在多重耐药的RRMM患者中包括对硼替佐米、卡非佐米、来那度胺、泊马度胺和(或)CD38单抗耐药患者,ORR达26%,mPFS为3.7个月[51]。基于上述数据,2019年7月美国FDA批准SEL用于治疗既往接受过至少4线治疗,对至少2种PIs、至少2种IMiDs和CD38单抗五重耐药的RRMM患者。目前多项临床研究关注SEL联合其他靶向药物在RRMM患者中的疗效。在Ⅲ期BOSTON研究中,对于前期治疗线数为1 ~ 3线的复发或难治性MM患者,SEL联合Vd(硼替佐米、地塞米松)与Vd相比,可显著提高治疗缓解率,ORR分别为76%和62%,mPFS分别为13.9个月和9.5个月[52]。
3.3 肽偶联药
PDC是一种新型的靶向新药,结构包含细胞毒素、Linker及靶向多肽3个部分,治疗机制与ADC类似,通过可分解的Linker将多肽序列与细胞毒素偶联结合。Melphalan也称美氟芬,是一种靶向氨肽酶的PDC,将美法仑与靶向细胞内氨肽酶的多肽偶联在一起。氨肽酶在MM细胞中高表达。Melphalan为亲脂性,可被MM细胞迅速吸收,药物偶联肽被MM细胞中氨肽酶裂解,释放出亲水性烷化剂美法仑,杀伤MM细胞。Melphalan可提高美法仑在细胞内的浓度,在体外实验中Melphalan对MM细胞杀伤效率比美法仑高50倍。Ⅱ期HORIZON研究中共入组157例RRMM患者,其中119例(76%)为三重耐药,Melphalan联合地塞米松治疗ORR为29%,mPFS为4.2个月[53]。Melphalan联合地塞米松对前期重度治疗的RRMM患者治疗安全有效。Ⅱ期O-12-M1研究中,Melphalan联合地塞米松总缓解率达31%,mOS为20.7个月,使RRMM患者长期获益[54]。2021年2月Melphalan获美国FDA批准上市,与地塞米松联合,用于前期至少接受4线治疗,且对至少1种PI、1种IMiD和CD38单抗耐药的RRMM患者。Ⅲ期OCEAN研究现正在进行中,旨在RRMM患者中比较Melphalan联合Pd(泊马度胺与地塞米松)的疗效[55]。
4 结语
肿瘤的治疗经过放疗、传统化疗、手术等时代变迁,进入到靶向药物及免疫治疗时代,尤其以MM为代表的新药研发如火如荼。目前MM靶向新药领域已取得了令人瞩目的成果,但MM尚无法治愈,基础研究和临床实践领域许多难题仍有待解决。MM靶向新药包括新一代PIs、新一代IMiDs、激素联合(或不联合)CD38单抗的多药治疗方案已逐步成为MM治疗的基石。未来MM治疗领域更多新药,包括针对不同靶点的单克隆抗体、双克隆抗体、CAR-T免疫治疗、XPO-1抑制剂等也逐渐进入临床前及临床应用阶段,使更多的MM患者获益。除上述新药外,目前在研的针对不同治疗靶点的新药品种高达200余种,上述靶向新药通过不同的作用机制,具有更好的克服耐药的功效,期待更早能进入临床应用,提高患者疗效及预后,使MM成为一种可控、可治、可防的疾病,最终走向治愈!
