介质阻挡放电等离子体处理对大豆分离蛋白结构及凝胶特性的影响
2022-07-12周迎雪刘连杰张琳琳谭亦成李晓娟彭开锋刘志伟龚德力
周迎雪,刘连杰,张琳琳,谭亦成,李晓娟,彭开锋,刘志伟*,龚德力
1.湖南农业大学 食品科学技术学院,湖南 长沙 410128 2.株洲千金药业股份有限公司,湖南 株洲 412000 3.中国检验认证集团湖南有限公司,湖南 长沙 410128
蛋白质是构成细胞的基本物质和生命活动的主要承担者,在人们摄入的蛋白质中,大豆蛋白占20%以上,其所含氨基酸组分齐全,具有很高的营养价值[1]。除营养价值外,大豆蛋白具有多种功能特性,如凝胶性、乳化性、起泡性等,被广泛应用于食品加工中[2]。食品中蛋白的构成与结构直接决定其加工特性,进而影响食品的功能和品质。天然蛋白特定的分子结构使其在食品加工普适性方面具有一定的局限性[3]。借助不同技术手段改善天然蛋白的功能性是目前研究的热点,物理手段主要包括超高压、超声波、脉冲电场、辐照等,通过改变蛋白二级、三级结构,使肽链展开、疏水基团暴露,表面巯基含量增加,在疏水作用力和分子间二硫键共同作用下,促使蛋白质分子交联、聚集,进而改善蛋白的功能性[4]。
冷等离子体(cold plasma,CP)技术作为一种利用高能活性氧氮粒子(RONS)实现处理基质物性修饰的手段,已广泛应用于消毒杀菌、环境保护、材料改性等领域[5-6]。室温条件下,气体经高能电场电离产生多种活性粒子(O、O3、OH-、HO2、O2-、NO和ONOO),形成复杂的RONS等离子体氧化体系,RONS在气-水界面进一步反应,产生稳定的活性粒子(OH-、O3、NxOy、H2O2等)[7]。由一系列活性粒子介导的氧化,作用于食品基质,从而实现杀菌保鲜、大分子(蛋白、淀粉等)改性修饰和有害物质(重金属、农残和生物毒素等)消减等,因具有绿色、非热、快速、无化学残留等优点,使CP在食品加工领域极具应用前景。
近年来,研究者从结构修饰的角度研究了CP对蛋白功能性的改善,Bu等[8]报道通过CP(14.5 W±0.1 W,20 kHz)处理12 s使豌豆分离蛋白溶解性从23.9%增加到78.1%,乳化性从229.4 m2/g增加到685.1 m2/g;Liu等[9]研究发现,CP(40 kV,10~20 kHz)处理2 min使大豆球蛋白溶解性由(10.78±0.35)%增加至(65.96±1.86)%,乳化性由(21.08±2.64) m2/g增加至(160.29±4.12) m2/g;Qian等[10]发现使用等离子活化水(处理100 s)制备鸡肌纤维蛋白凝胶,其持水性从48.78%(未处理)增加到54.95%。这些研究表明CP能显著改善豌豆、大豆分离蛋白的凝胶性、乳化性及乳化稳定性。介质阻挡放电(dielectric barrier discharge,DBD)是一种常见的低温等离子体发生方式,由介电材料覆盖在两个金属电极上,通过外部供给能源使电极间的气体电离形成等离子体。作者以大豆分离蛋白(soybean protein isolated,SPI)为原料,以DBD等离子体技术处理SPI为切入点,对SPI的pH值、游离巯基和羰基含量进行分析,采用凝胶电泳、光谱、质构及扫描电镜等方法,探究BDB等离子体处理对SPI 结构及凝胶特性的影响。
1 材料与方法
1.1 材料与试剂
大豆:长沙当地超市;SDS-PAGE凝胶配制试剂盒:上海碧云天生物技术有限公司;8-苯胺-1-萘、磺酸、5,5-二硫代双(2-硝基苯甲酸)(DTNB):阿拉丁化工有限公司(中国上海);2,4-二硝基苯肼、盐酸胍、甘氨酸、乙酸乙酯:国药集团化学试剂有限公司;分子量指示Marker:索莱宝科技(中国上海);其他试剂均为分析纯。
1.2 仪器与设备
CTP-2000 K等离子体装置:南京苏门电子有限公司;LeiCiPHS-3C pH仪:中国东夷有限公司;Wix-multipro 2垂直凝胶电泳装置:威克斯科技有限公司;UV-1800紫外分光光度计、F-7000荧光分光光度计:日本岛津;Nano-zs 90纳米粒度仪、Kinexus旋转流变仪:英国Malvern 仪器有限公司;EM-30 plus扫描电子显微镜平台:韩国COXEM。
1.3 方法
1.3.1 SPI提取与纯化
大豆超微粉碎,过70目筛,用正己烷脱脂。脱脂豆粕以料液比1∶ 10(g/mL)分散于去离子水中,用2 mol/L NaOH调节pH值至8.0,室温下磁力搅拌2~4 h,离心(10 000g,30 min,4 ℃),得到的上清液用2 mol/L HCl调节pH值至4.5,离心(4 500 r/min,15 min,4 ℃),去离子水洗涤沉淀3次,少量去离子水溶解沉淀,用2 mol/L NaOH调节pH值至7.0,离心后将上清液置于培养皿中冷冻24 h,真空冷冻干燥12 h,得到SPI成品。
1.3.2 DBD等离子体处理
将SPI按质量比1∶ 10分散于去离子水中,室温搅拌30 min,充分水化。将SPI样品(5 mL)装入石英容器,40 kV、12 kHz下DBD等离子体处理20、40、60、120 s,然后用2 mol/L NaOH调pH值至7.0,4 ℃储存备用。用Bradford法测定蛋白质浓度(y=7.18x-0.002 5,R2=0.999),用蒸馏水将样品稀释至2 mg/mL。
1.3.3 制备凝胶
取10 mL SPI 样品溶液(质量比10%,pH 7.0),置于20 mL玻璃瓶中(dm=30 mm),瓶盖密封,在90 ℃水浴锅中加热30 min,冷却至室温,在4 ℃冰箱中储存24 h,测试前在室温环境中静置1 h平衡温度。
1.3.4 大豆分离蛋白理化特性及结构分析
1.3.4.1 羰基含量、游离巯基含量、内源荧光光谱、紫外/可见光谱
羰基含量测定:0.5 mL SPI溶液(2 mg/mL)与 0.5 mL 2 mol/L HCl(含有10 mmol/L 2,4-二硝基苯肼)混合,25 ℃水浴40 min。另取0.5 mL SPI溶液(2 mg/mL)与0.5 mL 2 mol/L HCl(不含2,4-二硝基苯肼)混合,25 ℃水浴40 min,作为空白对照。每个试管中加入0.5 mL 20%的三氯乙酸,振荡混匀后静置 10 min,离心(12 000 r/min,5 min,10 ℃)。弃去上清液,用1.0 mL乙醇-乙酸乙酯溶液(1∶ 1,V/V)洗涤沉淀3次后,用1.0 mL 6 mol/L盐酸胍溶液溶解蛋白,37 ℃水浴30 min。用分光光度计于370 nm测定吸光度,用盐酸胍溶液调零。
羰基含量(μmol/g)=(A1-A2)×V2/(εdC1V1),
式中:A1为样品吸光度;A2为空白对照吸光度;V2为最终体积,1 mL;ε为消光系数,22 000(mol/L)-1cm-1;d为比色皿厚度,1 cm;C1为蛋白质量浓度,2 mg/mL;V1为样品体积,0.5 mL。
游离巯基含量测定:试管中加入0.5 mL SPI溶液(2 mg/mL),加入2 mL Tris-glycine缓冲液(86 mmol/L Tris、90 mmol/L 甘氨酸、4 mmol/L EDTA,pH 8.0),加入0.02 mL Ellman试剂(含有4 mg/mL DTNB的Tris-glycine缓冲液)。另取试管加入0.5 mL SPI溶液(2 mg/mL),加入2.0 mL Tris-glycine缓冲液,做空白对照。振荡混匀后于25 ℃水浴30 min。用Tris-glycine缓冲液在412 nm调零。
游离巯基含量(μmol/g)=75.53(A1-A2)×n/C,
式中:A1为样品吸光度;A2为空白对照吸光度;n为稀释倍数;C为样品质量浓度,2 mg/mL。
内源荧光光谱测定:使用0.1 mol/L磷酸缓冲液(pH 7.0)将SPI样品(2 mg/mL)稀释至0.1 mg/mL。激发波长280 nm,激发和发射狭缝宽度2.5 nm,发射波长300~400 nm。
紫外/可见光谱测定:使用0.1 mol/L磷酸缓冲液(pH 7.0)将SPI样品(2 mg/mL)稀释至0.1 mg/mL。在190~400 nm进行扫描(用磷酸缓冲液扫描基线并调零)。
1.3.4.2 SDS-PAGE凝胶电泳
于0.5 mL离心管中加入80 μL SPI样品(1 mg/mL)和20 μL还原型上样缓冲液,振荡混匀后,在 90 ℃金属加热器中加热10 min。凝胶电泳参数:上样量10 μL,电压75 V,时间1 h,染色40 min。过夜脱色,拍照。
1.3.4.3 傅里叶红外光谱
将制备的SPI凝胶冷冻干燥24 h得样品粉末,溴化钾于烘箱105 ℃烘3 d,样品粉末与溴化钾粉末按质量比1∶ 100加入坩埚研磨,压片。使用傅里叶红外光谱仪进行全波段扫描(400~4 000 cm-1),分辨率4 cm-1。采用Peakfit 4.12软件,高斯曲线拟合方法拟合二级结构特征峰,分析SPI各二级结构的含量。
1.3.5 大豆分离蛋白凝胶特性表征
1.3.5.1 动态流变学分析
采用动态流变仪测定,平板直径60 mm,间距1 mm,频率1 Hz,应变1%,温度以5 ℃/min从25 ℃升至90 ℃,保持30 min,然后以5 ℃/min降至25 ℃,测量时样品表面覆盖3-甲基硅油,防止测试过程中水分蒸发,记录弹性模量(G′)和损耗模量(G″)。
1.3.5.2 质构分析
采用TPA模式对制备的SPI凝胶进行测定,具体参数:P/0.5型号探头;测前速度1.0 mm/s,测试速度0.5 mm/s,测后速度1 mm/s;压缩深度5 mm;触发力5.0 g。
1.3.5.3 扫描电镜
取制备的SPI凝胶,先用2.5%戊二醛固定5 h,然后使用30%、50%、70%、80%、95%、100%的乙醇分别梯度洗脱15 min后,用醋酸异戊酯溶液(V(乙醇)∶V(醋酸异戊酯)=1∶ 1)洗脱20 min,冷冻干燥24 h,干燥后的样品喷金处理,观察。
1.4 数据处理与分析
所有数据采用单因素方差分析法(ANOAN)进行显著性分析,并以平均值±标准差表示,使用Origin 2019作图。
2 结果与分析
2.1 DBD等离子体处理对SPI的pH值、羰基和游离巯基含量的影响
DBD等离子体不同处理时间对SPI的pH值、羰基和游离巯基含量的影响见图1。由图1a可知,DBD等离子体处理20 s后,SPI的pH值从6.80±0.09下降为6.60±0.06,该结果与Ekezie等[11]的研究结果一致,其发现经大气压等离子处理10 min后的肌纤维蛋白溶液pH值从6.77±0.02下降至6.07±0.02。DBD等离子体处理过程中溶液pH值的降低是由于等离子体电离空气产生的高能活性粒子(·OH(羟基自由基)、·O2-(超氧阴离子)、O3和H2O2等)与水发生一系列化学反应导致。具体包括:(1)O3、·O、HO2·将NO氧化成·NO2,接着·OH和·NO2反应生成HNO3和HNO2;(2)H2O与H2O2反应产生酸性H3O+[12]。

注:图中不同小写字母表示差异显著(P<0.05)。图1 DBD等离子体不同处理时间对SPI的pH值、羰基和游离巯基含量的影响Fig.1 Effect of DBD plasma treatment on pH value, carbonyls and free sulfhydryl (—SH) content of SPI with different treatment time
羰基是氨基酸氧化中间产物,也是衡量蛋白氧化程度的重要指标。由图1b可知,羰基含量呈阶段性增加,首先从(2.39±0.09) μmol/g(未处理)增加到(3.41±0.50) μmol/g(40 s),最后增加到(4.36±0.16) μmol/g(120 s),并且20~60 s羰基含量变化不显著,表明DBD等离子体处理对蛋白产生弱氧化作用,处理时间延长(120 s),对蛋白产生强氧化作用,该结果与赵冰等[13]探究H2O2氧化作用对肌原纤维蛋白羰基的影响结论一致。
由图1c可知,游离巯基含量从(4.49±0.13) μmol/g(未处理)下降到(3.86±0.09) μmol/g(20 s),随后下降到(3. 25±0.04) μmol/g(40 s),与沈鹏辉等[14]探究不同浓度丙二醛逐级氧化对大豆分离蛋白巯基影响的结果相一致。另外,随着DBD等离子体处理时间延长,游离巯基含量在 40~120 s下降不显著,表明弱氧化作用对游离巯基的影响在处理40 s时已达到最大,进一步延长处理时间不对其含量产生影响。
2.2 DBD等离子体处理对SPI结构的影响
2.2.1 对SPI一级结构的影响
SPI的主要成分为β-伴大豆球蛋白(7 S)和大豆球蛋白(11 S),其中7 S由α′(71 kDa)、α(67 kDa)和β(50 kDa)亚基组成,11 S 由酸性亚基(37 kDa)和碱性亚基(20 kDa)组成[15]。通过聚丙烯蛋白凝胶电泳研究DBD等离子体处理对SPI一级结构的影响,结果如图2所示,处理与未处理样品都显示了SPI的5个特征条带,且条带强度无明显差异,表明DBD等离子体处理对SPI一级结构未造成显著影响。
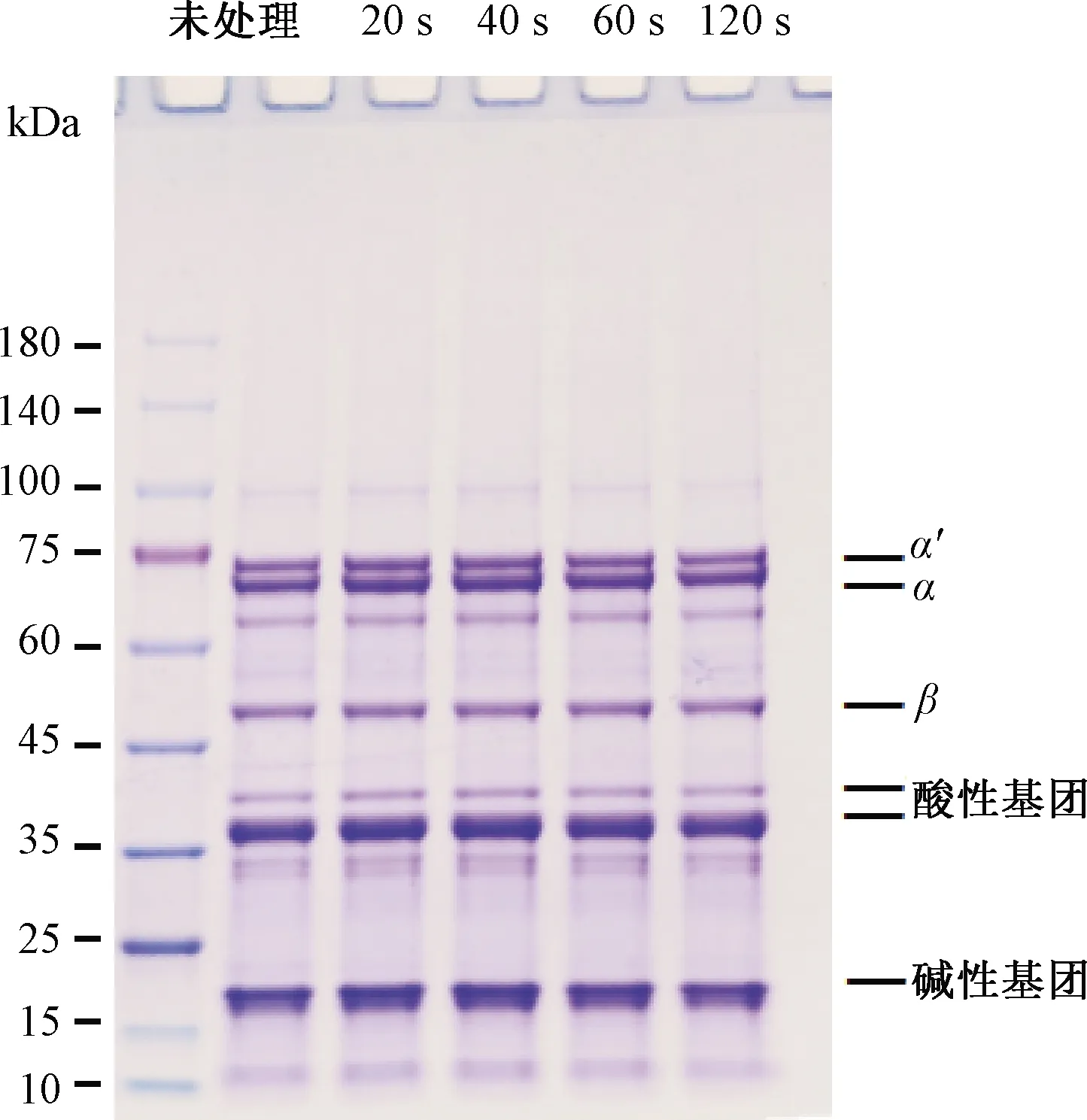
图2 DBD等离子体不同处理时间SPI 凝胶的电泳图谱Fig.2 SDS-PAGE of SPI gel with different treatment time of DBD plasma
2.2.2 对SPI二级结构的影响
通过傅里叶红外光谱(酰胺Ⅰ带(1 600~1 700 cm-1))研究了DBD等离子体处理对SPI二级结构的影响。如图3a所示,未处理样品与处理不同时间的样品峰值无显著差异。如图3b所示,未处理样品的α-螺旋25.74%、β-转角18.17%、β-折叠30.65%、无规卷曲25.44%,处理20~60 s的样品各结构含量无显著变化,表明DBD等离子体弱氧化作用下未对SPI的二级结构产生影响。与未处理样品相比,处理120 s后的SPI样品α-螺旋含量减少至20.41%,β-折叠相应地增加至41.07%,β-转角与无规卷曲无显著变化。该结果与Ji等[16]研究DBD等离子体处理4 min花生分离蛋白二级结构变化趋势一致。本研究中SPI二级结构改变可能是由于CP强氧化作用下形成的活性粒子将氨基酸侧链的NH—和NH2—氧化,导致氨基酸残基间氢键被破坏,最终影响二级结构含量。
2.2.3 对SPI三级结构的影响
荧光和紫外/可见光谱可用于表征SPI的三级结构变化。激发波长为290 nm时,荧光由蛋白内源色氨酸残基发射,蛋白质发生折叠或展开,荧光强度随之变化[17]。如图4a可知,未处理和处理后样品荧光发射峰最大吸收波长(λmax)均为335 nm,样品荧光强度随处理时间延长而下降,120 s时下降最为显著,荧光强度下降未伴随λmax蓝移红移等现象,是由于DBD等离子体处理破坏了蛋白结构,色氨酸微环境极性改变。由图4b可知,天然SPI在260~280 nm有色氨酸和酪氨酸残基的强吸收峰,该范围内样品紫外吸收强度随处理时间延长而增加,同样表明氨基酸微环境极性改变[18]。这些变化表明DBD等离子体处理对蛋白三级结构产生影响,且与Liu等[9]研究等离子体处理对大豆球蛋白三级结构影响变化趋势相同。

图3 DBD等离子体不同处理时间对SPI样品二级结构的影响Fig.3 Effect of DBD plasma treatment on secondary structure of SPI samples with different treatment time

图4 DBD等离子体不同处理时间对SPI样品三级结构的影响Fig.4 Effect of DBD plasma treatment on tertiary structure of SPI samples with different treatment time
蛋白的功能特性取决于蛋白结构。Deutsch等[19]研究表明,二硫键是影响蛋白质胶凝能力的主要因素,蛋白分子间二硫键所形成的三维网状结构,可以改善蛋白的凝胶强度及保水性。Dong等[20]发现玉米醇溶蛋白经等离子体处理2 min后二硫键含量增加0.78倍,游离巯基含量下降50%,其内在原因为CP活性粒子将游离巯基(—SH)氧化为硫自由基(—S·),高能硫自由基(—S·)不稳定易形成分子间/分子内的二硫键(—S—S—),从而导致—SH减少,—S—S—增加。本研究中DBD等离子体处理40 s游离巯基含量显著下降,凝胶性能达到最佳,并且SPI一级和二级结构无显著变化,因此可以推测在弱氧化作用下,SPI凝胶特性的改善主要由于DBD等离子体活性粒子氧化游离巯基为硫自由基,促进分子间二硫键的生成,从而使SPI凝胶强度显著增加。随着处理时间的延长(120 s),DBD等离子体的强氧化作用导致二硫键进一步氧化为亚磺酸和磺酸,从而导致SPI凝胶微观结构的改变和强度的下降。
2.3 凝胶性能表征
2.3.1 DBD等离子体处理对SPI凝胶微观结构的影响
通过扫描电镜(SEM)观察SPI凝胶的微观结构,如图5所示,未处理SPI凝胶三维立体结构不连续、孔洞不均匀;DBD等离子体处理20~60 s,SPI凝胶均呈现连续、规整的片状三维立体结构;处理120 s,SPI凝胶片状结构消失,孔隙较为规整。表明DBD等离子体处理20~60 s对SPI凝胶性能改良效果最显著,处理时间超过60 s凝胶性能有所提升但效果不明显。结合DBD等离子体处理对SPI溶液羰基影响可知,DBD等离子体弱氧化作用可改善SPI凝胶性,强氧化作用使改良效果下降。

注:a为未处理;b—e分别是DBD等离子体处理20、40、60、120 s制备的SPI凝胶。图5 SPI凝胶的扫描电镜图Fig.5 SEM characterization of SPI gel
2.3.2 DBD等离子体处理对SPI凝胶性能参数的影响
使用质构仪对SPI凝胶的硬度、黏附度、内聚性和回复性等指标进行测定,结果见表1。与未处理样品相比,DBD等离子体处理40 s SPI凝胶的硬度、内聚性和回复性达到最大,分别为(441.37±15.59) g、0.540±0.001、0.046±0.002,黏附度降至最小,为-482.91±17.91,其中硬度、黏附度较未处理样品增加2.63倍和5.98倍;DBD等离子体处理120 s凝胶各参数的变化幅度小于40 s的,与扫描电镜结果一致,表明DBD等离子体处理时间大于40 s,强氧化作用使SPI凝胶的强度降低。

表1 DBD等离子体不同处理时间对SPI凝胶参数的影响Table 1 Effect of DBD plasama treatment on textural properties of SPI gel with different treatment time

注:a为弹性模量(G′);b为黏性模量(G″);c为未处理SPI溶液的流变特性;d为DBD等离子体处理40 s SPI溶液的流变特性。图6 DBD等离子体不同处理时间对SPI样品流变特性影响Fig.6 Effect of DBD plasma treatment on rheological characteristics of SPI samples with different treatment time
2.3.3 DBD等离子体处理对SPI流变性能的影响
由图6a、6b可知,不同处理条件下SPI样品的G′与G″变化趋势相同,先缓慢下降后急剧上升,900 s以后上升幅度减缓。这是因为升温初期蛋白质分子的氢键和静电相互作用减少,溶液黏度降低;进一步升温样品发生相变,溶液转变为弱凝胶,G′与G″显著增加[21]。恒温与降温阶段,凝胶三维立体结构初步形成,G′与G″缓慢增加[22]。升温、恒温阶段经CP处理样品的G′与G″均高于未处理样品的,表明CP处理可增加样品弹性与黏性,处理40 s的SPI样品相同时间点数值最高,说明DBD等离子体处理40 s对凝胶性改良效果最佳,该结果与DBD等离子体处理对SPI凝胶性能参数影响的结果一致。图6c、6d中,G′与G″曲线交点为凝胶相变点,其所对应的温度为凝胶形成温度。比较未处理和处理40 s样品相变点对应温度,发现CP处理降低了SPI溶液相变最低温度,该现象与Zhang等[23]的研究结果一致,CP处理显著改善豌豆分离蛋白凝胶性的同时降低了其热凝胶形成温度。处理120 s的SPI样品G′与G″曲线低于其余处理样品,高于未处理样品,表明DBD等离子体处理带来的强氧化作用可改善SPI凝胶性能,但改良效果小于弱氧化作用的影响。
3 结论
本研究表明,DBD等离子体活性粒子介导的氧化作用对SPI结构的修饰显著改善了SPI的凝胶特性。在弱氧化作用下(处理40 s),自由巯基氧化为硫自由基,分子间二硫键的生成使凝胶形成稳固的三维网状结构,这是SPI凝胶性改善的主要原因。进一步延长处理时间(强氧化),导致二硫键的部分氧化,从而使SPI凝胶强度降低。关于低温等离子体在蛋白功能性改善方面所涉及的活性离子对蛋白关键结构和关键基团的修饰,以及在处理过程中的动态变化还有待深入研究。另外,控制低温等离子体处理参数和条件,避免蛋白的过度氧化对其功能特性产生不利影响也十分关键。
