内脏脂肪在肺癌中的研究进展
2022-07-11李岳航王愿李义帅赵敏
李岳航 王愿 李义帅 赵敏
1河北大学附属医院(河北保定071000);河北省胸科医院2肿瘤二科,3胸三科(石家庄050000)
肺癌的发病率逐渐上升,在男性肿瘤的发病率中高居第一位,在女性肿瘤的发病率中位居第二位[1]。虽然手术、放疗、化疗、靶向治疗、免疫疗法等综合治疗的应用改善了肺癌患者的临床预后,但在我国肺癌的死亡率仍居第一位[2]。发生肺癌的危险因素主要与吸烟、石棉、铅、铜、砷、多环芳烃、遗传因素、肺部疾病和饮食习惯等相关[3]。随着过去几十年人类生活方式和饮食的巨大变化,肥胖已被视为影响人类健康的主要问题之一,据报道肥胖已成为各种癌症的危险因素之一[4]。有研究表明,肥胖与肺癌的发生发展密切相关,主要与肥胖导致的脂肪因子分泌失衡、胰岛素抵抗、高血糖等代谢紊乱有关[5]。传统的肥胖评估方式主要是基于体质量指数(BMI),具有相同BMI 的个体可能具有不同数量的体脂和内脏脂肪[6]。与BMI 相比,内脏脂肪能更加准确的反应患者脂肪的分布情况[7]。内脏脂肪与包括肺癌在内的多种类型肿瘤的发生发展密切相关[6]。为达到肺癌初级预防和进一步提高肺癌治疗疗效的目的,本文首次就内脏脂肪的测量方法,内脏脂肪与肺癌发生风险之间的相关性,及其在肺癌发生发展、临床预后评估和临床治疗中的作用和机制综述如下。
1 内脏脂肪定义及其与肿瘤的关系
脂肪组织按照解剖学定义进行划分,包括皮下脂肪组织、腹膜内脂肪组织和腹膜后脂肪组织,后两者统称为内脏脂肪组织。内脏脂肪组织主要位于肝脏、胃和肠等多个器官附近,并且可以在动脉中积聚。内脏脂肪细胞具有更高的代谢活性,可产生不同的脂肪因子,导致代谢性疾病的发生[8-9]。一旦脂肪因子分泌失衡,将导致机体细胞赖以生存的微环境稳态被打破,从而促进肿瘤的发生发展[10]。但是内脏脂肪的准确测量方法是一难题。
2 内脏脂肪测量方法
2.1 人体测量指标 人体测量学指标因其成本低、安全性好、易于使用以及适用于所有体型而被广泛用于临床和大规模流行病学研究。主要包括腰围(waist circumference,WC)、腰臀比(waist to hip ratio,WHR)、颈围(neck circumference,NC)、内脏肥胖指数(visceral adiposity index,VAI)。
2.1.1 腰围(waist circumference,WC) WC 是衡量腹部肥胖最直接的指标。但是最佳方案尚无共识,目前最常用的方案是两侧髂嵴测量法和最后一根肋骨和髂嵴之间的中点测量法[11]。
2.1.2 腰臀比(waist to hip ratio,WHR) WHR
是在测量WC 的基础上与臀围之比,臀围的测量方法是在两侧大转子最宽处围绕一周[12]。
2.1.3 颈围(neck circumference,NC) 有研究表明NC 可以作为中国人群内脏肥胖的独立指标[13],颈围最常用的测量方法是在喉结下方绕颈一周[14]。
2.1.4 内脏肥胖指数(visceral adiposity index,VAI) VAI 是根据WC、BMI、甘油三酯(TG)和高密度脂蛋白胆固醇(HDL)来计算内脏脂肪堆积面积,其中男性VAI=[WC/39.68+(1.88×BMI)]×(TG/1.03)×(1.31/HDL),女性VAI =[WC/36.58 +(1.89×BMI)]×(TG/0.81)×(1.52/HDL)[15]。最近在此基础上开发了中国内脏肥胖指数(Chinese visceral adiposity index,CVAI),但目前有关CVAI 在肿瘤方面尚无报道。
人体测量指标的局限性主要受种族、性别、体型等方面的影响。即便是VAI,也是一种基于简单的人体测量和功能参数的经验性数学模型[16]。
2.2 生物电阻抗分析 生物电阻抗分析是一种非常流行的身体成分评估方法,其基本原理是低压电流通过人体的传输时间,用腹部横截面总面积减去皮下脂肪组织与非脂肪成分组织间接计算出内脏脂肪[17]。生物电阻抗分析的优点是无创和低成本,但是其准确性和临床价值存在质疑[18]。
2.3 基于CT 的腹部内脏脂肪面积 对于内脏脂肪的测定,目前应用最为广泛的是腹部CT 检查,多采用的是第3 腰椎层面或脐平面一定CT 值范围内(-190 ~-30 HU)的腹部内脏脂肪面积(visceralfatarea,VFA),也有研究计算腹部VFA 与皮下脂肪面积(subcutaneous fat area,SFA)比(VFA/SFA)评估腹部内脏脂肪情况。目前使用比较广泛的标准为VFA ≥100 m2,或者是VFA/SFA ≥0.4[19-20]。但是日本学者有研究提出VFA/SFA 分界值男性为1.33,女性为0.94[21]。二者不同的分界值可能与研究中纳入的人群不同有关。
3 高内脏脂肪与肺癌发生风险的相关性
目前大多数研究表明内脏脂肪高(即内脏肥胖)的人群具有较大的肺癌发生风险,一项来自鹿特丹的前瞻性研究中,利用Cox 回归分析了9 689例参与者的人体测量学指标,在平均13.2年的随访期内,有319 例患者发生肺癌,其中WHR 和WC的结果分别为HR= 1.23(95%CI:1.09 ~1.38)和HR=1.03(95%CI:1.01 ~1.05),该结果表明内脏肥胖与肺癌的发生正相关[22]。但是其数据均来自荷兰人群,存在选择偏倚,另外随访时间较长,导致其他变量的变化在一定程度上对结果产生影响。韩国的队列研究对2 290万韩国成年人进行了为期7年的前瞻性研究,分析了WC 与23 种实体瘤之间的关系,期间有769 871 例患癌症病例,其中肺癌病例有72 133 例,在控制了混杂因素的影响后结果显示内脏肥胖增加了包括肺癌(P<0.001)在内的18 种实体瘤的患病风险[23]。另一项涵盖美国人、欧洲人和亚洲人群的平均随访周期为12年的队列研究,纳入160 万人,有23 732 例参与者患肺癌,在控制其他变量的干扰后显示,罹患肺癌的风险随着WC 或WHR 的增加而增加,这一结果亦支持内脏肥胖与肺癌的发生呈正相关[24]。HIDAYAT等[25]在PubMed 和Web of Science 数据库进行了检索,纳入6 项人群均为女性的研究,荟萃分析结果显示内脏肥胖与发生肺癌的风险呈正相关,其中WC 每增加10 cm,WHR 每增加0.1 个单位,患肺癌的风险分别增加10%和5%。
BETHEA 等[26]研究显示在控制混杂变量后,WHR 和WC 与肺癌的发病率无显著相关性,但是该研究所纳入的病例数较少(n= 59 000)、纳入的人群只有非裔美国女性、WC 和WHR 数据的获取皆为纳入病例人员的自我测量,并且相关数据资料不完整。
4 内脏脂肪和肺癌进展的关系
肥胖与多种恶性肿瘤的发生发展有关,内脏脂肪细胞堆积致使内脏肥胖,从而引起胰岛素抵抗[27],胰岛素抵抗可使机体胰岛素水平升高,高胰岛素血症在癌症的发生发展中发挥重要作用,包括促进肿瘤细胞的生长、抗凋亡、侵袭和转移等,涉及到的主要信号传导通路有PI3K/Akt/mTOR 和Ras/Raf-1/MEK/Erk 等[28]。在一项肥胖与肺癌进展关系的研究中[29],研究人员给正常喂养组小鼠和饮食诱导的肥胖组小鼠接种Lewis 肺癌细胞,监测肿瘤细胞增殖及肿瘤负荷,结果发现肥胖小鼠肿瘤细胞增殖更快,肿瘤负荷增加,研究人员推测肥胖促进肿瘤进展的潜在机制可能与免疫相关IL-6/JAK/STAT3 信号通路中的基因表达显著降低有关。
5 内脏脂肪与肺癌治疗疗效的关系
5.1 内脏脂肪对肺癌术后生存的影响 内脏脂肪与肺癌患者术后的生存密切相关。BARBI 等[29]在一项回顾性临床研究发现在513 例早期非小细胞肺癌切除术后的患者中,内脏脂肪的增加与总生存率的降低显著相关。有研究也揭示了内脏脂肪是肺癌患者的不良预后因素之一[30-31]。梁皓等[32]研究发现内脏肥胖患者在接受肺切除术后的死亡率要高于非肥胖组,而且更容易发生肺栓塞、脑血管意外、心律失常、肾功能衰竭等,严重影响患者预后,总生存率降低。FERGUSON 等[33]发现形态学指数是肺癌切除术后生存的独立预测因子,而形态学指数包括内脏脂肪面积、肌肉面积和骨密度,该指数与肺癌切除术后患者的长期生存率显著相关,形态指数评分(内脏脂肪面积、骨小梁密度和背肌群面积的形态指数值相加,得出形态指数评分)越高,患者死亡率越高,总生存率降低。所以,高内脏脂肪含量有可能导致术后并发症增多,术后恢复慢,影响患者预后。因此,术前有效减少肺癌患者内脏脂肪含量,指导患者饮食,及时干预,对改善肺癌术后预后有重要意义。
5.2 内脏脂肪与化疗及预后的关系 高内脏脂肪的肿瘤患者对化疗的耐受性好,不良事件发生率较低,可以改善患者的临床预后。TRAN 等[34]回顾性研究分析375 例接受化疗的晚期结直肠癌患者,发现肥胖患者化疗时间显著长于体质量正常患者,分别为12.1 个月对比5.4 个月,总生存更佳,分别为20.7 个月对比15.7 个月,可能的原因是内脏肥胖者能量储备足,化疗耐受性好,从而改善生存。KASHIWABARA 等[35]回顾性分析结果显示在接受化疗的非小细胞肺癌患者中,肥胖患者倾向于产生较少的药物相关毒性,因化疗不良事件而导致治疗中止的发生率降低。
5.3 内脏脂肪与驱动基因阳性肺癌患者的相关性 驱动基因阳性非小细胞肺癌的靶向治疗提高了患者的生存。非小细胞肺癌的驱动基因包括EGFR、ALK、Ros-1 和HER2 等。KIM 等[36]为了评估性别、肥胖与EGFR 突变阳性率在肺癌中的相关性,对1 378 例肺腺癌病例进行了回顾性研究,结果显示在男性中,EGFR 突变的发生率与肥胖呈正相关,而女性中无明显相关性。内脏脂肪的增加,可能促进男性肺腺癌EGFR 基因突变。目前未见到内脏脂肪与肺癌靶向治疗疗效的相关性研究。
5.4 内脏脂肪与免疫治疗的关系 免疫治疗在肺癌的治疗中发挥着重要作用。内脏脂肪增加会影响免疫系统,进而影响免疫治疗效果,有研究表明,肥胖可能会对肿瘤患者的免疫治疗反应和生存产生影响。CORTELLINI 等[37]为探究肥胖与癌症患者免疫检查点抑制剂的疗效之间的相关性,对接受PD-1/PD-L1 抑制剂治疗的晚期非小细胞肺癌、黑色素瘤和肾细胞癌等患者进行了一项回顾性研究,结果显示高内脏脂肪组患者的客观缓解率(objective response rate,ORR)高于对照组,高内脏脂肪组患者免疫不良事件发生率明显高于对照组,单因素和多因素Cox 回归分析显示高内脏脂肪组患者的中位治疗失败时间(time to Treatment Failure,TTF)、无进展生存期(progression Free Survival,PFS)、总生存期(overall survival,OS)均比对照组显著延长。研究结果提示高内脏脂肪可能增强非小细胞肺癌、黑色素瘤和肾细胞癌免疫治疗的敏感性,以改善患者的临床预后,但也增加了免疫相关不良事件的发生[37]。CORTELLINI 等[38]也研究了帕博利珠单抗治疗PD-L1 表达≥50%的非小细胞肺癌患者与肥胖之间的关系,与体质量正常组相比,肥胖组的ORR、PFS 和OS 显著改善。KICHENADASSE 等[39]研究显示肥胖增强了阿特利珠单抗在肥胖相关的非小细胞肺癌患者的疗效,使接受阿特利珠单抗治疗的晚期非小细胞肺癌患者的总生存期得到改善。有关高内脏脂肪与肺癌治疗模式见图1。
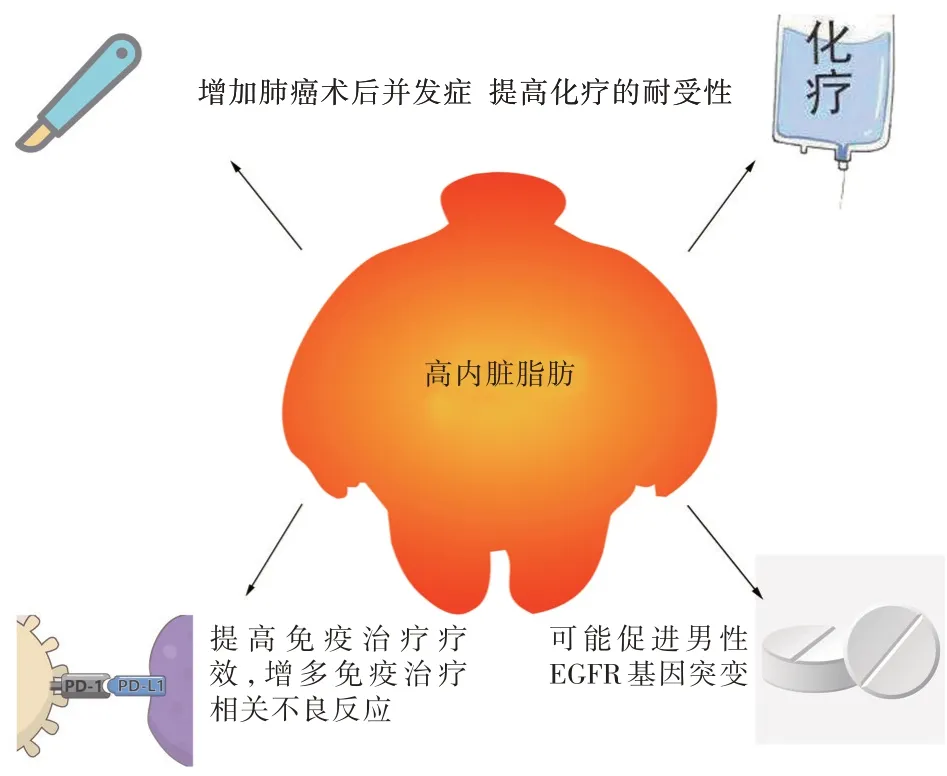
图1 高内脏脂肪对肺癌治疗的影响Fig.1 The effect of high visceral fat on the treatment of lung cancer
6 内脏脂肪与肺癌发生发展及预后的机制研究
6.1 炎症 目前研究发现[40]肥胖导致的慢性炎症是癌症发生发展的主要因素之一,肥胖致使各种炎症因子分泌增加,从而引发炎症反应。内脏脂肪细胞分泌各种促炎细胞因子,如白介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、单核细胞趋化蛋白-1(MCP-1)等[41]。IL-6 可以促进细胞存活、增殖、转移和血管生成,而这种作用离不开IL-6/STAT3 和NF-κB 信号传导通路的参与[42]。HAN等[43]研究发现TNF-α介导的肺部炎症可以上调肺腺癌中SOD-2 的表达,而SOD-2 是一种位于线粒体中的抗氧化酶,在肿瘤进展中起着关键作用。单核细胞趋化蛋白-1(MCP-1)是一种能够招募单核细胞、记忆T细胞和树突状细胞的炎症介质,与CC趋化因子受体2 结合可以增加非小细胞肺癌的癌细胞中转移基因的表达,最终促进癌细胞的侵袭潜力[44]。见图2。

图2 肥胖导致的慢性炎症促进癌症发生发展Fig.2 Chronic inflammation caused by obesity promotes the development of cancer
6.2 脂肪因子 脂肪组织最主要的细胞是脂肪细胞,脂肪细胞产生的物质统称为脂肪因子,参与调节糖脂代谢、胰岛素敏感性、能量平衡、炎症、免疫、血管功能或凝血等过程。脂肪因子与肿瘤的发生发展关系密切,并且种类繁多,主要包括脂联素、瘦素、雌激素和抵抗素等,在这些因子中,以脂联素、瘦素和雌激素的研究最为深入[45]。
6.2.1 脂联素 脂联素是唯一一种对健康和疾病有益的脂肪细胞分泌的蛋白,在正常情况下脂联素与其受体结合后可激活下游信号传导通路来发挥抗炎、促凋亡和抗增殖的作用[46]。脂联素发挥抑制细胞生长的主要机制可能是使细胞周期中G1/G0 期的细胞数量增多和诱导细胞凋亡,脂联素可以降低细胞周期蛋白D1 和E2 的表达并抑制细胞增殖,还可通过STK11/LKB1 通路诱导肿瘤抑制因子AMPK 的活化[45,47-48]。NIGRO 等[49]研究表明肺癌患者中的脂联素表达水平显著降低。脂联素与肺癌预后相关,WANG 等[50]研究表明脂联素基因的表达水平与非小细胞肺癌患者的预后相关,低表达者比高表达者的预后差。
6.2.2 瘦素 瘦素亦与多种肿瘤关系密切,在XI等[45]的研究中指出瘦素会增加肥胖相关癌症的风险,尤其是性激素依赖性肿瘤,如乳腺癌、子宫内膜癌和卵巢癌,但瘦素与肺癌的具体关系尚存在争议[51-52],产生不一致的结果原因可能与纳入的人群性别、年龄、种族和体型等其他因素的影响有关。
6.2.3 雌激素 雌激素与肺癌的发生发展相关[53]。雌激素有三种受体,雌激素受体α(ERα)、雌激素受体β(ERβ)和G蛋白偶联雌激素受体(GPER)[54],在肺腺癌中,以ERβ 为主[55]。最新的研究发现雌激素与ERβ 结合后可以上调TLR4 并激活其下游信号轴myd88/NF-κB/MMP2 来促进非小细胞肺癌的转移[56]。ERβ 与肺腺癌的预后相关,MENG等[57]荟萃分析结果显示ERβ 蛋白的高表达与肺腺癌的不良预后相关。有关脂肪因子与肿瘤的发生发展见图3。
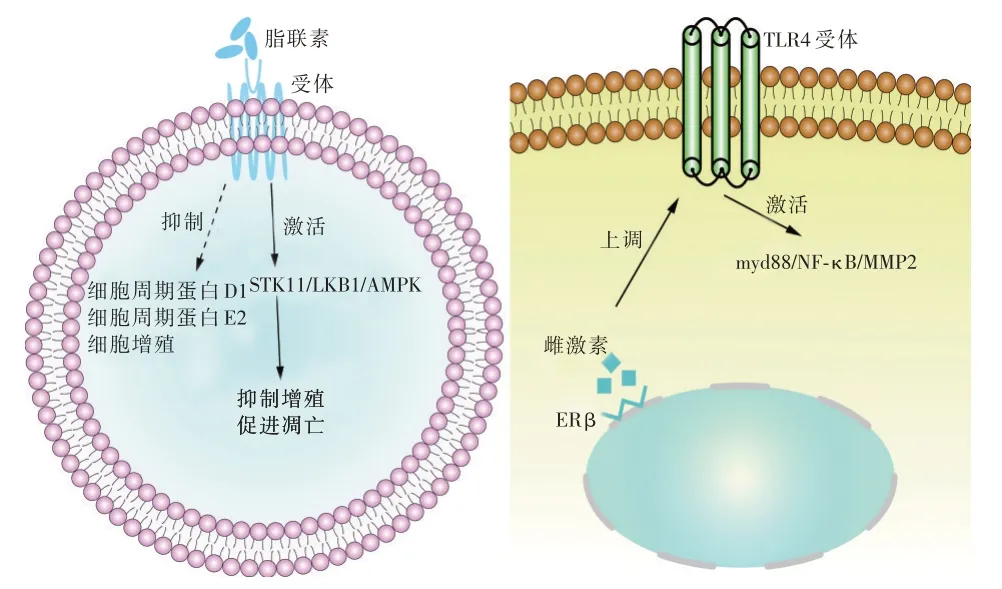
图3 脂肪因子与肿瘤的发生发展关系密切Fig.3 Adipokines are closely related to the occurrence and development of tumors
6.3 代谢紊乱微环境 内脏脂肪细胞的增多致使内脏肥胖,从而引起胰岛素抵抗和游离脂肪酸分泌增多[27],这些代谢紊乱与肿瘤发生发展密切相关[28,58-59],机制可能是肥胖患者的脂肪因子分泌增加创造了一个有利于肿瘤细胞运动、侵袭和转移的微环境[60]。另外,胰岛素抵抗可使机体胰岛素水平升高,产生高胰岛素血症。胰岛素作为一种有利于癌症发展的生长因子,可以提高肿瘤的发生率和死亡率,但与肿瘤发生的确切机制还需要进一步探索[28]。
7 总结及展望
综上所述,内脏脂肪的测量方法比较多,每种测量方法都有优缺点,目前应用最为广泛的是腹部CT 检查,高内脏脂肪的人群具有较大的肺癌发生风险,内脏肥胖可以促进肺癌的发生发展,是肺癌患者的不良预后因素,但是高内脏脂肪的肺癌患者具有更好的治疗耐受性。内脏脂肪的含量是一个可以改变的危险因素[61],因此正确评价内脏肥胖和对导致肥胖的生活方式进行干预(包括饮食调整和体育锻炼),将在肺癌预防中发挥重要作用,另外在抗肿瘤治疗过程中,关注患者的营养状况,关注患者的内脏脂肪含量,会对于治疗产生积极的作用。
