幽门螺杆菌代谢产物腺苷通过A2A受体调控炎症因子分泌的机制研究
2022-07-11罗萍王效惠向军英刘哲
罗萍 王效惠 向军英 刘哲
成都大学附属医院消化内科(成都610081)
作为革兰氏阴性菌的幽门螺杆菌(H.pylori)是第一个被正式认可的细菌致癌物,感染了世界上大约44 亿(59%)的人口[1]。慢性感染产生炎症状态,但在大多数受试者中是无症状的[2]。然而,在一部分幽门螺杆菌感染人群中,胃部炎症可能演变为慢性胃炎、消化性溃疡、胃黏膜相关淋巴组织(MALT)淋巴瘤和胃癌[3-5]。简而言之,幽门螺杆菌定植的阶段如下:穿过胃黏液层,黏附到胃上皮,然后在避免被宿主免疫反应击败的同时获得营养。对于一些幽门螺杆菌定植/毒力因子,已经提出其在炎症发展和对宿主免疫系统的影响中的特定作用[6]。另一方面,已经发现一些宿主因素与幽门螺杆菌感染的起源(慢性胃炎症)和随后的病理结果有关[7]。因此,细菌作用和宿主反应都参与发病机制。宿主-病原体共同适应导致幽门螺杆菌定植,在大多数情况下可能保持无害;然而,病原体和宿主的特定基因型的同时发生可能会导致严重病理的发展[8]。尽管自发现H. pylori以来已经提供了大量的临床和实验观察结果,但仍需要进一步了解宿主-病原体相互作用的机制以及导致对这种病原体获得保护性免疫的机制的证据,以指导和制定有效对抗幽门螺杆菌。宿主-微生物相互作用是健康和疾病的基本组成部分[9]。维持人类与微生物组之间健康共生状态的一个关键参数是微生物群产生独特的代谢物,这些代谢物既为宿主提供营养,也参与免疫发育的调节[10]。然而,关于H. pylori代谢物是否调控宿主炎症因子的分泌尚不清晰。基于此,本研究旨在探讨H.pylori代谢产物参与调控宿主炎症因子的潜在机制。
1 材料与方法
1.1 材料 幽门螺杆菌菌株H. pyloriSS1 获赠于中科院微生物所。大肠杆菌E.Coli购自北京博迈德基因技术有限公司(货号:BC102-03)。C57BL/6小鼠购自广州锐格生物科技有限公司(货号:C570005)。布鲁氏菌肉汤购自ELITE-MEDIA 公司(货号:M1070-01)。RPMI1640 培养基购自维森特生物技术(南京)有限公司(货号:350-000-CL*10)。人胃癌细胞AGS 购自北京欣盛百泰科技有限公司(货号:CL0031)。广州一科生物科技有限公司购自(货号:BS7772)。腺苷检测试剂盒购自上海群己生物科技有限公司(货号:KA4547)。抗幽门螺杆菌免疫球蛋白(IgG)检测试剂盒购自北京科瑞美科技有限公司(货号:QS440220-48T)。人IL-33检测试剂盒购自深圳市文乐生物科技有限公司(货号:JL19282)。人TNF-α检测试剂盒购自北京江晨文轩生物科技有限责任公司(货号:JL10208-1)。人IFN-γ 检测试剂盒购自北京江晨文轩生物科技有限责任公司(货号:JL28106-1)。鼠IL-33 检测试剂盒购自广州徕智生物科技有限公司(货号:2MKMLJM219447m)。鼠TNF-α 检测试剂盒购自昆明皇宝商贸有限公司(货号:ml002098-96T(JK))。鼠IFN-γ 检测试剂盒购自Elabscience 公司(货号:E-EL-SR001)。SiGFP、siA2AR 由南京金斯瑞设计和合成。
1.2 方法
1.2.1 细胞培养与感染 幽门螺杆菌菌株SS1是一种适应小鼠的人类分离物,用于所有实验。H. pyloriSS1 的甘油原液首先在5%羊血琼脂平板上在微需氧条件下生长2 d。平板培养后,H.pyloriSS1 在5%FCS 的布鲁氏菌肉汤中在37 ℃微需氧条件下温和搅拌培养14 ~16 h。人胃癌细胞AGS 维持在补充有10%灭活FBS 的RPMI1640 培养基中。AGS 细胞血清饥饿16 h,然后以200∶1 的感染复数(MOI)感染幽门螺杆菌。当AGS 细胞感染H.pylori或E.Coli时,它们的融合水平为60% ~70%。感染后几乎细胞附着在细胞培养皿上,并且与对照细胞相比,细胞数量也没有减少,因此判断MOI 为200∶1 的H.pylori感染后的对AGS 细胞的增殖无显著影响。本研究均使用lipo3000 进行相关转染。
1.2.2 幽门螺杆菌菌株SS1感染小鼠H.pyloriSS1由平板和液体培养物制备。每周3 次,在400 μL 5% FCS/布鲁氏菌肉汤中给C57BL/6 小鼠口服3 ×108CFU 的H.pyloriSS1,持续4 周。
1.2.3 液相色谱与串联质谱鉴定幽门螺杆菌菌株SS1 的代谢物 对H.pyloriSS1 感染AGS 细胞后的上清进行3 KDa 过滤器的过滤,收集滤液液进行LC/MS 分析。LC/MS 测量使用配备两个LC-30AD泵、DGU-20A5 脱气机、SIL-30AC 自动进样器、CTO-20AC 柱温箱和 一个CBM-20A 控制模块,连接到LCMS-8040 三重四极杆质谱仪。ChromaTOF 2.32版用于数据预处理,无需平滑、3 s 峰宽、略高于噪声水平的基线减法,以及在整个色谱图中以5∶1的信号/噪声水平进行自动质谱去卷积和峰检测。定点质量被报告用于BinBase 算法。结果以txt 文件形式导出到数据服务器,并由代谢组学BinBase数据库中实施的过滤算法进一步处理。BinBase算法(rtx5)使用以下设置:色谱图的有效性(<10 个峰,强度>107 个计数s-1),无偏保留指数标记检测(MS 相似性>800,高m/z 标记离子强度范围的有效性),并通过5 阶多项式回归计算保留指数。使用以下匹配过滤器将光谱切割至5%的基峰丰度并从最高到最低丰度光谱与数据库条目匹配:保留指数窗口,±2 000 单位(相当于约±2 s 保留时间);验证独特的离子和顶点质量(独特的离子必须包含在顶点质量中,并且以>3% 的基峰丰度存在);和质谱相似性必须符合取决于峰纯度和信噪比以及最终异构体过滤器的标准。
1.2.4 酶联免疫吸附实验 抽取处理后小鼠尾静脉血清或者细胞上清进行酶联免疫吸附实验。酶联免疫吸附实验检测腺苷、抗幽门螺杆菌免疫球蛋白(IgG)、IL-33、TNF-α、IFN-γ 的水平。
1.2.5 腺苷合成酶敲除株H.pyloriΔAdA菌株的构建和验证 使用Red/ET方法[11]在H.pyloriSS1菌株中构建AdA缺失编码的菌株H.pyloriΔAdA。H.pyloriSS1通过电转染PSQ 质粒转化,携带PSQ 的H. pyloriSS1 细胞能够进一步转化靶向目标基因组基因座的重组DNA 片段。通过PCR 后琼脂糖凝胶电泳确认AdA 被敲除,引物序列:AdA-F:5'-GGAGACCAGCGATATCCACG-3'、AdA-R:5'-ATGCGAGTCAGACCGTTGTT-3'、GAPDH-F:5'-CTGCCGCTAACGCAGAAATC-3'、GAPDH-R:5'-CCATAGACAAAGGTGGGCGT-3'。
1.2.6 统计学分析 使用Student'st检验分析数据,P<0.05 表示差异具有统计学意义。
2 结果
2.1 幽门螺旋杆菌代谢物抑制炎症因子分泌E.Coli或H. pylori感染后,人胃癌细胞AGS 中IL-33、TNFα、IFN-γ 的分泌水平上升。相比于感染E.Coli,感染H. pylori的AGS 细胞分泌的IL-33、TNF-α、IFN-γ的水平较低,见图1A-C。H. pylori感染AGS 细胞24 h后,将收取细胞上清进行3 kDa过滤器过滤,滤液为<3 kDa 的分子(一般为代谢物),未过完3 kDa过滤器的液体为>3 kDa的分子(一般为蛋白,图1D),将这些组分处理E.Coli刺激过的AGS 细胞16 h后,发现小于3 kDa的分子能够降低IL-33、TNF-α、IFN-γ的分泌水平,见图1E-G。

图1 幽门螺旋杆菌代谢物抑制炎症因子分泌Fig.1 Helicobacter pylori metabolites inhibit the secretion of inflammatory factors
2.2 腺苷抑制炎症因子分泌E.Coli或H. pylori感染AGS 细胞24 h 后,将收取细胞上清进行液相色谱与串联质谱鉴定H.pylori的代谢物,发现多种代谢物的表达水平存在差异,见图2A。将上述代谢物小分子以5 μmol/L 的浓度进行筛选,发现腺苷能够影响IL-33 的分泌水平,见图2B。此外,腺苷降低IL-33、TNF-α、IFN-γ 的分泌水平存在梯度依赖效应,见图2C-E。

图2 腺苷抑制炎症因子分泌Fig.2 Adenosine inhibits the secretion of inflammatory cytokines
2.3 腺苷合成酶/腺苷/A2A 受体轴调控炎症因子分泌 通过NCBI 数据库blast 功能发现H. pylori存在腺苷合成酶(NCBI Reference Sequence:WP_078247416.1),见图3A。构建腺苷合成酶敲除株H. pyloriΔAdA菌株,见图3B。H.pyloriΔAdA感染后,AGS细胞的腺苷水平无显著改变,见图3C。此外,H.pyloriΔAdA感染后,AGS细胞中IL-33、TNF-α、IFN-γ的分泌水平均比H. pyloriWT感染的AGS 细胞高,见图3D-F。A2A 受体是腺苷调控下游分子的关键[12],敲低A2A 受体后,H. pylori感染的AGS 细胞IL-33、TNF-α、IFN-γ的分泌水平上升,见图3G-I。
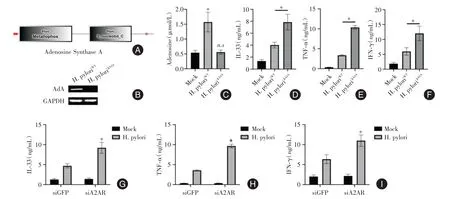
图3 腺苷合成酶/腺苷/A2A 受体轴调控炎症因子分泌Fig.3 Adenosine synthase/adenosine/A2A receptor axis regulates the secretion of inflammatory cytokines
2.4 幽门螺旋杆菌腺苷合成酶调控小鼠免疫反应H.pyloriΔAdA或H.pyloriWT感染小鼠4周后,与Mock组比较,H. pyloriWT感染和H. pyloriΔAdA感染胃组织出现囊性扩张,排列不规则和炎症细胞浸润,说明感染后胃组织有炎症发生见图4A。另外,发现小鼠血清中的IL-33、TNF-α、IFN-γ 的水平均上升。相比于H.pyloriWT感染,H.pyloriΔAdA感染后小鼠血清中的IL-33、TNF-α、IFN-γ 的水平上升更明显,见图4B-D。此外,相比于H.pyloriWT感染,H.pyloriΔAdA感染后小鼠产生的抗幽门螺旋杆菌抗体的滴度上升,见图4E。
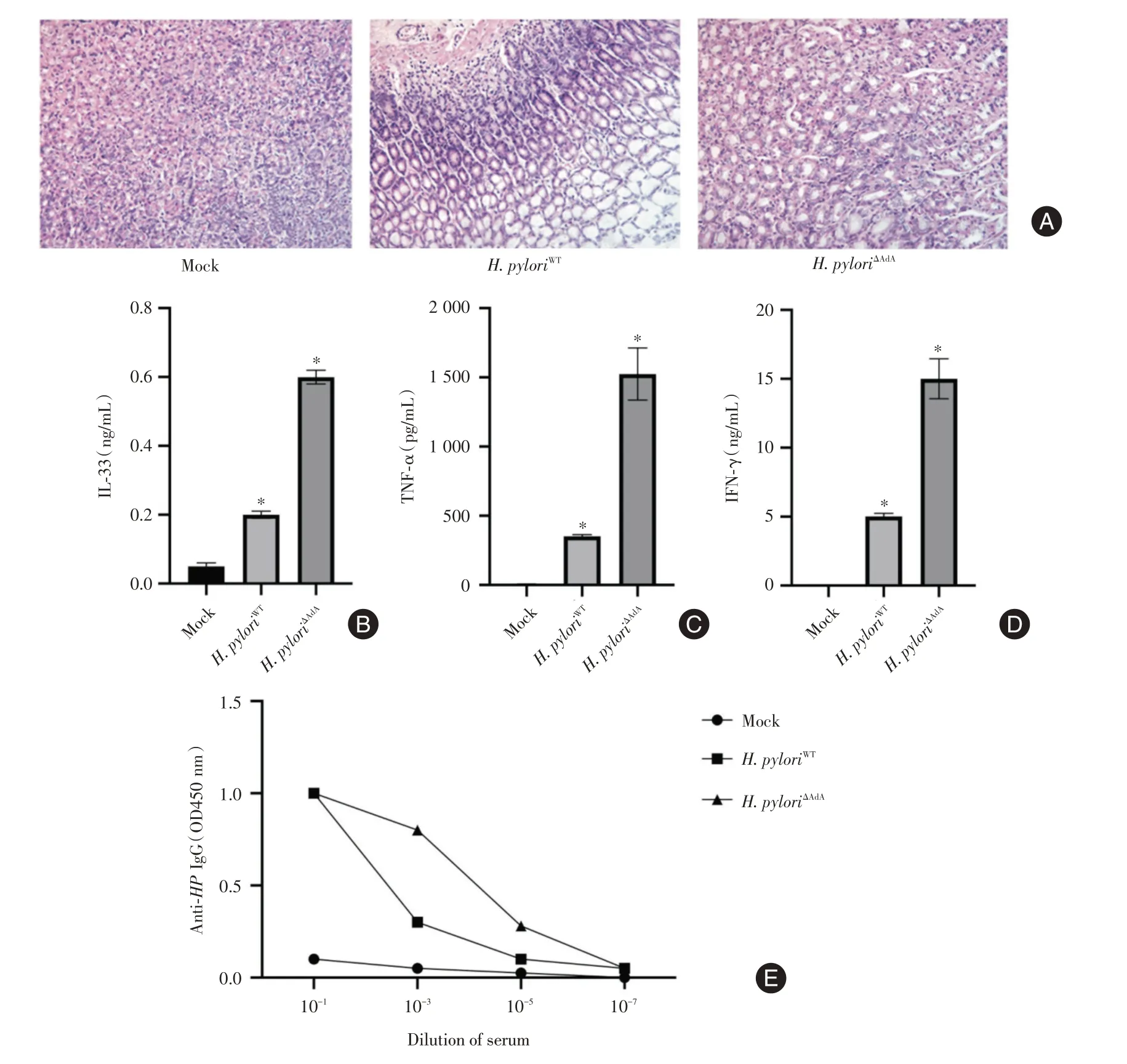
图4 幽门螺旋杆菌腺苷合成酶调控小鼠免疫反应Fig.4 Helicobacter pylori adenosine synthase regulates the immune response in mice
3 讨论
H.pylori感染会引起多种胃肠道疾病,如无症状慢性胃炎、消化性溃疡病、胃腺癌和胃淋巴瘤,以及相关的分子机制在对宿主和细菌的研究中开始阐明这些疾病的基础[13]。然而,很少有研究使用代谢组分析评估幽门螺杆菌感染产生的代谢物。在一项研究中,从已感染幽门螺杆菌(一种已知可在沙鼠中长期适应的临床分离物)的沙鼠中收集尿液,并使用质子核磁分析尿液中的代谢物共振光谱法[14]。此外,研究表明,幽门螺杆菌感染会改变肠道微生物群,如微生物相关代谢物的变化所示[15]。然而,幽门螺杆菌的代谢物如何影响宿主并实现免疫逃逸尚未明确。本研究通过代谢组学和遗传学操作鉴定了幽门螺杆菌代谢物腺苷对炎症因子IL-33、TNF-α、IFN-γ 的分泌水平的影响。
此前,有研究基于代谢物谱评估了几种代谢途径,包括糖酵解途径、TCA 循环、胆碱途径、尿素循环、谷胱甘肽循环、嘌呤途径、嘧啶途径和氨基酸代谢,并在一些中观察到H.pylori感染诱导的改变宿主代谢途径[16]。本研究发现H.pylori感染后,AGS 细胞中腺苷水平显著上升。腺苷具有免疫抑制特性,并且与癌症发展有关。因此,H. pylori可能通过代谢物腺苷参与宿主免疫逃逸。
本研究鉴定并表征了H.pylori的腺苷合成酶,一种具有5'-核苷酸酶特征序列的H. pylori细胞壁锚定蛋白。构建腺苷合成酶敲除株H. pyloriΔAdA菌株,发现H. pyloriΔAdA感染后,AGS 细胞的腺苷水平无显著改变。此外,H. pyloriΔAdA感染后,AGS 细胞中IL-33、TNF-α、IFN-γ 的分泌水平均比H. pyloriWT感染的AGS 细胞高。此外,相比于H.pyloriWT感染,H. pyloriΔAdA感染后小鼠产生的抗幽门螺旋杆菌抗体的滴度上升。因此,腺苷合成酶是感染期间腺苷合成所必需的,并且此蛋白有助于H.pylori在动物体内存活。
A2A 受体是腺苷调控下游分子的关键,敲低A2A 受体后,H. pylori感染的AGS 细胞IL-33、TNFα、IFN-γ 的分泌水平上升。有研究发现腺苷能够与A2A 受体结合并且调控NF-κB 通路,抑制细胞因子的表达[17]。但是本研究仅检测了细胞因子的分泌水平,其表达水平是否受到了调控值得进一步探讨。并且,本研究仍然具有一定的局限性,腺苷合成酶/腺苷/A2A 受体调控轴是在细胞水平中鉴定的,其是否在动物水平也发挥相同的作用值得进一步探讨。
综上所述,H. pylori表达的腺苷合成酶能够促进腺苷的产生,随后腺苷通过A2A 受体调控炎症因子IL-33、TNF-α、IFN-γ 的分泌,并且降低适应性免疫水平。腺苷合成酶/腺苷/A2A 受体可能是对抗幽门螺杆菌的潜在靶点。
