lncRNAH19/Sirt3介导自噬在脑出血后损伤中的作用机制
2022-07-11袁敏王素洁李茜张志月
袁敏 王素洁 李茜 张志月
唐山市工人医院(河北医科大学附属唐山临床医学院)(河北唐山063000)
脑出血(intracerebral hemorrhage,ICH)是一种可致命的卒中亚型,由自发性非创伤性出血进入脑实质引起[1]。目前,脑出血尚无有效的治疗策略,迫切需要确定针对脑出血的精确机制。自噬被认为是细胞克服外部刺激损伤的自我保护机制,其促进细胞在各种病理过程中的存活[2-4]。全基因组测序技术表明,脑出血影响了各种非编码RNA(ncRNA)的表达[5]。作为调节性ncRNA,lncRNA(>200 nt)通过调节发育和疾病相关基因参与某些疾病的发生、发展和病理过程[6-7]。有证据表明,lncRNA H19(以下简称H19)是在人脑灰质和白质中表达稳定性最高的10 种lncRNA 之一[8]。H19 在许多中枢神经系统疾病中发挥重要作用,例如H19通过转录和转录后调控参与颅内动脉瘤的病理生理过程[9]。最近,KIM 等[10]揭示H19 在脑出血后高表达,表明H19 可能作为脑出血的生物标志物。还有文献表明,H19 与自噬相关的miRNA 或蛋白质相互作用[11-12]。然而,H19 是否参与脑出血损伤病理过程中自噬调节的机制需要进一步探索。因此,本研究通过体内建立脑出血小鼠模型和体外将SH-SY5Y 细胞暴露于氧血红蛋白(OxyHb)模拟脑出血,共同探讨H19 在脑出血损伤中的作用。
1 材料与方法
1.1 材料
1.1.1 动物 84 只成年C57BL/6J(B6)小鼠(8 ~10 周,25 ~30 g,雌性各半)购自北京华阜康生物科技股份有限公司(许可证号SCXK(京)2019-0008)。小鼠在特定的无病原体条件下,允许随意获取食物和水。
1.1.2 试剂 胶原酶Ⅳ、MTT 溶液购自美国Sigma-Aldrich 公司;抗LC3、Beclin、p62、Sirt3、p-AMPK、AMPK、p-mTOR、mTORβ-actin 和HRP 偶联的二抗购自英国Abcam 公司;Cy3 标记的山羊抗兔Ig G 购自 上 海Beyotime 公司;OxyHb 购自德国Ruibio 公司;Lipo2000 购自美国Invitrogen 公司;总RNA 提取试剂盒购自北京Solarbio 公司;PrimeScript RT 试剂盒、SYBR Green PCR Master Mix 购自日本Takara 公司;ECL化学发光系统购自美国Thermo Fisher公司。含有sh-H19 或sh-NC 的慢病毒载体购自上海吉凯基因医学科技股份有限公司。
1.1.3 细胞 SH-SY5Y 细胞购自中国科学院上海生物化学与细胞生物学研究所,接种在含有10%胎牛血清、100 U/mL 青霉素和100 mg/mL 链霉素的DMEM 培养基中培养。
1.2 体内实验
1.2.1 脑出血模型建立 参照文献方法通过注射胶原酶Ⅳ诱导脑出血模型[13]。具体操作为:小鼠麻醉后固定在立体定向框架中,并在头部前囟点(前0.5 mm 和左侧纹状体部分外侧2 mm)钻一个孔。将溶解在0.5 μL 生理盐水中的总共0.06 单位胶原酶Ⅳ以0.18 μL/min 的速度注射到左侧纹状体中。输注后将针头保持原位10 min 以防止回流。
1.2.2 小鼠分组 将小鼠分为6 组:假手术(Sham)组、脑出血(ICH)组、Sham+shRNA 阴性对照(sh-NC)组,Sham+shRNA-H19(sh-H19)组,ICH+sh-NC组和ICH+sh-H19 组。Sham 组(n= 18):除了不注射胶原酶Ⅳ,其余同1.2.1 方法;ICH 组(n=18):按照1.2.1 方法建立脑出血模型;Sham+sh-NC 组、Sham+sh-H19 组:在假手术前72 h,分别将含有sh-NC(1 × 108TU/mL)和sh-H19(1 × 108TU/mL)的慢病毒颗粒10 min内缓慢注射到小鼠脑室中(10 μL,速率为0.5 μL/min);ICH+sh-NC 组、ICH+sh-H19组:在脑出血建模(同ICH 组)前72 h,分别将含有sh-NC(1×108TU/mL)和sh-H19(1×108TU/mL)的慢病毒颗粒10 min 内缓慢注射到小鼠脑室中(10 μL,速率为0.5 μL/min)。体内实验分为两部分:(1)脑出血后小鼠脑组织中H19 表达的时程分析:观察Sham 组和ICH 组脑出血建模术后24、48 和72 h H19 表达水平。(2)确定H19 在脑出血中的作用及其潜在机制:脑出血后48 h,Sham+sh-NC 组、Sham+sh-H19 组、ICH+sh-NC 组和ICH+sh-H19 组每组6 只小鼠被处死并分离病灶脑组织用于后续分析,其余6 只小鼠用于神经行为分析。
1.2.3 病灶体积评估 在神经学评估后,处死模型小鼠并将大脑切成2 mm 厚的冠状切片,参照文献方法评估病变体积(n=3)[13]。总病灶体积=4×每个脑切片的病灶体积×2 mm。
1.2.4 行为分析 采用量化改良神经严重程度评分(modified neurological severity score,mNSS)评估每只小鼠的神经功能缺损。
1.2.5 免疫荧光 给予脑切片以回收抗原,然后脱水,透化并与0.2%牛血清白蛋白孵育,将脑切片与抗LC3(1∶200)的一抗在4 ℃下孵育过夜。次日,在室温下将Cy3 标记的山羊抗兔Ig G(1∶200)添加到切片中孵育1 h。然后将切片用DAPI 染色。使用倒置荧光显微镜捕获图像。
1.3 细胞实验
1.3.1 细胞分组 将SH-SY5Y 细胞以约1.2 × 106的密度接种至6 孔板中,为了模拟脑出血,将SHSY5Y 细胞暴露于10 μmol/L 浓度下OxyHb[14]。将细胞分为对照(Control)组、H19 敲低组(sh-H19)、OxyHb 组、OxyHb+sh-NC 组、OxyHb+sh-H19 组、OxyHb+sh-Sirt3 组 和OxyHb+sh-H19+sh-Sirt3 组。Control 组:SH-SY5Y 细胞中加入空白溶剂;sh-H19组:采用sh-H19转染SH-SY5Y细胞48 h;OxyHb组:SH-SY5Y细胞中加入10 μmol/L浓度OxyHb;OxyHb+sh-NC组、OxyHb+sh-H19组和OxyHb+sh-Sirt3组:将sh-NC、sh-H19或sh-Sirt3转染SH-SY5Y细胞48 h,然后加入10 μmol/L OxyHb处理细胞;OxyHb+sh-H19+sh-Sirt3 组:将sh-H19 和sh-Sirt3 转染SH-SY5Y细胞48 h,然后,加入10 μmol/L OxyHb 处理细胞。体外实验分为4 部分:(1)暴露于10 μmol/L 浓度OxyHb的SH-SY5Y 细胞中H19 表达的时程分析:观察Control 组和OxyHb 组暴露OxyHb 后24、48 和72 h的H19 表达水平。(2)确定H19 敲低对OxyHb 诱导的神经细胞损伤的影响:OxyHb 处理48 h,测定Control 组、OxyHb 组、OxyHb+sh-NC 组和OxyHb+sh-H19 组的细胞凋亡。(3)测定H19 敲低后的SHSY5Y 细胞RNA 序列:Control 组和sh-H19 组在转染48 h 进行RNA 测序。(4)观察H19 敲低对Sirt3 介导AMPK/mTOR 信号通路影响:OxyHb 处理48 h,Oxy-Hb组,收集OxyHb+sh-H19组,OxyHb+sh-Sirt3 组和OxyHb+sh-H19+sh-Sirt3组细胞用于信号通路分析。
1.3.2 细胞活力测量 SH-SY5Y 细胞加入MTT 溶液(0.5 mg/mL)并在37 ℃下孵育4 h。然后在黑暗中将紫色晶体溶解在150 μL DMSO 中10 min。在酶标仪上获得570 nm 处的光密度。
1.3.3 RNA 提取和RT-qPCR 分析 使用总RNA提取试剂盒从脑组织和SH-SY5Y 细胞中提取总RNA。然后使用PrimeScript RT 试剂盒对2 μg RNA样本进行反转录,并在CFX96 实时系统(Bio-Rad)上使用SYBR Green PCR Master Mix 进行RT-qPCR扩增。H19的表达水平标准化为β-actin。使用2-ΔΔCt方法计算倍数变化。本研究中使用的引物如下:H19,F:5'-GGGTGTTTACGTAGACCAGAACC-3'和R:5'-CTTCCAAAAGCCTTCTGCCTTAG-3';β-actin,F:5'-AATTCCATGGCACCGTCAAG-3'和R:5'-TGGACTCCACGACGTACTC-3'。
1.3.4 免疫印迹分析 通过使用RIPA 裂解缓冲液从组织和细胞中分离总蛋白。蛋白质样品进行电泳并转移到PVDF膜上。在5%脱脂牛奶中封闭后,将膜与靶向β-actin(1∶2 000),Beclin(1∶1 000),LC3(1∶1 000),p62(1∶1 000),Sirt3(1∶500),p-AMPK(1∶500)、AMPK(1∶500)、p-mTOR(1∶500)和mTOR(1∶1 000)的一抗在4 ℃下孵育过夜。然后将膜与HRP 偶联的二抗(1∶5 000)一起温育1 h,并用ECL 化学发光系统观察条带。
1.3.5 Tunel 染色 冷冻切片和细胞使用0.25%Triton X-100 透化15 min。每个切片在室温下用100 μL 平衡缓冲液孵育20 min,然后用50 μL 重组末端脱氧核苷酸转移酶(RTdT)孵育缓冲液覆盖并在37 ℃下黑暗中孵育1 h,再用DAPI 染色15 min。使用倒置荧光显微镜捕获图像,并对脑出血部位周围的阳性细胞进行计数。
1.3.6 RNA测序 从SH-SY5Y中提取的RNA(4 μg)用DNase 处理,去除核糖体RNA 后,制备RNA 文库。在HiSeq 2000 系统(美国Illumina 公司)上进行RNA 测序。使用Bioconductor R 程序中的EBSeq程序包评估差异基因表达。运用注释、可视化和集成发现数据库对差异表达的mRNA 进行京都基因与基因组百科全书(KEGG)通路富集分析。
1.4 统计学方法 使用GraphPad Prism 7.0 进行统计分析。计量资料表示为均数±标准差,两组之间比较用t检验,多组比较用方差分析。P<0.05 为差异有统计学意义。
2 结果
2.1 H19 在体内和体外脑出血时高度表达 与Sham 组相比,ICH 组在模型建立后第2 天病灶体积显著增加(P<0.001),并且mNSS 得分显著较高(P<0.001,图1A-C)。脑出血后H19 的表达呈时间依赖性上调(均P<0.05,图1D),并且H19 表达也在OxyHb 处理细胞中以时间依赖性方式增强(均P<0.05,图1E)。

图1 H19 在体内和体外脑出血时高度表达Fig.1 H19 was highly expressed during ICH in vivo and in vitro
2.2 H19敲低减轻脑出血引起的神经损伤 sh-H19显著降低损伤区域的H19 表达(图2A)。与ICH+sh-NC 组相比,ICH+sh-H19 组在模型建立后第2 天病灶体积和mNSS 评分均显著降低(P<0.01),并且神经元细胞凋亡显著减少(P<0.01,图2B-E)。
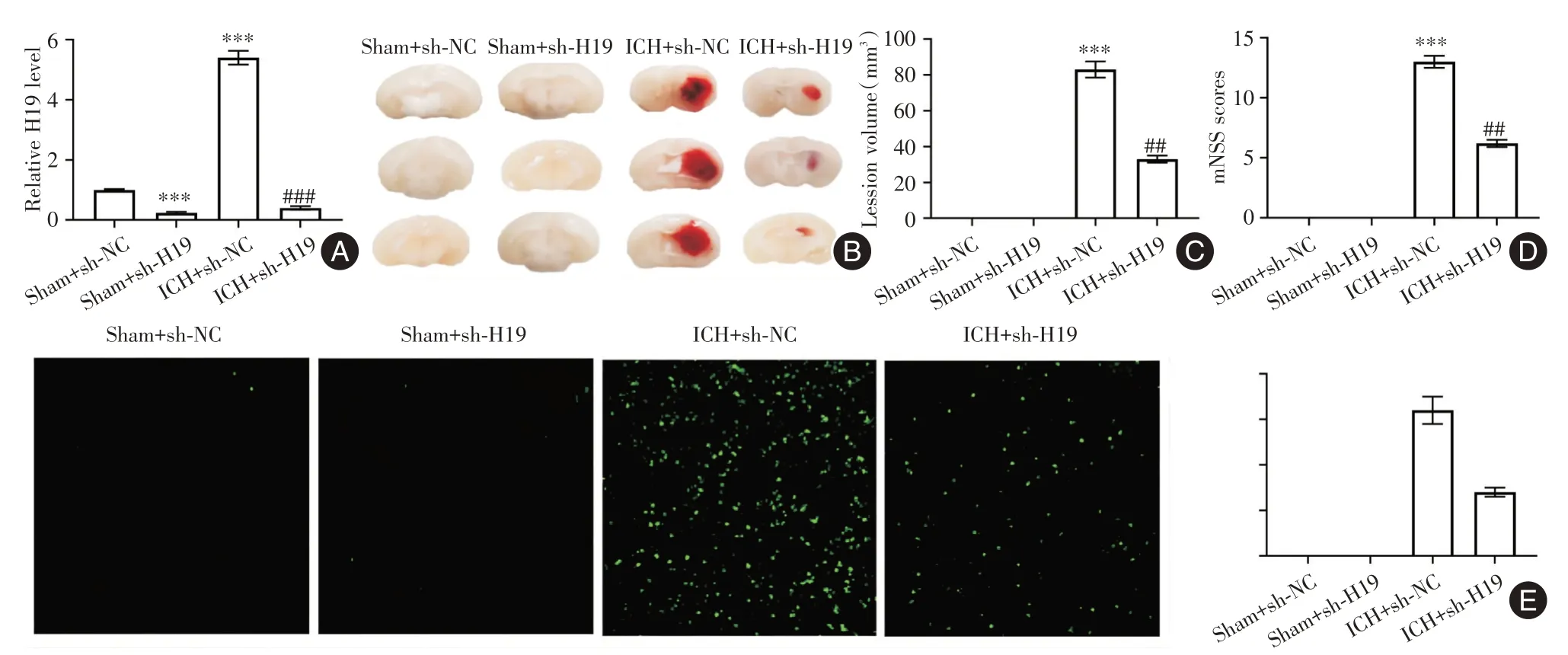
图2 H19 敲低减轻脑出血引起的神经损伤Fig.2 H19 knockdown attenuated ICH-induced nerve damage
2.3 H19 敲低增强脑出血小鼠脑内自噬 损伤区域LC3 的强度因脑出血而增加,而H19 敲低进一步增强了LC3 的强度。见图3。
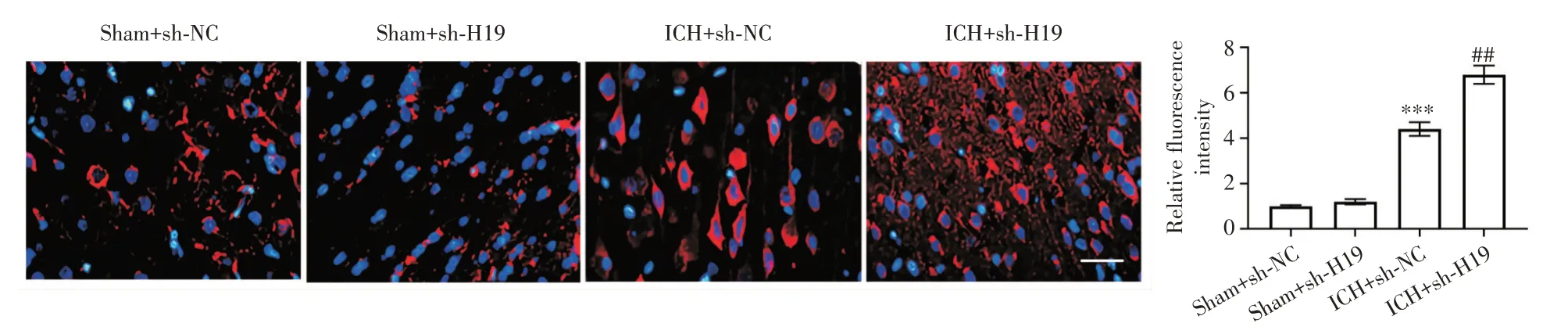
图3 H19 敲低增强脑出血小鼠脑内自噬Fig.3 H19 knockdown enhanced autophagy in the brain of ICH mice
2.4 H19敲低减轻OxyHb诱导的神经细胞损伤诱导脑出血后,细胞中H19 表达升高,并且细胞活力降低(图4A-B)。由脑出血诱导的凋亡细胞增加被H19 敲低所缓解(图4C-D)。此外,H19 敲低可增加LC3II/LC3I 和Beclin 水平,降低p62 蛋白水平(图4E)。

图4 H19 敲低减轻OxyHb 诱导的神经细胞损伤Fig.4 H19 knockdown attenuated OxyHb-induced neuronal injury
2.5 H19 敲低通过增强Sirt3 介导AMPK/mTOR信号通路促进自噬水平 与对照组相比,H19 敲低组中有1 120 个mRNA 差异表达,其中429 个上调mRNA 和691 个下调mRNA。mRNAs 的差异表达水平通过火山图直观表达(图5A)。KEGG 通路分析显示,差异表达的mRNA 在AMPK/mTOR 信号通路中富集,这与自噬调节有关(图5B)。Sirt3 通过AMPK/mTOR 途径在调节细胞防御和介导细胞存活中发挥重要作用。OxyHb 诱导Sirt3水平升高,H19敲低进一步提高Sirt3水平。在OxyHb 诱导后,p-AMPK/AMPK 比率升高,而p-mTOR/mTOR 比率下降。H19 敲低大大加剧了上述变化(图5C)。H19敲低细胞中的Sirt3 敲低逆转了升高的p-AMPK/AMPK 比率和降低的p-mTOR/mTOR 比率(图5D)。
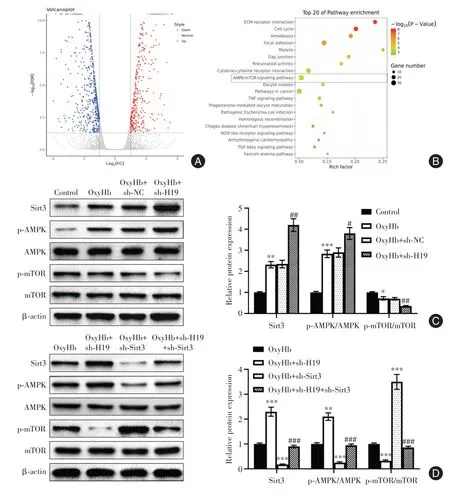
图5 H19 敲低通过增强Sirt3 介导AMPK/mTOR 信号通路促进自噬水平Fig.5 H19 knockdown promoted autophagy levels by enhancing Sirt3-mediated AMPK/mTOR signaling pathway
2.6 H19 敲低通过调节Sirt3 诱导的自噬减轻脑出血损伤 H19 敲低细胞中提高的细胞活力在Sirt3 敲低后得到降低,并且减少的细胞凋亡在Sirt3 敲低后得到增强(图6A-C)。此外,Sirt3 敲低降低了H19 敲低细胞中增加的细胞自噬(图6D)。
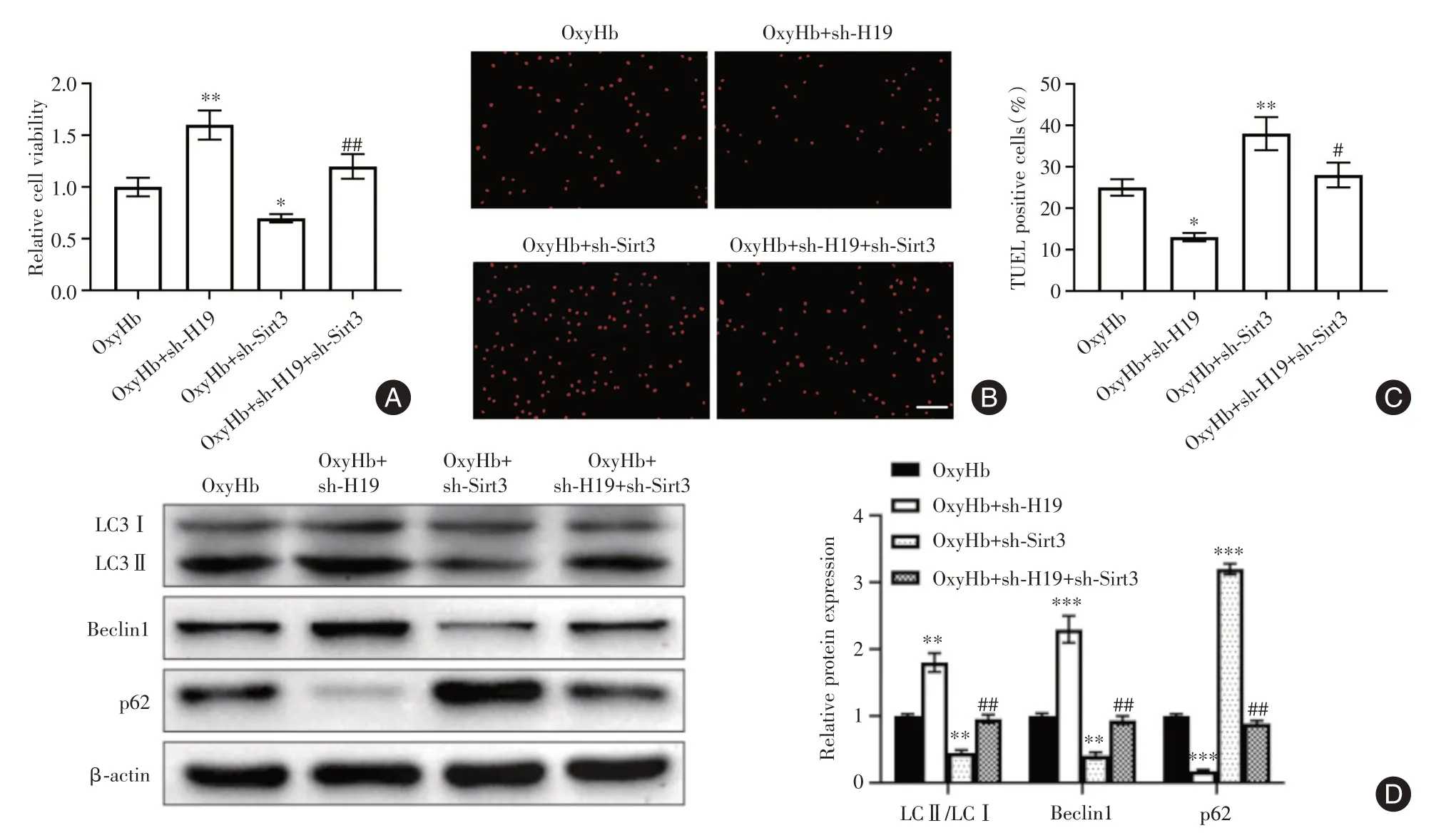
图6 H19 敲低通过调节Sirt3 诱导的自噬减轻脑出血损伤Fig.6 H19 knockdown attenuated ICH injury by regulating Sirt3-induced autophagy
3 讨论
研究表明,H19 在脑出血发展过程中发挥了关键作用[15]。H19 可以通过促进miR-675 的表达和靶向VEGF 来增加与脑血管痉挛有关的HIF-1α mRNA 和蛋白质水平。颅内动脉瘤是脑出血的主要原因,H19 通过转录和转录后调控参与颅内动脉瘤的病理生理过程[9]。此外,H19 也是腹主动脉瘤形成的诱发因素,并通过将SP1 募集到缺氧诱导的因子1α 启动子区域来促进其转录,从而诱导平滑肌细胞凋亡[16]。同样,ZHANG 等[17]发现H19可以通过Wnt/β-catenin 信号通路充当miR-148b 的分子海绵,从而调节人主动脉血管平滑肌细胞的增殖和凋亡。基于以上证据,本研究通过体内外构建脑出血模型证实了H19 在脑出血小鼠模型中的表达升高,和H19 敲低可以减轻脑出血引起的神经损伤,并在机制研究中发现其损伤机制可能与抑制自噬有关。
大量证据表明,脑出血细胞损伤的严重程度受自噬的影响,激活自噬可以通过降解受损蛋白质诱导新蛋白质的合成[18-19]。一些研究者报道,自噬可以减少脑出血后的梗死体积、神经元死亡和神经功能障碍[20]。本研究发现,脑出血损伤期间自噬被激活,并且H19 敲低进一步增加自噬水平。通过mRNA 测序,对照组和H19 敲低组差异表达的mRNA 在AMPK/mTOR 信号通路中富集。AMPK/mTOR 信号通路是自噬过程的经典调控通路,先前研究证实Sirt3 通过AMPK-mTOR 途径诱导自噬[21-22]。Sirt3 属于人类sirtuin 家族最保守和最具特征的一个成员,在调节系统大脑中能量稳态和细胞寿命方面起着至关重要的作用[23]。本研究发现H19 敲低增加了Sirt3 水平,并且H19 敲低通过调节Sirt3 诱导的自噬减轻了OxyHb 处理后SH-SY5Y 细胞损伤。因此,笔者认为H19 可能在脑出血模型中通过抑制Sirt3 介导的AMPK-mTOR信号通路来抑制自噬激活。
综上所述,本研究发现H19 在体内外脑出血模型中以时间依赖性方式增强,H19 敲低可以减少脑出血病灶体积,减轻神经损伤和减少神经元凋亡。此外,H19 敲低促进了Sirt3 的表达,进而通过激活AMPK-mTOR 信号通路增强自噬。这些结果揭示了H19 有可能成为脑出血治疗的一个关键靶点,这也为开发新的脑出血治疗方法提供了基础。然而,脑出血是一个复杂的调控体系,本课题组后续实验将进一步阐明H19 是否通过其他途径介导脑出血进展,并在临床大样本中验证。
