泛素结合酶E2T基因干扰影响人卵巢癌细胞株SKOV3增殖的作用与机制
2022-07-11李馨张瑜倪婷婷鲁亮
李馨 张瑜 倪婷婷 鲁亮
贵州省人民医院肿瘤科(贵阳550002)
卵巢癌是指起源于卵巢的恶性肿瘤,调查显示[1]我国近10年来卵巢癌的发病率已增长30%,且仍呈增长趋势。另有研究[2-3]显示,约有70%的卵巢癌患者确诊时已处于晚期,5年生存率低于30%。靶向治疗[4-5]是指在细胞分子水平上针对明确的致癌位点设计相应的治疗药物,使其能够特异性与致癌位点结合促使肿瘤细胞凋亡,是一种新型、高效、安全的治疗技术,也是目前抗肿瘤治疗研究的热点。但是目前人们对卵巢癌发病机制仍缺乏深入的认识,对靶向治疗的研究也仅仅处于起步阶段。
泛素结合酶E2T(UBE2T)是泛素结合酶E2 家族中的重要成员,已有大量研究证实该分子与细胞增殖、凋亡及肿瘤的发生发展密切相关[6-7]。UBE2T 可促使抑癌基因泛素化,降解抑癌基因表达的蛋白,促使恶性肿瘤细胞增殖;UBE2T 还可激活其下游的蛋白激酶B(AKT)、细胞周期蛋白D1(Cyclin D1),增强二者的表达,促进细胞G1 期到S期的转化,增强细胞增殖活性[8-9]。有实验证实[10]采用药物降低癌细胞UBE2T 的表达有助于抑制细胞增殖。另有研究[11]表明UBE2T 可调控三阴性乳腺癌细胞株的增殖、迁移和侵袭。据此推测UBE2T基因异常表达可能参与恶性肿瘤的发生和发展。然而目前关于UBE2T 基因干扰是否可通过抑制AKT 和Cyclin D1 的表达及其生物学作用从而影响人卵巢癌细胞株SKOV3 的增殖尚未可知。故此本研究进行细胞实验,旨在为卵巢癌靶向治疗提供新方向。
1 材料与方法
1.1 材料
1.1.1 细胞和病毒 人卵巢癌细胞株SKOV3(北京生命科学研究所,批号:CC19011136);慢病毒包装质粒(美国Sigma 公司,批号:1904152A)。
1.1.2 主要试剂 AgeI 酶、EcoRI 酶(美国NEB 公司,批号:1812117、1810145);puromycin 溶液(上海信帆生物科技有限公司,批号:1811075012);Trizol试剂盒、蛋白抽提试剂盒(美国Thermo 公司,批号:1901145001、1902183007);噻唑蓝(MTT)试剂盒(美国Sigma公司,批号:1902138C);鼠抗人UBE2T、AKT、Cyclin D1、p-AKT单克隆抗体、兔抗鼠UBE2T、AKT、Cyclin D1、p-AKT 多克隆抗体(酶标记)(Abcam 中国公司,批号:2018172、2019103、2019015、2019041、2019112、2019045、2019158、2019116);UBE2T-shRNA 序列、UBE2T、AKT、Cyclin D1 引物序列均委托宝生物(大连)科技有限公司合成。
1.1.3 主要仪器 EasyCycler 96 聚合酶链反应(PCR)仪(德国耶拿公司);CX23 型光学显微镜(日本Olympus 公司);LWD300-38CLFT 型倒置显微镜(西安测维光电技术有限公司);CFM-100A 型荧光显微镜(上海长方光学仪器有限公司);CytoFLEX S 型流式细胞仪(美国Beckman Coulter 公司)。
1.2 方法
1.2.1 细胞培养、传代、分组及干预 取人卵巢癌细胞株SKOV3 将其复苏后置入含10%胎牛血清的RPMI-1640 培养基中培养,然后离心弃去上清液,再次加入适量培养液并将细胞吹打均匀,移液至培养皿中,拧松瓶口,至于37 ℃、5%浓度二氧化碳、饱和湿度的二氧化碳培养箱中培养2 ~3 d,观察细胞传代情况。参照shRNA 的基本设计原则设计shRNA 序列[12]。构建UBE2T-shRNA、携带UBE2T、NC-shRNA 基因的慢病毒载体,将其转染至人卵巢癌细胞株SKOV3,分别记为沉默组、转染组、阴性对照组;并取未转染的人卵巢癌细胞株SKOV3,记为空白对照组。每组设置3 个复孔,制成细胞悬液,细胞浓度均调整为1×105个/mL。荧光显微镜下观察各组细胞转染效率,且均用含10%的胎牛血清的RPMI-1640 培养基培养72 h。
1.2.2 UBE2T 基因干扰效率鉴定 (1)采用RTqPCR 检 测UBE2T mRNA 表达,UBE2T 引物上游:5'-TGATCGATATGCGGCGAATTAGCTAG-3',下游:5'-CGATTAGCGGCGAGAGAGTAGCTAGC-3',扩增片段长度:278 bp;内参β-actin 引物上游:5'-TAGCTTGGCTAGAGCTGAGC-3',下游:5'-AGGCTAGAGCTATAGCTATG-3',扩增片段长度:202 bp。采用Trizol 法提取细胞总RNA,提纯定量,逆转录为cDNA。配置反应体系,包括去离子水10.0 μL,上下游引物各0.4 μL,cDNA 2.0 μL,预混液(GoTaq®qPCR Master Mix)7.2 μL,共20 μL。PCR反应流程:94 ℃(2 min),40个循环:94 ℃(15 s),60 ℃(1 min),最后95 ℃(1 min)、冷却至55 ℃。计算2-△△Ct。(2)采用Western blot 检测UBE2T 蛋白表达:加入裂解液,提取细胞总蛋白。取40 μg 总蛋白及蛋白标志物3 μL上样,将电泳槽置于冰上电泳。根据预染的标志物分子量在分离胶上确定目的蛋白的位置,将多余的凝胶去除,100 V 转膜1 h。转膜,并将一抗按照相应倍数稀释,将转膜后的样品置于一抗工作液,4 ℃过夜;洗膜后置入二抗工作液中摇床孵育2 h,室温。洗膜、化学发光,显影、定影和分析。
1.2.3 细胞形态学观察及增殖抑制率检测 (1)各组细胞培养72 h 后,倒置显微镜下观察细胞形态学变化;(2)MTT 法检测细胞增殖抑制率。向每孔中加入MTT 试剂(5 g/L)共10 μL,连续培养4 h后向其中加入十二烷基硫酸钠100 μL,采用多功能微孔板测试系统检测570 nm 波长处的光密度(OD)值,计算增殖抑制率=(OD对照-OD观察)/OD对照×100.00%。
1.2.4 细胞周期检测 采用流式细胞仪检测细胞周期。各组细胞培养72 h 后收集细胞,制成单细胞悬液,取70%冰乙醇(4 ℃)固定,以灭菌的磷酸盐缓冲液清洗、离心,撇去上清液后加入RNAase 150 μL 和碘化丙啶(PI)染液150 μL,室温下避光染色30 min。离心,撇去上清液,以磷酸盐缓冲液重悬后上机检测。
1.2.5 AKT、Cyclin D1 mRNA和蛋白表达及p-AKT水平检测 AKT、Cyclin D1 mRNA 表达检测参照1.2.3 中RT-qPCR 步骤,其中AKT 引物上游:5'-TAGCATAGCGGCGGATAGCA-3',下游:5'-CTAGAGCGGCGCGATACTAG-3',扩增片段长度:246 bp,Cyclin D1 引物上游:5'-ATAGCGGCGGATAGCGGCGAGAGATC-3',下游:5'-AAAGAGGCGGAGAGCTGCGAGAGGAG-3',扩增片段长度:310 bp。AKT、Cyclin D1 蛋白表达及p-AKT 水平检测参照1.2.3 中Western blot 步骤。
1.3 统计学方法 采用SPSS 24.0 软件进行统计学分析,计量资料以()表示,比较采用方差分析和SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 puromycin 最优浓度筛选结果 将puromycin 2.0 μg/mL 作为人卵巢癌SKOV3 细胞加压筛选的最优浓度,见表1。
表1 人卵巢癌细胞株SKOV3 细胞对puromycin 的药敏实验结果Tab.1 Results of drug sensitivity test of human ovarian cancer cell line SKOV3 to puromycin ±s
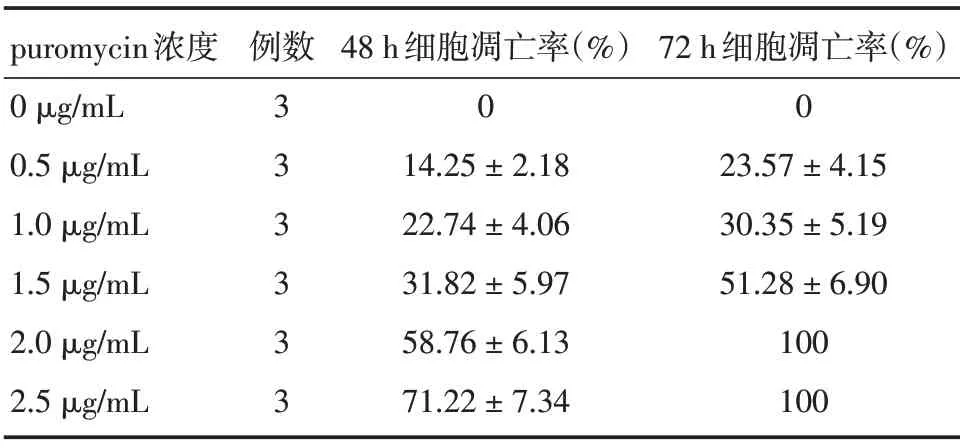
表1 人卵巢癌细胞株SKOV3 细胞对puromycin 的药敏实验结果Tab.1 Results of drug sensitivity test of human ovarian cancer cell line SKOV3 to puromycin ±s
puromycin浓度0 μg/mL 0.5 μg/mL 1.0 μg/mL 1.5 μg/mL 2.0 μg/mL 2.5 μg/mL例数3 3 3 3 3 3 48 h细胞凋亡率(%)0 14.25±2.18 22.74±4.06 31.82±5.97 58.76±6.13 71.22±7.34 72 h细胞凋亡率(%)0 23.57±4.15 30.35±5.19 51.28±6.90 100 100
2.2 转染率结果 阴性对照组、沉默组、转染组荧光视野均见转染细胞,转染率分别为(91.06 ±8.71)%、(94.61 ± 10.55)%、(93.25 ± 11.36)%,见图1。
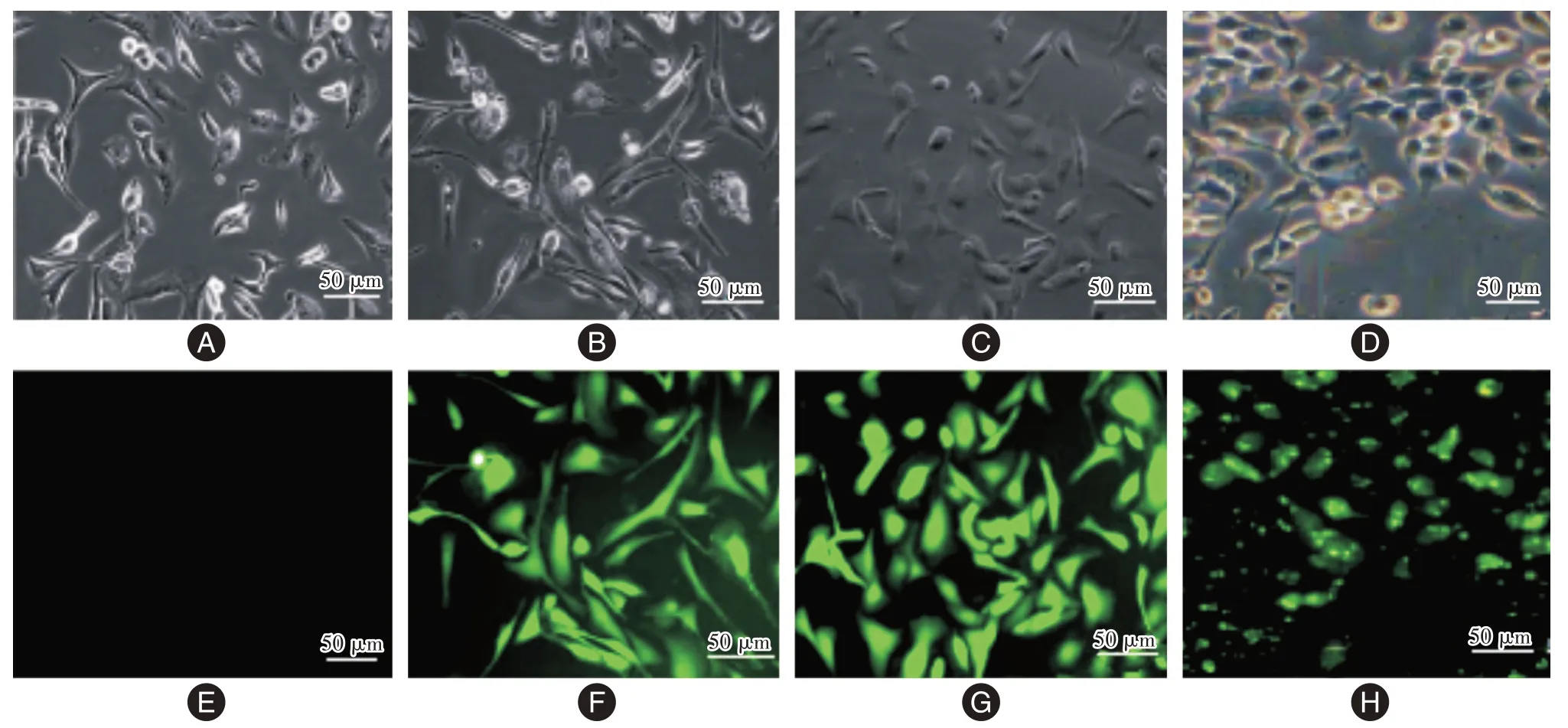
图1 各组细胞荧光图(×200)Fig.1 Cell fluorescence diagram of each group(×200)
2.3 UBE2T 基因干扰效率鉴定结果 转染组UBE2T mRNA 及蛋白表达均高于其余3 组(P<0.05),沉默组UBE2T mRNA 及蛋白表达均低于阴性对照组和空白对照组(P<0.05),见表2。
表2 各组UBE2T mRNA 及蛋白表达对比Tab.2 Comparison of UBE2T mRNA and protein expressions in each group ±s
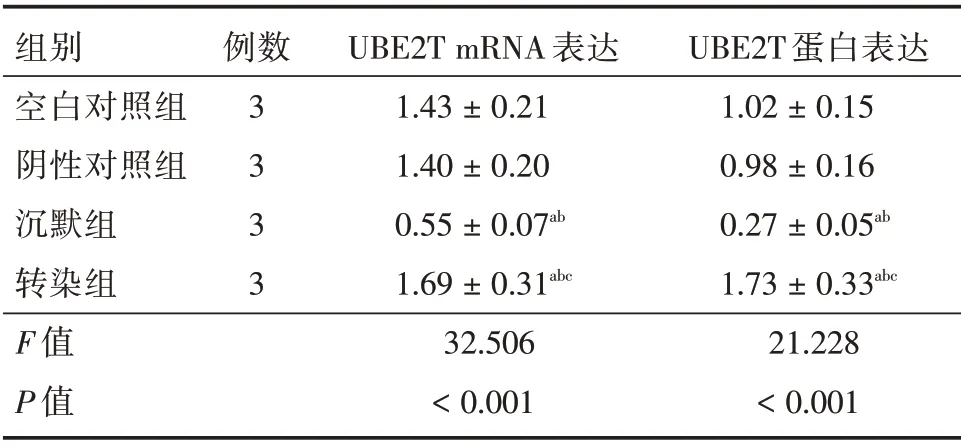
表2 各组UBE2T mRNA 及蛋白表达对比Tab.2 Comparison of UBE2T mRNA and protein expressions in each group ±s
注:与空白对照组比较,aP <0.05;与阴性对照组比较,bP <0.05;与沉默组比较,cP <0.05
组别空白对照组阴性对照组沉默组转染组F 值P 值例数3 3 3 3 UBE2T mRNA 表达1.43±0.21 1.40±0.20 0.55±0.07ab 1.69±0.31abc 32.506<0.001 UBE2T 蛋白表达1.02±0.15 0.98±0.16 0.27±0.05ab 1.73±0.33abc 21.228<0.001
2.4 各组细胞形态学变化 空白对照组、阴性对照组、转染组均可见细胞连接紧密,聚集片状生长,透光性良好;沉默组可见细胞呈圆形或类圆形,排列紊乱,形态多变,相对分散,细胞内颗粒感增强,透光性差,细胞间界限模糊且存活细胞少,见图2。
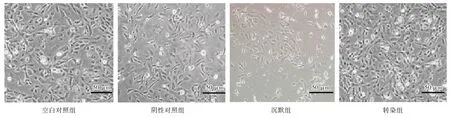
图2 各组细胞形态学变化(倒置相差显微镜,×200)Fig.2 Morphological changes of cells in each group(inverted phase contrast microscope,×200)
2.5 各组细胞增殖抑制率对比 空白对照组、阴性对照组、沉默组、转染组细胞增殖抑制率分别为0、(0±0.01)%、(38.71±9.15)%、(-32.56±6.13)%,沉默组均高于其余3 组(P<0.05),转染组低于空白对照组和阴性对照组(P<0.05)。
2.6 各组细胞周期观察对比 沉默组G1 期高于其余3 组(P<0.05),S 期和G2 期均低于其余3 组(P<0.05),转染组G1 期低于空白对照组和阴性对照组(P<0.05),S 期和G2 期均高于空白对照组和阴性对照组(P<0.05),见图3、表3。
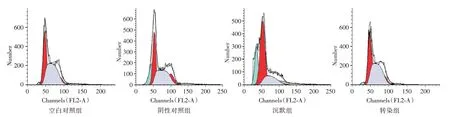
图3 各组细胞周期流式细胞仪检测Fig.3 Cell cycle detection by flow cytometry in each group
表3 各组细胞周期对比Tab.3 Comparison of cell cycle in each group±s
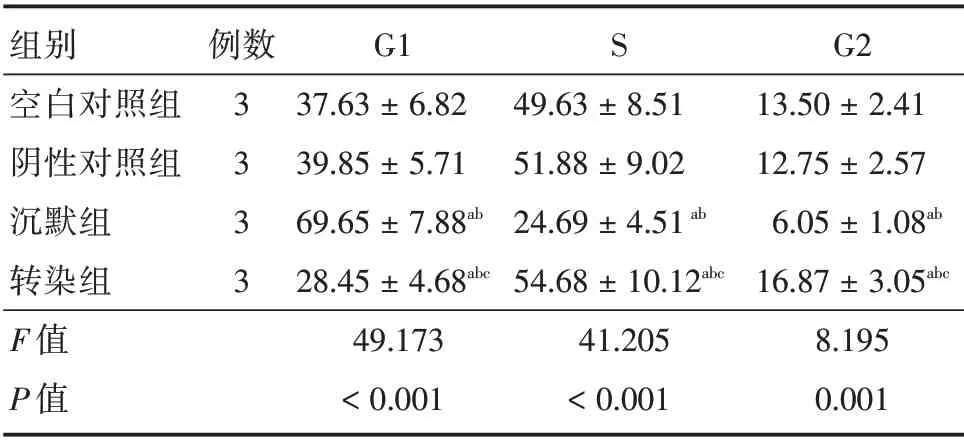
表3 各组细胞周期对比Tab.3 Comparison of cell cycle in each group±s
注:与空白对照组比较,aP <0.05;与阴性对照组比较,bP <0.05;与沉默组比较,cP <0.05
组别空白对照组阴性对照组沉默组转染组F 值P 值例数3 3 3 3 G1 37.63±6.82 39.85±5.71 69.65±7.88ab 28.45±4.68abc 49.173<0.001 S 49.63±8.51 51.88±9.02 24.69±4.51ab 54.68±10.12abc 41.205<0.001 G2 13.50±2.41 12.75±2.57 6.05±1.08ab 16.87±3.05abc 8.195 0.001
2.7 各组细胞AKT、Cyclin D1 mRNA 表达和AKT、Cyclin D1 蛋白表达及p-AKT 对比 沉默组细胞AKT、Cyclin D1 mRNA 及蛋白表达,p-AKT水平均低于其余3 组(P<0.05),转染组AKT、Cyclin D1 mRNA 及蛋白表达,p-AKT 水平均高于空白对照组和阴性对照组(P<0.05),见表4。
表4 各组细胞AKT、Cyclin D1 mRNA 表达、AKT、Cyclin D1 蛋白表达及p-AKT 对比Tab.4 Comparison of Akt and cyclin D1 mRNA expressions,Akt,cyclin D1 proteins and p-Akt levels in cells of each group±s
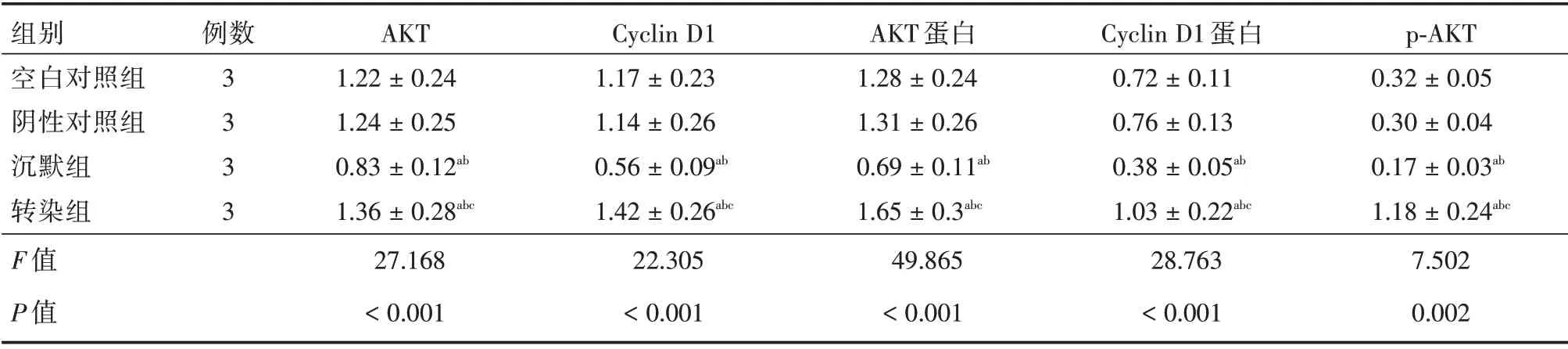
表4 各组细胞AKT、Cyclin D1 mRNA 表达、AKT、Cyclin D1 蛋白表达及p-AKT 对比Tab.4 Comparison of Akt and cyclin D1 mRNA expressions,Akt,cyclin D1 proteins and p-Akt levels in cells of each group±s
注:与空白对照组比较,aP <0.05;与阴性对照组比较,bP <0.05;与沉默组比较,cP <0.05
组别空白对照组阴性对照组沉默组转染组F 值P 值例数3 3 3 3 AKT 1.22±0.24 1.24±0.25 0.83±0.12ab 1.36±0.28abc 27.168<0.001 Cyclin D1 1.17±0.23 1.14±0.26 0.56±0.09ab 1.42±0.26abc 22.305<0.001 AKT 蛋白1.28±0.24 1.31±0.26 0.69±0.11ab 1.65±0.3abc 49.865<0.001 Cyclin D1 蛋白0.72±0.11 0.76±0.13 0.38±0.05ab 1.03±0.22abc 28.763<0.001 p-AKT 0.32±0.05 0.30±0.04 0.17±0.03ab 1.18±0.24abc 7.502 0.002
3 讨论
本研究通过构建UBE2T-shRNA 载体并以慢病毒包装可整合进入基因组并保持长效转染,还转染携带UBE2T 基因的质粒介导人卵巢癌细胞株SKOV3 基因转染从而实现UBE2T 的基因干扰。此外,本研究经不同浓度的puromycin 作用于人卵巢癌细胞株SKOV3,发现细胞加压筛选的最优浓度为2.0 μg/mL,为后期获得高转染率奠定了基础。本研究阴性对照组、沉默组和转染组的转染率均较高,提示获得了稳定表达株;沉默组UBE2T mRNA 与蛋白表达均显著低于其余3 组,且转染组UBE2T mRNA 与蛋白表达均显著高于空白对照组和阴性对照组,表明前期工作已顺利完成。
本研究发现UBE2T 基因沉默可促使人卵巢癌细胞株SKOV3 发生形态学改变,抑制其增殖,且主要是通过阻滞细胞从G1 期向S 期分化实现此作用的;而UBE2T 基因转染则可起反作用。UBE2T 属于泛素蛋白酶降解系统,可参与细胞信号传导、细胞周期调控、细胞增殖和凋亡等[13]。有实验报道显示[14],UBE2T 基因转上调人结直肠癌细胞株中UBE2T 蛋白表达发现其水平升高,同时细胞的增殖能力增强,本研究结果与其具有一致性;此外,有研究[15]利用si-UBE2T 载体沉默鼻咽癌细胞系5-8F 细胞中UBE2T 蛋白表达可降低OD值,同时还可减弱细胞迁移与侵袭能力,本研究报道与其相符;另有临床研究发现肺腺癌组织中UBE2T 蛋白表达高于癌旁正常组织,且与临床分期等密切相关[16]。
本研究表明UBE2T 基因沉默很可能是通过下调AKT、Cyclin D1 mRNA 与蛋白表达和p-AKT 水平实现抑制人卵巢癌细胞株SKOV3 增殖,抑制G1 期向S 期分化的;而UBE2T 基因转染的作用正相反。有研究表明[17],UBE2T 是泛素传递网络中的关键,可通过经典的信号调控通路影响恶性肿瘤的发生和发展。CHEN 等[18]报道显示,UBE2T 基因高表达与癌症的发生和发展相关。AKT 和Cyclin D1 均位于UBE2T 的下游,二者在细胞存活、增殖与凋亡过程中均有重要的调控作用[19]。有报道[20]发现,UBE2T可正向调控AKT的表达,沉默UBE2T基因表达可下调后者的表达,同时还可降低p-AKT 水平,推测可通过此途径抑制恶性肿瘤细胞增殖。本研究结果与上述报道和分析均一致。
综上所述,UBE2T 基因沉默可抑制人卵巢癌细胞株SKOV3 增殖和G1 期向S1 期分化,推测是通过抑制UBE2T、AKT、Cyclin D1 mRNA 与蛋白表达和p-AKT 水平实现此作用的。但沉默UBE2T 是否能够对体内接种SKOV3 肿瘤生长产生抑制作用尚不清楚,且调控UBE2T 基因是如何调控其下游的AKT、Cyclin D1 表达的尚未阐明,后期仍需要进一步探讨。
