基于嘌呤骨架的有机小分子荧光探针的研究进展及展望
2022-07-11许海燕鞠立鑫刘冬兰陆鸿飞
许海燕,鞠立鑫,刘冬兰,陆鸿飞
(江苏科技大学 环境与化学工程学院,镇江212100)
嘌呤衍生物在自然界中分布很广,且具有广谱的药理学活性.嘌呤衍生物是由嘧啶环和咪唑环稠合而成的杂环化合物(图1),可分为两类,一类是天然嘌呤,其中以腺嘌呤和鸟嘌呤为主;另一类则是合成嘌呤,是通过人为地对嘌呤环本身的2, 6, 8, 9位加入不同取代基团而得到的,因此嘌呤衍生物具有结构可修饰性的优点[1].

图1 嘌呤衍生物母体结构
嘌呤及其衍生物具有平面刚性环状结构,而且嘌呤环上含有丰富的氮原子可以有效地与金属离子配位,因此,基于嘌呤骨架设计的荧光分子探针可通过金属离子加入后荧光信号的改变实现对目标金属离子的检测[2].同时,嘌呤及其衍生物,毒性小,生物可降解,价格低廉,因此开发基于嘌呤类衍生物为母体的荧光探针具有很大的潜在应用价值[3].
近年来,荧光探针法以其操作简单、选择性好、灵敏度高、成本低、实时快速,无需破坏样品等优点,成为了石油化工,环境,食品以及生命科学等研究领域的研究热点[4]. 但是目前研究较多的荧光母体(图2)主要是:喹啉,吖啶, 1,10-菲啰啉,1,8-萘酰亚胺,香豆素,荧光素,罗丹明,而基于嘌呤为母体设计的近红外荧光探针研究只有零星的报道,且主要集中于对金属离子的荧光检测.文中旨在总结越来越多的依赖于嘌呤衍生物的独特电子和化学性质用于金属离子检测的荧光探针分子的设计,以及其在生物成像中的应用.
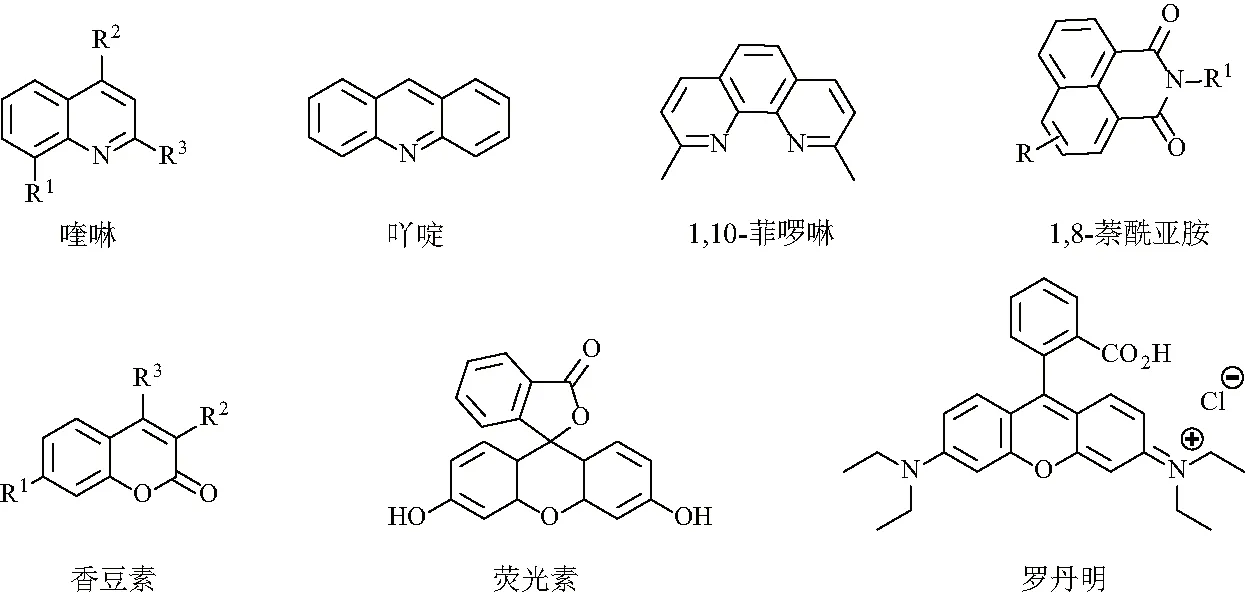
图2 经典的荧光探针母体
1 嘌呤类金属离子检测荧光探针的研究进展
1.1 检测Zn2+的嘌呤荧光探针
锌是自然界中含量较高的一种常见金属,在合金制造、电池制备等各类制造业中被广泛应用.在人体中,Zn2+是人体仅次于铁的第二丰富的过渡金属离子,锌(Zn)离子是许多生物过程的重要辅助因子,并在神经信号传递、金属酶的调节、人体免疫功能及哺乳动物繁殖等方面起重要作用.然而,不合理的Zn2+摄入可能引发多种严重的神经系统疾病,包括阿尔茨海默病和帕金森病等,同时过量的锌离子也会导致代谢的紊乱、糖尿病、癫痫或腹泻的等其它疾病.因此,迫切需要一种高灵敏度、高选择性的检测Zn2+浓度的方法.
2015年,文献[5]设计合成了具有席夫碱结构的嘌呤荧光探针HL1.探针HL1与锌离子螯合时,得到离散的二聚体结构,为绿色荧光配合物,显示出很强的荧光增强.具有6-氨基的配体HL1具有高量子产率,能够检测HeLa细胞中的锌离子.HL1-Zn2+配合物晶体结构显示探针HL1与锌离子的配位比是2∶1,其配位机制如图3.

图3 荧光探针HL1与Zn2+的识别机理
2019年,文献[6]报道了一种基于嘌呤为母体的近红外荧光探针YPT(图4).研究发现该荧光探针YPT可以高选择性地检测金属锌离子在DMSO/H2O(3/2,v/v)体系中,而且最低检出限可达到12 nM.同时,探针YPT对溶液中的Zn2+响应速度非常快(30 s),并伴随着明显的颜色变化(图5).探针YPT与锌离子之间的配位机理也得到了Job’s plot,质谱,核磁滴定以及密度泛函理论计算的支持.此外,探针(YPT)具有低毒性和良好的细胞兼容性,可以成功地用于检测活性HeLa细胞中微量的锌离子(图6).

图4 嘌呤-荧光探针(YPT)的设计与制备

图5 在紫外灯下加入不同竞争离子后荧光探针YPT的颜色变化

图6 在紫外灯下加入不同竞争离子后荧光探针YPT的颜色变化细胞实验图
2020年,文献[7]开发了一种新型基于嘌呤环的锌离子检测的荧光探针分子(PTAHN),其合成路线如图7.PTAHN在pH 7.4的HEPES缓冲系统中对表现出显着高选择性和快速响应,并且荧光明显增强.探针PTAHN对Zn2+的检出限(LOD)(61.6 nM)远低于WHO的标准(76.0 μM).同时,肉眼可以看到PTAHN和PTAHN-Zn2+之间明显的颜色变化.1H NMR和密度泛函理论支持了PTAHN对Zn2 +的传感机制(图8,9).探针(PTAHN)也具有低毒性和良好的细胞兼容性,可以成功地用于检测活性HeLa细胞中痕量的锌离子.
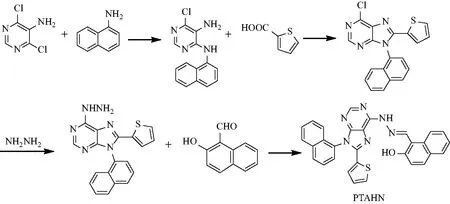
图7 嘌呤-荧光探针(PTAHN)的制备路线
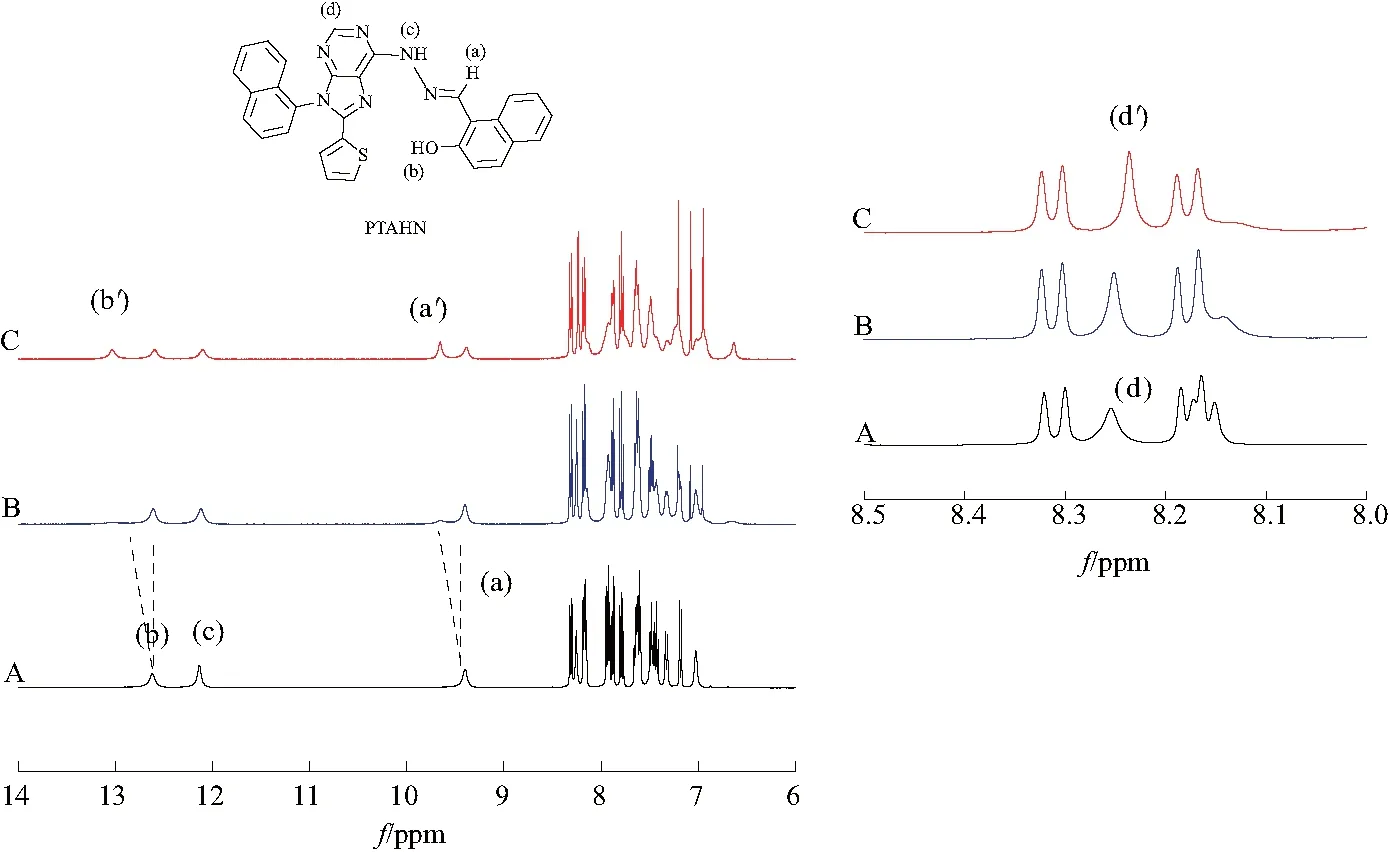
图8 嘌呤-荧光探针(PTAHN)核磁淀图


图9 DFT理论计算图和可能的配位机理图
1.2 检测Cu2+的嘌呤荧光探针
铜(Cu)作为一种微量营养素,作为蛋白质和许多金属酶的催化辅助因子,在人体中起着重要作用.据报道,过量摄入Cu2+会导致人体的许多疾病,包括癌症、神经性疾病、阿尔茨海默氏病、帕金森氏病和胃肠道疾病等.饮用水中Cu2+的最高允许含量被限制为1.3 ppm (~20 μm).因此,实时监测环境中的Cu2+的浓度受到越来越多的关注,开发高灵敏度和高选择性的检测Cu2+的荧光探针尤为重要.
2018年,文献[8]报道了一种基于嘌呤衍生物与2-吡啶甲醛缩合合成的Schiff碱荧光探针PHP.研究发现探针(PHP)不仅对铜离子响应时间短、选择性高、检出限低,而且与铜离子配位后的PHP-Cu2+配合物可以有效地检测硫负离子.探针PHP对Cu2+的检出限(LOD)为2 μM,且与Cu2+配位后,发射峰出现明显红移,是一种性能优良的荧光探针分子.探针PHP还可以制备成荧光试纸,研究发现随着Cu2+浓度增加,试纸颜色会加深,可以用于实时检测环境中的铜离子含量,操作简单,成本低.此外,探针PHP与Cu2配位后的配合物结构得到了单晶结构的验证.从单晶PHP-Cu2+配合物的结构我们知道嘌呤环不仅可以提供大π 键,而且环上的N原子也参与了配位.图10为探针PHP合成路线图.

图10 嘌呤-荧光探针(PHP)的制备路线
2020年,文献[9]利用吲哚醛设计并合成了一种新型基于嘌呤为母体的荧光探针PTAID.该探针PTAID在DMSO/H2O的混合溶液中表现为对Cu2+的荧光淬灭.同时,荧光探针PTAID也可以通过荧光猝灭用于检测钯离子.通过荧光滴定实验和 Job’s plot曲线推测了探针与Cu2+和Pd2+的配位比分别为1∶1和2∶1,图11为探针PTAID的合成路线图.图12为探针PTAID与Cu2+和Pd2+结合机理图.

图11 嘌呤-荧光探针(PTAID)的制备路线
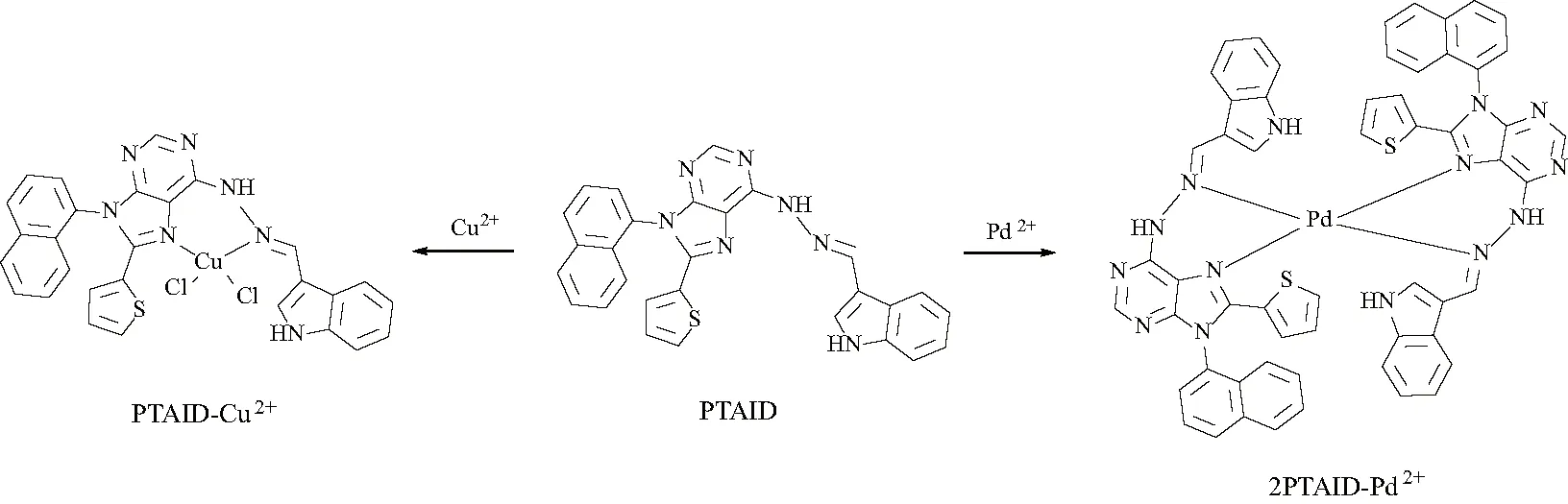
图12 嘌呤-荧光探针(PTAID)分别与Cu2+和Pd2+的络合机理
1.3 检测Pd2+的嘌呤荧光探针
钯(Pd)作为一种稀有的铂族元素,由于其在燃料电池、不饱和烃加氢、珠宝等工业生产中起到重要作用而受到人们的广泛关注.然而,过量残留的钯离子往往会进入环境,包括土壤、植物和河流.在这种情况下,钯离子最终将通过被污染的食物、药物和水摄入身体中,从而会对我们的身体健康产生不利影响.例如,Pd2+可能与含硫醇的氨基酸、蛋白质、DNA等生物分子等结合而对正常的生理过程造成干扰.因此,需要开发一种能检测Pd2+的有效方法.
2013年,文献[10]报道了一种基于推拉式嘌呤核苷型荧光探针L1,是第一个基于Pd2+的“开-关”型嘌呤核苷荧光传感器.探针L1是在C6位置处螯合N,N-二(2-吡啶甲基)胺基官能团,在(10% DMSO, v/v)的缓冲液对Pd2+具有高灵敏度和选择性.探针L1与Pd2配位后表现为荧光淬灭.图13为嘌呤核苷型荧光探针L1-L3的合成路线图.

图13 推拉式嘌呤核苷型荧光探针L1-L3的合成路线
2019年,文献[11]利用罗丹明荧光团设计并合成了一种新型基于嘌呤为母体的荧光探针RBTP.传感器RBTP对Pd2+在EtOH / H2O溶液(3/2,v / v,pH 7.4,HEPES缓冲液,0.5 mM)中表现出高灵敏度和选择性.传感器RBTP与Pd2+配位时,不仅有由无色到粉红色的肉眼颜色变化,而且还显示出“开启”荧光,即荧光增强.荧光滴定分析显示传感器RBTP对Pd2+的检测限为49.5 nM.研究发现RBTP的荧光强度与Pd2+的浓度(0-40 μM)之间具有线性关系,说明荧光探针RBTP可以定量检测环境中的Pd2+.探针RBTP的晶体结构得到了X射线衍射验证.图14为嘌呤-荧光探针(RBTP)的设计路线图.图15为探针RBTP与Pd2+配位机理以及相应的颜色变化图.

图14 嘌呤-荧光探针(RBTP)的制备路线

图15 荧光探针(RBTP)与Pd2+可能的配位机理
1.4 检测Co2+的嘌呤荧光探针
钴(Co)作为人体中必需的微量元素之一,钴在人体中铁的代谢和血红蛋白的合成以及红细胞数量的增加起不可替代的作用.同时,钴是维生素B12(钴胺素)和其他生物化合物的重要组成部分.然而,含量过多的Co2+不仅会引发严重的生理疾病,如哮喘、心脏病、肺病和血管扩张等,也会造成严重的环境污染,环境中过量的Co2+也会抑制微生物的代谢和生长.因此,开发一种高效快速的检测环境和人体中的Co2+浓度的分析方法具有重要意义.
2020年,文献[12]报道了一种基于嘌呤衍生物与香豆素的缩合检测Co2+荧光探针CMP (图16).探针CMP在DMSO/H2O(3/2, v/v)的混合溶液中对钴离子表现为荧光淬灭, 溶液颜色由无色变为粉红色.探针CMP对钴离子具有很高的选择性,其检出限为0.487 μM.
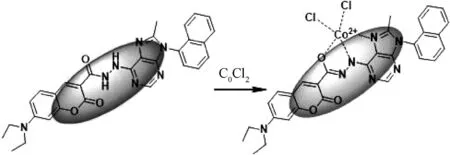
图16 探针CMP与Co2+荧光响应及配位模式
1.5 检测Al3+的嘌呤荧光探针
铝是地球表面上第三多的元素,在现代日常生活中广泛应用于工业和民用领域,例如电子,建筑材料,食品包装材料,药品,水净化系统和其他领域.但是,由于铝在工业生产中的广泛应用,可能会被动扩散到生态系统中,这对人类的居住环境和健康带来了潜在的有毒威胁.更重要的是,研究有表明过量的铝的摄入可能导致严重的中枢神经系统问题和骨骼疾病,例如阿尔茨海默氏病,肌萎缩症侧索硬化症,贫血,帕金森氏病和骨质疏松症等.世界卫生组织(WHO)报告,每日Al3+的可接受限量铝摄入量约为3-10毫克,每周可耐受铝摄入量约为7毫克/千克.因此,鉴于不可避免的使用和潜在生态毒理效应,高灵敏度地监测Al3+的浓度水平在环境和其他科学领域的研究至关重要.
2020年,文献[13]设计并合成一种检测Al3+的基于嘌呤为母体的荧光探针WYW(图17).当加入Al3+后,探针WYW的DMSO/H2O(9/1, v/v)的缓冲溶液荧光明显增强并肉眼可见由无色变为蓝绿色,而在加入其它金属离子,并没有出现荧光强度增强现象,这表明该荧光探针WYW对Al3+具有高选择性和高灵敏度.除此之外,原位生成的荧光探针WYW-Al3+配合物可以有效地通过荧光猝灭检测氟离子,系统颜色由蓝绿色变为无色,可能的原因是为F-从WYW-Al3+配合物中捕获Al3+,释放出荧光探针WYW和AlF63-, 这个实验现象也说明了探针WYW具有化学可逆性.Job’s plot曲线图表明该探针WYW与Al3+的配位比为1∶1.结合1H NMR和密度泛函理论计算进一步证实了该荧光探针WYW与Al3+的配位模式,即最优结构模式为亚胺(C=N),嘌呤环上的氮原子以及苯醛上的邻位羟基共同与Al3+配位(图18).
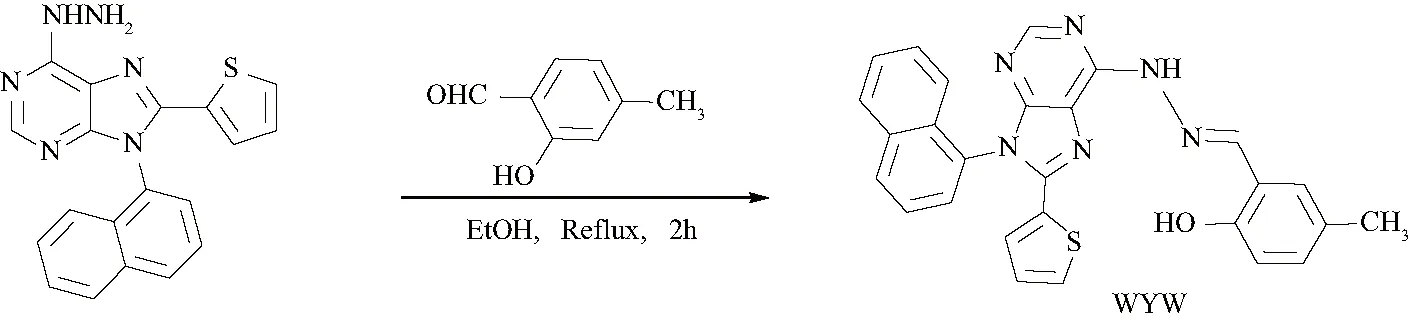
图17 探针WYW的合成路线

图18 探针WYW和Al3+的1H NMR滴定图以及DFT计算图
细胞实验即探针WYW可以在HeLa细胞中与痕量Al3+细胞成像,说明探针WYW渗透性好且毒性低.图19为探针WYW与Al3+的配位机制及细胞实验.探针试纸实验说明探针WYW可以实时定量检测环境中铝离子的含量.图20为探针WYW作为试纸检测固态定量检测痕量锌离子.
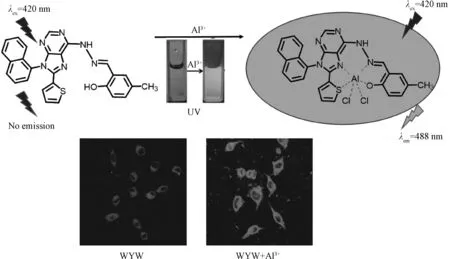
图19 探针WYW与Al3+的配位机制以及细胞成像

图20 加入不同浓度Al3+后的荧光探针试纸颜色变化
1.6 检测其它金属离子
1.6.1 检测Hg2+的嘌呤荧光探针
2014年,文献[14]设计并合成了一种新型的基于推拉式嘌呤核苷荧光探针L1(图21),探针L1对Hg2+有很高的灵敏度和选择性在CH3CN-H2O (92/8, v/v)溶液中,而且检出限为7.8×10-8M.同时,荧光传探针L1与Hg2+的浓度呈线性正比,可用于定量分析Hg2+的含量.

图21 基于推拉式嘌呤核苷的荧光传感器L1的配位机制
1.6.2 检测Ag+的嘌呤荧光探针
2010年,文献[15]首次合成了在C6处含有冠醚基团的嘌呤类荧光探针2j.该冠醚-嘌呤类似物在水环境中对Ag+的微摩尔浓度表现出高选择性和高效的信号传导行为,图22为含有冠醚-嘌呤基团的荧光探针2j的制备路线.
2012年,文献[16]将七甲胺花青染料与腺嘌呤结合,设计了一种基于嘌呤为母体的荧光探针A,并用于选择性检测水性介质中的金属银离子(Ag+),而且检出限为60 nM (图23).9-取代的腺嘌呤提供三个主要的配位点N1,N3和N7,其中N1和N7主要用于金属离子配位.虽然大多数腺嘌呤与金属离子的配合物表现出单配体和二齿配体模式,但在银-腺嘌呤金属四元组中观察到9N取代腺嘌呤的3N(μ-N1,N3,N7)配体模式.

图22 荧光探针2j的合成路线

图23 荧光探针A的合成路线
综上所述,目前利用嘌呤衍生物为骨架设计合成的荧光探针研究还比较缺乏,而且已报道的嘌呤-荧光探针仅限于少量的金属离子,如 Zn2+, Pd2+, Al3+, Hg2+, Cu2+等金属离子的检测.而且,目前发表的嘌呤类荧光探针多数是基于Schiff碱反应制备而成,虽然Schiff碱类荧光探针合成步骤简单,容易与金属离子螯合.但是大多数基于Schiff碱的荧光化学传感器都具有较差的水溶性,并且只有在水和有机溶剂的混合溶剂甚至是纯有机介质中才能表现出良好的选择性和灵敏度,这极大地限制了嘌呤类荧光探针在生理条件下的应用,其中,一个事实就是有机溶剂本质上是有毒的,不适用于生物系统.因此,开发用于基于嘌呤-Schiff碱的水溶性荧光化学传感器进行选择性和灵敏检测纯水介质中的金属离子非常具有挑战性.
近年来,基于聚合物的荧光化学传感器用于金属离子检测由于其独特的优势而备受关注,例如信号放大,多个输出的轻松组合以及制备简单.其中,聚乙二醇(PEG)是一种众所周知具有生物相容性的水溶性高分子.因此,PEG作为构建水溶性荧光化学传感器的高效水溶性高分子基质引起了广泛的关注.
2 PEG导向的水溶液荧光探针研究进展
2014年,文献[17]通过将水溶性的PEG单元附加到罗丹明衍生物上,开发了一种检测水中汞离子的水溶性开启荧光探针Rh1(图24).该探针Rh1对Hg2+具有很高的灵敏度(检出限0.14 ppm)和选择性,并伴随着由粉红色到橙色明显的颜色变化.更重要的是该探针Rh1毒性低且具有很好的细胞渗透性,可以有效地检测活性HeLa细胞中的痕量Hg2+.
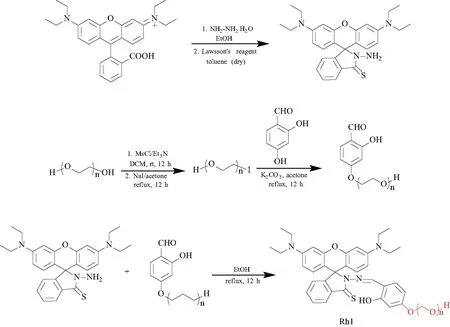
图24 水溶性荧光探针Rh1合成路线
2020年,文献[18]合成了一种PEG功能化呋喃席夫碱荧光探针(PEGFB)(图25).探针PEGFB可以高灵敏度地在水溶液中检测痕量金属铝离子,而且伴随着明显的颜色变化.PEGFB对Al3+的最低检出限为7.9×10-9M.同时,依次添加Al3+和EDTA到PEGFB溶液的可逆荧光响应被成功用于构建INHIBIT分子.

图25 水溶性荧光探针PEGFB合成路线
3 总结与研究展望
综上所述,目前利用嘌呤衍生物为骨架设计合成的荧光探针研究还比较缺乏,而且已报道的嘌呤类荧光探针仅限于少量的金属离子,如Pd2+, Cu2+, Co2+, Al3+等金属离子的检测且由于探针本身的溶解性,只有在水和有机溶剂的混合溶剂甚至是纯有机介质中才能表现出良好的选择性和灵敏度.在未来,利用PEG等水溶性基团作为官能团,设计与制备一系列具有高灵敏度和高选择性的基于嘌呤为母体结构的新型水溶性荧光探针,并将其用于纯水介质以及生物细胞中痕量金属离子的检测,对环境检测、生命科学以及生物学研究都具有重要的意义和应用价值.
