DNA结合分化抑制蛋白-1促进乳腺癌细胞干细胞特性与血管形成的机制初探
2022-07-11贺洪洲李太军李小荣
贺洪洲,陈 萍,梁 华,李太军,李小荣
(内江市第一人民医院甲状腺乳腺外科,四川 内江 641000)
乳腺癌是女性常见的癌症类型,全世界每年有超过150万女性被诊断出患有乳腺癌,占女性所有癌症的25%[1]。乳腺癌通常从导管过度增殖开始,在各种致癌因素的不断刺激下发展为良性肿瘤,后续形成转移癌,且可以转移到骨、肝、肺和脑等远处器官,导致无法治愈[2-3]。近年来,乳腺癌的理论与临床研究均取得了很大进展,患者的病死率也有所下降,但据统计乳腺癌仍然是20~59岁女性癌症死亡的首要原因。
DNA结合分化抑制蛋白-1(inhibitors of DNA binding-1,ID-1)是一种螺旋—环—螺旋(helix-loop-helix,HLH)蛋白,可与HLH家族转录因子成员形成异源二聚体,其编码的蛋白质没有DNA结合活性,但会抑制与其相互作用的HLH蛋白质的DNA结合及转录[4]。ID-1参与细胞生长、衰老和分化过程,并且与多种肿瘤的发生及转移具有相关性[5-6]。已有研究表明,ID-1 mRNA在乳腺癌组织中高表达,且其与患者的无病生存率和总体生存率呈负相关[7]。鉴于此,本研究通过建立抑制或过表达ID-1的乳腺癌细胞系,经体外实验探究ID-1是否参与调控乳腺癌细胞干细胞特性及血管形成,并探讨其分子机制,以期为乳腺癌的治疗提供新的靶标。
1 材料与方法
1.1 临床资料
收集2019年6月至2020年12月在我院进行手术切除治疗的女性乳腺浸润性癌(非特指型)患者的癌组织与癌旁组织标本共42例。患者年龄29~68岁,平均(46.58±4.50)岁。所有患者的临床、病理资料均完整,术前均未接受放疗、化疗、免疫制剂治疗等,未患其他肿瘤或重大疾病。按2019版WHO乳腺肿瘤分类标准[8]对患者进行分级分期:Ⅰ级3例、Ⅱ级29例、Ⅲ级10例;TNM分期:Ⅰ期4例、Ⅱ期31例、Ⅲ期 7例;有淋巴结转移者31例,无淋巴结转移者11例。本研究已通过我院医学伦理委员会批准(审批号:20190528128),组织标本收集前患者或家属均知情同意。
1.2 主要材料与试剂
人乳腺癌细胞系SUM159和人脐静脉内皮细胞HUVECs(中科院上海细胞库),Ham’s F-12K培养液、青霉素、链霉素及胰蛋白酶(美国HyClone公司),Lipofectamine 2000转染试剂盒和Trizol试剂盒(美国Invitrogen公司),SensiFast cDNA合成试剂盒和SensiFastTMSYBR Hi-ROX试剂盒(美国Meridian公司),肿瘤细胞球诱导因子(美国Sigma公司),细胞培养板和Matrigel胶(美国Corning 公司),PVDF膜(瑞氏Roche公司),结晶紫染液、DAB免疫组织化学染色试剂盒和BeyoECL Plus试剂盒(上海碧云天生物研究所),免疫荧光染色试剂盒(南京博恩生物公司),辣根过氧化物酶标记的山羊抗兔和异硫氰酸荧光素荧光标记的小鼠抗兔(北京博奥森公司),ID-1、p-Src、Src及GAPDH抗体(英国Abcam公司),shRNA-NC、shRNA-ID-1、pcDNA3.1-NC和pcDNA3.1-ID-1质粒以及引物序列均由广州锐博生物公司构建合成。
1.3 方法
1.3.1 免疫组织化学染色 将收集的乳腺癌组织及癌旁组织置于4%多聚甲醛中,室温固定过夜,制备蜡块,切成厚度为4 μm的切片。65 ℃烤箱内烤片2 h,二甲苯脱蜡,梯度酒精水化,流水冲洗后,置于枸橼酸缓冲液煮沸15 min修复抗原,冷却后,通过3%过氧化氢去离子水温育10 min去除内源性过氧化氢酶活性,再以10%山羊血清于37 ℃下封闭非特异性抗原30 min。加入一抗工作液,4 ℃共孵育过夜,次日,弃去一抗工作液,加入对应二抗,37 ℃孵育40 min,PBS清洗后,利用DAB显色液显色,苏木素复染,1%盐酸酒精分色3 s,梯度酒精脱水,二甲苯透明,中性树胶封片,普通光学显微镜下观察并摄取图片。ID-1主要表达于细胞质,着色显示棕黄色至棕色颗粒表示阳性。阳性细胞率评分:≤5%记0分,6%~25%记 1分,26%~50%记2分,51%~75%记3分,≥76%为 4分;染色强度评分:无色记0分,黄色记1分,棕黄色记2分,棕色至棕褐色记3分。两项指标得分的乘积为 0~4分表示阴性结果,5~12分表示阳性结果。
1.3.2 细胞培养与转染 将SUM159细胞复苏后,添加含10%胎牛血清和1%青—链霉素双抗的Ham’s F-12K培养液,置于37 ℃、5%CO2培养箱中培养。待细胞生长至80%~90%时,用0.25%胰蛋白酶消化,传代继续培养。将细胞随机分为Control组、shRNA-NC组、shRNA-ID-1组、pcDNA3.1-NC组、pcDNA3.1-ID-1组,采用Lipofectamine 2000将shRNA-NC、shRNA-ID-1、pcDNA3.1-NC和pcDNA3.1-ID-1质粒分别转染至对应组的SUM159细胞中,按照试剂盒说明书操作,转染48 h后,收集各组细胞和培养上清液,进行后续实验,Control组细胞正常培养,不进行转染。
1.3.3 实时荧光定量聚合酶链反应(qRT-PCR) 在各组SUM159细胞中加入Trizol试剂液,使细胞充分裂解,按试剂盒说明书步骤提取细胞总RNA,核酸测定仪测定RNA含量和纯度。利用一步法qRT-PCR进行反转录实验,按照SensiFast cDNA合成试剂盒说明书进行操作。以获得的cDNA为模板,在qRT-PCR系统中进行扩增,检测ID-1 mRNA相对表达量,按照SensiFastTMSYBR Hi-ROX试剂盒说明书进行操作,以β-actin作为内参基因。扩增条件:95 ℃ 2 min;95 ℃ 5 s、60 ℃10 s,共40个循环。引物序列:ID-1上游序列5’-ACGGCTGTTACTCACGCCTC-3’,下游序列5’-GCTGGAGAATCTCCACCTTGC-3’;β-actin上游序列5’-TGCGTGACATGAGAAG-3’,下游序列5’-GCTCGTAGCTTCTCCA-3’。以2-ΔΔCt计算ID-1 mRNA相对表达量。
1.3.4 平板集落形成实验 将各组SUM159细胞制备成单细胞悬液,按照每皿500个细胞的密度接种于细胞培养皿中,轻轻晃动使细胞均匀分散,置于37 ℃、5%CO2培养箱中静置培养,当出现肉眼可见的集落时,终止培养,甲醇室温固定,0.1%结晶紫染色,PBS清洗后,显微镜下计数各组的集落数目。
1.3.5 肿瘤球形成实验 将各组SUM159细胞以1×104/孔的密度接种于低黏附细胞6孔板中,添加含有10 ng/mL bFGF、5 μg/mL胰岛素、4 g/L BSA、1% B27及20 ng/mL EGF的培养液,置于37 ℃、5% CO2培养箱中培养1周,倒置显微镜下观察肿瘤球体的形成与生长情况,并获取图像,计数球体个数。
1.3.6 HUVECs小管形成实验 将Matrigel胶在4 ℃下过夜溶解,与缓冲液按照1∶1比例混合进行稀释,取50 μL加入96孔板中,均匀铺开,置于37 ℃下至基质胶成固体状。待HUVECs细胞消化后,收集转染后各组细胞培养上清液与无血清细胞培养液按照1∶1比例混合,重悬HUVECs细胞,调整细胞密度,以1×104/孔的密度接种于铺好Matrigel胶的96孔板内,将培养板置于37 ℃、5%CO2的培养箱中培养10 h后,倒置显微镜下观察各组成管效果并摄取图像,采用Image J软件进行分析。
1.3.7 免疫荧光染色法 将各组SUM159细胞以1×105/皿的密度接种于含爬片的培养皿,置于37 ℃、5%CO2培养箱中过夜培养,PBS清洗爬片,使用4%多聚甲醛室温固定20 min,加入细胞通透剂0.1% Triton X-100处理5 min后,再以5% BSA封闭穿孔20 min,PBS清洗后,于玻片上滴加一抗工作液,4 ℃孵育过夜,次日弃去一抗工作液,并加入荧光二抗,避光条件下室温染色2 h,PBS清洗,用DAPI在避光条件下孵育15 min,中性树胶封片,通过倒置荧光显微镜观察染色情况并摄取图像。
1.3.8 Western blot 在各组SUM159细胞中添加含NP-40的PIPES缓冲液裂解细胞,获得细胞总裂解物,BCA法检测蛋白浓度。制备12% SDS-PAGE,取40 μg蛋白样品上样,通过电泳分离,将分离的蛋白转至PVDF膜上,用5%脱脂奶粉室温封闭1 h后,TBST洗膜,再将膜浸泡在一抗工作液中4 ℃孵育过夜,次日TBST洗膜,将膜与对应二抗工作液共孵育2 h,TBST再次清洗后,使用BeyoECL显色,以GAPDH作为内参蛋白,采用Image J软件分析各蛋白条带灰度值,以目的蛋白与内参蛋白的灰度值比值作为目的蛋白相对表达量。
1.4 统计学分析
2 结果
2.1 乳腺癌组织及癌旁组织中ID-1表达
免疫组织化学染色结果显示,乳腺癌组织中ID-1阳性表达率为85.71%(36/42),癌旁组织中ID-1阳性表达率为7.14%(3/42),乳腺癌组织中ID-1阳性表达率显著高于癌旁组织(P<0.05),见图1。

a:癌旁组织;b:乳腺癌组织图1 乳腺癌组织及癌旁组织ID-1表达(免疫组织化学染色×100)
2.2 各组乳腺癌细胞ID-1表达比较
SUM159细胞转染后,qRT-PCR和Western blot检测结果显示,与Control组和shRNA-NC组比较,shRNA-ID-1组ID-1 mRNA与蛋白表达水平均显著下调(P<0.05);与Control组和pcDNA3.1-NC组比较,pcDNA3.1-ID-1组ID-1 mRNA及蛋白表达水平均显著上调(P<0.05),见图2。由此说明,成功得到抑制或过表达ID-1的SUM159细胞。

*:与Control组比较,P<0.05;#:与shRNA-NC组比较,P<0.05;△:与pcDNA3.1-NC组比较,P<0.05图2 各组SUM159细胞ID-1 mRNA及蛋白表达比较
2.3 ID-1对乳腺癌细胞干细胞特性的影响
平板集落形成实验结果显示,与Control组和shRNA-NC组比较,shRNA-ID-1组SUM159细胞集落形成数目显著减少(P<0.05),SUM159细胞集落形成能力降低;与Control组和pcDNA3.1-NC组比较,pcDNA3.1-ID-1组SUM159细胞集落形成数目显著增加(P<0.05),说明SUM159细胞集落形成能力增强,见图3。

*:与Control组比较,P<0.05;#:与shRNA-NC组比较,P<0.05;△:与pcDNA3.1-NC组比较,P<0.05图3 各组SUM159细胞克隆形成比较
肿瘤球形成实验结果显示,与Control组和shRNA-NC组比较,shRNA-ID-1组形成的肿瘤球体体积明显变小,球体数目显著减少(P<0.05);与Control组和pcDNA3.1-NC组比较,pcDNA3.1-ID-1组形成的肿瘤球体体积明显增大,球体数目显著增多(P<0.05),见图4。
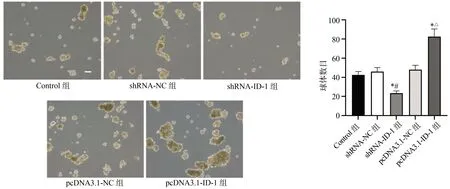
*:与Control组比较,P<0.05;#:与shRNA-NC组比较,P<0.05;△:与pcDNA3.1-NC组比较,P<0.05图4 各组SUM159细胞肿瘤球形成比较
2.4 ID-1对HUVECs小管生成的影响
HUVECs小管形成实验结果显示,与Control组和shRNA-NC组比较,shRNA-ID-1组HUVECs形成的分支点数减少(P<0.05);与Control组和pcDNA3.1-NC组比较,pcDNA3.1-ID-1组HUVECs形成的分支点数显著增加(P<0.05),见图5。
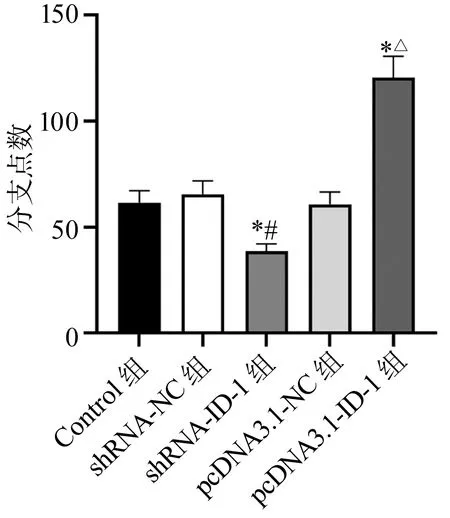
*:与Control组比较,P<0.05;#:与shRNA-NC组比较,P<0.05;△:pcDNA3.1-NC组比较,P<0.05图5 各组HUVECs小管生成比较
2.5 ID-1对乳腺癌细胞中Src激酶活化的影响
免疫荧光染色检测各组SUM159细胞中p-Src表达,以绿色荧光标记,结果如图6所示,可见Control组、shRNA-NC组以及pcDNA3.1-NC组细胞中均有绿色荧光表达,而shRNA-ID-1组细胞中未见明显的绿色荧光表达,同时,pcDNA3.1-ID-1组细胞中有较强的绿色荧光表达,说明过表达ID-1促进了Src激酶活化。

图6 各组SUM159细胞内p-Src表达(免疫荧光染色×100)
Western blot检测结果显示,与Control组和shRNA-NC组比较,shRNA-ID-1组SUM159细胞中p-Src蛋白表达水平显著下调(P<0.05);与Control组和pcDNA3.1-NC组比较,pcDNA3.1-ID-1组细胞中p-Src蛋白表达水平显著上调(P<0.05),见图7。
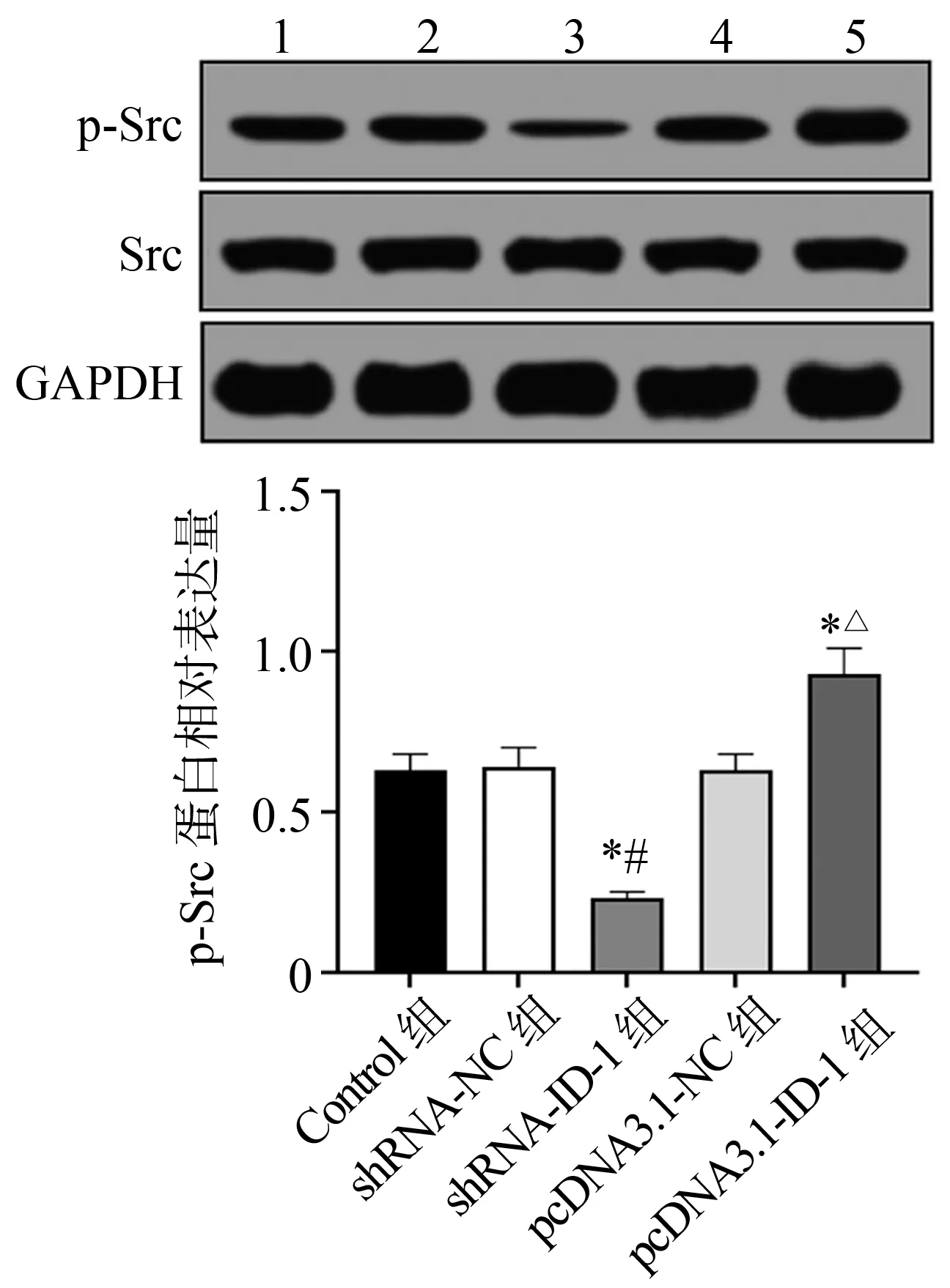
1:Control组;2:shRNA-NC组;3:shRNA-ID-1组;4:pcDNA3.1-NC组;5:pcDNA3.1-ID-1组 *:与Control组比较,P<0.05;#:与shRNA-NC组比较,P<0.05;△:与pcDNA3.1-NC组比较,P<0.05图7 各组SUM159细胞内p-Src与Src蛋白表达比较
3 讨论
目前,乳腺癌临床治疗中最关键的问题是缺乏敏感有效的分子靶点,大多数乳腺癌患者确诊时已处于晚期,预后较差且病死率偏高[1]。乳腺癌病理过程较为复杂,涉及多种细胞活动以及相关信号通路的相互作用。因此,准确了解乳腺癌的发病分子机制将有助于发现有价值的生物标志物用于早期诊断或预测临床结果。肿瘤干细胞(cancer stem cells,CSCs)是血液系统恶性肿瘤和实体瘤中存在的特定细胞亚群,首次在人类急性髓系白血病中被检测到,CSCs具有较高的恶性程度,能够促进肿瘤转移与复发,并可使肿瘤细胞对治疗药物产生抵抗[9]。除了具备常见的肿瘤细胞能力(如迁移和侵袭),CSCs还表现出特征性的干细胞特性,包括分化潜能多向、自我更新能力强和肿瘤起始细胞的作用。越来越多的证据表明,CSCs与胰腺癌、结肠癌、前列腺癌和乳腺癌等多种癌症的发生和进展密切相关,可促进肿瘤细胞增殖以实现肿瘤异质性,通过调节CSCs的分化和自我更新是治疗乳腺癌的有效方式[10-12]。
ID-1在多个实体肿瘤中过表达,并且与肿瘤的高度侵袭性及患者的不良临床结局密切相关,此外,ID-1还在胚胎神经干细胞维持自我更新和多能性方面发挥重要作用[6,13]。Sun等[14]研究发现,ID-1通过激活Wnt/β-catenin、Shh以及ID-1-c-Myc-PLAC8信号通路来维持结直肠癌细胞的干细胞特性,并促进肿瘤细胞的上皮间质转化。Li等[15]通过使用小干扰RNA敲低胃癌细胞中ID-1表达后发现,肿瘤干细胞关键相关因子Nanog和Oct-4的表达均受到抑制,并减弱了胃癌细胞中干细胞的自我更新能力,同时也降低了胃癌细胞增殖及对顺铂化疗的抵抗。Cook等[16]的研究指出,ID-1在胶质母细胞瘤中作为自我更新的肿瘤干细胞特性标记物,通过Cox-2衍生的PGE2激活ERK1/2-MAPK信号通路诱导ID-1表达,促进胶质母细胞瘤细胞的自我更新与辐射抗性产生。本研究通过将shRNA-ID-1和pcDNA3.1-ID-1转染至乳腺癌细胞系SUM159,并在基因和蛋白水平验证抑制或过表达效率,经检测发现,在SUM159细胞中抑制ID-1表达后,细胞集落形成数目明显减少,形成的肿瘤球体体积明显变小且球体数目减少,说明抑制ID-1表达减弱了SUM159细胞的干细胞特性;而在过表达ID-1的SUM159细胞中,作用与抑制后完全相反,细胞集落形成数目和肿瘤球体数目显著增加。由此推测,抑制ID-1表达可以降低乳腺癌细胞的干细胞特性。
肿瘤转移是肿瘤患者治疗失败和死亡的主要原因。肿瘤血管生成是肿瘤进展的必要条件,其通过提供营养和氧气,为肿瘤生长及转移提供保障。血管生成是一个高度调节的过程,其中促血管生成因子和抗血管生成因子之间的相互作用介导了血管内皮在血管生成不同阶段的转变,研究者们通过对肿瘤血管生成的不断探究,很多靶向血管生成的药物已投入临床使用[17]。目前,在乳腺癌患者手术或放/化疗的基础上,辅以靶向血管生成的治疗方法,可能对肿瘤转移起到进一步的控制作用。已有研究表明,ID-1参与多条骨肉瘤血管生成相关通路,通过上调骨肉瘤细胞中VEGF-A的表达来促进骨肉瘤血管生成[18];ID-1可以通过介导激活PI3K/Akt和NF-κB/MMP-2信号通路来增强卵巢癌内皮祖细胞血管生成,因此ID-1及其下游效应子可作为治疗卵巢癌的潜在靶点[19];此外,在胶质瘤中ID-1和VEGF的表达呈正相关,在肿瘤血管生成过程中起协同作用[20]。这些研究结果均提示ID-1可作为抗肿瘤血管生成的治疗靶点。本研究中,采用抑制ID-1表达的乳腺癌细胞培养上清液处理HUVECs能够减少小管生成,过表达ID-1的乳腺癌细胞培养上清液处理HUVECs则明显促进了小管生成,与上述研究结果一致。
迄今为止,ID-1在肿瘤中发挥作用的潜在机制尚未充分阐明。Src激酶家族是一类非受体酪氨酸激酶,作为一种多效激活剂,可介导由G蛋白偶联受体、β1-整联蛋白、生长因子受体等启动的众多信号转导通路,在肿瘤发生发展中起着关键作用,参与调节各种肿瘤细胞的增殖、迁移、侵袭和上皮间质转化等过程[21-22]。Src激酶活化后可与下游靶标因子相互作用,促进肿瘤进展。本研究通过检测发现,抑制ID-1表达的SUM159细胞中未见明显的p-Src标记绿色荧光表达,p-Src蛋白表达受到抑制,而过表达ID-1的细胞中有较强的绿色荧光表达,p-Src蛋白表达增加,由此说明,ID-1可能具有促进Src激酶活化的作用。
综上,本研究通过检测乳腺癌组织以及体外细胞发现,ID-1在乳腺癌组织中高表达,其能够增加乳腺癌细胞干细胞特性,并且促进肿瘤血管生成,该作用机制可能与激活Src激酶途径有关,由此推测ID-1有望成为乳腺癌治疗的新靶点。但关于ID-1具体如何调控Src激酶表达以及该途径是否涉及其他分子机制,有待后续进行更为深入的研究来阐明。
