Exendin-4对hIAPP转基因鼠胰岛功能的改善作用
2022-07-11刘辰邹庆宝赵济全
刘辰 邹庆宝 赵济全
[摘要]目的探究Exendin-4对hIAPP转基因鼠的保护作用及其可能的作用机制。方法正常小鼠和hIAPP转基因鼠分别注射PBS和Exdendin-4,共分為四组:正常小鼠对照组(WT+PBS)、正常小鼠注射Exendin-4组(WT+Ex-4)、hIAPP小鼠对照组(homo+PBS)、hIAPP小鼠注射Exendin-4组(homo+Ex-4),每组6只。对四组小鼠进行2个月每天一次的腹腔注射,给药结束后进行葡萄糖耐受实验;体外培养Min6胰岛β细胞,取对数生长期细胞分别加入2.5、5、10、20μM的hIAPP完全培养基,检测细胞周期相关蛋白的表达;分离小鼠原代胰岛细胞,AnnexinV-FITC检测细胞凋亡;提取小鼠胰腺组织蛋白,检测周期相关蛋白表达水平变化。结果homo+PBS组小鼠葡萄糖耐受能力显著降低,差异有统计学意义(P<0.05),hIAPP体外处理Min6细胞会剂量依赖式下调ABC蛋白及周期相关蛋白CCND2和CCND3的蛋白表达。相反,homo+Ex-4组的小鼠葡萄糖耐受能力显著增强,差异有统计学意义(P<0.05),原代胰岛细胞的凋亡比例明显降低,细胞周期蛋白CCND2和CCND3的表达水平增加。结论Exendin-4对hIAPP转基因鼠造成的胰岛损伤具有保护作用,其机制与调控胰岛细胞增殖和凋亡有关。
[关键词]Exendin-4;胰岛淀粉样多肽;细胞增殖;细胞凋亡
[中图分类号]R587.1
[文献标识码]A
[文章编号]2095-0616(2022)11-0027-04
2型糖尿病胰岛β细胞病变的主要特点是β细胞质量和功能减退而不能分泌足够的胰岛素[1]。胰岛淀粉样蛋白沉积是导致胰岛β细胞功能逐渐丧失的重要因素[2]。淀粉样蛋白的独特成分是胰岛淀粉样多肽(islet amyloid polypeptide,IAPP),人源胰岛淀粉样多肽(human IAPP,hIAPP)是由胰岛β细胞合成的具有37个氨基酸的短肽。hIAPP的过度沉积会导致胰岛β细胞的凋亡并损伤葡萄糖代谢,从而导致2型糖尿病的发生[3]。Exendin-4含有39个氨基酸残基,属于GLP-1受体长效激动剂。研究发现Exendin-4可以通过多种途径改善胰岛β细胞的功能,起到治疗糖尿病的作用[4]。然而,这种作用是否发生在由内源性hIAPP形成的淀粉样蛋白沉积的条件下尚不清楚,本研究旨在探讨Exendin-4在体内对hIAPP转基因鼠的保护作用及其可能的分子机制。
1材料与方法
1.1材料
hIAPP转基因小鼠购自JacksonLab;血糖仪和血糖试纸购自三诺生物传感公司;hIAPP购自肽谷生物科技有限公司;Exendin-4购自MCE公司;小鼠Min6胰岛β细胞由本实验室保存;胎牛血清、DMEM培养基购自Gibco公司;AnnexinV-FITC/PI双染凋亡检测试剂盒购自凯基生物公司;ABC和β-catenin抗体购自CST公司;CCND2、CCDN3和CDK4购自ABclonal公司;β-Actin抗体购自Proteintech公司;PVDF膜、ECL发光液购自Millipore公司。
1.2方法
1.2.1小鼠Exendin-4处理将6~8周龄雄性小鼠分为四组:正常小鼠对照组(WT+PBS)、正常小鼠注射Exendin-4组(WT+Ex-4)、hIAPP转基因小鼠对照组(homo+PBS)、hIAPP转基因小鼠注射Exendin-4组(homo+Ex-4)。Exendin-4按照10nmol/kg的剂量给药。对四组小鼠进行2个月每天一次的腹腔注射,给药结束后进行葡萄糖耐受实验(oral glucose tolerancetest,OGTT)。
1.2.2小鼠葡萄糖耐受实验实验前先将小鼠禁食16h,而后检测小鼠血糖水平作为起始血糖值,然后,对小鼠按照2g/kg体重的标准进行葡萄糖腹腔注射,分别在30、60、120min尾静脉取血测定血糖水平。
1.2.3小鼠胰腺组织取材每组取3只小鼠用3%的戊巴比妥钠麻醉后,打开胸腔,将灌流针刺入心尖,先用生理盐水进行冲洗,然后灌注4%的多聚甲醛,当肝脏发白时灌流结束。迅速摘取胰腺组织于-80°C保存,用于蛋白检测。
1.2.4小鼠原代胰岛细胞分离每组取3只小鼠颈椎脱臼处死后用酒精浸泡消毒。在生物安全柜中打开腹腔,十二指肠的开口处灌注Hank’s盐,当胰腺膨胀后,摘除胰腺组织装入盛有预冷Hank’s盐的平皿中,剪成1~3mm的小块,在37°C培养箱中消化15min后加入预冷Hank’s盐中止消化,1500r/min室温离心3min洗涤3次,用PBS重悬后置于冰上用于后续流式细胞仪检测。
1.2.5Annexin V-FITC检测细胞凋亡将分离好的小鼠胰岛细胞加入5μl Annexin-V-FITC和10μl碘化丙啶(PI)试剂,室温避光孵育20min,随后立即进行流式细胞仪检测,Annexin V-FITC为绿色荧光,碘化丙啶(PI)为红色荧光。
1.2.6Westernblot检测相关蛋白表达RIPA裂解液裂解细胞,BCA法进行蛋白定量。SDS-PAGE凝胶电泳进行蛋白分离,半干法转运至PVDF膜,室温封闭1h,加入一抗抗体4°C孵育过夜。TBST洗涤后,二抗室温孵育1h,加入ECL发光液,使用天能成像系统进行检测。
1.3统计学方法
采用SPSS19.0统计学软件进行数据处理,计量资料用均数±标准差(x±s)表示,采用t检验,P<0.05为差异有统计学意义。
2结果
2.1Exendin-4提高hIAPP小鼠的葡萄糖耐受能力
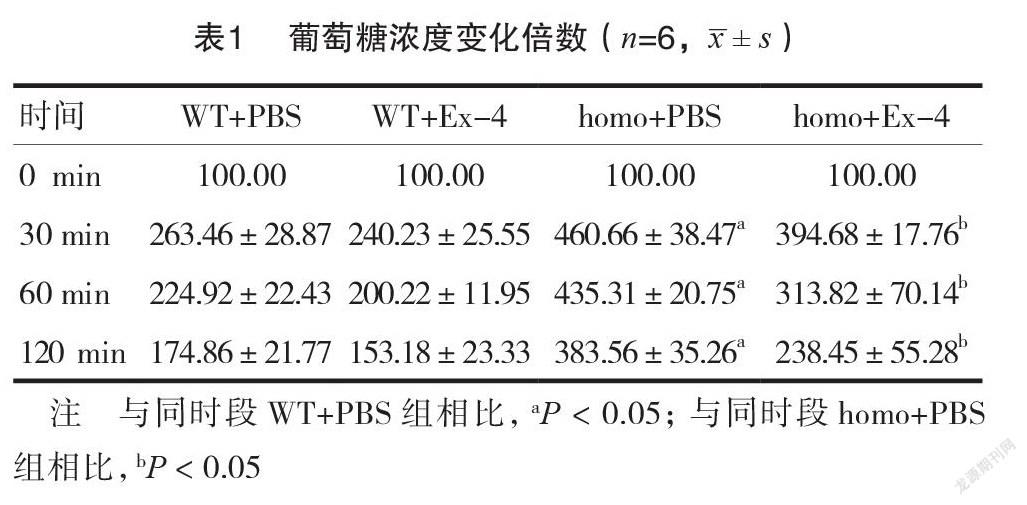
腹腔注射葡萄糖后,各组小鼠的血糖水平均升高。相比WT+PBS组,homo+PBS组上升更为显著,差异有统计学意义(P<0.05),而homo+Ex-4组血糖水平相比homo+PBS组明显降低,差异有统计学意义(P<0.05),随着时间的增加,WT+PBS组的血糖几乎恢复到正常水平,而homo+PBS组仍较高,homo+Ex-4组血糖水平迅速下降。见表1。
2.2hIAPP抑制胰島β细胞周期相关蛋白的表达
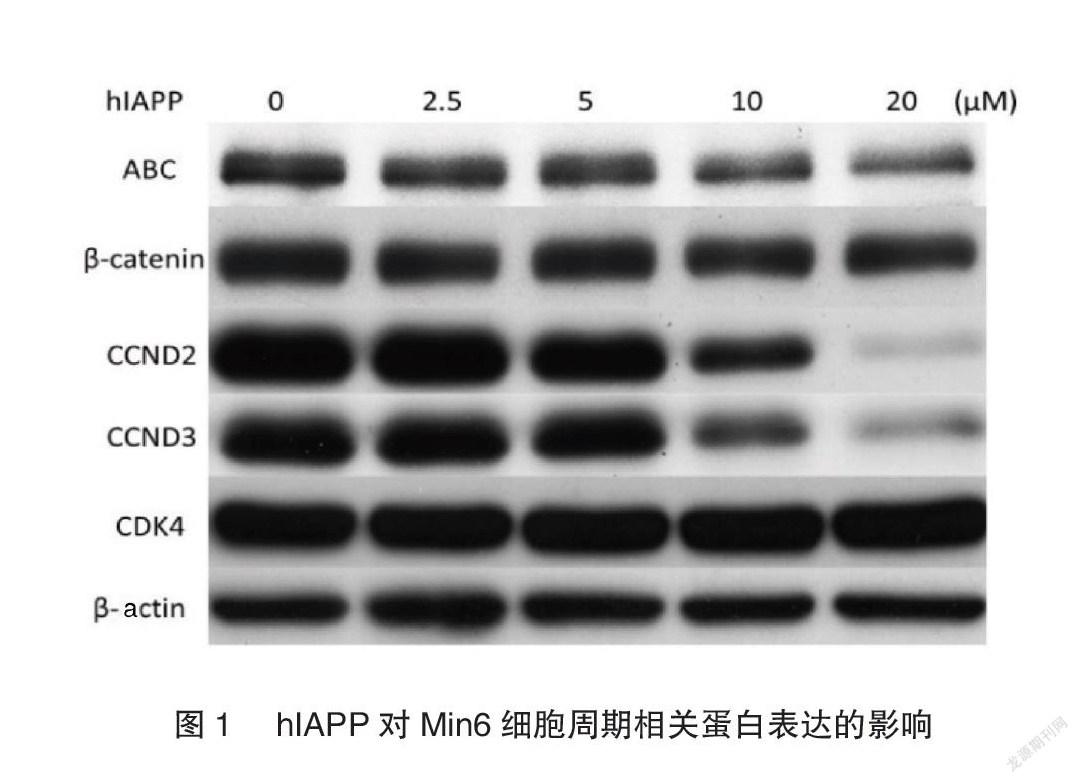
不同浓度的hIAPP体外刺激小鼠Min6胰岛β细胞48h。Western blot结果显示,hIAPP可以明显抑制ABC、CCND2以及CCND3的蛋白表达,并且呈现剂量依赖,而CDK4和β-catenin的蛋白表达水平无明显变化,见图1。
2.3Exendin-4抑制hIAPP转基因小鼠的胰岛细胞凋亡
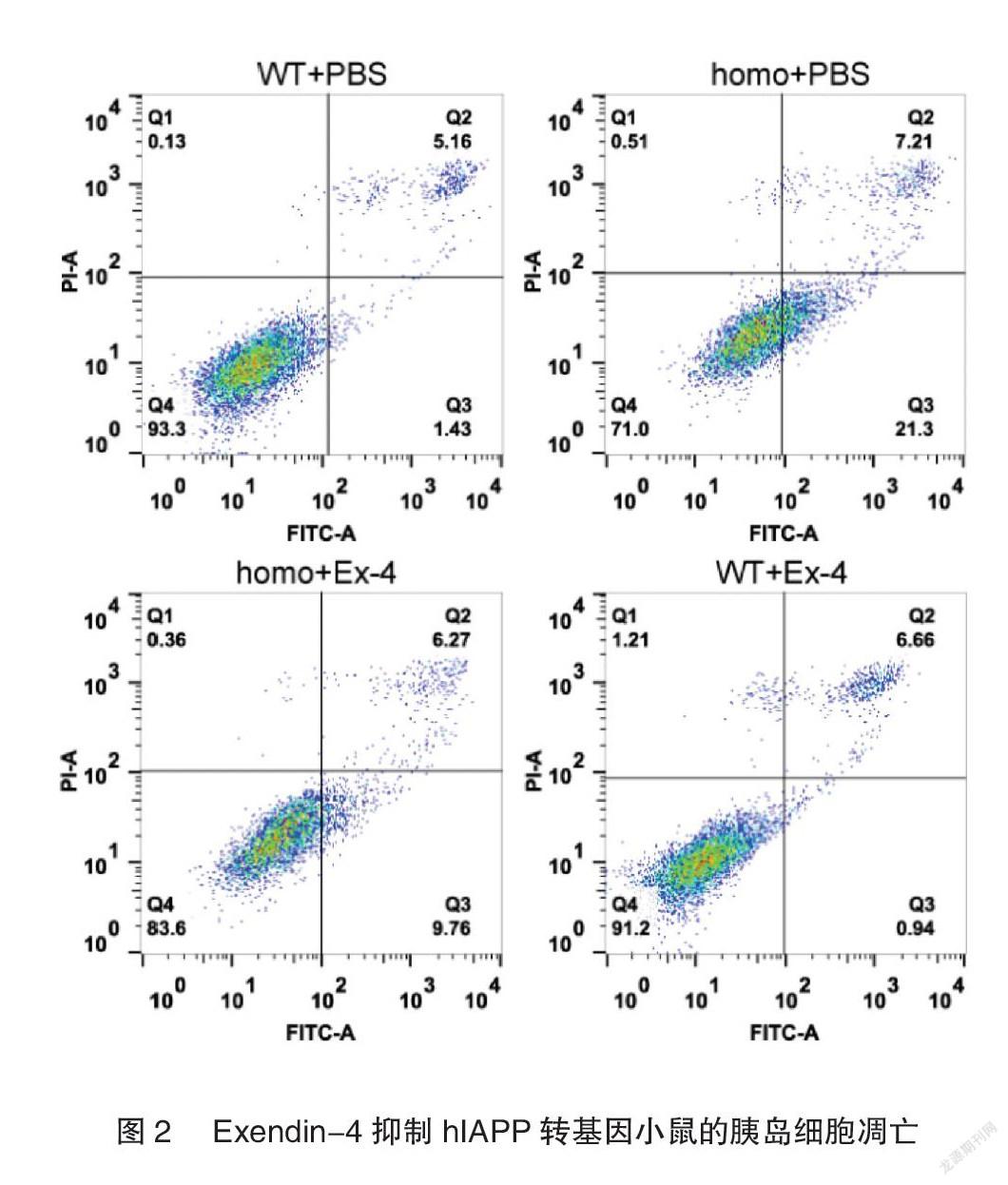
小鼠原代胰岛细胞凋亡分析结果显示,相比于WT+PBS组(1.43%),homo+PBS组的早期凋亡细胞数明显增加(21.3%),而homo+Ex-4组可以明显降低由hIAPP导致的原代胰岛细胞凋亡比例(9.76%),WT+Ex-4组无明显变化,见图2。
2.4Exendin-4促进hIAPP转基因小鼠的胰岛细胞周期相关蛋白表达
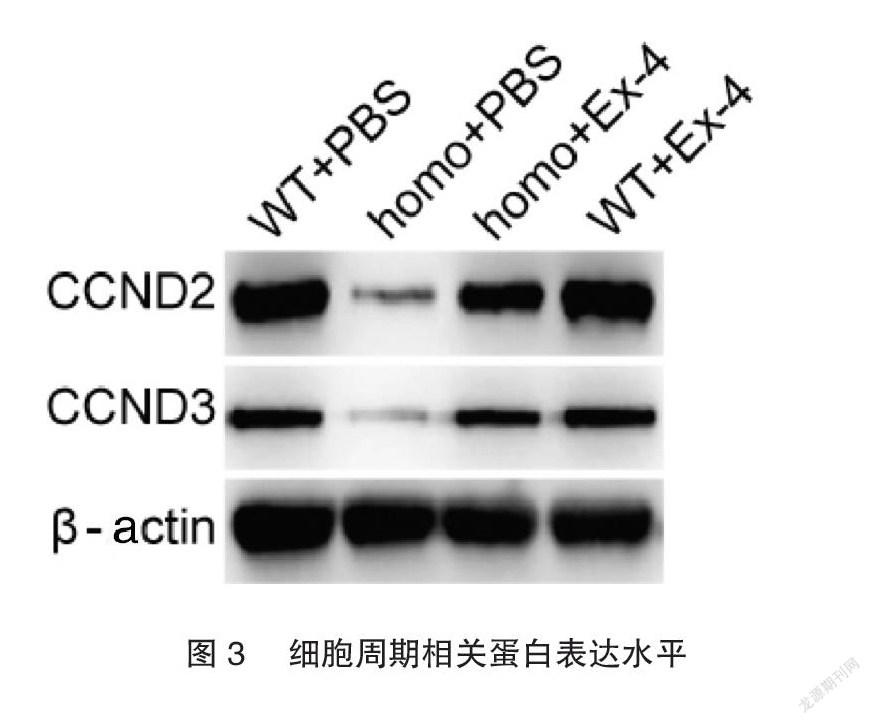
小鼠原代胰腺细胞Western blot结果显示,homo+PBS小鼠原代胰岛细胞中CCND2和CCND3的蛋白表达显著降低,而Exendin-4可以逆转由hIAPP导致的CCND2和CCND3的降低,见图3。
3讨论
2型糖尿病的主要特征是胰岛β细胞的功能下降所引起的慢性高血糖,通常伴有胰岛素敏感性降低[5-6]。尽管β细胞的功能改变在糖尿病的发病中起到关键作用,但β细胞数量的减少同样对糖尿病的病理进展具有重要影响[7]。与非糖尿病患者相比,2型糖尿病患者体内β细胞数量减少了40%~65%[8]。目前认为增殖能力降低且凋亡增多是造成β细胞数量减少的主要因素。在2型糖尿病患者的胰岛组织中发现有大量的淀粉样蛋白沉积,经鉴定发现其主要成分是IAPP[9]。胰岛周围高浓度的IAPP通过形成大量淀粉样沉积导致β细胞的功能紊乱[2]。在动物模型中,过表达hIAPP能够显著增加淀粉样蛋白沉积,导致β细胞功能障碍和凋亡[10-11]。本研究发现,hIAPP转基因小鼠的葡萄糖耐受能力明显减弱,表现出了糖尿病症状。
Exendin-4是一种葡萄糖浓度依赖性促胰岛素分泌剂,可通过促进胰岛β细胞的增殖、调控细胞自噬以及抑制细胞凋亡来改善胰岛的功能[4,12]。但是Exendin-4是否在体内对hIAPP转基因鼠具有保护作用尚缺乏研究。在本研究中,体内注射Exendin-4可以明显增强hIAPP转基因小鼠的葡萄糖耐受能力,提示Exendin-4具有改善IAPP诱导的细胞凋亡作用。
细胞周期是在众多蛋白分子调控下最终产生两个新的子细胞的过程[13],细胞周期蛋白(cyclin)通过与细胞周期依赖性激酶(cyclin-dependent kinases,CDKs)相互协作,共同维持和协调细胞周期的运行[14-15],细胞周期的正常运转对于维持细胞数量和功能至关重要[16]。在本研究中,hIAPP在体外会明显抑制小鼠β细胞中细胞周期相关蛋白CCND2和CCND3的表达,而对细胞周期依赖性激酶CCRK和CDK4无影响。在hIAPP转基因小鼠原代胰岛细胞检测中发现,体内注射Exendin-4可以有效逆转由hIAPP导致的周期蛋白CCND2和CCND3的表达丢失,提示Exendin-4可以促进体内胰岛细胞增殖。另外,本研究还发现,hIAPP转基因小鼠的胰岛组织中凋亡细胞比例明显增加,而Exendin-4处理组细胞凋亡比例显著降低,说明Exendin-4具有抑制胰岛细胞凋亡的功能。
综上所述,Exendin-4可以恢复hIAPP转基因小鼠的胰岛功能,其作用机制可能与Exendin-4促进小鼠体内胰岛细胞增殖并且抑制胰岛细胞凋亡有关。本研究为Exendin-4的临床应用提供了新的理论指导。
[参考文献]
[1] TAYLOR R.Type 2 diabetes: etiology and reversibility[J]. Diabetes Care,2013,36(4):1047-1055.
[2] BISHOYI AK,ROHAM PH,RACHINENI K,et al. Human islet amyloid polypeptide (hIAPP) -a curse in type II diabetes mellitus: insights from structure and toxicity studies[J].Biological Chemistry,2021,402(2): 133-153.
[3] RALEIGH D,ZHANG X,HASTOY B,et al.The β-cell assassin: IAPP cytotoxicity[J].Journal of Molecular Endocrinology,2017,59(3):R121-R140.
[4] YAP MKK,MISUAN N.Exendin-4 from Heloderma suspectum venom: From discovery to its latest application as type II diabetes combatant[J].Basic Clin Pharmacol Toxicol,2019,124(5):513-527.
[5] MEZZA T,CINTI F,CEFALO CMA,et al.β-Cell Fate in Human Insulin Resistance and Type 2 Diabetes: A Perspective on Islet Plasticity[J].Diabetes,2019,68(6): 1121-1129.
[6] HAN JCN,LIM LL,WAREHAM NJ,et al.The Lancet Commission on diabetes: using data to transform diabetes care and patient lives[J].Lancet,2021,396 (10267):2019-2082.
[7] WEIR GC, GAGLIA J,BONNER-WEIR S.Inadequate β-cell mass is essential for the pathogenesis of type 2 diabetes[J].Lancet Diabetes Endocrinol,2020,8(3): 249-256.
[8] RAHIER J,GUIOT Y,GOEBBELS RM,et al.Pancreatic beta-cell mass in European subjects with type 2 diabetes[J]. Diabetes Obes Metab,2008,10 Suppl 4:32-42.
[9] MIYAZATO M,NAKAZATO M,SHIOMI K,et al. Identification and characterization of islet amyloid polypeptide in mammalian gastrointestinal tract[J]. Biochemical and Biophysical Research Communications, 1991,181(1):293-300.
[10] COSTES S,LANGEN R,GURLO T,et al.β-Cell failure in type 2 diabetes: a case of asking too much of too few?[J].Diabetes,2013,62(2):327-335.
[11] BLENCOWE M,FURTERER A,WANG Q,et al. IAPP-induced beta cell stress recapitulates the islet transcriptome in type 2 diabetes[J].Diabetologia, 2022,65(1):173-187.
[12] NAUCK MA,QUAST D R,WEFERS J,et al.GLP-1 receptor agonists in the treatment of type 2 diabetes- state-of-the-art[J].Mol Metab,2021,46:101102.
[13] LI X.Epigenetics and cell cycle regulation in cystogenesis[J].Cellular Signalling,2020,68: 109509.
[14] COLLER HA.Regulation of Cell Cycle Entry and Exit: A Single Cell Perspective[J].Compr Physiol,2019, 10(1):317-344.
[15] MARTíNEZ-ALONSO D,MALUMBRES M.Mammalian cell cycle cyclins[J].Semin Cell Dev Biol,2020, 107:28-35.
[16] INGHAM M,SCHWARTZ GK.Cell-Cycle Therapeutics Come of Age[J].J Clin Oncol,2017,35 (25):2949-2959.
(收稿日期:2021-12-23)
