关于我国体外诊断试剂集采的几点思考
2022-07-09胡宏伟
胡宏伟 王 爽,2
(1中国人民大学公共管理学院 北京 100872;2雅培贸易(上海)有限公司 上海 200002)
体外诊断(In-Vitro Diagnostic,IVD)是指通过对人体体液、细胞和组织等样本进行检测而获取信息,进而判断疾病或机体功能的重要诊断方法,可为疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价提供重要依据,是医疗卫生服务中不可或缺的要素之一[1]。按照检测原理和技术,IVD 可分为生化诊断、免疫诊断、分子诊断、微生物诊断、血液诊断和凝血诊断等6个主要类别。数据显示,2019 年免疫诊断和生化诊断在我国IVD 市场中的市场占比最高,合计达57%[2]。整体上,IVD 产品主要由诊断设备(仪器)和诊断试剂构成,前者包括开放式和封闭式系统诊断仪器,后者包括相应的主试剂、试剂盒、校准品和质控品等。
近年来,随着国家/区域联盟/省(市)集中带量采购工作的开展,药品与部分医用耗材的价格得到了有效的治理,但是我国IVD 试剂的集中(带量)采购工作整体上仍处于起步阶段。本文以分析我国目前IVD 主要采购模式为基础,结合药品与医用耗材采购实践经验以及IVD 的特性问题,以期为IVD 试剂的集中(带量)采购的科学有序开展提供可行性建议。
1 IVD试剂集中采购的必要性与迫切性
1.1 规范IVD试剂流通秩序、降低虚高价格的需要
当前,我国IVD 行业的整体毛利率较高。笔者对2014 年—2018 年期间我国18 家主要IVD上市公司的毛利率数据[3]进行分析后发现,尽管整体上已呈现逐年下降的趋势,但直至2018 年其平均值仍高于60%,部分企业毛利率甚至高达90%。这一水平不仅远高于我国规模以上工业企业主营业务利润率,也高于医药行业其他细分领域的上市企业毛利率[4]。通过开展集中采购工作,将有助于降低IVD试剂价格中的虚高部分,并有利于进一步规范其流通环节的秩序。
1.2 促进检验服务项目价格结构合理化的需要
作为检验服务项目价格和收费的核心成本要素,目前IVD 试剂是以“打包”在项目内涵中的方式向患者收取费用,因此经销商向医疗机构报送的采购价格也与检验服务项目价格直接挂钩。通常情况下,试剂采购价格占该检验服务项目价格的20%—50%[5]。由于同一检验服务项目在不同省市和地区的定价水平往往差异较为显著,因此同一种IVD 试剂的采购价格也相差较大。以免疫比浊法特定蛋白补体测定(补体C3、C4)项目为例,湖北省项目价格为31 元,而浙江省为10 元(见图1)。以现有试剂入院模式计算,同一试剂在两省的采购价有可能相差3 倍之多。因此,开展集中采购有助于促使同质的IVD 试剂产品价格回归,减少因服务项目价格差异带来的IVD 试剂价格不合理差异,促进检验服务项目价格结构合理化。
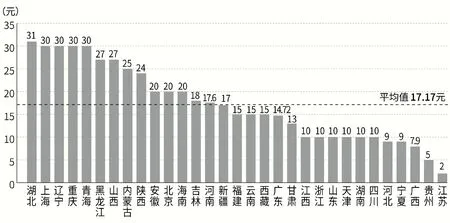
图1 全国31个省市补体测定(C3、C4)检测项目收费水平
1.3 促进我国IVD产业转型升级的需要
近年来,我国IVD 行业快速发展,产业集群化发展的格局初步形成,但总体发展水平仍不高,且自主创新能力不足,国内市场仍由外资企业占据相对主导地位。以化学发光法免疫诊断为例,进口品牌试剂的市场占有率高达80%[3]。开展IVD 试剂的集中采购,有助于进一步实现国产优质产品替代和产业升级,也有助于相关国内企业向质量型、效益型和创新型企业转型。
2 当前我国IVD试剂招标采购模式的现状与问题
目前,我国IVD 试剂招标采购主要有四类模式,包括相对传统的院级自主非集中采购模式和地市级集中招标采购模式,以及近年来逐步开展或试点的省级集中挂网采购模式和省级集中带量采购模式。
2.1 院级自主非集中采购模式
院级自主非集中采购模式具体包括院内议价和院内公开招标两种。(1)院内议价:以北京市某三甲医院为例[6],首先由相关医技科室提出IVD 试剂采购的目标要求,之后由试剂采购管理部门负责查找出所有符合要求的产品及对应企业,并在逐一征询其意愿的基础上优选3 个品牌的产品入围。其后,通过对入围产品进行性能验证,比较分析和评估其精密度和稳定性,并形成可溯源的数据报告。最终,该院试剂采购评审委员会组织投票,并与企业开展谈判议价,确定IVD 试剂的最终采购价格。(2)院内公开招标:以浙江省某三甲医院为例[7],首先由医院采购管理部门根据上年度IVD 试剂采购总金额预估本年度采购预算金额,之后由分管院领导、财务部门和检验科室负责人以及院外专家等相关人员组成专家组,召开招标前专家论证会,确定招标要求,并委托第三方代理机构开展招标工作。对于试剂采购价格,则要求企业的报价应为该产品在该院现行采购价或当前本省最低采购价格的更低者。
2.2 地市级集中招标采购模式
对2016 年—2021 年期间全国范围内发布且目前处于执行状态中的地市级IVD 试剂集中招标采购文件进行检索统计发现,目前已有12个省(自治区)的61 个地市开展了地市级集中招标采购工作,其中开展的地市数量排名前三的省(自治区)依次为江苏省(18个)、湖南省(16个)、新疆维吾尔自治区(14 个)。对上述文件及其配套实施方案的对比分析结果显示,目前已开展的地市级IVD 试剂集中招标采购工作有以下特点。(1)多与常规医用耗材集中招标采购合并发文,其具体竞价/议价规则主要服务于医用耗材。(2)采购限价(或企业报价)的参考对象主要为该地市或所在省(自治区)范围内的价格数据,存在一定局限性。(3)采购对象主要为主试剂,将与主试剂配套的产品(定标品、质控品和清洗液等)纳入采购范围的地市相对较少。
2.3 省级集中挂网采购
截至目前,全国共有19 个省(自治区、直辖市)发布了IVD试剂省级采购工作文件(见表1)。从管理形式上大致分为限定价格-参考省内外、限定价格-参考省内、限定价格-参考省外以及平台监测四种。其中重庆市较早开展(2011年),最初仅要求通过省级平台监测医疗机构实际交易价格,目前已通过所掌握的价格数据设定IVD试剂的最高挂牌价。其后,四川省于2016 年启动,2021 年又进一步调整模式,要求选择各产品在5 省挂网(中标)价与本省既往最低成交价中最低者作为最高限价。四川省和重庆市的IVD 试剂挂网价格也成为其后多省(自治区)的主要参考/联动对象。其他部分省份(如安徽省)进一步细化了对挂网价的要求,对于有外省挂网(中标)价格的,取其中最低者与当地最近一次实际采购价的次低价中的较低者作为最高限价;没有外省价格的,则在当地最近一次实际采购价中位数的基础上再降低一定比例作为最高限价。
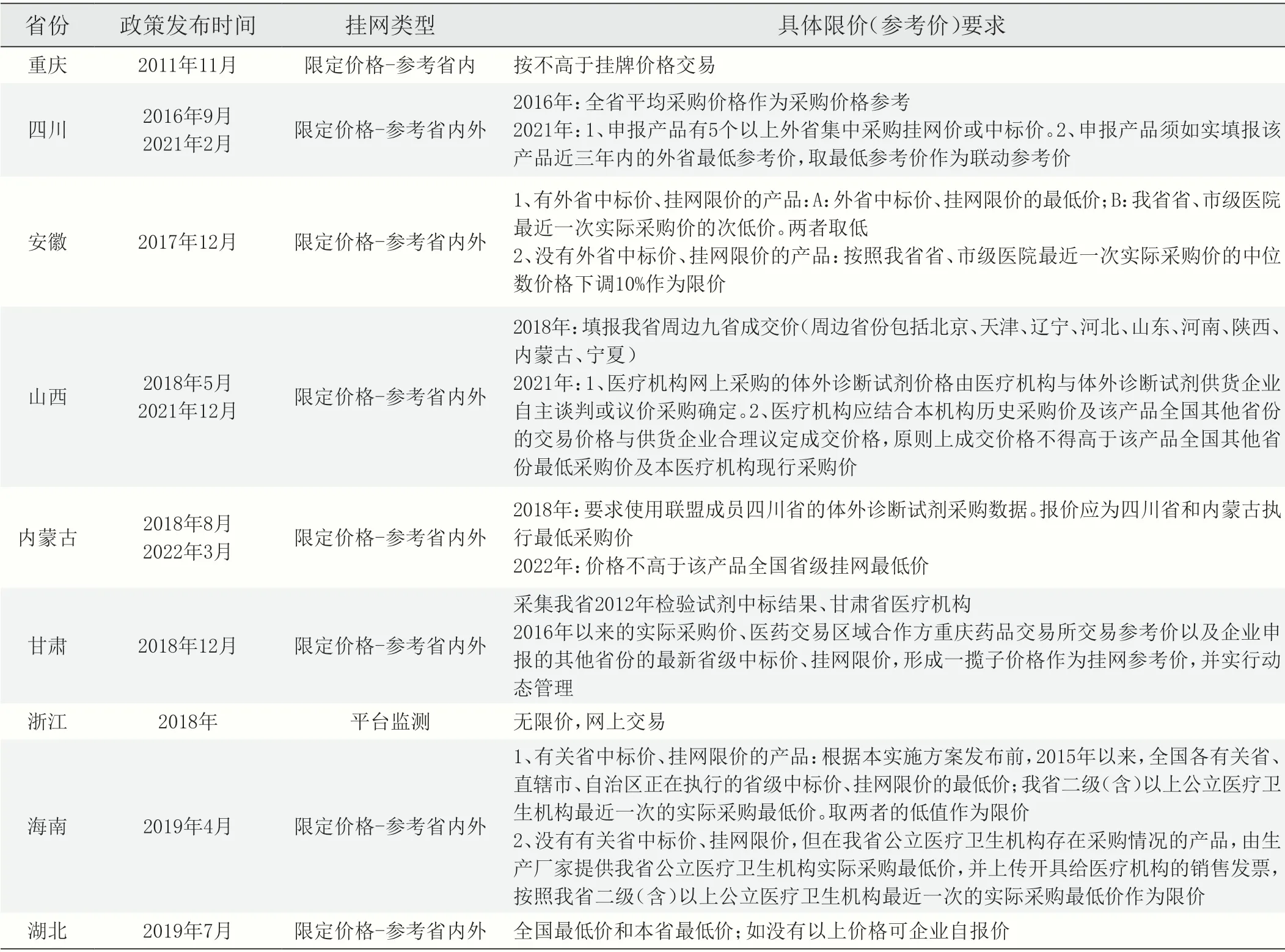
表1 全国省级体外诊断试剂集中挂网开展情况汇总
2.4 省级集中带量采购
目前,全国范围内仅安徽省在2021 年下半年正式启动了IVD试剂的省级集中带量采购工作,选择临床用量大、使用相对成熟、市场竞争较为充分的部分免疫诊断类IVD 试剂作为首批采购对象。该省工作中主要参考本省医疗机构的既往采购价格设定入围价格,并采用“按注册证”与“按组套”相结合的方式与企业进行两轮谈判,确定最终的带量采购价格,各医疗机构以产品上年度采购量的80%作为协议采购量;对于未中标产品则给予3 个月的过渡期,并列为重点监控目录品种,从严监管。

注:信息来源于各省市医疗保障局/公共资源交易中心/招标采购中心
2.5 四类采购模式的对比分析
作为相对传统且长期实行的模式,院级自主非集中采购模式对控制IVD 试剂的采购成本并提高医院运营效益有一定作用,但同时也存在着诸多弊端。首先,各医疗机构各自独立开展招标或议价采购时,往往缺乏足够和全面的价格参考,不利于在价格谈判过程中进行充分议价。同时,从前期逐一筛选可采购的试剂品种,到组织开展性能验证和专家评审/论证,均需花费大量的时间和人力成本,对医院的管理效率和成本存在影响。此外,由于院级组织的评审/论证仍主要采用专家打分的方式,其主观性相对较强,可能无法充分反映不同试剂产品的客观属性差异。
相较于院级自主招标采购,地市级集中招标采购模式增加了采购方对基础信息掌握的全面性,更有利于实现降低采购价格的目标。同时由于普遍委托经验丰富的第三方机构开展工作,一定程度上保障了招标采购流程的规范性,也大幅节约了医疗机构和IVD 试剂企业的人力和时间成本。但是,该模式也存在一些问题,由于普遍由各地市自主、自发开展,不少情况下其设定的具体议价/报价规则未(完全)与IVD 试剂的属性和特点相匹配,导致其可行性不佳,最终提出的价格降幅要求/意向与规则相关性不佳。同时,地市级集中招标采购中往往未实现带量采购,其降价的科学性和合理性也存在一定的问题。
目前已开展的省级集中采购工作模式的主要工作内容为限价挂网,具体依据从最初的当地最低采购价逐渐扩展至周边省份的最低采购价,甚至联动全国最低价,这有利于全国IVD 试剂采购价逐渐回归其自身价值,更好体现医疗服务资源利用的公平性原则。尽管如此,也有部分省份采取挂网但不设定限价的模式,仅要求医疗机构必须通过平台采购,这种方式虽在一定程度上实现了对采购各方购销行为的监测和管理,但并未充分发挥省级集中采购管理的规模和制度优势。
相比之下,目前已探索开展的省级集中带量采购,以安徽省为例,在采购对象的选择、采购组别的划分以及谈判和落地执行的规则设计等方面较为充分地借鉴了药品与高值医用耗材带量采购的经验和做法,并且适当体现了IVD 试剂的特点,具有相对较高的科学性、合理性和可行性。最终,中标产品的平均采购价降幅达47.02%,预计该年度可节约资金1.73 亿元,取得了良好的效果和效益,体现了省级集中带量采购的可行性和效益优势。
3 开展IVD试剂集中采购工作的建议
3.1 尽快分步分类推进省级集中(带量)采购
在仍未开展IVD 试剂集中挂网的省份加快推动省级试剂挂网的平台技术建设,并尽快开展试剂挂网采购和价格阳光挂网工作,实现IVD 试剂采购工作的公开化和规范化,为科学设定省级试剂挂网限价做好数据积累,为进一步开展省级集中带量采购奠定基础,也为进一步促进和实现区域间试剂价格合理化提供更多的数据参考。对于IVD试剂省级集中挂网采购工作较为成熟的省份,则建议及时推进探索不同细分类别的IVD 试剂集中带量采购,扩大采购的覆盖范围;有条件时可充分运用动态量价挂钩等工具和方法,进一步促进IVD 试剂市场的合理竞争,提高集中带量采购的经济效益。
3.2 加快推动医保IVD试剂编码的全国统一
一方面,与药品和部分医用耗材不同,IVD 试剂普遍缺乏统一的通用名称,且具体产品的规格和型号复杂多样,甚至同一检测目的试剂存在多种方法学;另一方面,IVD 试剂的市场竞争格局不充分,“独家品种”的比例高达83%,其中“独家规格”的比例又占86%[5]。这就导致在开展集中(带量)采购工作的过程中,很难简单地将功能相近的不同品牌试剂直接划分为同一竞价产品组进行比较和议价。既往已开展的各级IVD 试剂招标采购中,由于难以形成有效的竞价分组机制,各企业之间不存在实质性的竞争,降价也多为“蜻蜓点水”。在此背景下,通过加快推动IVD 试剂医保编码的全国统一,可有助于在开展集中(带量)采购工作中划分产品竞价组别和层次,使集中带量采购的核心逻辑和效用切实得以发挥,有助于更加规范、有效地降低IVD 试剂的采购价格。此外,在医保编码统一的基础上,各省还可通过对接统一的医保信息平台,更为高效、准确地实现试剂价格的跨区域横向比较,有助于进一步实现区域采购价格联动。
3.3 在IVD领域实施医疗服务价格项目“技耗分离”
国家医保局等八部委(局)于2021 年联合印发《深化医疗服务价格改革试点方案》,明确要求逐步将医用耗材从医疗服务价格项目中分离。由于当前IVD 试剂价格仍以“打包”形式收费,其采购价格与各地服务项目价格挂钩,最终使同一试剂在不同地方的采购价格差异较大,不利于公共医疗服务资源公平性原则的体现。同时,“打包”形式下的试剂集中采购降价,若不能及时对相对应的医疗服务项目价格进行调整,则无法有效将集采的成果转化为医保基金和患者经济负担方面的获益。因此,在IVD领域配套实施医疗服务价格项目的“技耗分离”,通过开展集中带量采购降低IVD 试剂价格的同时,协同开展相应的医疗服务项目价格调整,既有利于进一步在价格项目中体现医疗技术服务的价值,也有利于节约医保基金并降低患者负担,更加充分地体现集中(带量)采购工作的经济和社会效益。
3.4 科学化设置具体采购标准与规则
耗材集中带量采购中提出的“一品一策”的采购思路,可以借鉴到IVD 试剂领域,针对不同类别的体外诊断试剂采取不同的采购方式。生化试剂由于在我国体外诊断市场发展最为成熟,国产化程度高,且大多为通用型试剂,可替代性强,建议先以此类试剂开始探索集中带量采购。免疫诊断与分子诊断以封闭仪器为主,为保证医疗机构一定时期内试剂使用的稳定性,建议以省级平台阳光挂网的形式提高此类试剂采购价格的管理力度。
质量优先、价格合理是医药市场集中采购的第一准则。而对于IVD 试剂,完善可行的质量一致性评价体系尚未建成,市场上现有产品的质量良莠不齐,且缺乏可参考管理的标准。因此,建议国家和地方药监部门加快推动IVD 试剂量值溯源,卫健委临床检验中心进一步扩大IVD 试剂质量评价控制的覆盖面,不断提高IVD 试剂的质量安全水平。
此外,由于IVD 每次检测的样本数量不同,主试剂外的其他配套耗材的消耗量与主试剂的消耗量并不一致,因此在实际工作中,后者可能会以正常采购价格进入医疗机构,也存在以低价采购或赠品形式入院的情况。同时,部分配套耗材不具备独立的注册证,难以作为采购对象。既往各地的集中(带量)采购工作仍主要针对主试剂的实际采购价格数据作为限价/议价参考依据,对于主试剂外的其他配套耗材,能否以及如何科学、合理、可行地纳入采购范围,需要进一步探索实践,并持续改善。
3.5 完善配套措施及多部门协作
不同于药品或者医用耗材,部分IVD 需要配合使用试剂及其配套设备才能完成检测,特别是专机专用IVD 试剂(即试剂注册证中明确限定了适用的设备,或注册证中未限定但实际操作中仅适用于某种设备/系统的试剂)。在集中采购尤其是集中带量采购背景下,部分IVD 试剂将面临淘汰出局和被替换的问题。试剂的替换需要配合设备的替换,而后者属于医疗机构购置固定资产的工作范畴,且存在一定的更新采购周期和使用年限的要求,频繁替换设备既不现实,也会造成医疗卫生资源的浪费和管理风险。目前已开展的IVD 试剂集中采购中,鲜有对此设定配套解决措施。因此,在科学选择IVD 试剂采购对象的基础上,还需要进一步做好医保部门与财政、卫生健康等部门之间的协作,确保集中带量采购工作顺利推进。
